α-苦瓜素对巨噬细胞炎性细胞因子风暴的选择性抑制作用
2023-10-22成佳聪谭苏航叶晨欣彭克军沈富兵
李 成,成佳聪,谭苏航,叶晨欣,刘 鳐,彭克军,沈富兵,
(成都医学院 1.药学院、2.检验医学院、3.临床医学院,四川 成都 610500)
α-苦瓜素(α-momorcharin,α-MMC)是从苦瓜种子中提取的Ⅰ型核糖体失活蛋白(ribosomal inactivating protein Ⅰ,RIP Ⅰ),不仅具有抗肿瘤、抗病毒活性,还具有免疫调节作用[1-2]。前期研究表明,α-MMC能选择性抑制THP-1单核细胞中IL-1β、IL-2、IL-8、IL-9、IL-12、MIP-1α/β、MCP-1和TNF-α等细胞因子的表达,而对WIL2-S B淋巴细胞和H9 T淋巴细胞的细胞因子表达没有影响[3]。α-MMC对THP-1细胞的选择性免疫调节作用源自于细胞表面分布的高密度LRP1受体(low-density lipoprotein receptor-related protein 1,LRP1)[4]。LRP1已被证明为α-MMC等Ⅰ型核糖体失活蛋白的特异性受体,其在单核细胞表面的分布密度为12 618±3 766/细胞,而在淋巴细胞的分布密度仅为41± 44/细胞[5]。
众所周知,单核细胞为巨噬细胞的前身,在炎症期间,单核细胞从血管迁移到炎症部位并分化成为巨噬细胞,吞噬病原微生物并被激活,表达促炎症细胞因子如IL-1β、TNF-α、IL-6和IL-8,以激活其他免疫细胞并启动炎症反应[6-7]。这种炎性巨噬细胞被称为M1型巨噬细胞,若被病原体极化会过度表达炎症细胞因子,形成细胞因子风暴,并导致炎症风暴[8]。新冠病毒(SARS-CoV-2)、巨细胞病毒、流感病毒、H5N1流感病毒以及A组链球菌等都会激发巨噬细胞炎性因子风暴,导致严重的临床综合征,亦被称为巨噬细胞活化综合征(macrophage activation syndrome,MAS)[9]。由于单核细胞在演化为巨噬细胞后,其细胞表面的LRP1受体密度是否发生变化尚不清楚,因此,α-MMC是否也能选择性作用于巨噬细胞并抑制炎性极化巨噬细胞的细胞因子风暴,非常值得探讨。
本研究拟通过Western blot法分析单核细胞和巨噬细胞的LRP1受体表达量,并以脂多糖(lipopolysaccharide,LPS)诱导的炎性巨噬细胞为模型,探讨α-MMC对巨噬细胞炎性细胞因子风暴的抑制效应和对TOLL样受体4(Toll-like receptor 4,TLR4)炎症信号通路的抑制作用机制。同时,以受体阻断剂受体相关蛋白(receptor-associated protein,RAP)阻断LRP1受体的方式,证明α-MMC对M1巨噬细胞的选择性抗炎作用。α-MMC对M1巨噬细胞炎性细胞因子风暴选择性抑制作用和机制的阐明,可以为其应用于以炎性细胞因子风暴为特征的MAS治疗奠定基础,从而开发出一种新型抗病毒感染的免疫调节剂。
1 材料与方法
1.1 主要仪器CO2细胞培养箱,中国Heal Force公司产品;EnVision型全功能微孔板检测仪,英国PerkinElmer公司产品;化学发光凝胶成像仪,美国Bio-Rad公司产品;Western blot电泳仪,美国Bio Rad公司产品。
1.2 药品与主要试剂α-MMC药品由四川大学生命科学学院孟延发教授提供,RPMI 1640培养基(11875119)购自美国Gibco公司,TNF-α、IL-8、MCP-1、MIP-1α、IL-1β、IL-6 ELISA试剂盒(KE1272、KE1360、KE1511、KE1052、KE1379、KE1368)购自美国Immuno Way公司,佛波酯PMA(79346)、LPS(L2880)、RAP(553506-M)均购自美国Sigma公司,RIPA细胞裂解液(P0013B)购自上海碧云天生物技术有限公司,CCK-8试剂盒(CK04)购自中国上海Dojindo公司,鲁米诺试剂和增强型化学发光试剂(enhanced chemiluminescence,ECL,11582950001)购自美国Millipore公司,鼠抗人β-actin抗体(60008-1-Ig)购自美国Proteintech公司,HRP标记山羊抗兔抗体(SA00001-2)、HRP标记山羊抗小鼠抗体(SA00001-1)均购自武汉三鹰生物技术有限公司,TAK1抗体(YT4535)、p-TAK1抗体(YP0424)、JNK抗体(YT2440)、p-JNK抗体(YP0156)、AP1抗体(YT0248)、p-AP1抗体(YP0018)均购自Immuno Way公司,兔抗人LRP1抗体(ab92544)、TRAF6抗体(ab137452)、NF-κB p65抗体(ab32536)、p-p65抗体(ab76302)均购自美国Abcam公司。
1.3 细胞人单核细胞系THP-1和人正常T淋巴细胞系H9购自中国武汉Procell公司,人正常B淋巴细胞系WIL2-S购自中国上海百英生物科技有限公司。
1.4 方法
1.4.1细胞培养 THP-1、WIL2-S和H9细胞分别在含有10%热灭活胎牛血清、100 kU·L-1青霉素和100 mg·L-1链霉素的RPMI 1640培养基中生长,于5% CO2、饱和湿度、37 ℃条件的培养箱中培养。M0巨噬细胞诱导方法:将约1×106个THP-1细胞接种于6孔板中,加入PMA(30 μg·L-1),培养72 h后更换培养基,完全去除漂浮细胞,加入新鲜培养基(不含PMA),培养24 h,获得M0巨噬细胞。
1.4.2LRP1受体Western blot分析 取对数生长期的WIL2-S、H9、THP-1细胞和M0巨噬细胞,以1×106个细胞/孔分别接种于6孔细胞培养板的5孔中,置于37 ℃培养箱中培养24 h后。每孔加入RIPA裂解液,在冰上裂解30 min并超声3 min,然后在4 ℃ 12 000 r·min-1条件下离心10 min,转移到新的EP管中。采用BCA法测定蛋白浓度,根据裂解物体积加入5倍SDS缓冲液,100 ℃煮沸5 min。将20 μg蛋白样品分别用10%SDS聚丙烯酰胺凝胶和5%SDS浓缩凝胶分离,然后电泳转移到PVDF膜上,用5%牛奶/TBST封闭PVDF膜。在4 ℃封闭液中封闭2 h后,将膜与兔抗人LRP1和鼠抗人β-actin的一抗孵育过夜。再分别用HRP标记的山羊抗兔二抗和山羊抗小鼠二抗在室温下置于摇床上孵育1 h。之后采用增效鲁米诺试剂和ECL作为显色底物,使用化学发光凝胶成像仪进行显色,用兔抗人β-actin抗体作为内参对照。采用ImageJ软件分析各条带的灰度值,计算目标蛋白条带灰度值与β-actin条带灰度值的比值。
1.4.3CCK-8法细胞活性分析 取对数生长期THP-1、WIL2-S、H9细胞和M0巨噬细胞,以1.2×104个/孔的密度接种于96孔板。每种细胞用0、0.5、1、2、4、8、16、32和64 mg·L-1的α-MMC处理,每剂量组设置3个复孔。24 h后,每孔加入20 μL CCK-8溶液,37 ℃孵育4 h后每孔加入20 μL终止液。用EnVision酶标仪在450 nm波长下测量每孔的吸光度(A)。细胞存活率=(A实验组-A空白对照组)/(A正常对照组-A空白对照组)×100%。
1.4.4M1巨噬细胞的细胞因子检测 在培养的M0巨噬细胞中加入LPS 20 μg·L-1,并在含10%胎牛血清的RPMI 1640培养基中培养48 h,诱导巨噬细胞向炎症表型(M1巨噬细胞)极化。诱导完成后进行如下实验:(1)分别以0、0.1、0.5和2.5 mg·L-1的α-MMC处理细胞40 h;(2)分别以α-MMC(0.3 mg·L-1)处理细胞0、2、8、24和48 h。每组取5×106个细胞,每组3孔,并设M0巨噬细胞对照组。之后,各组细胞在RPMI培养基中洗涤2次,液氮速冻,37 ℃解冻。经重复2次快速冻溶后,离心除去细胞碎片,保存上清液。使用TNF-α、IL-1β、MIP-1α、IL-6、IL-8和MCP-1定量ELISA试剂盒检测各上清液样品中相应的细胞因子表达水平。
1.4.5TLR4信号通路Western blot分析 按1.4.4所述方法诱导M1巨噬细胞。将培养的M1型巨噬细胞分为4组:α-MMC(0.5 mg·L-1)0 h组、α-MMC(0.5 mg·L-1)4 h组、α-MMC(0.5 mg·L-1)8 h组、α-MMC(0.5 mg·L-1)8 h+RAP组,每组共设置5复孔。RAP阻断剂组给药方式为,在α-MMC给药前1 h加入终浓度为320 nmol·L-1的RAP。各组细胞在相应处理后,按1.4.2所述方法对细胞进行处理并进行Western blot检测。各转印膜加入一抗的稀释倍数分别为:TRAF6(1 ∶1 000)、TAK1(1 ∶1 000)、p-TAK1(1 ∶600)、NF-κB p65(1 ∶2 000)、p-p65(1 ∶1 000)、JNK(1 ∶1 000)、p-JNK(1 ∶60)、AP1(1 ∶1 000)、p-AP1(1 ∶1 000)。

2 结果
2.1 α-MMC样本检定α-MMC的凝胶电泳分析结果和Western blot分析结果分别见Fig 1A、1B,通道1和通道2分别为1 μg和2 μg的α-MMC样本。检测结果显示,α-MMC的分子量约为28 Ku,样本条带均一无杂带。
2.2 LRP1受体蛋白含量的Western blot分析WIL2-S B淋巴细胞、H9 T淋巴细胞、THP-1单核细胞和M0巨噬细胞的LRP1受体蛋白的Western blot结果如Fig 2A。结果显示,WIL2-S和H9细胞只有浅而模糊的条带,而THP-1和M0巨噬细胞则显示为深而浓密的条带。灰度值相关性分析可知,THP-1细胞和M0巨噬细胞LRP1蛋白密度明显高于WIL2-S和H9细胞(P<0.05),M0巨噬细胞的LRP1蛋白密度同THP-1细胞相比无明显差异(P>0.05)。实验结果表明,THP-1细胞经PMA诱导为巨噬细胞后其LRP1受体蛋白密度没有发生改变,依然明显高于在B细胞和T细胞的表达量。

Fig 1 Results of gel electrophoresis(A)and Western blot(B) of α-MMC samples
2.3 α-MMC对单核-巨噬细胞的选择性细胞毒作用α-MMC在0、0.5、1、2、4、8、16、32和64 mg·L-1的剂量下,对WIL2-S细胞、H9细胞、THP-1细胞和M0巨噬细胞的存活率结果如Fig 2B。结果显示,α-MMC给药剂量低于8 mg·L-1时,4种细胞的存活率皆在95%以上,而在给药剂量高于16 mg·L-1后,α-MMC对THP-1和M0巨噬细胞显示出了细胞毒性(存活率<90%),并且同WIL2-S细胞和H9细胞相比差异具有显著性(P<0.05)。显示出α-MMC对THP-1和M0巨噬细胞的细胞毒性明显高于WIL2-S和H9细胞,α-MMC对该4种细胞的细胞毒性差异与它们LRP1受体密度差异相一致。
2.4 α-MMC对M1巨噬细胞炎性细胞因子表达的调节作用α-MMC对LPS诱导M1型巨噬细胞的炎性细胞因子(TNF-α、IL-1β、IL-6、IL-8、MIP-1α和MCP-1)表达具有明显抑制作用,实验结果如Fig 3所示。(1)炎性细胞因子TNF-α、IL-1β、IL-6、IL-8、MIP-1α、MCP-1在M0型巨噬细胞表达较低,而在LPS诱导后,这些细胞因子呈现爆炸式升高。如TNF-α在M0巨噬细胞中的表达量为(43.92±8.09) ng·L-1,极化为M1巨噬细胞后,其表达量分别急剧上升到(1 398.52±231.9) ng·L-1(剂量依赖实验)和(1 507.16±339.9) ng·L-1(时间依赖实验);IL-6在M0巨噬细胞中的表达量为(80.07±15.43) ng·L-1,极化成M1巨噬细胞后,其表达水平分别急剧上升到(689.5±65.85) ng·L-1和(671.5±70.1) ng·L-1,呈现出细胞因子风暴特征。(2)当α-MMC以0.1、0.5和2.5 mg·L-1的剂量给药40 h后,这些炎症细胞因子的表达量皆呈剂量依赖性下降,其中TNF-α、IL-6和IL-1β的水平下降最为明显。例如TNF-α,随着α-MMC剂量的增加,其表达量分别为(1071.48±168.82)、(880.56±318.91)和(595.45±176.93) ng·L-1,呈明显的逐渐下降趋势,且与未处理模型组的表达量相比,除0.1 mg·L-1剂量组外,其余各组的表达量差异均有统计学意义(P<0.05)。(3)当α-MMC以0.3 mg·L-1的剂量作用0、2、8、24及48 h后,这些炎症因子的表达皆呈时间依赖性下降。例如TNF-α,随着给药时间的增加,其表达量分别为(1337.81±344.30)、(995.22±193.88)、(726.46±170.32)和(523.09±144.55) ng·L-1,与未处理模型组的表达量比较,除给药时间2 h组外,其余各组的表达量差异均有显著性(P<0.05)。各细胞因子表达量的变化趋势详见Fig 3A-F。
2.5 α-MMC对TLR4受体信号通路的抑制作用鉴于LPS诱导M1型巨噬细胞的作用机制是通过TLR4受体信号途径激发炎性细胞因子表达完成的,
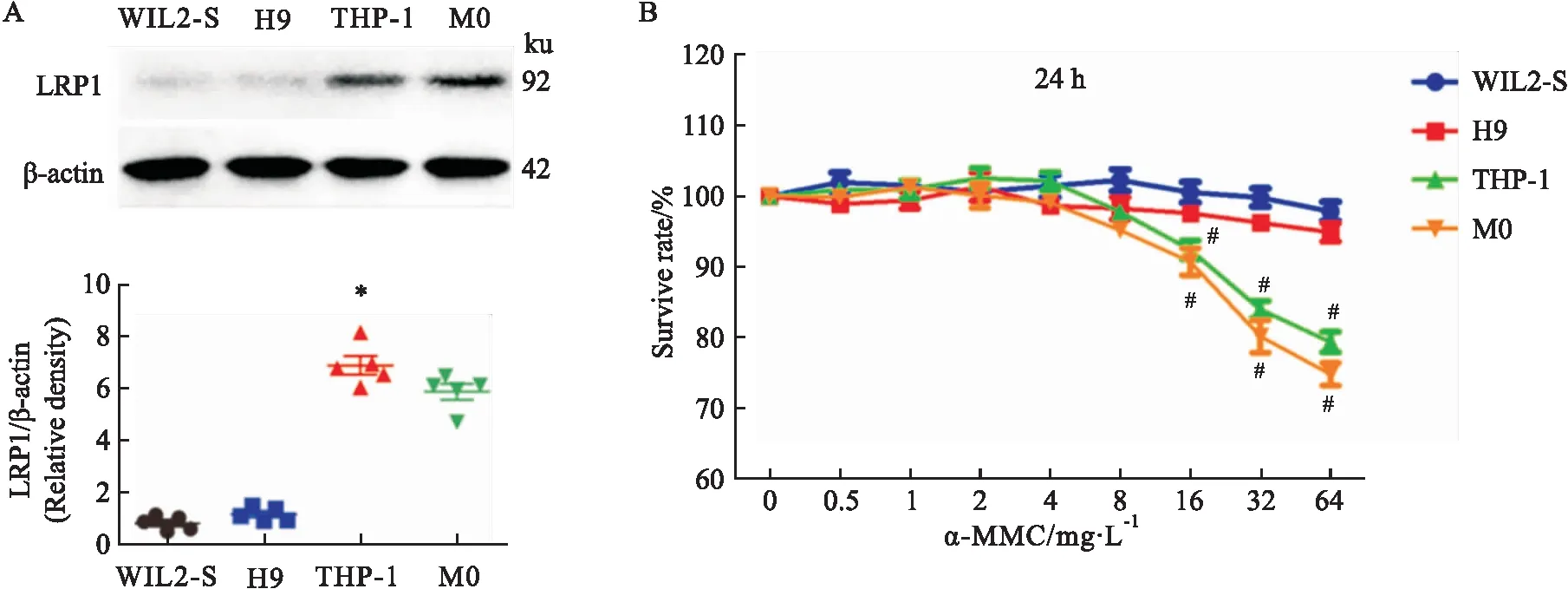
Fig 2 Western blot of LRP1 receptor protein density and CCK-8 analysis in four cell lines
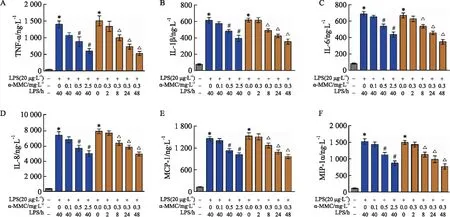
Fig 3 The regulatory effect of α-MMC on expression of inflammatory cytokines in M1
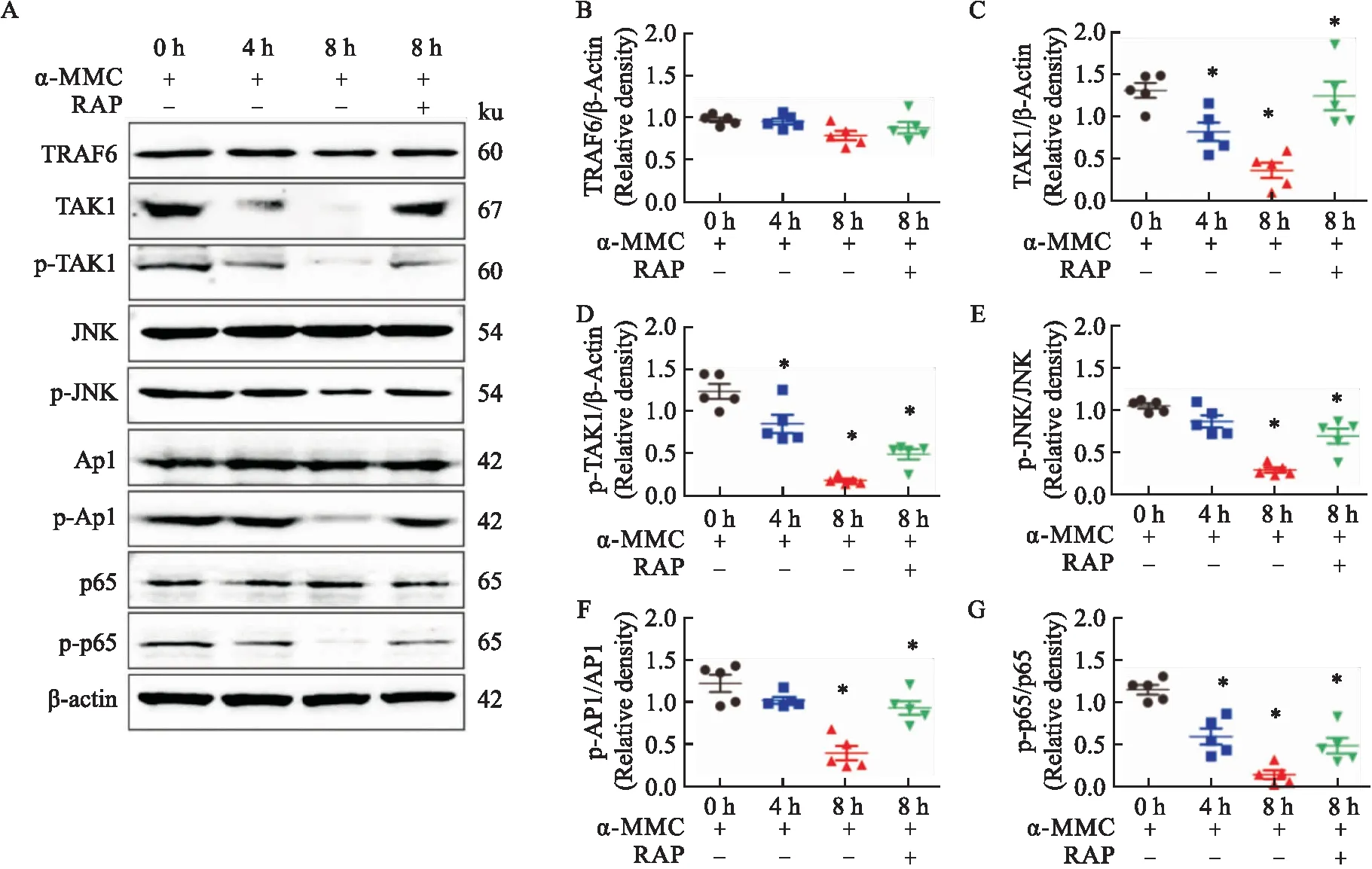
Fig 4 Western blot bands and relative gray value of TLR4 pathway signaling proteins
本实验选取该通路的TRAF6、TAK1/p-TAK1、NF-κB p65/p-p65、JNK/p-JNK、AP1/p-AP1信号蛋白观察α-MMC对该信号通路的抑制效应。各信号蛋白的免疫印迹条带汇总于Fig 4A,各条带的相对灰度值分析见Fig 4B-G。结果显示,TRAF6信号蛋白在α-MMC给药0、4和8 h时均呈浓密而均一的深色条带,显示出α-MMC对TRAF6蛋白没有调节作用;而TAK1蛋白和p-TAK1在α-MMC处理后皆有条带颜色减弱,在给药8 h时条带颜色减弱最为明显,呈现浅而模糊的条带,其重复检测的灰度均值与0 h相比差异有显著性(P<0.05),如Fig 4C,D,显示出α-MMC对TAK1蛋白和TAK1磷酸化激活信号有明显抑制作用。同时,我们观察到JNK和AP1蛋白条带在给药0、4和8 h均没有明显的变化,而它们的磷酸化蛋白p-JNK、p-AP1条带的密度则随着α-MMC处理时间增加而明显下降,显示出α-MMC对JNK和AP1蛋白的磷酸化抑制。同样,p65蛋白的致密均一条带在给药0、4和8 h时并未改变,而其磷酸化p-p65蛋白则逐渐变浅,显示了α-MMC对p-p65磷酸化的明显抑制。各蛋白的相对灰度值分别见Fig 4E-G。
同时,我们观察到,使用RAP阻断剂可成功阻滞α-MMC对相应信号蛋白的抑制作用。α-MMC处理8 h组,被抑制的p-TAK1、p-JNK、p-AP1和p-p65蛋白条带的蛋白浅而模糊,而使用RAP阻断剂后,这些蛋白条带的着色明显加深,各蛋白的相对灰度值几乎与α-MMC处理4 h时的相当,见Fig 4A、4C、4E-G。
3 讨论
α-MMC能通过失活核糖体而诱导肿瘤细胞和病毒感染细胞凋亡[10],α-MMC的这种细胞毒性作用是受其特异性受体LRP1的分布密度限定的[3]。α-MMC尚具有较好的免疫调节作用[2],我们前期研究也发现,在非细胞毒性剂量时,α-MMC能调节单核细胞的细胞因子表达,而对B淋巴细胞和T淋巴细胞没有作用[11]。α-MMC对单核细胞选择性免疫抑制作用同样是由于LRP1受体高密度分布导致的,在LRP1受体被siRNA敲降后,α-MMC对THP-1细胞的细胞因子调节即被阻滞[12]。本研究中,我们探讨α-MMC对巨噬细胞的免疫调节作用,并观察这种调节作用是否也具有受体依赖的选择性。我们首先使用PMA诱导的M0巨噬细胞模型,观察到M0巨噬细胞的LRP1受体密度与单核细胞THP-1并无差异,并明显高于正常B细胞株WIL2-S和T细胞株H9。同时,我们也观察到了与LRP1受体密度相一致的差异性细胞毒性,即α-MMC对THP-1和M0巨噬细胞的细胞毒作用远高于WIL2-S和H9细胞。
我们进一步观察到,α-MMC对LPS诱导M1巨噬细胞的炎性细胞因子风暴具有明显的抑制作用,并呈现出良好的剂量和时间依赖性。实验观察到M1型巨噬细胞的TNF-α、IL-1β、IL-6、IL-8、MIP-1α和MCP-1等炎性细胞因子有爆发式高表达,在分别给予α-MMC 0.1、0.5、2.5 mg·L-1剂量作用40 h后,这些细胞因子呈现剂量依赖性降低,在α-MMC以0.3 mg·L-1剂量分别给予0、2、8、24和48 h后,这些炎性细胞因子的表达量呈时间依赖性降低。
鉴于LPS诱导巨噬细胞炎性极化并表达炎性细胞因子是通过激活TLR4受体信号通路发生的[13-14],我们通过检测TLR4受体信号通路蛋白,观察α-MMC对该信号通路的抑制作用,并观察使用LRP1受体阻断剂后的效应。结果显示,α-MMC能明显抑制TLR4信号通路的TAK1和p-TAK1,其下游的NF-κB/p-p65和MAPK/p-JNK和p-AP1蛋白也相应被抑制。使用特异性RAP受体阻断剂后,α-MMC对TAK1/p-TAK1以及p-p65/p-JNK/p-AP1的抑制效应被明显阻滞。结果证明,α-MMC是通过LRP1受体介导抑制TAK1,进而抑制了下游的NF-κB和MAPK通路,从而发挥对炎性细胞因子合成的抑制作用。
本实验证实的α-MMC对巨噬细胞的选择性调节作用,特别是对其炎性细胞因子风暴的良好的抑制作用,将有可能使其成为治疗MAS的临床有效药物。相比于靶细胞不专一的常用抗炎免疫抑制剂如糖皮质激素,α-MMC的单核-巨噬细胞选择性使其具有高效低毒优势。糖皮质激素不仅能抑制巨噬细胞,也能抑制T细胞和B细胞,对中性粒细胞和树突状细胞也有抑制作用[15-16],同时,糖皮质激素对其他组织细胞也有不同的药理作用,引起诸如胰岛素抵抗、肥胖、青光眼、骨质疏松、伤口愈合困难甚至库欣综合征等副作用[17-18]。
由于我们前期研究中已经使用了siRNA敲降法阻断LRP1受体,本研究我们采用特异性受体阻断剂RAP来观察阻滞效果。RAP是LRP1受体的分子伴侣,其对LRP1的结合非常牢固,是一种常用的LRP1受体阻断方法。在后续研究中,我们会使用效果更好的基因敲除法,以进一步探讨LRP1受体在单核-巨噬细胞的功能。
总之,本研究证实了(1)α-MMC能选择性作用于单核细胞THP-1和M0巨噬细胞,该选择性依赖于LRP1受体的分布密度;(2)α-MMC呈剂量依赖性和时间依赖性抑制M1巨噬细胞炎性细胞因子(TNF-α、IL-1β、IL-6、IL-8、MIP-1α和MCP-1)表达;(3)α-MMC是通过LRP1受体介导抑制TLR4信号通路,从而抑制了炎性细胞因子合成。α-MMC靶向抑制单核-巨噬细胞的药理特性极有可能使其成为治疗MAS的免疫调节剂。
