LINC00707靶向miR-30c-5p对ox-LDL诱导的人血管平滑肌细胞增殖、迁移及炎症因子的影响
2023-10-22林云钗
林云钗,王 航,周 强
(1.福建医科大学附属第一医院心血管内科,福建 福州 350000;2.福建医科大学附属第一医院滨海院区国家区域医疗中心心血管内科,福建 福州 350212;3.福建医科大学附属第一医院药学部,4.厦门大学附属福州第二医院内分泌科,福建 福州 350000)
动脉粥样硬化是诱发多种心血管疾病的重要原因,人血管平滑肌细胞增殖、迁移异常可促进动脉粥样硬化发生及发展[1-2]。长链非编码RNA(long noncoding RNA,LncRNA)是一种长度超过220 nt的非编码RNA分子,其可充当微小RNA(microRNA,miRNA)竞争性内源RNA(competing endogenous RNA,ceRNA)分子而参与动脉粥样硬化发生过程[3-4]。LINC00707在脂多糖(lipopolysaccharide,LPS)诱导的神经细胞中表达水平升高,干扰其表达可抑制细胞炎症反应及细胞凋亡[5]。但还没有相关研究报道LINC00707在动脉粥样硬化中的作用。此外,通过预实验我们发现miR-30c-5p在LINC00707上有结合位点。miR-30c-5p在氧化型低密度脂蛋白(oixidized low-density lipoprotein,ox-LDL)诱导的内皮细胞中表达水平降低,上调其表达可减轻细胞损伤[6]。然而,miR-30c-5p在动脉粥样硬化发展过程中的作用尚未有研究。因此,本研究用ox-LDL诱导血管平滑肌细胞HVSMCs建立体外动脉粥样硬化细胞模型,进而探索LINC00707在动脉粥样硬化发展过程中作用,此外,我们还探索miR-30c-5p是否为LINC00707的功能靶标,以及LINC00707是否通过影响miR-30c-5p表达水平发挥其调控作用。
1 材料与方法
1.1 材料与试剂人血管平滑肌细胞HVSMC(HTX2352)购自深圳市豪地华拓生物;ox-LDL(IO1300)、CCK-8试剂(CA1210)购自北京索莱宝;DMEM培养基(12430047)、胎牛血清(10100147)与胰蛋白酶(15400054)购自美国Gibco;美国Invitrogen提供LipofectamineTM3000(L3000075)、TRIzol试剂(15596026CN)、反转录与荧光定量PCR试剂;广州锐博生物合成si-NC、si-LINC00707、miR-NC、miR-30c-5p mimic、anti-miR-NC、miR-30c-5p Inhibitor;Transwell小室(PI8P01250)购自美国Corning;IL-6(ml058097)、TNF-α(ml077385)、IL-10(ml064299)检测试剂盒购自上海酶联生物;双荧光素酶报告基因载体(E1330)购自美国Promega;美国Santa Cruz提供一抗抗体[兔抗人E-cadherin(ab40772)、N-cadherin(ab18203)抗体]与HRP标记的山羊抗兔IgG二抗(ab205781)。
1.2 方法
1.2.1实验仪器 超净工作台,上海赫田科学仪器有限公司;PCR仪,德国Eppendorf公司;7500实时荧光定量PCR仪,美国ABI公司;DW-110W192超低温冰箱,广州傲雪制冷设备有限公司;涡旋振荡器,韩国JeioTech公司;ELX800型酶标仪,美国Bio-Tek公司;CKX41型倒置显微镜,日本Olympus公司;Smartspec3000型分光光度计,美国Bio-Rad公司。
1.2.2实验分组 将HVSMCs培养于含有100 mg·L-1ox-LDL的DMEM培养基的6孔板(1×105个/孔)中孵育24 h[7],记为ox-LDL组。在不含有ox-LDL的DMEM培养基中培养的细胞做为对照组(Con组)。采用脂质体转染法进行细胞转染,转染后细胞经100 mg·L-1ox-LDL刺激24 h,分别记为ox-LDL+si-NC组、ox-LDL+si-LINC00707组、ox-LDL+miR-NC组、ox-LDL+miR-30c-5p mimic组。采用脂质体转染法将si-LINC00707和anti-miR-NC、si-LINC00707和miR-30c-5p Inhibitor分别共转染至HVSMCs,随后细胞经100 mg·L-1ox-LDL刺激24 h,分别记为ox-LDL+si-LINC00707+anti-miR-NC组、ox-LDL+si-LINC00707+miR-30c-5p Inhibitor 组。
1.2.3qRT-PCR检测细胞中LINC00707、miR-30c-5p的表达水平 使用TRIzol试剂根据制造商说明从细胞中分离和提取总RNA。为了量化mRNA表达,使用反转录试剂盒将RNA反转录合成cDNA,然后使用PCR试剂盒进行qRT-PCR反应。GAPDH和U6分别作为LINC00707和miR-30c-5p 检测的内对照,采用2-ΔΔCt法计算相对表达量。
1.2.4CCK-8实验 将细胞按每孔3×103个细胞的密度播种到96孔板中。每孔中加入100 μL含有CCK-8的新鲜培养基,37 ℃孵育2 h,在450 nm处测定吸光度。
1.2.5Transwell实验检测细胞迁移 取各组HVSMCs细胞接种于小室的上室(1×105个/孔),下室添加500 μL含有20% FBS的完全培养基,37 ℃、5% CO2条件下培养48 h,用多聚甲醛在室温下固定细胞20 min,0.1%结晶紫染色10 min,随机挑选5个区域于显微镜下计数染色细胞。
1.2.6ELISA法 将对照缓冲液和HVSMCs培养液上清加入到含有IL-6 和IL-1β抗体的ELISA孔板中,37 ℃孵育2 h。清洗后,每孔加入100 μL二抗偶联HRP,孵育2 h。清洗后,将100 μL处理过的TMB加入各孔,避光,孵育15 min,加终止液终止反应,测定吸光度值。
1.2.7双荧光素酶报告实验 Starbase预测miR-30c-5p在LINC00707上存在互补序列。将预测的序列扩增并克隆到pmirGLO载体以构建野生型WT-LINC00707载体。采用点突变手段获得预测序列的突变序列,随后构建突变型MUT-LINC00707载体。采用脂质体转染法将WT-LINC00707、MUT-LINC00707分别与miR-NC或miR-30c-5p mimic共转染至HVSMCs。24 h后,检测细胞荧光素酶活性。
1.2.8Western blot 将各组细胞与500 μL含有1% PMSF蛋白酶抑制剂的预冷裂解缓冲液孵育30 min,提取总蛋白,用BCA法测定蛋白浓度。SDS-PAGE分离40 μg蛋白后,将分离的条带转膜,脱脂奶粉封闭培养2 h。加入E-cadherin(1 ∶1 000)、N-cadherin(1 ∶1 000)和GAPDH(1 ∶3 000)一抗稀释液,与PVDF膜在4 ℃条件下孵育24 h,随后加入二抗稀释液(1 ∶5 000)室温下孵育1 h。应用化学发光试剂和ImageJ软件检测和分析各条带灰度值。
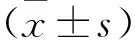
2 结果
2.1 抑制LINC00707对ox-LDL诱导的HVSMCs活性、迁移的影响与Con组比较,ox-LDL组LINC00707的表达量升高(P<0.05),miR-30c-5p的表达量降低(P<0.05),细胞存活率和N-cadherin蛋白水平升高(P<0.05),迁移细胞数增多(P<0.05),E-cadherin蛋白水平降低(P<0.05);与ox-LDL组、ox-LDL+si-NC组比较,ox-LDL+si-LINC00707组中LINC00707的表达量降低(P<0.05),miR-30c-5p的表达量升高(P<0.05),细胞存活率和N-cadherin蛋白水平降低(P<0.05),迁移细胞数减少(P<0.05),E-cadherin蛋白水平升高(P<0.05),见Fig 1、Tab 1。
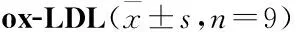
Tab 1 Effect of inhibiting LINC00707 on active migration of HVSMCs induced by
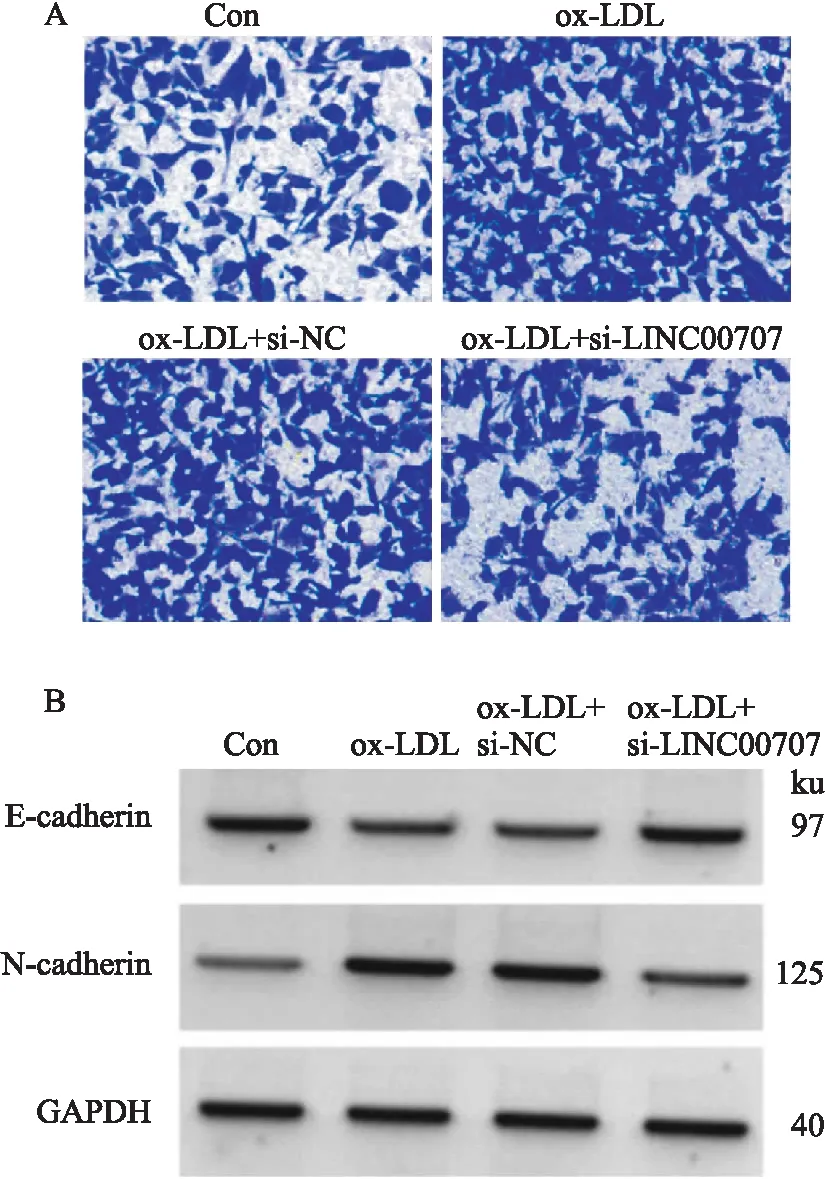
Fig 1 Effect of LINC00707 inhibition on HVSMC migration-and migration-related protein expression induced by ox-LDL
2.2 抑制LINC00707对ox-LDL诱导的HVSMCs中炎性因子的影响与Con组比较,ox-LDL组IL-6、TNF-α的水平升高(P<0.05),IL-10的水平降低(P<0.05);与ox-LDL组、ox-LDL+si-NC组比较,ox-LDL+si-LINC00707组IL-6、TNF-α的水平降低(P<0.05),IL-10的水平升高(P<0.05),见Tab 2。
2.3 LINC00707靶向调控miR-30c-5pmiR-30c-5p在LINC00707上存在结合位点,见Fig 2。过表达miR-30c-5p可降低WT-LINC00707载体的荧光素酶活性(P<0.05),见Tab 3。si-LINC00707组miR-30c-5p的表达量比si-NC组中的高(P<0.05),见Tab 4。

Fig 2 Binding site for miR-30c-5p on LINC00707
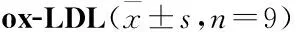
Tab 2 Effect of inhibitory LINC00707 on inflammatory factors in HVSMCs induced by

Tab 3 Dual-luciferase reporter assay
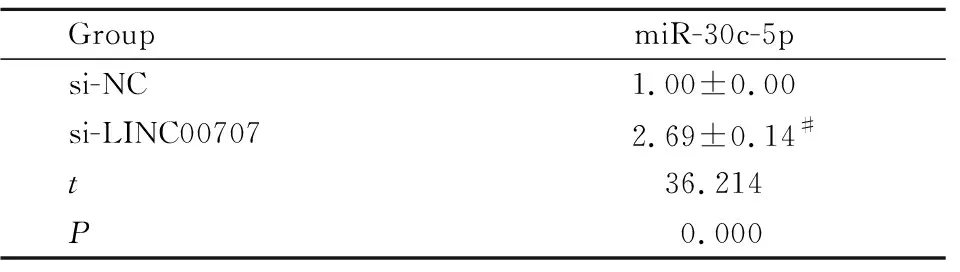
Tab 4 Expression of miR-30c-5p regulated by LINC00707
2.4 miR-30c-5p在ox-LDL诱导的HVSMCs中的调控作用ox-LDL+miR-30c-5p mimic组与ox-LDL+miR-NC组比较,细胞存活率和N-cadherin蛋白含量降低(P<0.05),迁移细胞数减少(P<0.05),E-cadherin蛋白含量和IL-10的水平升高(P<0.05),IL-6、TNF-α的水平降低(P<0.05),见Fig 3、Tab 5。
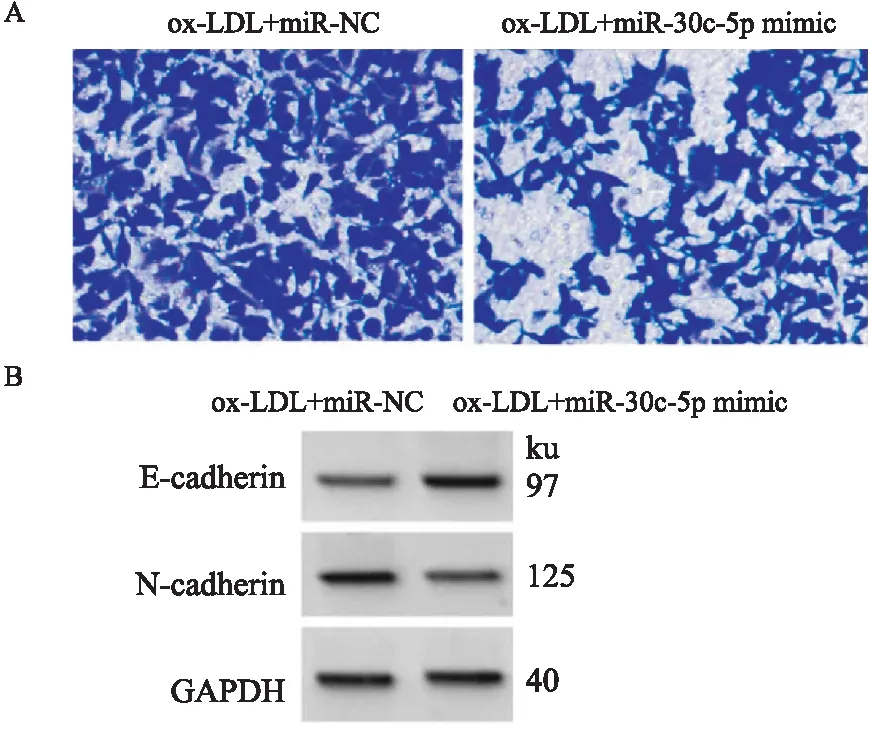
Fig 3 Effects of miR-30c-5p on migration and expression of HVSMCs and migration-related proteins induced by ox-LDL
2.5 miR-30c-5p表达下调在ox-LDL诱导的HVSMCs中对LINC00707沉默介导作用的影响与ox-LDL+si-LINC00707+anti-miR-NC组比较,ox-LDL+si-LINC00707+miR-30c-5p Inhibitor 组细胞存活率和N-cadherin蛋白水平升高(P<0.05),迁移细胞数增多(P<0.05),E-cadherin蛋白水平降低(P<0.05),见Fig 4、Tab 6。
2.6 抑制miR-30c-5p对抑制LINC00707处理的ox-LDL诱导的HVSMCs中炎性因子的影响与ox-LDL+si-LINC00707+anti-miR-NC组比较,ox-LDL+si-LINC00707+miR-30c-5p Inhibitor 组IL-6、TNF-α的水平升高(P<0.05),IL-10的水平降低(P<0.05),见Tab 7。
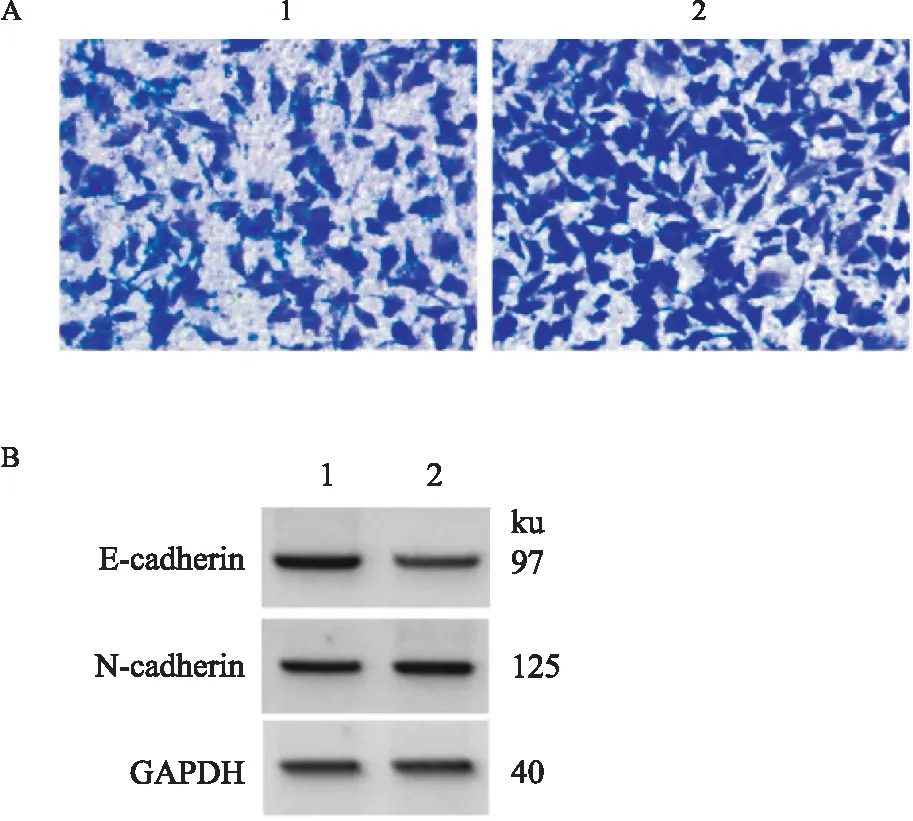
Fig 4 Effects of inhibition of miR-30c-5p on inhibition of HVSMC migration and migration-related protein expression induced by ox-LDL treated with LINC00707
3 讨论
ox-LDL可通过引发炎症等促进人血管平滑肌细胞增殖及迁移,并可通过抑制细胞凋亡进而促进动脉粥样硬化的发生及发展[8-9]。LncRNA在动脉粥样硬化中表达异常,并可通过调节miRNA/mRNA分子轴而调节ox-LDL诱导的人血管平滑肌细胞增殖及迁移等,还可能作为动脉粥样硬化防治的潜在靶点[10-11]。

Tab 5 Effects of miR-30c-5p on active migration and inflammatory factors of HVSMCs induced by ox-LDL
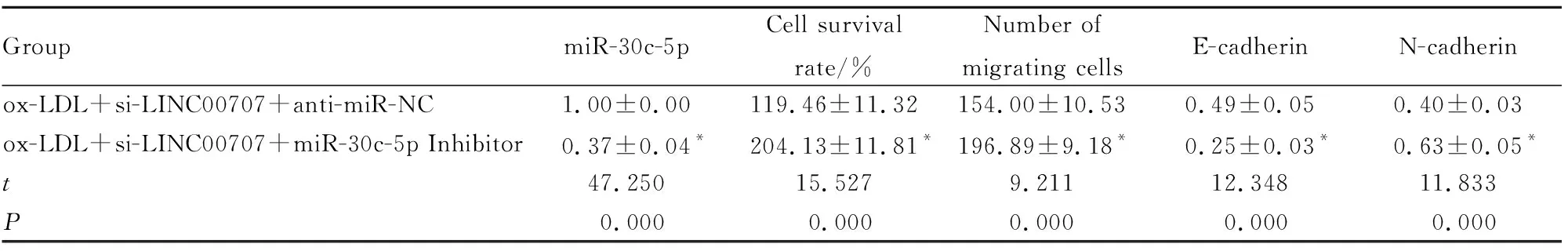
Tab 6 Effects of inhibition of miR-30c-5p on active migration of HVSMCs induced by ox-LDL treated with LINC00707
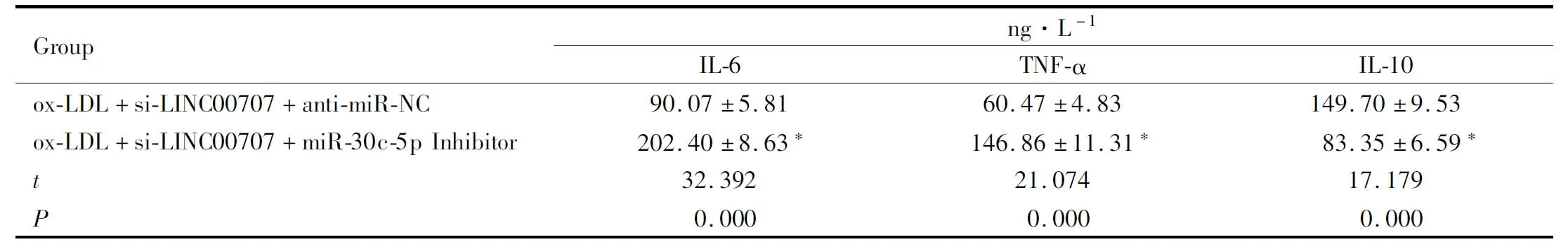
Tab 7 Effects of inhibition of miR-30c-5p on inflammatory factors induced in HVSMCs induced by ox-LDL treated with LINC00707
LINC00707在LPS诱导的人胚肺细胞中高表达,敲低其表达可通过抑制细胞凋亡而减轻细胞损伤[12]。沉默LINC00707可抑制骨肉瘤细胞增殖及转移[13]。但LINC00707在ox-LDL诱导的人血管平滑肌细胞中的表达及其作用尚未可知。在本次试验中,我们发现LINC00707的表达量在ox-LDL诱导的HVSMCs中明显升高,提示LINC00707在动脉粥样硬化发生及发展过程中可能发挥重要调控作用。本研究结果显示,ox-LDL诱导的人血管平滑肌细胞存活率升高,迁移细胞数增多,N-cadherin表达上调,而E-cadherin表达下调,与相关研究报道结果相似[14],而抑制LINC00707表达后ox-LDL诱导的人血管平滑肌细胞存活率降低,迁移细胞数减少,N-cadherin表达下调,E-cadherin表达上调,提示抑制LINC00707表达可减弱ox-LDL诱导的人血管平滑肌细胞增殖及迁移能力。此外,IL-6、TNF-α的含量在ox-LDL诱导的HVSMCs中升高,而IL-10的表达量则降低,也与已发表研究结果相似[15],而抑制LINC00707表达可降低IL-6、TNF-α的水平,增加IL-10的水平,提示LINC00707低表达可抑制ox-LDL诱导的人血管平滑肌细胞炎症因子产生而抑制炎症反应。
miR-30c-5p通过靶向OPG进而促进血管平滑肌细胞分化[16]。miR-30c-5p过表达可通过逆转ox-LDL诱导的凋亡及炎症反应减轻人脐静脉内皮细胞的损伤[17]。miR-30c-5p过表达可减轻脓毒症引起的急性肾损伤[18]。此外,miR-30c-5p可以抑制小胶质细胞凋亡及自噬活性,进而减轻新型隐球菌感染程度。本研究结果显示,在ox-LDL诱导的人血管平滑肌细胞中miR-30c-5p的表达量降低,初步证实LINC00707可负向调控miR-30c-5p的表达,miR-30c-5p过表达可降低ox-LDL诱导的人血管平滑肌细胞增殖、迁移能力及炎症反应,而抑制miR-30c-5p表达可拮抗LINC00707低表达对ox-LDL诱导的HVSMCs损伤的抑制作用。
综上所述,LINC00707在ox-LDL诱导的人血管平滑肌细胞中高表达,而miR-30c-5p则表现出低表达趋势。功能实验显示,下调LINC00707可通过靶向作用导致miR-30c-5p表达上调,从而抑制ox-LDL诱导的人血管平滑肌细胞炎症反应、增殖和迁移,提示LINC00707/miR-30c-5p通路可能参与动脉粥样硬化的发病过程,为发展治疗该疾病的方法提供了新的策略。然而,我们仍需进一步探索是否还有其他miRNAs参与LINC00707对动脉粥样硬化发展过程的调控作用。另外,鉴于miRNAs能够通过抑制靶mRNA翻译或促进mRNA降解来调节生理和病理过程,在随后的研究中还需要探索miR-30c-5p的靶mRNA是否参与LINC00707对动脉粥样硬化发展过程的调控作用。
