25例子宫非典型息肉样腺肌瘤的临床特征分析
2023-10-21宋菁华郭红燕
宋菁华 郭红燕 韩 钦 于 博
(北京大学第三医院妇产科,北京 100191)
子宫非典型息肉样腺肌瘤(atypical polypoid adenomyoma,APA)是一种含有平滑肌和纤维组织的间质内嵌不规则增殖内膜腺体的子宫肿瘤,存在恶变潜能。目前病因不明,标准的治疗方案及随访尚无共识,也暂无前瞻性临床研究。本文回顾性分析我院2010年1月~2022年1月25例APA的临床资料,对临床特点、治疗方案及复发情况等进行分析。
1 临床资料与方法
1.1 一般资料
本组25例,年龄21~60岁,(34.3±6.4)岁。主要临床表现:异常子宫出血20例,包括月经紊乱8例,经期延长5例,经量增多4例,经间期出血3例;同房后出血1例;绝经后出血2例;无明显症状、体检超声提示宫腔内异常回声或子宫内膜增厚2例。妇科查体:3例子宫增大如孕6~10周,均合并子宫肌瘤;22例妇科查体无明显异常。盆腔超声检查:子宫腔或宫颈管内异常回声14例,子宫内膜增厚或回声不均11例;子宫内膜可见少量血流信号10例;子宫肌瘤6例(单发肌壁间肌瘤2例,单发浆膜下肌瘤1例,多发子宫肌瘤3例),直径0.8~5 cm,数目1~3个;卵巢良性肿瘤1例,直径2.5 cm;双侧卵巢多囊样改变3例。合并不孕症6例(原发性不孕4例,继发性不孕2例),原发性高血压2例,糖尿病1例,甲状腺功能亢进1例。既往行宫腔镜子宫内膜息肉/宫颈息肉切除术3例。
1.2 方法
均行宫腔镜检查+宫腔内占位病变切除术。宫腔检查镜为日本Olympus光学株式会社6.5 mm诊断用硬性宫腔镜,宫腔电切镜为日本Olympus光学株式会社9 mm等离子双极电切系统。术前15~20 min间苯三酚80 mg静脉滴注。静脉全身麻醉。取膀胱截石位,常规消毒铺巾,放置窥阴器,0.5%碘伏溶液消毒阴道及宫颈,Hegar扩张器逐号扩张宫颈管至10号,等离子双极宫腔镜电切系统环形电极完整切除宫腔内病灶,并全面刮取子宫内膜。灌流液采用生理盐水,膨宫压力80~100 mm Hg(1 mm Hg=0.133 kPa),流速260~300 ml/min,电切功率200 W,电凝功率120 W。将全部组织送病理检查。根据宫腔镜术后病理结果,结合患者年龄、生育愿望等制定后续治疗方案。患者有保留子宫或者生育愿望可考虑药物保守治疗,常用药物包括高效孕激素(醋酸甲羟孕酮、醋酸甲地孕酮)、孕激素(地屈孕酮、黄体酮胶囊)、口服短效避孕药(妈富隆、优思明)等,定期复查宫腔镜。如果连续2次病理结果评估子宫内膜无异常,不再定期行宫腔镜检查,门诊定期随诊,观察月经情况及复查超声。患者无保留子宫愿望可考虑行子宫切除术。
2 结果
2.1 宫腔镜手术
23例病变位于宫腔内,其中19例位于宫底(图1),4例位于宫腔下段;1例病变位于宫颈管;1例宫腔及宫颈管均存在病变。19例为单发息肉样赘生物,其中2例病变表面可见丰富血管,1例病变表面可见粗大的异型血管,病变直径0.5~5.5 cm,(2.54±1.53)cm;6例为多发息肉样赘生物或子宫内膜不均匀增厚,其中1例病变表面可见丰富血管,2例病变表面可见粗大的异型血管,病灶直径0.5~5.0 cm,(2.57±1.77)cm。手术时间5~30 min,(17.9±5.9)min;术中出血2~10 ml,(3.12±1.95)ml。宫腔镜手术顺利,无并发症发生。
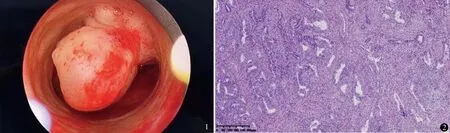
图1 宫腔镜见病变位于宫腔左前壁,单发,大小约2.0 cm×1.0 cm,形态欠规则图2 显微镜下见子宫内膜局灶腺体呈非典型性增生伴桑葚样化生,周围绕以增生的纤维肌性组织,符合APA(HE染色 ×10)
2.2 病理诊断
25例病理均为APA(图2),其中8例合并子宫内膜不典型增生,7例合并子宫内膜样癌,2例合并子宫内膜息肉,1例合并子宫颈息肉。
2.3 宫腔镜术后治疗
18例保守治疗:年龄21~37岁,(30.9±4.1)岁。13例有生育愿望。6例合并子宫内膜非典型增生,3例合并子宫内膜样癌(2例高分化子宫内膜样癌,1例高-中分化子宫内膜样癌):口服高效孕激素(醋酸甲羟孕酮250 mg/d或醋酸甲地孕酮160 mg/d)治疗3个月,行宫腔镜检查+分段诊刮术,病理提示子宫内膜部分腺体萎缩,间质蜕膜样变,符合药物性子宫内膜,继续高效孕激素治疗,3个月后再次复查宫腔镜检查+分段诊刮术,子宫内膜均无异常。其余9例:月经后半周期口服孕激素(地屈孕酮/黄体酮胶囊)10~14 d 4例,口服短效避孕药(妈富隆/优思明)3例,未药物治疗定期随访2例。均间隔3~6个月行宫腔镜检查+分段诊刮术,子宫内膜均无异常。
7例手术治疗:年龄38~60岁,(43.8±5.7)岁。3例行腹腔镜全子宫切除+双侧附件/双侧输卵管切除术,其中2例合并子宫内膜非典型增生,1例合并子宫肌瘤。4例行腹腔镜全子宫切除+双侧附件切除+盆腔淋巴结切除+腹主动脉旁淋巴结活检术,均合并子宫内膜样癌(1例高分化子宫内膜样癌,1例高-中分化子宫内膜样癌,1例中分化子宫内膜样癌,1例中-低分化子宫内膜样癌),根据子宫内膜癌美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南术后相应辅助治疗。
2.4 随访
失访1例(接受手术治疗者),24例术后随访12~142个月,(42.8±28.7)月。有生育愿望13例:宫腔镜术后妊娠10例,其中自然妊娠4例,促排卵治疗或辅助生殖技术助孕成功妊娠6例,其中3例合并子宫内膜样癌均行辅助生殖技术助孕成功妊娠;辅助生殖技术助孕失败放弃生育3例,其中合并异常子宫出血-排卵障碍2例[口服孕激素后半周期治疗1例,放置左炔诺孕酮宫内缓释系统(levonorgestrel releasing intrauterine system,LNG-IUS)1例]。1例接受保守治疗者宫腔镜术后76个月因多发子宫肌瘤行腹腔镜全子宫切除+双侧输卵管切除术。其余保守治疗的4例(包括未药物治疗2例),无生育愿望,术后定期随访均无异常。6例手术治疗后随访无异常。
3 讨论
3.1 临床特点
APA通常发生在育龄期女性,但也可发生于绝经后妇女。本研究生育年龄患者居多,年龄(34.3±6.4)岁,其中绝经前23例(92.0%),绝经后2例(8.0%)。本组25例APA合并不孕症6例,不孕症发生率24.0%(6/25)。Zhu等[1]报道39例APA合并不孕症12例(30.8%),本组合并不孕症6例(24.0%)。本组最常见的临床表现为异常子宫出血(20/25,80.0%),其次为无明显症状、体检超声提示宫腔内异常回声或子宫内膜增厚(2/25,8.0%),其他症状如腹痛、阴道分泌物异常等较罕见。本研究结果与既往研究[2~4]一致。
3.2 诊断及鉴别诊断
虽然所有患者均行阴道或腹部超声检查,但宫腔镜手术前很难对APA进行诊断及鉴别诊断。宫腔镜检查需要全面评估子宫内膜,术中应仔细观察子宫内膜厚度、质地、血管形态及宫腔内有无占位性病变。根据APA患者宫腔镜检查结果,APA病变通常发生在子宫底,也可见于子宫下段或宫颈管。病变通常为单发,偶有多发,病灶直径0.1~6.5 cm。APA的外观形态与子宫内膜息肉、宫颈息肉或子宫黏膜下肌瘤相似,颜色多为黄褐色或灰白色,边界清晰,质地中等,带蒂或蒂宽,凸向宫腔,表面可能有丰富、粗大血管[1,5]。然而,宫腔镜无法准确区分APA与子宫内膜息肉,APA均需术后病理检查确诊[6,7]。
3.3 病理特征
根据世界卫生组织2020年第5版女性生殖肿瘤分类,APA被归类为混合性上皮-间叶肿瘤[8]。组织学上,APA由结构复杂、细胞具有非典型性的子宫内膜腺体和平滑肌瘤或纤维肌瘤性间质组成。腺体结构复杂,大小不一,疏密不等,腺上皮细胞具有不典型性,细胞核大、深染,排列极向紊乱,常伴有鳞状化生,局灶可能出现类似分化好的腺癌样结构,其周围间质为富于细胞的平滑肌或纤维平滑肌组织[9]。本组25例病理组织均具有这些特征,符合APA的诊断标准。
近年来,越来越多的研究探讨APA的免疫表型和免疫组化模式,以发现更多有针对性的鉴别诊断标志物。研究结果显示,ER和PR在APA腺体中广泛表达,Ki-67有不同程度的表达。APA间质成分中a-SMA和SATB2强阳性,CD10阴性或部分阳性,h-caldesmon阴性或局灶阳性[7,10,11]。p16是另一个主要的间质标记物,在大多数APA间质成分中呈弥漫阳性[6]。
3.4 恶变
虽然APA以前被认为是良性病变,但越来越多的研究表明APA具有恶性潜能。APA可以和子宫内膜不典型增生或子宫内膜癌共存[12]。本组宫腔镜术后病理提示APA合并子宫内膜样癌7例(28.0%),明显高于国外文献报道,导致此结果最可能的原因是本研究病例数较少。如何识别具有恶性潜能的APA?首先,APA和子宫内膜癌有许多相同的危险因素,包括肥胖、糖尿病、高血压和雌激素刺激[2,5]。共同的危险因素可能导致了这两种疾病的发生。其次,与子宫内膜不典型增生或子宫内膜癌相关的分子改变可用于APA恶性潜在风险分层,因为这2种病变具有相似的分子改变。已知的异常包括错配修复蛋白缺失、MLH-1启动子高甲基化及PTEN表达缺失[13,14]。此外,在一些APA患者中也发现了CTNNB1和KRAS基因突变[13,15]。然而,从APA发展到癌症的分子遗传机制在很大程度上仍然未知,需要进一步探索。Longacre等[16]在组织形态学上发现55例APA中有25例的结构复杂性与分化良好的子宫内膜腺癌难以区分,因此提出将腺体复杂程度显著(结构指数高)的APA命名为“低恶性潜能APA”(APA of low malignant potential,APA-LMP),以强调其侵犯子宫肌层的潜在风险及与子宫内膜癌的关联。但目前该方案尚未在临床上得到进一步推广。因此,评估危险因素、分子或遗传改变以及形态学可以帮助我们识别APA恶性潜能,从而指导临床治疗。
3.5 治疗
目前,尚无APA的标准治疗方案,可根据患者年龄、婚姻状况、生育要求、个人情况及术后病理结果等制定个体化治疗方案[9,12]。建议绝经期或围绝经期APA患者行全子宫切除术。如果患者年轻或希望保留生育功能或保留子宫,可选择保留生育功能的治疗方案但术后严密随访。
目前,宫腔镜被广泛应用于APA的保守治疗。Di SpiezioSardo等[17]描述的“四步诊疗法”具有最低的疾病进展和复发率,包括步骤1:APA病变完全切除;步骤2:切除病变邻近的子宫内膜;步骤3:切除病变处浅表肌层组织;步骤4:其他部位子宫内膜多点活检。因此,“四步诊疗法”对于希望保持生育功能的APA患者是一个很好的治疗选择。本组18例有生育要求者接受宫腔镜保守性手术,均无复发。
雌激素的持续刺激和孕激素的缺乏可能是APA的主要病理机制。APA的腺体成分ER和PR呈强阳性,提示激素治疗可能对APA患者具有保护作用。药物特别是孕激素,虽不是一线治疗,但可以防止APA复发[12]。最常见的保守治疗方法包括醋酸甲羟孕酮、醋酸甲地孕酮和LNG-IUS。
3.6 随访
接受保守治疗的APA患者有较高的复发率和子宫内膜癌发生率。一旦患者被诊断为APA,需要进行长期随访,但各项研究的随访模式和持续时间各不相同。考虑到APA复发、进展和合并子宫内膜不典型增生、子宫内膜癌的风险,建议行基于病理学的密切随访。Nomura等[18]研究显示宫腔镜术后2~5年是APA复发或恶变的高峰期,建议术后密切随访5年,前2年每3个月行经阴道超声检查、刮宫或宫腔镜活检,此后3年每4~6个月行经阴道超声检查,此后每年行经阴道超声检查。此外,如果患者在随访期间出现异常子宫出血、宫腔占位性病变等症状,应同时进行宫腔镜检查和子宫内膜活检。
APA是一种少见的发生于育龄期女性的子宫肿瘤。异常子宫出血和不孕是APA的主要临床症状。妇科超声检查只能用于对子宫状况的初步评估,建议在宫腔镜下进行子宫内膜病理学检查。免疫组织化学标记物的检测有助于APA的诊断和鉴别诊断。虽然APA组织学上是良性疾病,但有复发和恶变的倾向。因此,子宫切除术是围绝经期及绝经后女性的首选治疗方案。对于希望保留生育功能的APA患者,宫腔镜手术完全切除病变是首选治疗方案,术后需密切随访,定期进行妇科超声、宫腔镜检查和子宫内膜活检。本研究为回顾性研究,且样本量小,保守治疗方案不统一,对于APA的发病机制及治疗方案仍需要前瞻性、长期、大样本临床研究进一步验证。
