穴位刺激联合COX-2抑制剂对乳腺癌骨转移大鼠镇痛、NK细胞活性及PK2蛋白水平的影响
2023-10-21于珊珊张华新
马 强,于珊珊,孟 杰,马 跃,张华新
(唐山市协和医院,河北 唐山 063000)
近年来研究发现,乳腺癌具有趋骨性,大约有65%~80%的晚期患者都会发生骨转移,而发生骨转移的患者都会承受不同程度的骨癌痛折磨,这是晚期患者早出现、最痛苦的症状之一,严重影响着患者的生活质量,因此有效控制骨转移的发生、发展以及有效镇痛是当今肿瘤学研究的重要课题[1]。天然杀伤(Natural killer,NK)细胞是机体内重要的免疫细胞,在固有性免疫应答中发挥着重要作用,此外有研究表明其具有自发溶解肿瘤细胞的能力,不需致敏就可直接杀伤敏感的肿瘤细胞,是抗肿瘤的第一道防线,同时在降低癌症复发和第二种癌症风险上又具有举足轻重的作用,因此有效调控NK细胞活性可成为治疗乳腺癌骨转移的有效靶点[2-3]。近年来研究发现,乳腺癌的发生与生物钟系统紊乱有关,而前动力蛋白2(Prokineticin2,PK2)是一种分泌型的小分子蛋白,近年来研究发现其是节律控制中枢视交叉上核一种重要的节律输出信号分子,在生物昼夜节律的调节中发挥着重要的作用[4-5]。目前临床治疗乳腺癌骨转移的方法很多,但效果多数不理想,因此寻找新的靶点已成为当今世界治疗癌症、控制癌痛的关键和热点之一[6]。中医学中的穴位刺激法作为中医药非常具有代表性的治疗方法之一,具有安全、简便、并发症小与应用范围广等优点。此外,近年来研究表明,其在控制癌痛方面效果也较显著,止痛作用较快且效果可靠,还不会产生依赖性、成瘾性及戒断性,因此被广泛应用于临床[7]。近年来有研究表明,环氧化酶-2(Cyclooxygenase,COX-2)与包括乳腺癌在内多种癌症的发生、发展密切相关,其在促进肿瘤细胞增殖、转移、侵袭及新生血管生成和抑制细胞凋亡方面发挥了必不可少的作用,故COX-2抑制剂应运而生,且临床应用取得了较为理想的效果[8]。因此,本研究就穴位刺激联合COX-2抑制剂对乳腺癌骨转移大鼠镇痛、NK细胞活性及PK2蛋白的作用机制进行研究探讨,为临床治疗提供理论基础。
1 材料与方法
1.1 实验动物
本实验选取北京维通利华实验动物技术有限公司提供的60只SPF级SD雌性大鼠[合格证书为:SCXK(京)2021-0008],平均体质量200~250 g,大鼠单笼喂养,室温生长,模仿12 h昼夜交替,在常温下进行无菌自由进食、饮水2周,按照《实验动物管理条例》规定进行实验。
1.2 实验材料
乳腺癌细胞(型号:YT800239,北京伊塔有限公司);韩氏穴位神经刺激仪(型号:HANS-200,南京济生有限公司);光学显微镜(型号:CX-60,日本OLYMPUS公司);塞来昔布(货号:YT0490,北京伊塔有限公司);VonFrey针刺痛觉测试套件(货号:Aesthesio,深圳瑞沃德有限公司);大鼠平衡测痛仪(型号:ZL-024,安徽耀坤有限公司);热痛刺激仪(型号:BME-410C,天津伯尔尼有限公司);双能线骨密度仪(型号:EXA-3000,上海聚慕有限公司);苏木素染液(货号:E-IR-R120,武汉伊莱瑞特有限公司);伊红染液(货号:J-SG1100-500,上海研谨有限公司);RIPA裂解液(货号:SY4680,北京伊塔有限公司);BCA蛋白浓度测定试剂盒(货号:E112-01,南京诺唯赞有限公司);SDS-PAGE凝胶电泳试剂盒(货号:KGP113,凯基有限公司);NKp30抗体(货号:81349-RP01,北京义翘神州有限公司);NKp44抗体(货号:ATA33975,武汉益普有限公司);NKp46抗体(货号:310305-T36,北京义翘神州有限公司);PK2抗体(货号:YB115Bo01,上海钰博技有限公司);GAPDH抗体(货号:FNab03343,武汉菲恩有限公司);ECL检测试剂盒(货号:CDLG-4911,武汉纯度有限公司);免疫组化试剂盒(货号:YDDEF001,上海羽哚有限公司)。
1.3 实验方法
1.3.1 建模 随机选取50只大鼠,禁食12 h后,腹腔注射3%戊巴比妥纳麻醉大鼠,然后暴露出左侧胫骨内侧面,用一次性椎体成形术开路器钻孔后,取制备好的10 μL,2×105个/mL的乳腺癌细胞悬液缓慢注入骨髓腔内, 注射完毕静置3 min后,针孔用骨蜡密封, 将肌肉及皮肤缝合好并消毒,术后连续4 d给予大鼠注射10 mg/kg的T胺卡纳霉素预防感染。当大鼠出现的体质量下降、毛色灰暗、精神萎靡与患肢运动障碍等症状,则可视为造模成功。造模过程中大鼠死亡3只,其余均建模成功。
1.3.2 分组与干预 随机选取建模成功的大鼠40只,随机数字表将其分为模型(B)组、穴位刺激(C)组、COX-2抑制剂(D)组和穴位刺激联合COX-2抑制剂(E)组,每组10只,取剩余10只健康大鼠作为正常(A)组。对C组大鼠给予穴位刺激治疗[9],首先固定好大鼠头部和尾部,然后用韩氏穴位神经刺激仪取背部双侧L3~5夹脊穴进行单针治疗,刺激参数为音频脉冲调制波、800 Hz和0.6 μA,每次刺激20 min;对D组给予灌胃25 mg/kg的塞来昔布;对E组给予穴位刺激联合塞来昔布治疗。3组均1次/d,治疗30 d,A组、B组同期给予灌胃同体积生理盐水。
1.3.3 大鼠疼痛检测 用Von Frey纤维刺激左足的50%缩足阈值(50% Paw withdrawal threshold,50%PWT),以评价机械痛觉超敏,用大鼠平衡测痛仪测定双侧后肢负重差值表示机械痛觉过敏,用热痛刺激仪测定的热缩足反射潜伏期(Thermal withdrawal latency,TWL),以评价热痛觉过敏,均测量3次取平均值并记录。
1.3.4 标本采集 实验完成后,腹腔注射1%利多卡因麻醉处死大鼠,剥去皮肤和肌肉组织,保留完整的胫骨和骨转移肿瘤,双能线骨密度仪检测骨密度(Bone mineral density,BMD)和骨矿物质含量(Bone mineral content,BMC)后,4%多聚甲醛溶液固定24 h,常规石蜡包埋、切片,放入冰箱密封保存。
1.3.5 大鼠病理组织HE染色 取各组大鼠胫骨组织,二甲苯及梯度乙醇脱蜡后,用苏木素-伊红染液行HE染色,完成后,进行梯度乙醇及二甲苯脱水、透明和中性树胶封片处理,用光学显微镜进行组织病理学观察。
1.3.6 免疫印迹法检测大鼠胫骨组织中NK细胞活化性受体蛋白 取各组胫骨组织清洗、剪碎,用RIPA裂解液在冰上充分裂解10 min,离心后取上清液用BCA法测定蛋白浓度,首先按照试剂盒说明书配置好工作液,然后取等浓度的上清液加入等体积的加样缓冲液,沸水浴3 min,冷却后用电泳仪进行电泳,电泳完成后,半干法进行软膜,转膜条件为80 V 120 min,转膜1.5 h,洗涤后置于封闭液中37℃封闭2 h,加入稀释的NKp30、NKp44及NKp46的一抗(1∶1 000),4 ℃孵育过夜,PBS洗涤3次,加入稀释的辣根酶标记的二抗(1∶5 000),37 ℃孵育2 h;PBS洗涤3次,用ECL荧光试剂盒测定结果,计算与GAPDH比值求得NKp30、NKp44及NKp46蛋白的相对表达含量。
1.3.7 免疫组化检测大鼠胫骨组织中PK2蛋白表达 取各组肾组织,用二甲苯进行脱蜡,乙醇进行梯度水化后,进行组织抗原修复及H2O2灭活内源性过氧化物酶,10%的山羊血封闭2 h,加入稀释的PK2一抗(1∶100),4 ℃孵育过夜,PBS洗涤3次,加入生物素标记的二抗,辣根过氧化物酶标记的链霉卵白素,37 ℃孵育30 min,PBS洗涤3次,DAB显色试剂盒显色10 min,脱水、透明和中性树胶封片后显微镜观察。
1.4 统计学处理
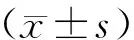
2 结果
2.1 各组大鼠疼痛比较
与A组比较,B组50%PWT、TWL显著降低,差异具有统计学意义(P<0.05),双侧后肢负重差值显著升高,差异具有统计学意义(P<0.05);与B组比较,C组、D组与E组50%PWT、TWL明显升高,差异具有统计学意义(P<0.05),双侧后肢负重差值显著降低,差异具有统计学意义(P<0.05);D组与C组比较差异无统计学意义(P>0.05);E组比D组变化明显,差异具有统计学意义(P<0.05)。见表1。

表1 各组大鼠疼痛指标比较
2.2 各组HE染色比较
A组大鼠骨组织形态完整,骨小梁排列整齐,骨皮质连续,无坏死区域,骨髓腔内充满深染的血细胞,B组骨组织形态遭到破坏,骨皮质出现连续性中断,并可见大量肿瘤细胞浸润,瘤细胞形态不规则,且排列紊乱,细胞核大,异型性明显,与B组比较,C组、D组及E组病理形态明显改善。见图1。
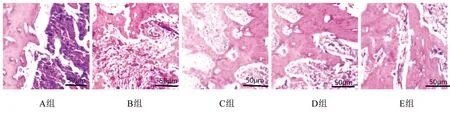
图1 各组大鼠胫骨HE染色(200×)
2.3 各组大鼠BMD、BMC比较
与A组比较,B组BMD、BMC显著降低(P<0.05);与B组比较,C组、D组与E组BMD、BMC显著升高,差异具有统计学意义(P<0.05);D组与C组比较差异无统计学意义(P>0.05);E组比D组升高显著,差异具有统计学意义(P<0.05)。见表2。
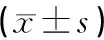
表2 各组大鼠BMD、BMC比较
2.4 各组大鼠NK细胞活化相关指标结果
与A组比较,B组大鼠胫骨组织中NKp30、NKp44及NKp46蛋白表达显著降低,差异具有统计学意义(P<0.05);与B组比较,C组、D组及E组大鼠胫骨组织中NKp30、NKp44及NKp46蛋白表达显著升高,差异具有统计学意义(P<0.05);且D组与C组比较差异无统计学意义(P>0.05);E组比D组升高显著,差异具有统计学意义(P<0.05)。见表3、图2。
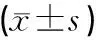
表3 各组大鼠胫骨组织中NKp30、NKp44及NKp46蛋白表达
2.5 各组大鼠胫骨组织PK2蛋白表达结果
与A组比较,B组大鼠胫骨组织中PK2蛋白表达显著降低,差异具有统计学意义(P<0.05);与B组比较,C组、D组及E组大鼠胫骨组织中PK2蛋白表达显著升高,差异具有统计学意义(P<0.05);D组与C组比较差异无统计学意义(P>0.05);E组比D组升高显著,差异具有统计学意义P<0.05)。见表4、图3。
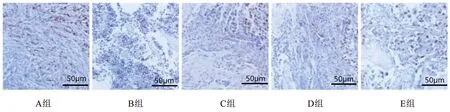
图3 各组大鼠胫骨组织PK2蛋白免疫组化图(200×)
表4 各组大鼠胫骨组织PK2蛋白表达
3 讨论
乳腺癌是严重影响女性生命安全的世界性公共健康问题,而远处转移是引起患者死亡的重要原因,其中骨转移是晚期乳腺癌常见的转移部位,占70%,骨转移可以导致患者出现骨折、骨痛等一系列骨相关事件,严重影响患者的生活质量,甚至可能导致患者死亡[10]。因此,探究乳腺癌骨转移发生、发展的分子机制,寻找新的治疗靶点是目前临床治疗亟待解决的重大课题。所以,本研究就穴位刺激联合COX-2抑制剂对乳腺癌骨转移大鼠镇痛、NK细胞活性及PK2蛋白的作用机制进行研究探讨,以期为临床治疗提供新的思路及治疗靶点。
本研究发现,穴位刺激联合COX-2抑制剂对乳腺癌骨转移大鼠具有显著疗效,可显著改善乳腺癌骨转移模型大鼠骨组织形态,提高BMD、BMC,并起到显著镇痛作用。现代研究发现,针灸穴位治疗具有良好的镇痛作用,且协调胃肠平滑肌功能、改善机体免疫和抗机体氧化应激等,且穴位刺激在我国得到了几千年的应用,随着近几十年的发展,更是受到了国内外专家的认同及肯定,其价格不高,对身体无害,具有良好的镇痛作用[11]。塞来昔布是COX-2抑制剂的一种,是新一代的非甾体抗炎镇痛药,有研究表明对轻、中度癌痛安全有效,并能改善1/3患者生活质量、1/2患者体能状况及2/3患者活动障碍,此外在抑制癌细胞增殖并诱导凋亡方面具有重要作用[12]。有研究表明,针刺可通过兴奋外周传入纤维,调节下行抑制通路、痛觉调制负反馈通路、皮层丘脑环路以及通过缔结组织联轴效应改变病变部位细胞的以钙离子为主通道参与镇痛[13]。而对于乳腺癌骨转移大鼠,针刺L3~5夹脊穴可通过督脉、膀胱经、脊神经和交感神经的神经体液调节作用发挥效应,从而疏通经络、调节气血以治痛,又与心、脑和髓关系密切,影响神气而治痛,穴位刺激联合COX-2抑制剂则可能是通过外治及内治相结合疏通经络、活血化瘀和调和气血,同时增加COX-2抑制剂的有效利用率,从而有效促进血液循环及诱导神经纤维长入、促进内源性阿片肽物质等神经肽类物质的释放,进而抑制神经系统过度兴奋、减少致痛物质释放,最终达到有效镇痛的目的。蔡杨乾等研究表明[14],电针对乳腺癌细胞致骨癌痛大鼠具有显著的镇痛作用,同时还可显著改善NK细胞活性,这与本研究结果类似。
本研究表明,与B组比较,C组、D组、E组大鼠胫骨组织中NKp30、NKp44及NKp46蛋白表达显著升高,且D组与C组比较差异无统计学意义,E组比D组升高显著,这说明穴位刺激联合COX-2抑制剂可显著改善NK细胞活性。NK细胞是固有免疫的执行者,主要是通过其表面活化性与抑制性受体的协同调控发挥作用,近年来研究表明,其在人体内对肿瘤起着非常重要的免疫作用,不经活化就可借助细胞介导的细胞毒作用杀伤肿瘤细胞,发挥特异性抗肿瘤作用,同时也被视为免疫监视网络的一部分,尤其在肿瘤监视中具有重要地位,故当其活性降低时会导致机体免疫监视功能受损,从而致使癌细胞发生免疫逃逸,进而发生转移[15]。自然细胞毒性受体是NK细胞特有的活化性受体,其在NK细胞活化及杀伤作用中发挥着重要作用,而NKp30、NKp44与NKp46是NCRs的重要成员,可有效反映NK细胞活性[16]。对于乳腺癌骨转移大鼠,穴位刺激联合COX-2抑制剂可能是通过加强血液和淋巴循环以及离子的运转,来促进局部代谢及受体相应衔接蛋白表达,从而促进NKp30、NKp44及NKp46等活化受体的表达和促使机体新陈代谢加速等,进而促使NK细胞活化,发挥其免疫监视作用,最终起到对肿瘤细胞快速杀伤和溶解的作用。张知云研究发现[17],NK细胞活性在乳腺癌小鼠中显著降低,给予电针治疗后,NK细胞活性显著改善,这与本研究结果类似。
本研究发现,与B组比较,C组、D组和E组大鼠胫骨组织中PK2蛋白表达显著升高,且D组与C组比较差异无统计学意义,E组比D组升高显著,这说明穴位刺激联合COX-2抑制剂可显著促进PK2蛋白表达。生物钟系统作为机体内循环系统的重要组成部分,其几乎维持着所有脊椎动物细胞代谢的稳定性,同时维持着生物体昼夜节律的正常运转,保障着各种生物的健康和繁衍,故一旦失调就会导致包括癌症在内的多种疾病的发生,乳腺癌同样的发生、发展就与此密切相关[18]。而PK2不仅在炎症细胞的增殖、分化和迁移中起到重要作用,其基因的转录过程产生还对生物节律紊乱地起调控作用,有研究表明敲除小鼠PK2 基因,动物行为和多种生理活动的昼夜节律会被打乱,故可推测促进其表达将成为治疗乳腺癌的有效靶点[19]。而对于乳腺癌骨转移大鼠,穴位刺激联合COX-2抑制剂可能是通过抑制微血管形成来调整内分泌系统,并调控相关分子转导,从而调整细胞功能,促进PK2表达,进而达到调控生物钟系统的目的,最终有效抑制肿瘤细胞生长及转移。李胜吾等研究发现[20],PK2在乳腺癌小鼠中呈低表达,给予电针干预后PK2表达显著升高,这与本研究结果类似。
综上所述,穴位刺激联合COX-2抑制剂对乳腺癌骨转移大鼠具有显著的镇痛作用,并可显著改善NK细胞活性,促进PK2蛋白表达。
