静脉导管用的涂层改性硅橡胶材料制备及应用效果
2023-10-20王茜茜
赵 素,王茜茜,姚 瑶,王 婷
(泸州市人民医院,四川 泸州 646000)
静脉导管作为现代最常用的一种介入型医用器械,对材料的要求也更加严苛。硅橡胶由于其良好的生物相容性,高度的生物惰性,超疏水和柔软易变形等性质,是较为重要的导管制作材料之一。但由于硅橡胶极易吸附细菌的特性,当其作为植入性材料使用时,易在人体内造成细菌感染,造成一些不好的结果。这就使得硅橡胶的使用受到了很大的限制。寻找一种适合的医用导管材料是目前医学邻域较为重要的研究,基于此,试验以王立蓉[5]论文中的方法为参考,制备了一种新型功能涂层对硅橡胶进行改性,提升硅橡胶的抗菌性和生物安全性。
1 试验部分
1.1 材料与设备
主要材料:丙酮(AR),前衍化学;无水乙醇(AR),铭信化工;硅橡胶(生物级 达泽希新材料 );TRIS(AR),德诺弘成化工;稀盐酸(AR),汉羽化工;戊二醛(AR),翰月化工;乙酸(AR),乾耀科技;壳聚糖(AR),亚图生物科技;多巴胺(AR),凯新生物;硫酸铜(AR),众成化工。
主要设备:TP-50C型摇床(靳澜仪器);ZEM15型扫描电镜(泽镜科技);HM-3020型红外光谱仪(恒美电子科技);6880型ICP-MS(美析仪器);YK-SY96A 型酶标仪(云科智能科技)。
1.2 试验方法
1.2.1硅橡胶预处理
(1)提前将硅橡胶制成面积为1×1 cm,厚度为2 mm的片状,然后通过去离子水进行超声清洗,清洗时间和次数分别为20 min和 2次。依次用丙酮和无水乙醇进行超声清洗,清洗时间分别为5、20 min,清洗次数均为2次;
(2)将在100 mL蒸馏水中溶入0.121 14 gTRIS,通过HCl调节溶液pH值至8.5,得到浓度为1 mol/L的 Tris-HCI 溶液;
(3)将20 mg多巴胺粉末溶于10 mL“步骤(2)”配制溶液中,充分搅拌混合均匀,得到质量浓度为2 mg/mL的多巴胺溶液;
(4)将硅橡胶放入“步骤(3)”制备的多巴胺溶液中浸泡,然后在TP-50C型摇床的作用下进行振荡,振荡时间为48 h。倒出反应液后对产物进行超声清洗3 min;
(5)在质量分数2.5%的戊二醛溶液中浸泡样品1 d,冲洗干净后自然晾干。
1.2.2功能涂层的制备
(1)将0.602 5 g壳聚糖溶入40 mL质量分数2%的乙酸水溶液中;
(2)在5 mL蒸馏水中溶入0.060 7 g硫酸铜粉末,得到质量分数1%的硫酸铜溶液;
(3)按照不同的体积比混合壳聚糖溶液和硫酸铜溶液,并调节溶液pH值至4.5,具体配比如表1所示;
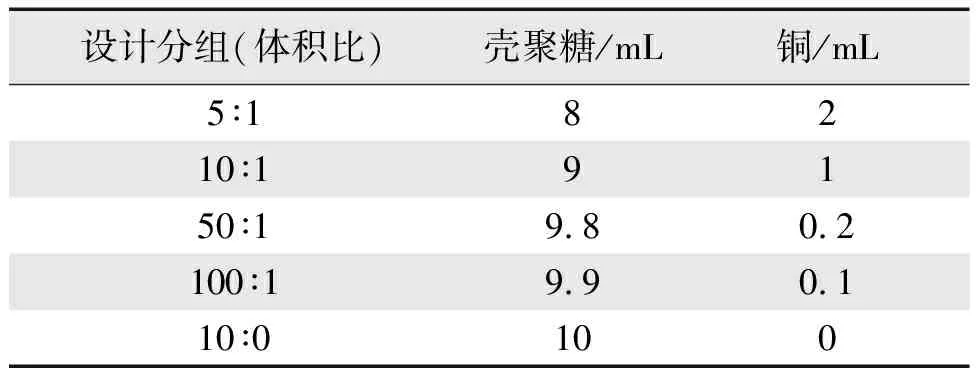
表1 功能涂层配比设计
(4)将制备涂层通过浸提法覆涂在硅橡胶材料上,自然晾干后置于电热鼓风干燥箱内烘干,烘干温度和时间分别为40 ℃和6 h。
1.3 性能测试
1.3.1微观形貌
通过扫描电镜观察材料的微观形貌。
1.3.2红外光谱
通过红外光谱仪分析材料的官能团。
1.3.3抗菌性测试
参照ISO 10993—5:2009标准,进行抗菌性能测定[6-7]。
抗菌率表达式为:
N=C×d×1000/1
(1)
R=(Nc-Nm)/Nc×100%
(2)
式中:N为样品表面菌液浓度,CFU/mL;R为抗菌率,%;Nc为对照组平均菌落数;Nm为实验组平均菌落数;C为每种样品表面平均菌落数;d为稀释倍数。
1.3.4抗菌持久性测试
参照GB/T 16886.12—2005/ISO10993—12:2005进行试验[8-9]。
1.3.5细菌粘附试验
将样品与50 μL浓度为107CFU/mL的菌液共同培养,培养温度和时间分别为37 ℃和24 h。取出样品并用PBS进行清洗后,通过1 mL质量分数4%的多聚甲醛溶液进行固定,固定温度和时间分别为4 ℃和4 h。经过乙醇对固定后的样品进行脱水,然后常温放置过夜,喷金后通过扫描电镜对细菌粘附情况进行观察。
1.3.6铜离子溶出试验
参照ISO 10993—12 标准进行试验[10]。先将样品置于质量分数0.9%氯化钠溶液中浸泡一段时间,然后通过ICP-MS6880型电感耦合等离子体质谱仪对浸出液中铜离子浓度进行测试。
1.3.7细胞毒性试验
通过细胞相对增殖率(RGR)评价材料的细胞毒性,一般来说,RGR超过75%即可认定该材料符合植入标准要求[11-12]。
细胞相对增值率表达式:
RGR=OD实/OD对×100%
(3)
式中:RGR为细胞相对增殖率,%;OD实、OD对为实验组、对照组酶标仪在450 nm 波长的 OD 值。
1.3.8细胞迁移试验
通过Transwell 实验对细胞迁移能力进行评价[13]。
2 结果与讨论
2.1 官能团结构表征
图1为红外光谱结果。
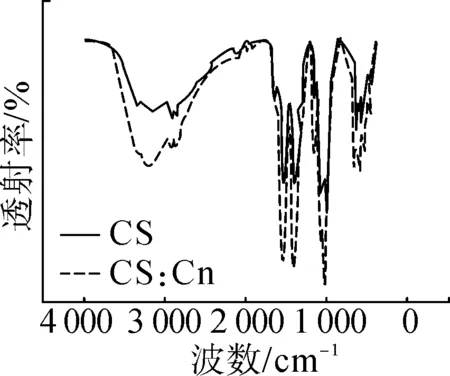
图1 红外光谱测试结果
由图1可知,CS/Cu复合功能涂层中,在1 636.3 cm-1和 636.6 cm-1处存在属于CS的NH2特征峰。同时,羟基的吸收峰发生红移,这是由于壳聚糖与铜离子发生配位反应后,铜取代部分羟基上的氢引起的。而C—O 键的振动吸收峰发生蓝移,这是C—O—Cu 键合引起的官能团变化[14-17]。综上,铜离子与壳聚糖上的活性基团成功发生配位反应,即成功制备出了CS/Cu复合功能涂层。
2.2 抗菌性能研究
2.2.1抗菌性能测试结果
图2为抗菌性能测试结果。
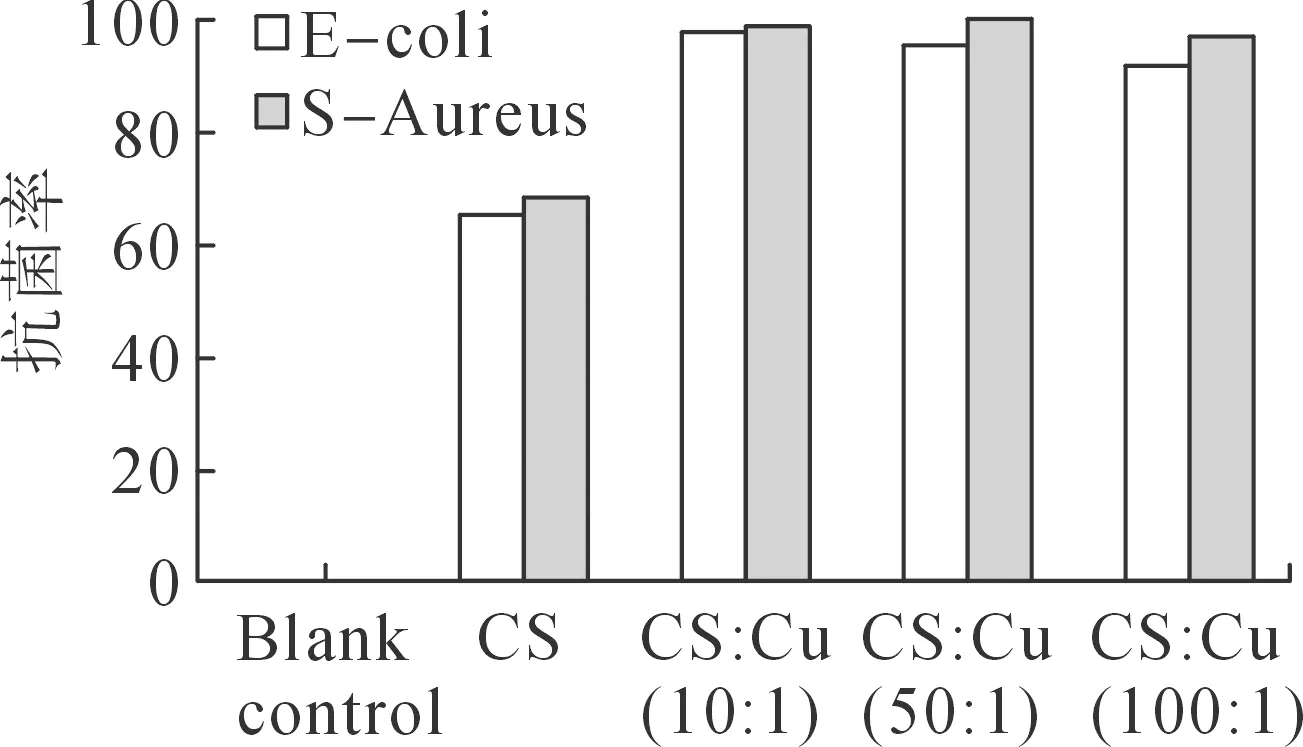
(a)接触24 h后抗菌作用结果
由图2可知,单一CS涂层具备一定的抗菌效果,抗菌率约为65%。而CS/Cu复合功能涂层对两种细菌抗菌率均达到了95%以上,表现出良好的抗菌效果。
2.2.2抗菌持久率测试结果
将样品经过生理盐水浸泡不同时间后,再与金黄色葡萄球菌共同培养1 d,表征涂层的抗菌持久率,结果见图3。
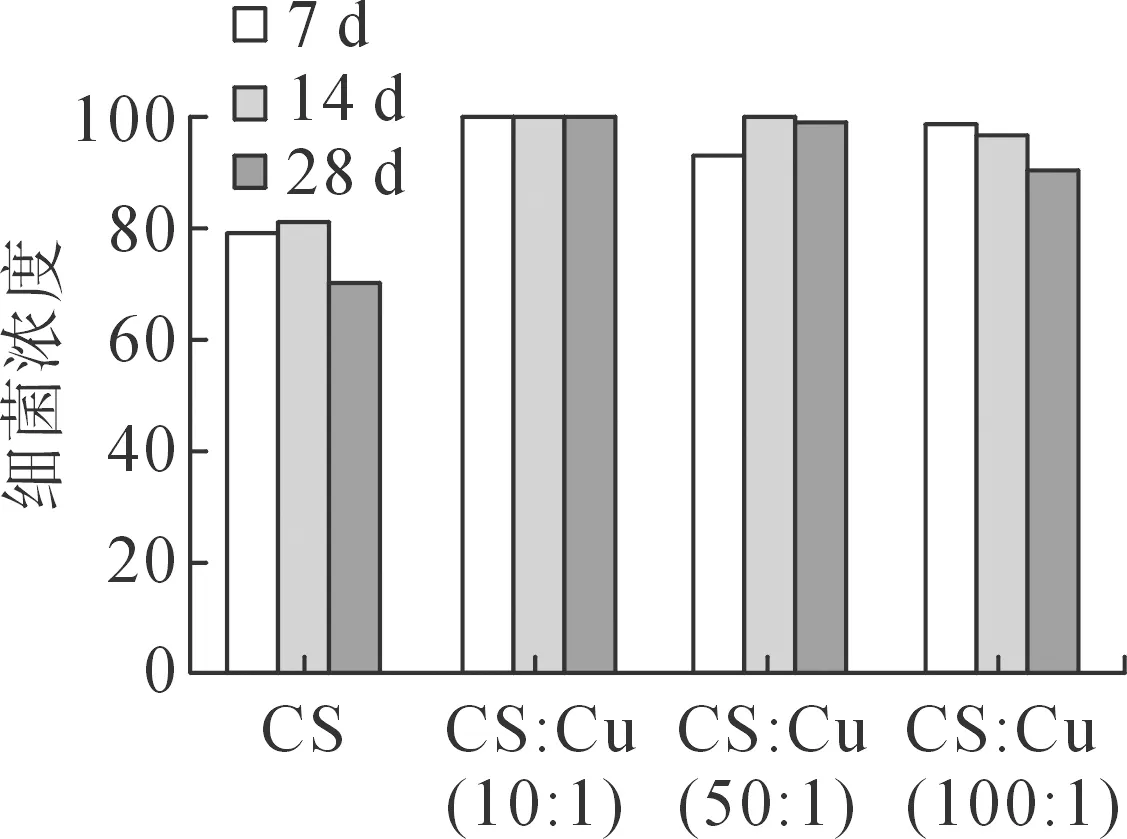
(a)抗菌作用结果
由图3可知,经过生理盐水浸泡后,CS/Cu复合功能涂层的抗菌性几乎不受影响,对金黄色葡萄球菌的抗菌率仍旧超过95%。这说明生理盐水浸泡不会对CS/Cu复合功能涂层的抗菌性产生影响,表现出较强的抗菌持久性。
2.2.3铜离子溶出试验结果
通过浸提液中铜离子累积释放曲线对铜离子溶出情况进行表征,结果见图4。

图4 铜离子溶出情况
由图4可知,随浸泡时间的增加,浸提液中铜离子的释放量也有一定增加。同时还从图4中观察到,当CS/Cu复合功能涂层中含铜量较多时,铜离子的释放量也随之增加。当CS/Cu复合功能涂层中CS∶Cu比例为100∶1时,铜离子溶出量基本不变。而CS∶Cu比例为10∶1时,28 d铜溶出量超过220 mg/L。
2.3 生物安全性试验结果
由于试验制备的材料主要用于静脉导管,因此需要对其生物相容性和生物稳定性进行研究,结果见图5。

(a)涂层与 HUVECs 细胞共同培养
由图5(a)可知,涂层与 HUVECs 细胞共同培养后,细胞浓度并未发生较明显的变化,这就说明内皮细胞可以很好的作用于涂层表面,也就是说制备的涂层表现出良好的细胞相容性,并未表现出明显的细胞毒性。由图5(b)、(c)可观察到,浸提液与 HUVECs 和 HUSMCs 细胞共同培养后,细胞浓度并没有出现较大的变化,这就说明涂层浸提液中的铜离子不对内皮细胞产生明显的抑制或者促进作用。以上结论证明了试验研究的3种配比功能涂层浸提液中,铜离子浓度均在生物安全范围内,可以作为生物植入材料使用[18-20]。
3 结语
(1)红外光谱结果表明,CS/Cu复合功能涂层中,铜取代部分羟基上的氢引起羟基的吸收峰发生红移,C—O 键特征峰蓝移,证明成功制备出CS/Cu复合功能涂层;
(2)抗菌试验结果表明,CS/Cu复合功能涂层对对细菌的抑菌率超过95%,抗菌效果良好;
(3)生理盐水浸泡后,CS/Cu复合功能涂层的抗菌性几乎不受影响,对金黄色葡萄球菌的抗菌率仍旧超过95%,表现出良好的抗菌持久性;
(4)CS/Cu复合功能涂层表面附着的细菌数量明显减少,且细菌的分布较为零散。同时,部分细菌出现皱缩,塌陷,细胞壁破口的现象。证明铜离子能很好的抑制细菌的生长,表现出很好的抑菌性;
(5)当CS/Cu复合功能涂层中CS∶Cu比例为100∶1时,铜离子溶出量变化较小。
