复合微生物菌剂发酵制备生物腐植酸的条件优化及其结构特性
2023-10-19师杨杰靳红梅管益东龙玉娇朱燕云朱宁
师杨杰,靳红梅,管益东,龙玉娇,朱燕云,朱宁*
(1.江苏省农业科学院农业资源与环境研究所,农业农村部长江下游平原农业环境重点实验室,南京 210014;2.南京信息工程大学环境科学与工程学院,南京 210044;3.江苏省有机固体废弃物资源化协同创新中心,南京 210095)
近年来,我国化肥过量施用带来了一系列环境污染、土壤质量退化和农产品品质下降等问题。随着农业发展方式的转变,开发绿色高效新型肥料是保障我国农田生态安全和农产品质量安全的重大需求。腐植酸是一类以芳香环和脂肪链为基本结构的非均相高分子聚合物[1],具有酸性、亲水性、界面活性、阳离子交换、络合及吸附能力[2]。腐植酸含有大量有机质和多种活性官能团,可以改良土壤结构,提高土壤保水、保肥能力,促进植物生长发育,增强作物抗逆性[3]。腐植酸已成为农业中土壤调理剂、植物抗旱剂和复合肥料的主要有效成分,其开发利用受到肥料研究者和生产企业的重视。
目前,商品腐植酸的规模化生产主要是利用化学降解或氧化的方法从泥炭、褐煤及风化煤中提取,在制备过程中需要消耗大量的酸、碱等化学物质,还需要高温、高压等剧烈条件及严格的工艺和特殊设备[4-5]。生物腐植酸是以有机废弃物为原料,在人工控制条件下经微生物发酵制备获得,因其生产成本低、处理条件温和、无二次污染等优点,受到研究者的广泛关注[6]。与矿物腐植酸相比,生物腐植酸分子量小、含有活性基团多,易被植物吸收,具有抗二价离子、抗硬水、抗酸碱的特性,同时含有作物生长所需的氮磷钾养分以及氨基酸、有机酸、糖类、生物酶等生物活性物质[7]。以木质纤维素类原料生产生物腐植酸是当前腐植酸研究领域的热点。尚校兰等[8]分别利用微生物发酵法和化学法以巨菌草为底物制备腐植酸,发现利用毛霉发酵制备的腐植酸含量是10%氨水提取的腐植酸含量的1.45 倍。王思同等[9]以枯草芽孢杆菌、地衣芽孢杆菌、乳酸菌和酵母菌作为菌剂,采用堆肥的方式发酵菌糠制备生物腐植酸,36 d后生物腐植酸含量达23.3%。吕志伟等[10]利用微生物菌群发酵玉米秸秆生产生物黄腐酸,发酵7 d后,生物黄腐酸产量为15.70%。然而,利用木质纤维素类原料生产生物腐植酸仍存在以下问题:(1)有机废弃物中各类组分的微生物降解转化是影响其腐殖化进程的限制因素,目前发酵菌剂大多是单一或少数几种菌种混合而成,没有根据原料组成特点针对性设计,导致原料降解转化速率慢,发酵生产周期长,腐植酸产率低;(2)固态发酵工艺尚不成熟,发酵条件和参数不明确,导致发酵过程的稳定性差,生物腐植酸产品的质量难以保证。因此,极有必要开发高效复合微生物菌剂并进行发酵条件优化,这对于缩短腐植酸发酵生产周期、提高腐植酸产量具有重要的现实意义。
本研究从腐殖化作用活跃的森林环境样品中分离筛选高效腐殖化功能菌株,并进行发酵微生物菌剂复配,以常见农业废弃物为底物,探究不同发酵条件对腐植酸产量的影响,明确生物腐植酸的最佳发酵条件,通过元素分析和红外光谱研究生物腐植酸的结构特性,以期为生物腐植酸的产业化生产和应用提供参考依据。
1 材料与方法
1.1 供试材料
1.1.1 环境样品
本研究分别从吉林松花江三湖国家级自然保护区(42°57'N,127°09'E)、内蒙古额尔古纳湿地(50°19'N,120°14'E)和云南苍山(25°48'N,100°05'E)采集枯木、森林凋落物和表层土样品。
1.1.2 农业废弃物
本研究所用农业废弃物包括麦秸、麸皮、米糠、玉米芯、花生饼、豆粕,其中麦秸取自江苏省农业科学院六合试验基地,麸皮、米糠、玉米芯、花生饼、豆粕购自湖南省商大农贸有限公司,各原料基本性质见表1。
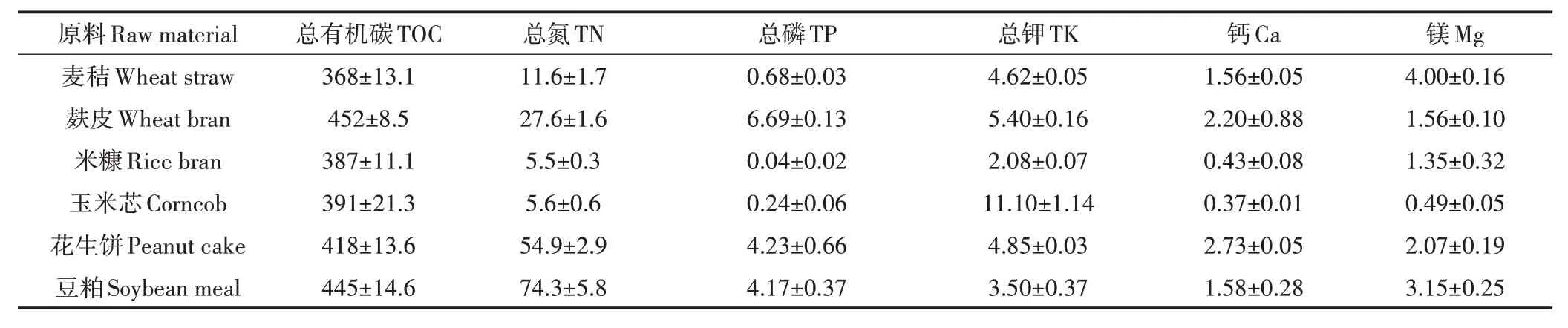
表1 原料基本性质(g·kg-1)Table 1 Basic properties of raw materials(g·kg-1)
1.1.3 培养基
真菌分离培养基(马铃薯葡萄糖琼脂培养基PDA):马铃薯6.00 g,葡萄糖20.00 g,琼脂10.00 g,补加蒸馏水至1 L,121 ℃灭菌15 min。
腐殖化功能菌株筛选培养基:发酵体系为150 mL 三角瓶,含麦秸3.00 g、(NH4)2SO40.30 g、蛋白胨0.15 g、麸皮0.30 g、KH2PO40.45 g,调节pH 为6、含水率至80%,121 ℃灭菌30 min。
生物腐植酸发酵培养基:发酵体系为150 mL 三角瓶,含麦秸3.00 g、麸皮0.45 g、KH2PO40.45 g,调节pH为6、含水率至80%,121 ℃灭菌30 min。
1.1.4 商品腐植酸
供试商品腐植酸为济农牌液体腐植酸水溶肥,主要以碱溶液作为萃取剂从风化褐煤中提取。购于江苏省农科院明天种业公司,相关技术指标为:腐植酸≥40 g·L-1,总养分(N+P2O5+K2O)≥800 g·L-1。
1.2 方法
1.2.1 真菌菌株分离
取1 g 环境样品充分悬浮于10 mL 无菌水中,梯度稀释至10-4、10-6、10-8,吸取200µL悬液均匀涂布于PDA 固体培养基,置于28 ℃培养3~5 d。待长出菌落后,挑取平板上生长良好且形态特征不同的单菌落,转接至新的PDA 固体培养基进一步纯化并传代2~3次。将分离获得的真菌菌株转接于PDA 斜面培养基培养,置于4 ℃下保存备用。
1.2.2 菌株鉴定
真菌菌株基因组DNA 提取采用Omega 公司的EZNA Fungal DNA Mini Kit 试剂盒进行提取;利用引物ITS1(正向引物:5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(反向引物:5'-TCCTCCGCTTATTGATATGC-3')扩增ITS 区域[11],纯化后的扩增产物由生工生物工程(上海)股份有限公司进行测序;将获得的测序结果提交NCBI 数据库进行Blast 同源性分析,采用MEGA5.2软件邻位连接法构建系统进化树。
1.2.3 腐殖化功能菌株筛选
(1)种子液制备。28 ℃培养7~10 d,待菌丝长满整个平板后,用灭菌竹签刮取培养基表面孢子加入到适量无菌水中,充分振荡制成孢子悬液,利用血球计数板法计算孢子浓度,然后用无菌水调整孢子浓度至107个·mL-1备用。
(2)腐殖化功能菌株的初筛。将种子液按照1×107个·g-1(以干质量计,下同)接种于灭过菌的筛选培养基,无菌条件下搅拌均匀,于28 ℃发酵15 d。发酵结束后,测定腐植酸产量、木质纤维素降解酶活力,并进行分子生物学鉴定。
(3)菌株产腐植酸能力测定。发酵结束后的样品参照国际腐殖质协会规定的方法提取腐植酸[12],即在1 g 样品中加入10 mL 提取液(0.1 mol·L-1NaOH+0.1 mol·L-1Na4P2O7,体积比为1∶1),室温下振荡2 h,4 000 r·min-1离心10 min,提取上清液,去掉滤渣,滤渣按照上述操作重复3次提取过程。滤液为总腐植酸,取1/3测定腐植酸,剩下2/3 用6 mol·L-1的盐酸酸化至pH 1.0~2.0,充分搅拌,室温下静置过夜,4 000 r·min-1条件下离心10 min,沉淀物为胡敏酸,沉淀用0.1 mol·L-1KOH溶解,采用重铬酸钾氧化法(《水溶肥料腐植酸含量的测定》NY/T 1971—2010)测定腐植酸碳含量。
(4)菌株产木质纤维素降解酶能力测定。分别以Whatman No.1滤纸、羧甲基纤维素和山毛榉木聚糖为底物,采用DNS 法测定滤纸酶、内切葡聚糖酶和木聚糖酶活力[13],分别以2,6-DMP、藜芦醇和2,2’-连氮基-双-(3-乙基苯并噻唑啉-6-磺酸)(ATBS)测定锰过氧化物酶、木质素过氧化物酶和漆酶酶活力[14]。
1.2.4 菌株复配
采用对峙培养法考察腐殖化功能菌株之间的相容性。用灭过菌的打孔器(直径5 mm)分别取活化的直径相同的功能菌株菌饼接于平板(直径9 cm)直径线上一侧、距平板边缘3 cm 处,将不同的功能菌株菌饼接于直径线另一侧对称处,即两株菌饼在平板同一直径线上相距3 cm、各距平板边缘3 cm,将筛选出来的功能菌株按照上述方法两两组合,28 ℃培养7 d,每日观察菌落的形态和生长情况,选择相容性良好的功能菌株进行复配。按照1.2.3 中种子液制备方法制备功能菌株种子液,将相同孢子浓度等量混合均匀,获得复配后的液体菌剂。
1.2.5 优化固态发酵产腐植酸条件
采用单因素试验优化发酵条件。在1.1.3 生物腐植酸发酵培养基的条件下,种子液接种量为1×107个·g-1,将碳源分别设为麦秸、麸皮、玉米芯、米糠,将氮源分别设为尿素、硫酸铵、蛋白胨、豆粕、花生饼,以考察碳源和氮源对生物腐植酸产量的影响。接着在最优碳源和氮源的基础上,将碳氮源质量比分别设为1∶1、1∶0.8、1∶0.5、1∶0.2,将初始含水率分别设为50%、60%、70%、80%,将接种量分别设为105、106、107、108个·g-1,于28 ℃发酵7 d 后测定生物腐植酸产量,分别考察相应因素对生物腐植酸产量的影响。最后,在最佳培养基组成和最佳培养条件下分别发酵5、10、15、20 d,测定生物腐植酸产量,考察发酵时间对生物腐植酸产量的影响。每个处理3 个平行。
1.2.6 生物腐植酸性质分析
将生物腐植酸与市售标准腐植酸冻干得到固体粉末样品,比较二者的元素组成和表面官能团种类。
(1)元素组成分析。用德国VARIO IP20 型元素分析仪测定两种腐植酸组分的C、N、H、S 元素含量[15],通过操作软件自动计算出待测样品中元素的百分比含量。用灼烧法测定腐植酸灰分,利用差减法计算得到腐植酸中O元素含量。
(2)红外光谱。采用傅里叶红外光谱(FTIR)对生物腐植酸、市售腐植酸进行特征官能团分析。取1~2 mg 冻干固体,利用傅里叶变换红外光谱仪(Nicolet Is50,赛默飞世尔科技公司,美国)进行红外光谱分析,波数采集范围为4 000~400 cm-1。红外谱图数据处理[16]:将样品透射率转换为吸光度之后,进行基线自动矫正,利用OMNIC9 软件对样品图谱进行峰面积计算。
1.2.7 数据分析
采用Excel 2019 进行数据处理,采用SPSS Statistics 26.0v.进行不同样本数据之间的差异显著性分析,多重比较采用Duncan 法(α=0.05),采用Origin 2019b制图。
2 结果与分析
2.1 真菌菌株分离及鉴定
本研究从吉林、内蒙古和云南的枯木、森林凋落物和表层土样品中筛选得到14 株真菌,并对其进行编号。分别提取这14 株菌总DNA 扩增ITS 序列并测序,提交至NCBI 数据库获得登录号,并在NCBI 数据库比对选取与每个真菌菌株序列同源性最高的前10个菌株ITS序列,使用MEGA5.2软件通过邻接法构建系统发育树。通过与已知菌株序列进行比对,获得其分类学地位信息,包括5 株深绿木霉(OR041595、OR041596、OR041593、OR041594、OR041605)、1株杂色曲霉(OR041599)、1 株裂褶菌(OR041598)、1 株拟康氏木霉(OR041601)、1 株哈茨木霉DLT21(OR041602)、1 株康氏木霉(OR041603)、1 株绒毛木霉(OR041604)、1 株硫色木霉(OR041606)、1 株雅致小克银汉霉(OR041607)、1 株托姆青霉(OR041604),其中木霉属真菌数量最多,且在3 个采样地均有分布,表明木霉菌对不同环境均有较强适应性。
2.2 腐殖化功能菌株筛选和复配
以小麦秸秆为原料,分别利用14 株真菌进行固态发酵,腐植酸产量如图1 所示。由图1a 可看出,哈茨木霉DLT21 总腐植酸产量最多,为299 mg·g-1,其次是绒毛木霉DLS32 和裂褶菌JLD3,其总腐植酸产量分别为281、281 mg·g-1。总腐植酸产量最少的是雅致小克银汉霉DLS21,为125 mg·g-1。不同属菌株的腐殖化能力差异明显,这归因于菌株的产酶能力不同,对底物的降解转化能力不同。由图1b 可看出,哈茨木霉DLT21 胡敏酸产量最高,为96 mg·g-1,其次是杂色曲霉JLS2,为83 mg·g-1,这两株菌胡敏酸产量显著高于其他菌株。

图1 功能菌株的生物腐植酸产量Figure 1 BHS production of functional strains
微生物在降解木质纤维素过程中会产生腐植酸的重要前体酚类物质[17],因此木质纤维素降解酶活力是筛选腐殖化功能菌株的重要指标。各功能菌株酶活力如图2 所示。对于纤维素酶,裂褶菌JLD3、硫色木霉DLL42 和杂色曲霉JLS2 滤纸酶活力显著高于其他菌株酶活(图2a)。裂褶菌JLD3、杂色曲霉JLS2 和绒毛木霉DLS32 内切葡聚糖酶活力明显高于其他菌株酶活(图2b)。对于半纤维素酶,在14 株菌中托姆青霉DLL22 木聚糖酶活力最高,其次是裂褶菌JLD3和哈茨木霉DLT21(图2c)。对于木质素降解酶,拟康氏木霉DLS12高产锰过氧化物酶,其余菌株产锰过氧化物酶能力无显著差异(图2d)。所有菌株均未检测到木质素过氧化物酶和漆酶活力。

图2 功能菌株的木质纤维素降解酶活性Figure 2 Lignocellulose-degrading enzyme activities of functional strains
以菌株产腐植酸和产酶能力为衡量指标选择腐殖化功能菌株,14 株菌中哈茨木霉DLT21、绒毛木霉DLS32、裂褶菌JLD3 和拟康氏木霉DLS12 腐植酸产量最高,裂褶菌JLD3 产纤维素酶和半纤维素酶能力强于其他菌株,拟康氏木霉DLS12的木质素降解酶活力较高,因此选择这4 株功能菌株进行菌剂复配。虽然托姆青霉DLL22、硫色木霉DLL42和杂色曲霉JLS2也表现出较高的产腐植酸或产酶水平,但由于这些真菌在发酵过程中可能产生真菌毒素,所以在菌剂复配中予以排除。
为了考察四株功能菌株的相容性,采用对峙培养法将功能菌株两两组合接于平板,观察菌株生长情况,各功能菌株相容性结果如图3 所示,各平板两菌株之间未出现抑菌圈且交叉点生长良好,表明这四株真菌均不产生拮抗作用。将这四株真菌按照相同孢子浓度等量混合均匀,获得复配后的液体菌剂,用于后续发酵条件优化。
图3 功能菌株的相容性Figure 3 Compatibility of functional strains
2.3 复合菌剂发酵条件优化
2.3.1 碳源对腐植酸产量的影响
不同碳源含类腐殖质的结构复杂程度不同,对真菌转化碳源底物形成腐植酸具有重要影响[18]。如图4a 所示,当以麸皮、玉米芯为碳源时,总腐植酸、胡敏酸产量最高,且无显著差异性。但以麸皮为碳源时,总腐植酸产量最高,为178 mg·g-1,这可能是由于麸皮的TOC、TN、TP和TK含量高于其他碳源(见表1)。另外,麸皮中含有的矿物质、维生素等营养物质,能够促进菌体代谢,所以选择麸皮作为最佳碳源。
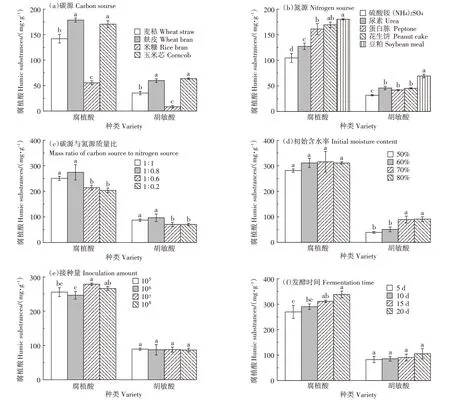
图4 不同发酵条件对生物腐植酸产量的影响Figure 4 Effects of different fermentation conditions on the yield of humic substrance
2.3.2 氮源对腐植酸产量的影响
不同氮源可以为腐殖化过程提供不同的前体物质[19]。氮源对腐植酸产量影响如图4b 所示,当豆粕作为氮源时,腐植酸产量显著高于其他氮源,其总腐植酸、胡敏酸产量分别为180、69 mg·g-1,这可能是因为豆粕中TOC 和TN 含量较高,并且豆粕中丰富的蛋白质提供了更多氨基酸等腐植酸前体物质,经微生物转化作用产生了更多的腐植酸。
2.3.3 碳氮源质量比对腐植酸产量的影响
碳氮源形成的C/N 影响着有机质的分解速率和降解程度,进而影响腐植酸的形成[20]。由图4c 可知:当碳氮源质量比较小时,总腐植酸产量显著高于碳氮源质量比较大时的总腐植酸产量。当调节碳氮源质量比为1∶0.8 时,总腐植酸产量达到最高,为275 mg·g-1,此时胡敏酸的产量也是最高的,为96 mg·g-1。
2.3.4 初始含水率对腐植酸产量的影响
固态发酵培养基的初始含水率通过影响通氧量从而影响微生物发酵的腐植酸产量[21]。图4d 表明调节发酵培养基含水率对总腐植酸产量无显著差异性,但培养基含水率为70%时,总腐植酸产量最高,为316 mg·g-1,此时对应的胡敏酸产量也较高,为90 mg·g-1。
2.3.5 菌剂接种量对腐植酸产量的影响
接种量会直接影响菌株在培养基质中的发酵速度和生产效率。功能菌株菌剂接种量对腐植酸产量的影响如图4e 所示,总腐植酸产量随菌剂接种量改变而改变,而胡敏酸产量随着菌剂接种量的改变无显著性差异。当孢子接种量为107个·g-1时,总腐植酸产量最高,为279 mg·g-1,此时胡敏酸产量为88 mg·g-1。
2.3.6 发酵时间对腐植酸产量的影响
由图4f可知,腐植酸产量随着发酵时间的延长呈增加趋势,总腐植酸产量随着发酵时间延长逐渐增加,当发酵20 d 时,总腐植酸产量均最高,分别为338 mg·g-1;胡敏酸产量随着发酵时间延长呈略微增加趋势,但并不显著,其产量在82~105 mg·g-1之间。当发酵时间分别为15 d和20 d时,总腐植酸产量无显著差异,考虑到实际生产成本,因此选择发酵15 d 作为最优发酵时间,此时总腐植酸产量为311 mg·g-1。
2.4 生物腐植酸结构特性分析
2.4.1 生物腐植酸元素含量分析
腐植酸主要由碳(C)、氢(H)、氧(O)三种元素组成,其次含有少量氮(N)和硫(S)元素[22]。由表2 可知,生物腐植酸中C 元素含量最多,为41.03%,O 元素次之,为26.09%,均低于商品腐植酸C、O 元素含量,而生物腐植酸中N、H 元素含量分别是商品腐植酸的4.63 倍和2.48 倍,这进一步影响了两种腐植酸的C/H、O/C、C/N。C/H 被认为是腐植酸分子缩合度的评价指标,C/H 值越小,表明腐植酸缩合度越低[23],生物腐植酸的C/H 小于商品腐植酸,表明生物腐植酸缩合度低于商品腐植酸。O/C 表征腐植酸的氧化程度,反映了腐植酸中含氧官能团含量,O/C 值越大,说明腐植酸中含氧官能团越多[24],生物腐植酸O/C 值小于商品腐植酸,表明生物腐植酸含氧官能团含量低于商品腐植酸。另外,生物腐植酸的C/N 值小于商品腐植酸,表明生物腐植酸含氮基团较多。

表2 腐植酸元素分析Table 2 Element analysis of humic substrance
2.4.2 生物腐植酸红外光谱分析
FTIR 是研究腐植酸官能团种类的重要方法之一。图5 中峰1(3 500~3 200 cm-1)是的伸缩振动,化合物来源主要为多糖、纤维素[25];峰2、峰3(3 000~2 800 cm-1)是指表征脂肪和脂质类化合物的亚甲基CH2的伸缩振动[26];峰4(1 630 cm-1)是表征羧酸根的伸缩振动[27];峰5(1 590~1 540 cm-1)表征酰胺类化合物的伸缩振动;峰6(1 480~1 340 cm-1)代表羧酸根离子的非对称伸缩振动;峰7(1 320~1 240 cm-1)代表羧基上的伸缩振动;峰8(1 120~990 cm-1)代表酚类或醇类上的不对称伸缩振动;峰9(920~800 cm-1)代表伸缩振动。生物腐植酸的官能团种类与商品腐植酸类似,但两种腐植酸的官能团含量存在较大差异,生物腐植酸中峰1、峰2、峰3、峰5、峰8代表的基团伸缩振动较强烈,表明生物腐植酸中含有较多的羟基、亚甲基和酰胺基官能团。
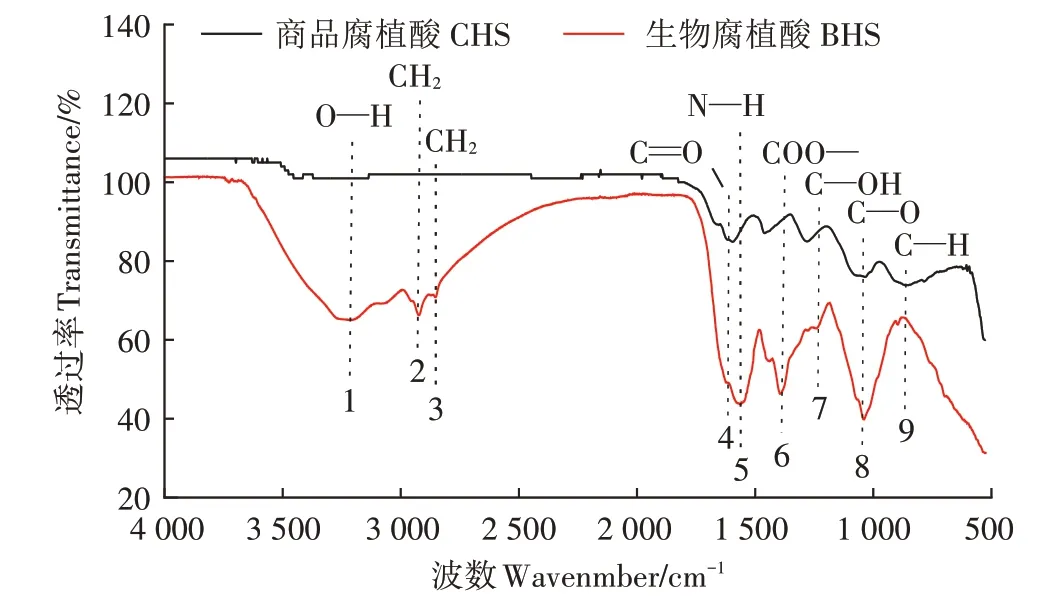
图5 腐植酸的FTIR图谱Figure 5 FTIR spectra of humic substrance
3 讨论
不同微生物的木质纤维素降解酶系组成不同,导致其对木质纤维素的降解转化能力也存在差异,进而影响菌株的腐殖化能力。本研究筛选得到的裂褶菌JLD3、绒毛木霉DLS2、哈茨木霉DLT21和拟康氏木霉DLS12四株功能菌株可以分别产生纤维素降解酶、半纤维素降解酶和木质素降解酶,能够降解发酵原料中的大分子有机物,生成腐植酸前体物质,复配后菌剂的腐植酸产量较单一菌株均有所提高。本试验中对复合菌剂发酵条件优化后腐植酸产量达到338 mg·g-1,较优化前腐植酸产量提高了32%~128%,而冀颐之等[28]利用解淀粉芽孢杆菌、地衣芽孢杆菌和长枝木霉组成复配菌剂,以果渣为底物发酵产生的黄腐酸仅为103 mg·g-1。陈勇强[29]以玉米秸秆和麸皮作为底物,利用枯草芽孢杆菌进行发酵条件优化,其腐植酸产量为196 mg·g-1。本研究结果较二者分别提高了202%和59%。此外,本研究经过发酵条件优化,接种复合菌剂制备腐植酸显著缩短发酵周期,15 d腐植酸产量达34%,而王思同等[9]利用细菌菌剂进行36 d 的菌糠发酵,腐植酸产量为23%。本文结果表明,根据原料组成特点进行功能菌株的合理复配,可以显著提高农业废弃物发酵制备生物腐植酸的产量。
本研究利用复配的微生物菌剂对常见的农业废弃物进行固态发酵,对发酵条件优化后提高了生物腐植酸产量。本研究表明,固态发酵中碳源、氮源以及碳氮源质量比对腐植酸产量的影响较其他发酵条件的影响更大。以麸皮为碳源时,复合菌剂产腐植酸量明显高于其他碳源,这可能是因为麸皮中富含的具有生理活性的酚类物质是腐植酸形成的重要前体物质[30-31]。以豆粕为氮源时复合菌剂产腐植酸量显著高于其他氮源,这可能是因为豆粕中含有的蛋白质及少量可溶性多糖有助于微生物的生物量积累[32]。有研究指出,腐植酸的酚型化合物和醌型化合物等前体物质在微生物作用下与蛋白质、氨基酸等氨基化合物经过复杂作用形成腐植酸[33],因此通过调节麸皮和豆粕的质量比,使发酵体系中酚类物质与氨基化合物达到适宜比例,从而显著提高了复合微生物菌剂发酵的腐植酸产量。本研究制备生物腐植酸用的麦麸、豆粕等原料都属于农副产品、价格低廉,按照腐植酸产率为原料30%计算,生产每千克腐植酸成本为63元,而市场现有腐植酸价格普遍较高,成本为每千克75~140 元,因此本研究技术在实现农业废弃物原料高效转化的同时,极大地降低了生物腐植酸的生产成本,具有较强的市场竞争力。
两种不同来源的腐植酸在元素组成及FTIR 图谱具有相似特征,两种腐植酸中C、O 元素含量均最高,腐植酸结构中都存在等官能团,这与前人研究结果一致[34]。本研究中生物腐植酸的C、O 元素含量都略低于商品腐植酸,这可能是因为商品腐植酸的提取方式改变了其组成,使得商品腐植酸C、O 含量较高。生物腐植酸的N、H 元素含量均高于商品腐植酸,这可能是制备生物腐植酸的原料中蛋白质含量较高所致。另外,两种腐植酸官能团种类相似,但官能团含量存在较大差异性,生物腐植酸中、CH2和的伸缩振动较强烈,表明生物腐植酸中此类官能团含量较高,与生物腐植酸中N、H元素含量高相一致,这主要是由于生物腐植酸中含有较多糖类、脂质类物质。
4 结论
(1)本研究从森林环境样品中筛选获得4 株具有高效木质纤维素腐殖化能力的真菌菌株,包括哈茨木霉DLT21、绒毛木霉DLS32、裂褶菌JLD3 和拟康氏木霉DLS12,各菌株之间具有良好的相容性和互补的降解酶系,通过4株真菌组配构建了复合微生物菌剂。
(2)利用复合微生物菌剂进行产腐植酸固态发酵条件优化,明确最佳发酵条件为:麸皮为碳源、豆粕为氮源、碳源与氮源质量比为1∶0.8、培养基含水率为70%、孢子接种量为107个·g-1(以干质量计),发酵20 d 时,总腐植酸产量达338 mg·g-1。
(3)与商品腐植酸相比,本研究制备获得的生物腐植酸具有更高的N、H 元素含量以及更多的羟基、亚甲基和酰胺基官能团。
