赤羽病病毒G1蛋白生物信息学分析及截短基因的真核表达
2023-10-19胡世享叶玲玲肖妍卓娜陈朝林汪琳蒲静陈培富艾军
胡世享,叶玲玲,肖妍,卓娜,陈朝林,汪琳,蒲静,陈培富*,艾军*
(1. 云南农业大学,云南 昆明 651000;2. 昆明海关技术中心,云南 昆明 651000;3. 天津海关动植物与食品检测中心,天津 300041;4. 中国海关科学技术研究中心,北京 100026)
赤羽病又称阿卡斑病(Akababe disease,AKA),由赤羽病病毒(Akabane virus,AKV)引起的牛、羊传染病,主要症状有早产、妊娠损失、死胎、先天性关节弯曲以及多水性无脑畸形症[1-2]。AKV属于泛布尼亚病毒科、辛波病毒群[3-4],单股负链RNA病毒[5],是一种具有囊膜、纤突的球状虫媒性病毒。
AKV基因组由3个RNA片段组成,即大(L)、中(M)、小(S)。L-RNA发挥催化作用,协助病毒复制和转录;M-RNA表达合成促使机体产生中和抗体及血凝抑制抗体的囊膜糖蛋白G1和G2[6];S-RNA编码具有群特异性抗原表位的核衣壳蛋白[7-8]。作为AKV主要囊膜蛋白G1,其氨基端位于病毒粒子表面,能被脊椎动物宿主免疫系统所识别,从而诱导宿主产生强烈的特异性免疫反应,最终产生保护性的中和抗体[9-10]。研究发现通过3种不同制剂对小鼠进行免疫试验,证实G1蛋白含有中和抗原决定簇,并引起小鼠的保护性免疫[11-12]。G1蛋白是决定AKV致病力及感染性的重要基因产物,也是刺激机体产生中和抗体的主要结构蛋白,对疫病监测和防控都具有重要意义。鉴于G1蛋白对AKV起着重要作用,本文对G1基因编码的蛋白质进行生物信息学分析,从中筛选结构稳定的优势抗原区域,并在此基础上利用昆虫细胞杆状病毒表达系统对截短基因进行表达,为进一步深入了解AKV G1的免疫特性及生物学特性奠定基础,也为进一步研制以赤羽病G1截短表达产物为抗原的检测试剂提供物质基础。
1 材料与方法
1.1 质粒、菌种和细胞
大肠杆菌DH10Bac、sf9昆虫细胞、pFastBac HTB质粒、AKV病毒KR260715.1病毒株及阳性血清均由昆明海关技术中心动检实验室保存;大肠杆菌DH5α感受态细胞购于北京擎科生物科技有限公司。
1.2 主要试剂
质粒抽提试剂盒、胶回收试剂盒、限制性内切酶EcoRⅠ和PstⅠ、DNA Marker、蛋白Marker、T4连接酶、BSA、DAB均购自宝生物工程(大连)股份公司;Cellfectin转染试剂制备盒由Invitrogen有限公司生产;胎牛血清、Grace’s细胞培养基购自GBICO公司;兔抗山羊IgG-HRP购自武汉博士德生物工程有限公司;高效RIPA组织/细胞裂解液、PMSF均购自Solarbio公司。
1.3 方法
1.3.1 生物信息学分析
利用在线软件 Protparam(http://www.expasy.org/tools/protparam.html)分析AKV G1结构的基本生化特性;软件NetPhos3.1(https://services.healthtech.dtu.dk/service.php?NetPhos-3.1),Sig-nalP4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)预测蛋白中存在的潜在磷酸化位点;软件NetOGlyc4(www.cbs.dtu.dk/services/NetOGlyc),NetNGlyc1.0(www.cbs.dtu.dk/services/NetNGlyc)预测蛋白 N-糖基化潜在位点;利用在线工具 TMHMM(v2.0)(www.cbs.dtu.dk/services/TMHMM)预测G1蛋白的跨膜区结构;利用 Cell-PLoc2.0(www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2)软件预测蛋白的亚细胞定位;利用在线工具SOPMA(https://links.jianshu.com/go?to=http%3A%2F%2Fnpsa-pbil.ibcp.fr%2Fcgi-bin%2Fnpsa_automat.pl%3Fpage%3Dnpsa_sopma.html)预测G1蛋白的二级结构;利用 Phyre2(www.sbg.bio.ic.ac.uk/phyre2)预测蛋白的三级结构,并用 RasWin软件进行查看;利用在线软件IEDB(https://www.iedb.org)预测蛋白的T细胞和B细胞抗原表位。
1.3.2 引物设计与合成
根据GenBank发布的KR260715病毒株全基因组序列(GenBank登录号:927338546)利用在线软件分析G1蛋白的线性抗原表位,从G1蛋白中筛选出具有优势抗原性的基因片段,即G1蛋白中的208个氨基酸肽段(189~397 aa),并设计引物进行目的基因克隆,目的片段扩增长度为653 bp。参考 Bac-to-Bac杆状病毒的表达体系使用说明书合成用于鉴定穿梭杆状病毒的通用M13引物,下划线为酶切位点。引物序列如表1。

表1 引物序列
1.3.3 目的基因克隆及其纯化
利用核酸提取试剂盒提取AKV病毒RNA并反转录。利用所设计的特异性引物AKV-F/AKV-R克隆AKV目的基因,其中模板RNA总量5 μL,反转录酶缓冲液2 μL,2×1 step buffer 25 μL,上下游引物(20 pmol/L)各1 μL,灭菌去离子水16 μL,轻轻混匀。PCR反应条件:94 ℃预变性2 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1.5 min,35个循环;72 ℃延伸10 min。经1%的琼脂糖凝胶电泳后,在紫外凝胶成像体系中,将PCR产物按凝胶回收试剂盒的标椎操作步骤进行纯化回收。
1.3.4 目的基因与表达载体的构建
利用EcoRⅠ和PstⅠ双酶切PCR产物,与经相同酶切处理的 pFastBac HTB载体,连接转化至DH5α感受态细胞,涂布于含有100 μg/mL氨苄固体培养基培养过夜,挑取单一菌落于含有Amp的LB液体培养基中37 ℃恒温摇床培养15 h,提取质粒。获得重组供体质粒,对其进行PCR、双酶切鉴定,将鉴定过的重组质粒送宝生物工程(大连)有限公司测序,测序后与NCBI数据库中已知序列进行比对。以确定目的基因组及其表达载体是否构建成功,将鉴定正确的重组质粒命名为pFastHTB-AKV-G1-2。
1.3.5 重组穿梭质粒的构建与鉴定
根据Bac-to-Bac杆状病毒的表达体系,将pFastHTB-AKV-G1-2转化DH10Bac感受态细胞,将菌液全部涂布于含有浓度为50 μg/mL卡那霉素、7 μg/mL四环素、10 μg/mL庆大霉素的 LB固体平板上,在37 ℃恒温箱进行48 h的培养。从上述平板上选择形态良好且单一的菌落接种在LB液体培养基中,该培养基含卡那霉素(50 μg/mL)、四环素(7 μg/mL)和庆大霉素(10 μg/mL)3种抗生素。37 ℃恒温摇床条件下过夜培养15 h,并根据 Bac-to-Bac操作手册中的操作步骤,提取重组穿梭质粒Bacmid-AKV-G1-2,并使用引物M13进行PCR鉴定目的基因是否插入。反应体系为:10×LATaqBuffer Ⅱ 5 μL,TaKaRaLATaq(5 U/μL)0.5 μL,dNTP Mixture(2.5 mmol/L)8 μL,M13上下游引物各1 μL,菌液5 μL,ddH2O 29.5 μL,总体系50 μL。PCR反应条件:94 ℃预变性4 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 5 min,35个循环;72 ℃延伸10 min,4 ℃保存。
1.3.6 重组病毒的拯救与蛋白表达
根据Invitrogen Bac-to-Bac Baculovirus Expression Systen 应用说明手册,将构建的重组穿梭质粒Bacmid-AKV-G1-2在脂质体介导下,转染对数期增殖的sf9昆虫细胞,设置空白对照组(健康sf9细胞),转染后27 ℃培养观察,待80%~90%细胞出现裂解,收集已出现严重病变的sf9细胞和培养上清液,冻融3次,3 000 r/min离心5 min除去细胞和大细胞碎片,收集上清液为病毒种毒,感染sf9细胞,27 ℃培养120 h后用同样的方法获得第二代(P2)和第三代(P3)重组病毒。
1.3.7 重组蛋白的Western blot分析
使用购于Solarbio公司的高效组织细胞裂解液,取 P3代重组病毒感染细胞及正常sf9细胞各20 mL进行裂解,裂解步骤详见说明书,上清液用15%的分离胶和4%的浓缩胶进行SDS-PAGE检测,将电泳后的凝胶电泳蛋白区转移至固相载体硝酸纤维膜(PVDF膜)上,转膜结束后,用5% BSA封闭1 h,1×PBST洗涤3次,加入1∶10稀释的AKV山羊阳性血清,4 ℃过夜孵育,再用1×PBST洗涤3次,每次10 min,加入1∶3 000稀释的兔抗山羊IgG-HRP,37 ℃孵育1 h,重复上述洗涤步骤,使用DAB显色观察,拍照留存。
2 结果与分析
2.1 生物信息学分析
2.1.1 理化性质
利用在线软件分析AKV G1基因编码蛋白质的基本生化特性,结果显示,G1基因共编码808个氨基酸,理论蛋白分子式为C4003H6347N1099O1211S49,总原子数为12 709,总分子质量为 90 817.01 D,理论等电点为85.87。氨基酸组成:共含有约20种氨基酸,所占的比重最大(8.5%)为异亮氨酸,所占的比重较小(0.9%)为色氨酸,并且包含83个负电荷氨基酸碱基(天冬氨酸+谷氨酸)和94个正电荷氨基酸(精氨酸+赖氨酸),如表2所示。消光系数为 92 900,不稳定系数为32.33,表明该蛋白为稳定蛋白,预计的半衰期为1.3 h,脂肪系数为 85.87,总平均亲水性为-0.322,使用ProtScale 软件分析其蛋白亲疏水性,发现该蛋白结构为亲水性蛋白。

表2 G1蛋白氨基酸组成
2.1.2 磷酸化、糖基化位点及亚细胞定位
利用软件分析 G1氨基酸序列中存在的潜在磷酸化作用位点,结果显示,共存在80个潜在的苏氨酸磷酸化位点,如图1所示。
图1 G1蛋白磷酸化位点预测
利用软件完成的G1蛋白N-糖基化位点预测,结果显示有6个潜在的N-糖基化位点,分别在第31、96、176、260、330、369位氨基酸,如图2所示。
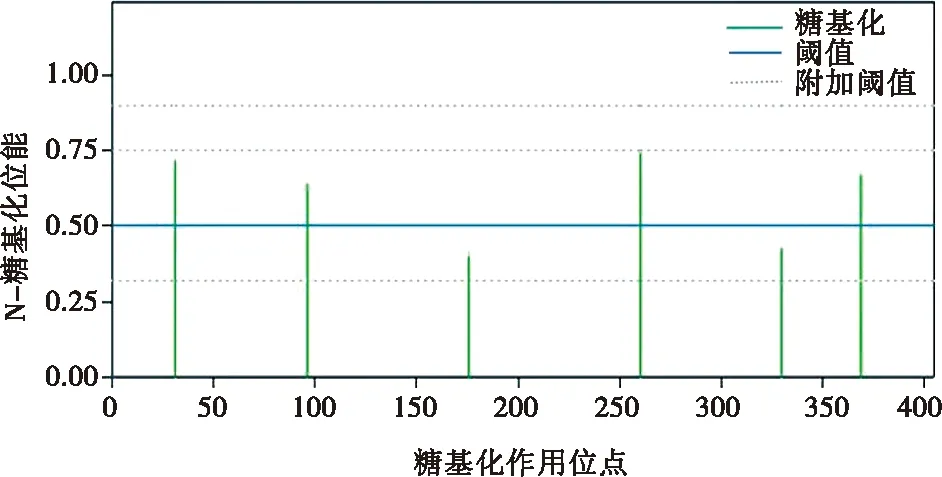
图2 G1蛋白N-糖基化位点预测
使用在线软件对G1蛋白进行定位分析,结果显示在G1蛋白808个氨基酸中,仅在前60个氨基酸中存在跨膜氨基酸0.000 32;利用软件对G1蛋白的亚细胞结构进行定位分析,结果发现G1蛋白在宿主细胞质、细胞核中分布较多。
2.1.3 G1蛋白二级结构及三级结构分析
利用在线软件分析G1蛋白二级结构,结果如图3所示,G1蛋白共含有α-螺旋210个,延伸链184个,β-折叠34个,无规则卷曲380个,其中α-螺旋占25.99%,延伸链占22.77%,β-折叠占4.21%,无规则卷曲占47.03%。利用在线软件建立了AKV G1蛋白的三级模型(图4),三级结构预测结果与二级结构预测结果一致,G1蛋白的三级结构是环状的,非常稳定,更多β-折叠位于蛋白质中间;在蛋白质三级结构的上部和下部存在许多易于形成构象表位的结构。

Hh.α-螺旋;Ee.延伸链;Tt.β-折叠;Cc.无规卷曲。图3 G1蛋白二级结构分析
图4 G1蛋白三级结构分析
通过在线软件对G1氨基酸序列进行表位预测和分析,结果显示其具有26个T细胞优势抗原表位(表3),30个B细胞优势抗原表位(表4)。抗原性如图5所示,纵坐标数值代表对应横坐标区域的氨基酸抗原性数值,以0.5为阈值,数值越高则表示该区的氨基酸抗原性越强,黄色区间为各肽段预测存在抗原表位的区域,结果显示抗原指数较高区域为:1~80 aa、140~180 aa、189~397 aa、300~400 aa、560~620 aa。综合细胞表位肽段免疫原性得分,选取了1个由208个氨基酸组成的肽段(189~397 aa)进行抗原性预测分析。如图6所示,蛋白质的理化分析显示,该段截短表达蛋白为亲水性蛋白,具有较好的稳定性,跨膜区预测显示该蛋白存在跨膜区,推测该蛋白主要以包涵体形式存在;该蛋白存在多个潜在的磷酸化位点,且该片段二级结构中β-折叠与无规则卷曲所占比例超过50%。综合以上分析,该肽段具有较好的抗原优势表位,则选取该肽段进行截短表达。
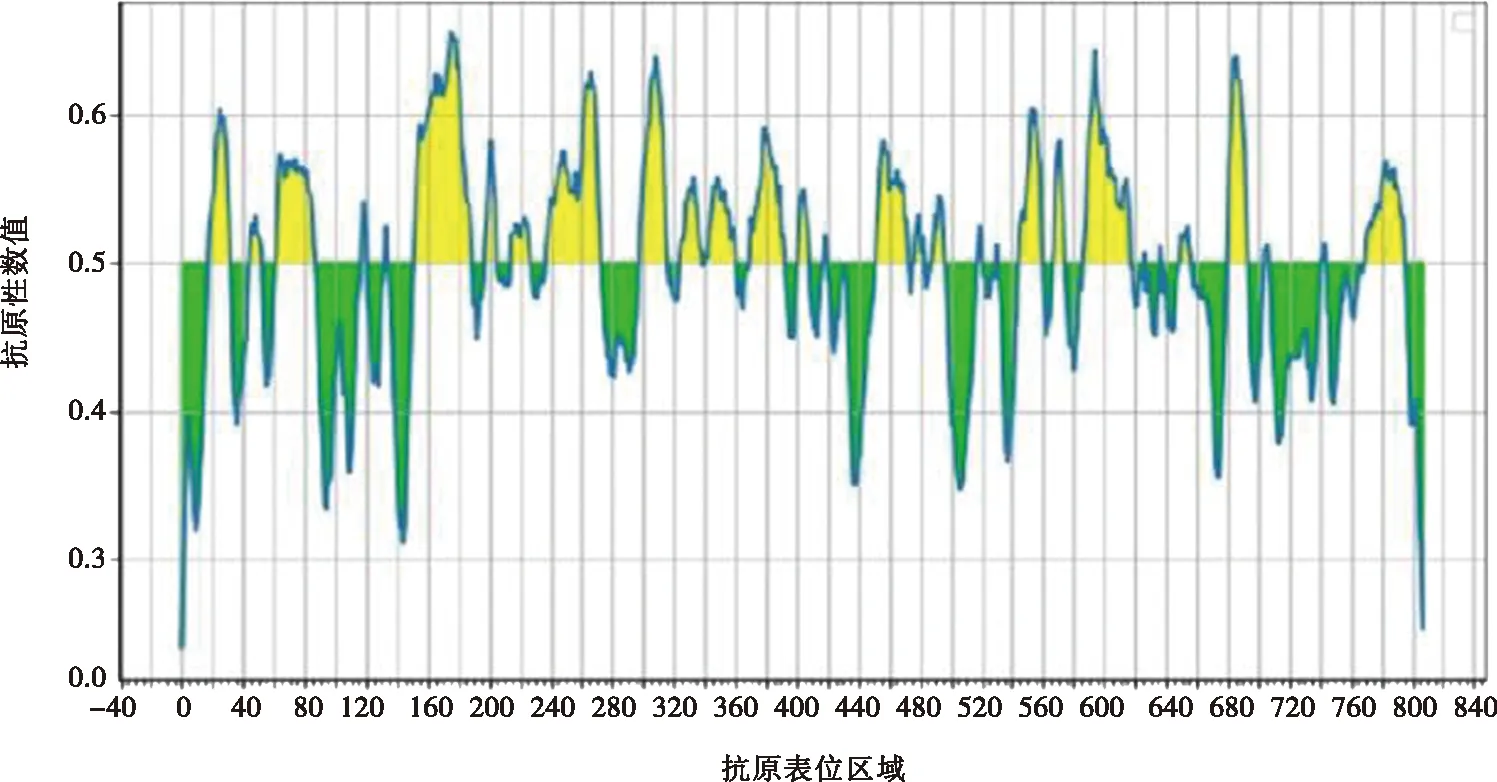
图5 G1(1~808 aa)氨基酸抗原性预测
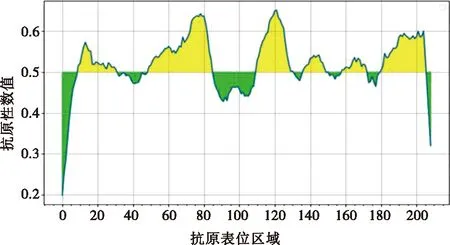
图6 208个氨基酸肽段(189~397 aa)抗原性预测
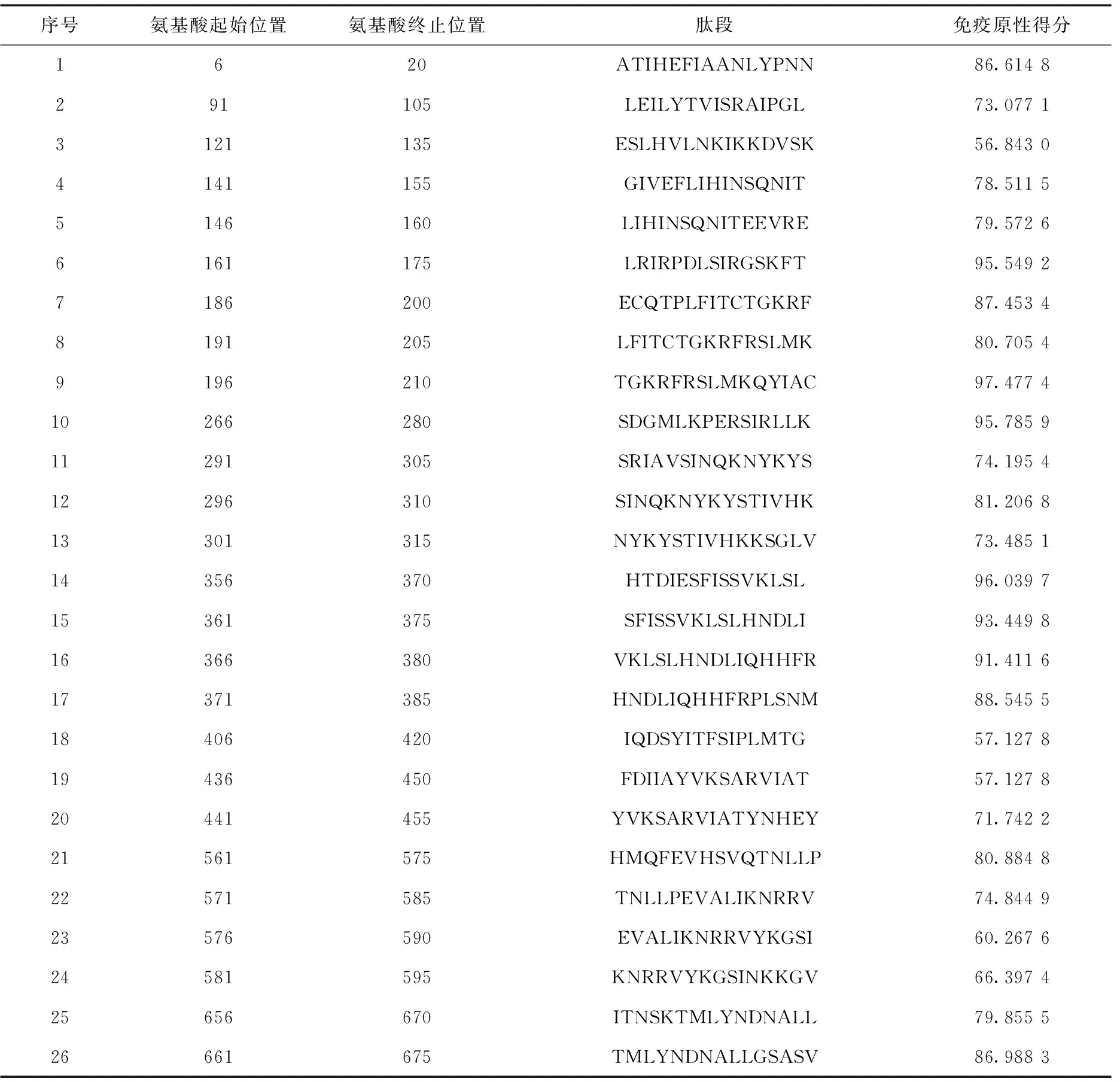
表3 T细胞表位预测
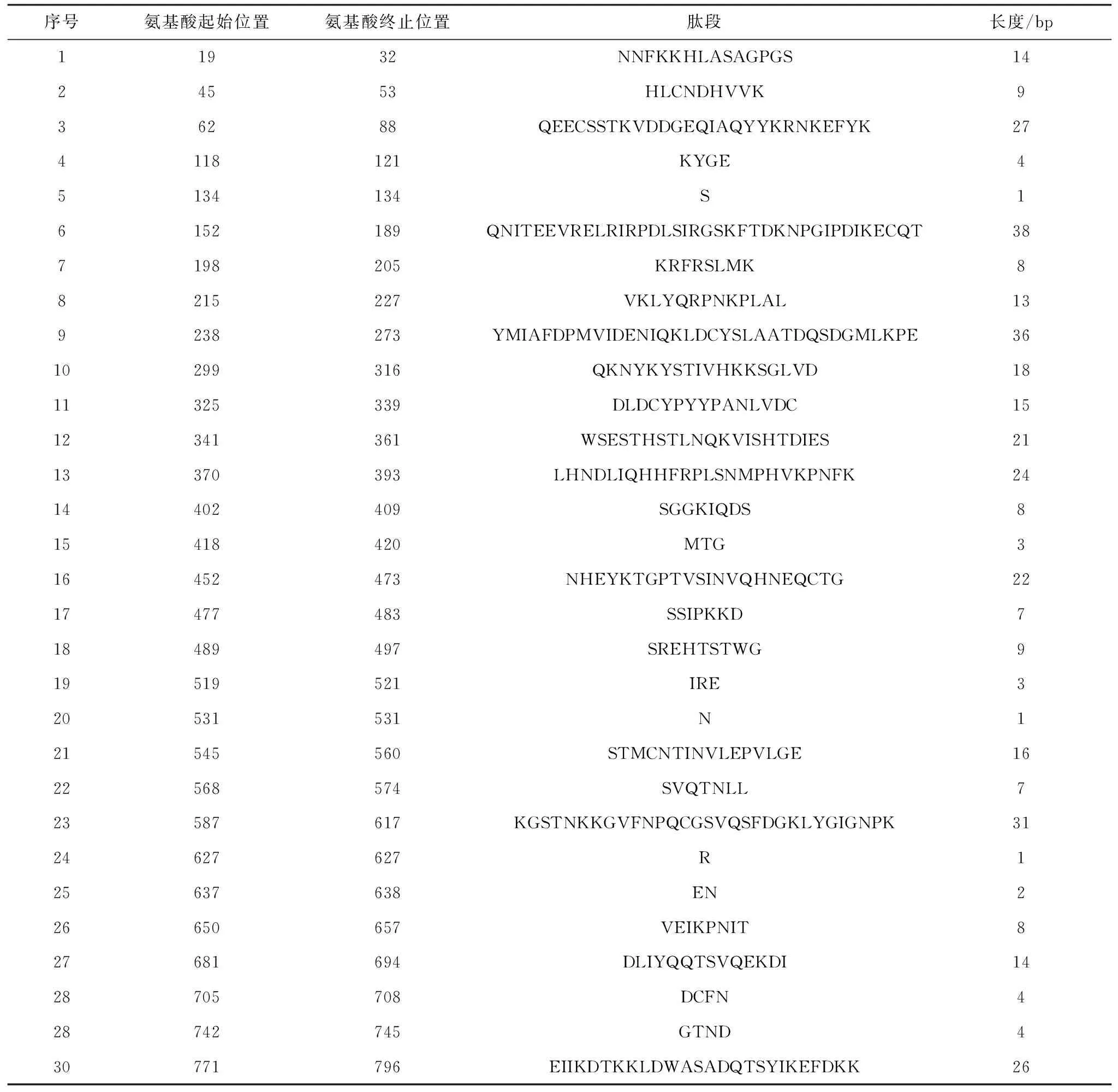
表4 B细胞表位预测
2.1.4 目的基因的克隆、鉴定
电泳图显示在653 bp处出现单一条带,与预期大小相符,如图7所示,经测序鉴定证实该 DNA 合成片段的碱基序列及编码的氨基酸序列完全正确,即获得所需克隆目的片段。
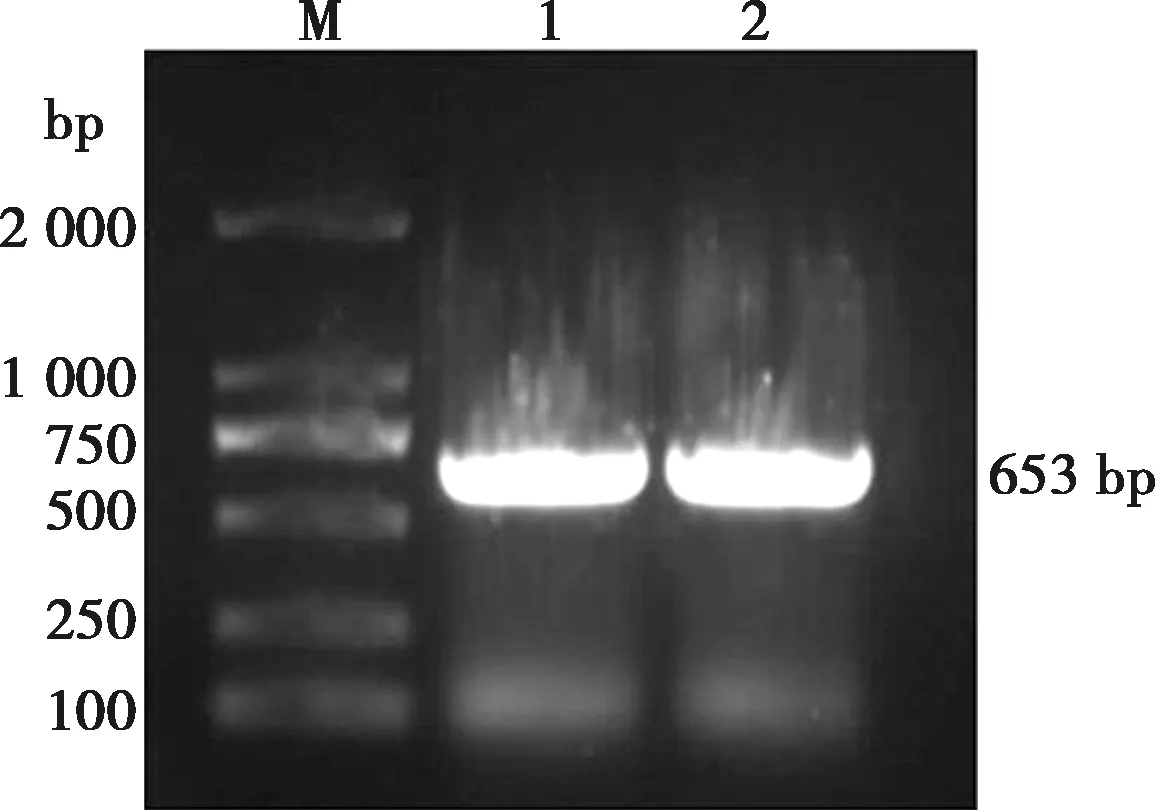
M. DNA标准DL2000;1~2. AKV-G1-2基因的PCR产物。图7 G1-2基因PCR扩增
2.1.5 重组供体质粒HTB-AKV-G1-2 的鉴定
PCR产物与 pFastBac HTB载体连接后,经EcoRⅠ和PstⅠ双酶切可以在4 856和653 bp处看到2个条带,如图8所示,大小与预期结果一致。经PCR、酶切、测序鉴定,结果表明外源性目标片段的大小和阅读框正确,成功构建了重组供体质粒,阳性质粒命名pFastHTB-AKV-G1-2。
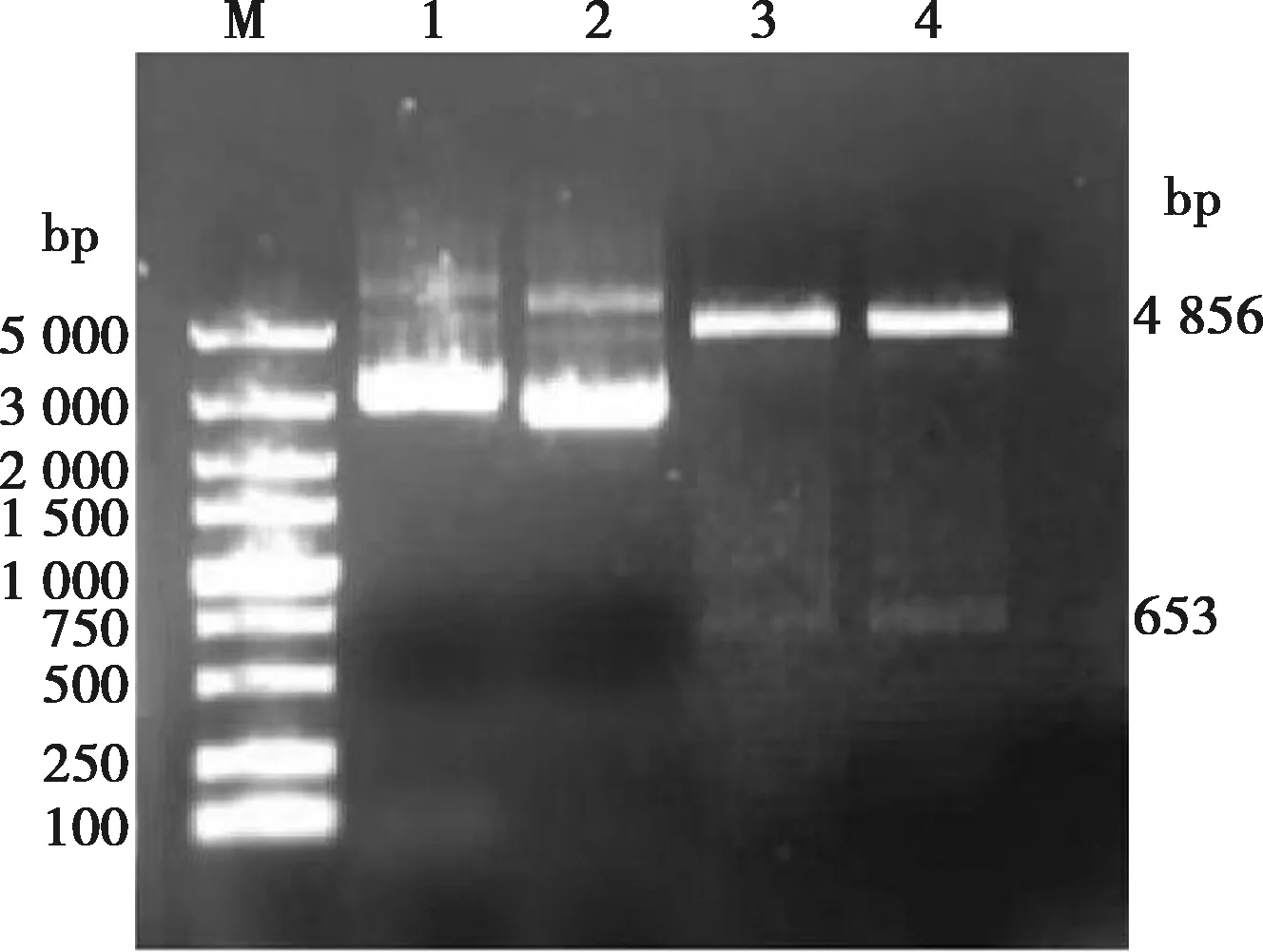
M.DNA标椎DL5000;1. 重组质粒pFastHTB-AKV-G1-2;2. pFastBac HTB空载体;3~4. pFastHTB-AKV-G1-2经EcoRⅠ和PstⅠ双酶切。图8 重组供体质粒pFastHTB-AKV-G1-2酶切鉴定
2.1.6 重组穿梭质粒Bacmid-AKV-G1-2的PCR鉴定
将pFastHTB-AKV-G1-2重组供体质粒转入DH10Bac感受态细胞后,经含有庆大霉素、卡那霉素、四环素的平板培养筛选48 h后提取重组穿梭质粒,用M13引物进行PCR鉴定,结果扩增的产物分别为3 083和300 bp,未转化质粒的DH10Bac菌株仅在300 bp出现条带,如图9所示,证明目的片段已经成功转座至Bacmid,重组穿梭质粒Bacmid-AKV-G1-2构建成功。
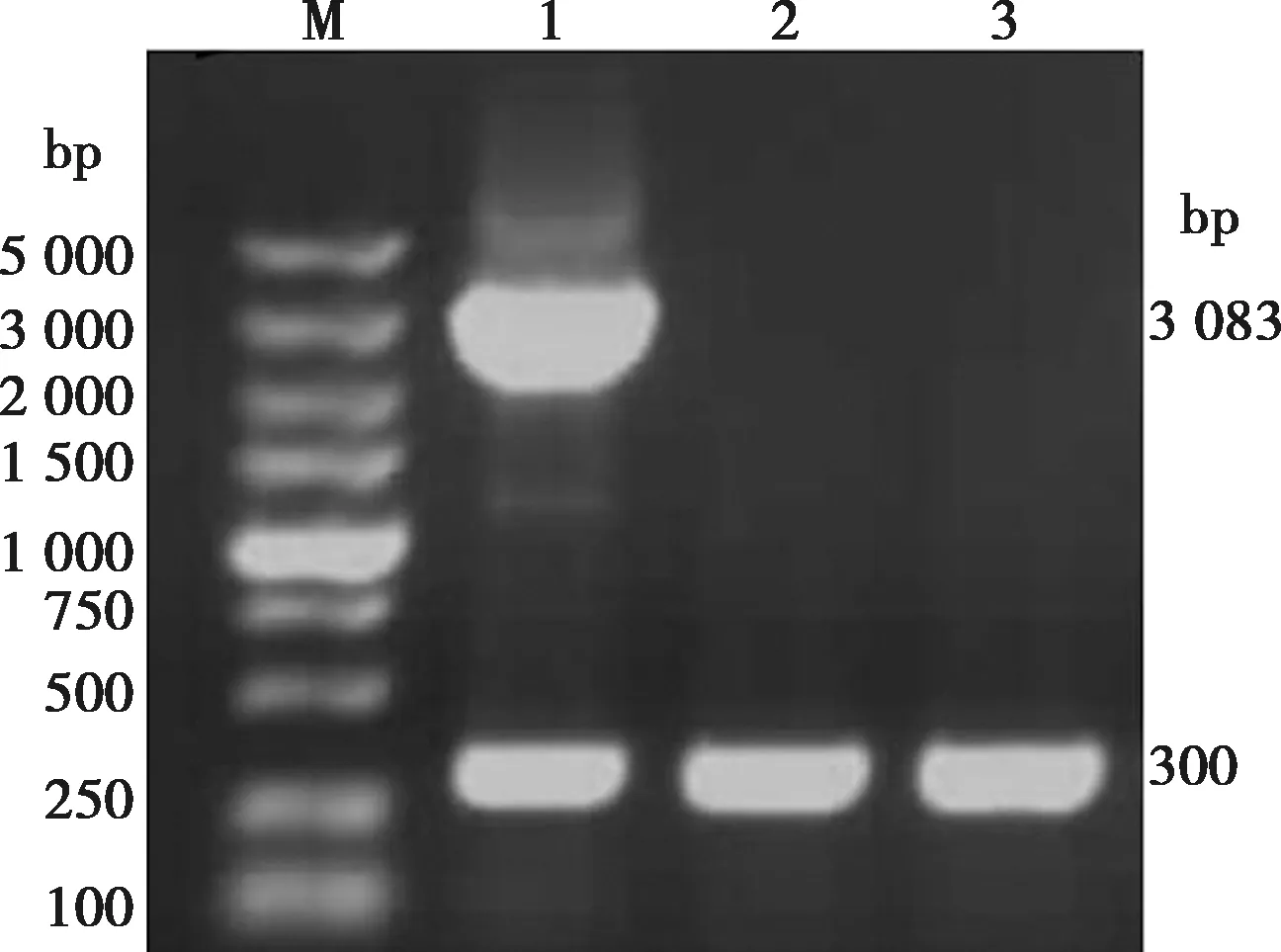
M.DNA标椎DL5000;1. Bacmid-AKV-G1-2用引物M13的PCR产物;2~3. 未转化质粒DH10Bac。图9 重组穿梭质粒Bacmid-AKV-G1-2的PCR鉴定
2.1.7 重组病毒的拯救
提取重组穿梭质粒,在脂质体介导下转染对数期增殖的健康sf9昆虫细胞,设立空白对照组,27 ℃进行培养,在倒置显微镜下观察,转染Bacmid-AKV-G1-2 的细胞,培养120 h病变明显,与正常细胞相比,质粒转染细胞明显变大、变圆,并开始出现裂解,如图10所示。
2.1.8 重组蛋白的SDS-PAGE鉴定和Western blot分析
将重组病毒感染的细胞裂解上清液用15%的分离胶和4%的浓缩胶进行SDS-PAGE分析,结果在约27 kDa左右可见表达产物,见图11,与预期大小一致。以AKV抗体阳性血清为一抗,兔抗山羊IgG-HRP为二抗,Western blot结果表明重组蛋白能被特异性识别,如图12所示,在约27 kDa处出现特异性目的印迹,而正常细胞上清液中在此位置没有出现特异性印迹,证明截短表达产物在昆虫细胞中得以表达。
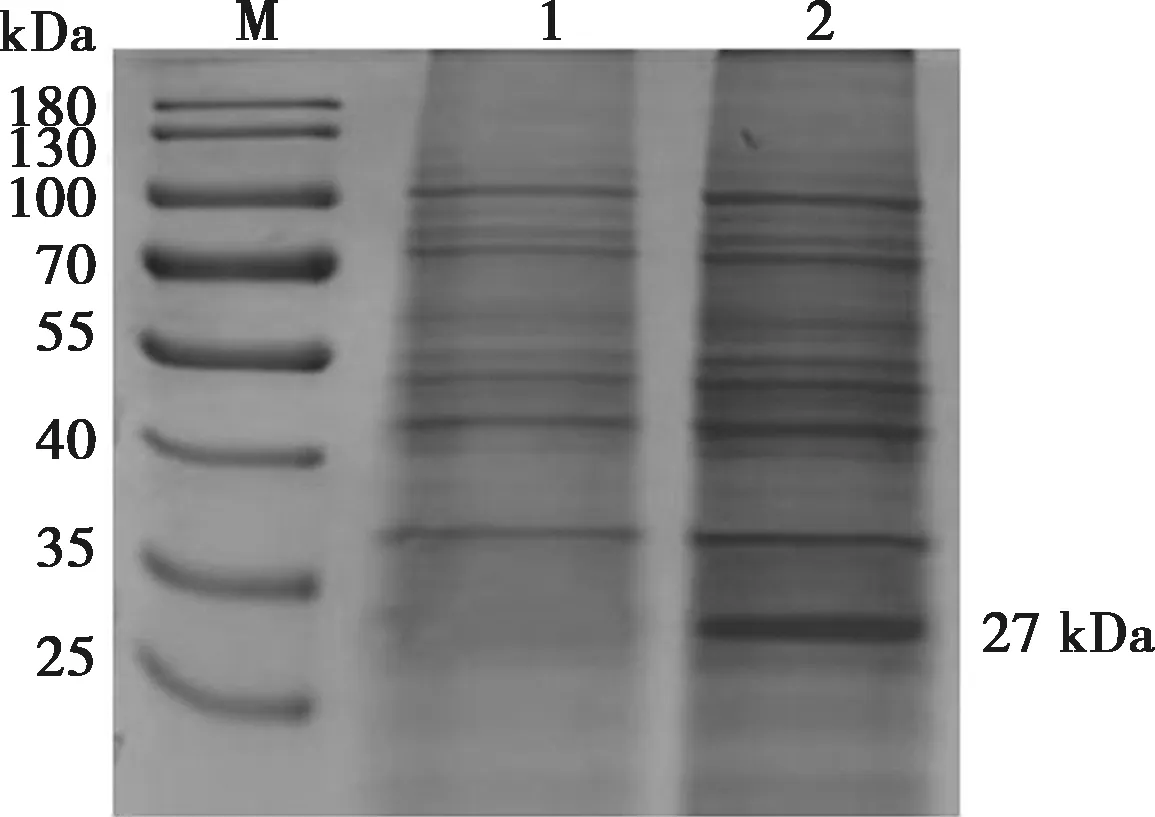
M.蛋白分子质量标准;1. 正常的sf9细胞;2. 转染Bacmid-AKV-G1-2的sf9细胞。图11 重组蛋白SDS-PAGE分析
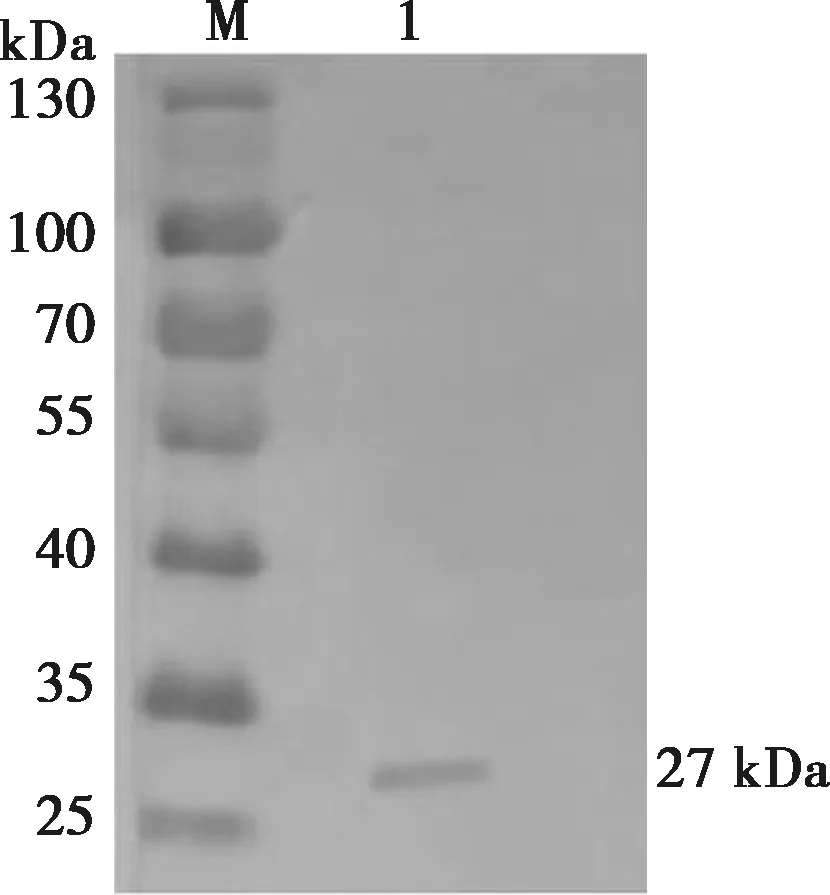
M.蛋白分子质量标准;1. 转染Bacmid-AKV-G1-2的sf9细胞。图12 Bacmid-AKV-G1-2重组蛋白Western blot分析
3 讨论
2021年8月之前,赤羽病对我国养殖业的危害报道较少。随后,我国东北多个地区牛养殖区出现怀孕母牛流产、产死胎,新生牛犊畸形等现象,主要症状为患病犊牛出生后四肢关节弯曲呈蜷缩状,脊柱和头部变形,部分患病牛犊出现双目失明、吞咽困难等症状,其后吉林大学动物医学院王新平教授团队,分离到赤羽病病毒。中国动物疫病预防控制中心监测结果显示,除黑龙江省未检出赤羽病阳性病例外,其他省份均有报告检出赤羽病病例,现赤羽病病毒在我国已较为普遍存在[13]。赤羽病的防控现尚无商品化疫苗,因此对于此病的检测监测尤为重要。
在AKV的所有蛋白中,G1是 AKV的主要包膜蛋白,同时也是AKV致病能力和感染性的重要基因,它的氨基酸部分位于病毒颗粒的最表层,能被宿主的免疫系统所识别,进而使其形成免疫力反射,形成了保护性的中和抗体。有学者对G蛋白部分进行了截短表达和抗原性的研究,但其表达方式为包涵体或是利用原核表达获得重组蛋白[14]。本研究前期尝试用昆虫细胞表达G1蛋白的整个编码基因,但可能是表达基因片段较长、密码子嗜好等原因,未能获得表达完整的G1蛋白。本研究中采用生物信息学方法对AKV M片段上的G1基因进行分析,发现G1蛋白共含有α-螺旋210个,延伸链184个,β-折叠34个,无规则卷曲380个,具有26个T细胞优势抗原表位,30个B细胞优势抗原表位,5个抗原指数较高区域。综合蛋白质的理化分析,确定截短表达189~397 aa肽段蛋白为亲水性蛋白,具有较好的稳定性,该蛋白存在跨膜区,推测该蛋白主要以包涵体形式存在,这可为后续的纯化及研究奠定基础。该蛋白存在多个潜在的磷酸化位点,推测可能与细胞内信号转导和蛋白定位有关系,且该片段二级结构中β-折叠与无规则卷曲占比较高,表明该蛋白具有形成抗原表位的结构基础。β-折叠一般作为凸出结构位于蛋白质位置表面,容易产生扭曲结构,更容易与抗体结合。由于β-折叠的生物学特性,使得β-折叠存在的区域更容易形成抗原表位。细胞表位预测结果表明该截短片段细胞免疫原性得分较高,存在丰富的潜在抗原表位,属于优势抗原肽段,选取该肽段(189~397 aa)利用昆虫细胞杆状病毒表达系统进行表达,表达后的重组蛋白可与AKV阳性血清发生特异性反应,表明重组表达产物具有良好的反应原性。
辛波病毒群M 基因节段的序列变异性较大,其编码G蛋白的氨基酸序列同源性仅为33.1%~47.3%,而G蛋白在AKV各分离株之间的同源性却很高,提示选用G蛋白为检测抗原可能是提高AKV血清抗体ELISA检测方法特异性的有效途径[15-16]。Ogawa等[17]用AKV糖蛋白Gc的N端(1~97 aa)和中间(189~397 aa)2个重组蛋白与中和单克隆抗体发生反应,并用这2个重组蛋白及其融合蛋白产物免疫小鼠,能诱导产生中和抗体。本研究对AKV G1蛋白进行生物学分析后,利用昆虫细胞表达具有免疫活性的G1-2蛋白,理论上与天然蛋白构像更接近,不仅可作为AKV血清抗体ELISA检测方法的诊断抗原,而且也可以作为一种重要的AKV防控的亚单位疫苗候选抗原。
