雷公藤多苷及其主要活性成分抑制类风湿性关节炎的作用机制研究进展
2023-10-19崔东晓乐世俊徐顶巧付瑞嘉刘文娟马文福唐于平
崔东晓,乐世俊,徐顶巧,付瑞嘉,刘文娟,张 赛,马文福,唐于平*
雷公藤多苷及其主要活性成分抑制类风湿性关节炎的作用机制研究进展
崔东晓1,乐世俊1,徐顶巧1,付瑞嘉1,刘文娟1,张 赛1,马文福2,唐于平1*
1. 陕西中医药大学陕西省中医药管理局中药配伍重点研究室,陕西 西安 712046 2. 北京中医药大学生命科学学院,北京 102488
雷公藤多苷是从雷公藤根部提取出的总苷,其现代制剂雷公藤多苷片在临床上对类风湿性关节炎(rheumatoid arthritis,RA)有确切疗效,雷公藤甲素和雷公藤红素是雷公藤多苷的主要活性成分。现代研究发现雷公藤多苷治疗RA的机制包括抑制血管生成、维持调节性T细胞(regulatory T cells,Treg)和辅助性T细胞17(T helper type 17,Th17)之间的平衡、抑制基质金属蛋白酶表达和促进成纤维样滑膜细胞凋亡等。而其主要活性成分雷公藤甲素和雷公藤红素除了调节Treg和Th17细胞之间的平衡外,还可以通过调节细胞自噬、抑制多条炎症相关信号通路活化等多种途径发挥抑制RA的作用。首先回顾RA的发病机制,并重点对雷公藤多苷及其主要活性成分抑制RA的作用机制进行总结和阐述,以期为有关雷公藤多苷抗RA的研究提供参考。
雷公藤多苷;雷公藤甲素;雷公藤红素;类风湿性关节炎;抗炎;作用机制
类风湿性关节炎(rheumatoid arthritis,RA)是一种慢性的炎症性关节疾病,以关节炎症、增生肿胀、自身抗体产生、软骨和骨破坏为特征[1-2]。早期临床特征是关节红肿热痛和功能障碍,病程晚期可出现关节僵硬和畸形,并伴有骨骼肌的萎缩,严重者可致残疾。我国目前约有500万RA患者,生命质量严重降低,给家庭和社会带来沉重负担。中医认为,RA属于“痹证”,最早在《黄帝内经》中就有关于“痹症”的记载,《素问·痹论》云:“风寒湿三气杂至,合而为痹也。其风气胜者为行痹,寒气胜者为痛痹,湿气胜者为着痹也”。在张仲景的《金匮要略》中记载的“历节病”与RA的病理病机和临床症状相一致,认为“历节病”的肿痛表现是由于气血不足、风邪入侵、荣气不通所致。
雷公藤来源于卫矛科植物雷公藤Hook. f. 干燥根的木质部,具有祛风除湿、活血通络、消肿止痛、杀虫、解毒的功效。雷公藤用于治疗“风湿痹证”已有数百年的历史,雷公藤多苷是从雷公藤根部提取出的总苷,含多种二萜内酯(如雷公藤甲素、雷公藤内酯甲等)、生物碱(如雷公藤吉碱、雷公藤春碱、雷公藤次碱等)、三萜类(如雷公藤红素等)及苷类成分,具有抗炎、调节免疫等作用[3-4],临床上主要用于RA、肾病综合征、自身免疫性肝炎等疾病的治疗。本文将着重对雷公藤多苷及其主要活性成分抑制RA的作用机制进行综述。
1 RA的发病机制
RA的发病涉及了多种免疫细胞、免疫因子和多种信号通路的复杂调控[5-6],滑膜部位的免疫细胞和成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)介导的免疫和炎症反应是RA的主要发病机制,见图1。固有免疫过程在RA发病机制中起着关键作用,多种固有免疫细胞包括单核-巨噬细胞、自然杀伤细胞(natural killer cells,NK)和肥大细胞等,都在RA患者的滑膜部位被发现,并参与了关节炎症和骨侵蚀[5]。由单核细胞分化来的M1型巨噬细胞是局部炎症的重要参与者,在RA的发病过程中,血液中的单核细胞被招募到关节滑膜,并且分化为促炎性的M1型巨噬细胞,释放肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)和白细胞介素-1β(interleukin-1β,IL-1β)等多种细胞因子和趋化因子,导致局部炎症和组织损伤的进展和放大[7-8]。除此之外,适应性免疫也在RA的发病机制中起着重要作用,T细胞和B细胞都在不同程度上参与了RA的发病过程[9-11]。T细胞是RA的关键炎性细胞因子TNF-α的主要生产者。B细胞聚集在炎性RA滑膜中分泌类风湿因子(rheumatoid factor,RF)和抗瓜氨酸蛋白抗体(anti-citrullinated peptide antibodies,ACPA)等自身抗体,参与RA的炎症过程。此外,FLS在RA的疾病进程中也被激活,分泌IL-6和基质金属蛋白酶(matrix metalloproteinases,MMP)等炎症介质,参与滑膜炎症[12]。炎症的长期累积引起滑膜细胞增生、滑膜增厚、血管翳形成,导致软骨和骨质破坏,最终导致关节功能丧失。因此,RA是以关节滑膜炎症为主要病理特征的自身免疫疾病,采取各种策略实现减轻炎症、缓解肿痛的目的,是RA的主要治疗策略。

图1 免疫和炎症反应参与的RA病理机制
2 雷公藤多苷及其主要活性成分抑制RA的作用
RA在中医临床上属于“痹证”范畴,是由于风、寒、湿三气入侵,留滞于内所致的气血痹阻和经络不畅[13]。雷公藤多苷具有抗炎、抗肿瘤、免疫调节等多种药理活性,雷公藤多苷片是临床上治疗RA等“痹证”的中药制剂,且疗效确切[14]。雷公藤多苷的临床症状富集分析表明,其治疗RA的效应基因与“痹证”相关症状和医学临床表型紧密相关[15]。临床研究发现,雷公藤多苷可以降低患者的关节压痛程度和关节肿胀指数,同时减轻患者的炎症反应,改善免疫功能[16]。体内动物实验显示,雷公藤多苷可以降低胶原诱导关节炎(collagen-induced arthritis,CIA)大鼠中的IL-1β、TNF-α等炎症因子水平,改善CIA大鼠关节炎症,减轻关节病理损害[17-18]。雷公藤多苷的主要成分包括雷公藤甲素(triptolide)、雷公藤红素(celastrol)、雷公藤内酯酮、雷公藤内酯甲、雷酚内酯等[19]。研究最为广泛的是雷公藤甲素和雷公藤红素,被认为是雷公藤多苷治疗RA的主要活性成分,前者是一种二萜类内酯化合物,而后者是五环三萜类化合物,均具有强大抑制RA的作用[19-20]。动物实验结果表明,雷公藤甲素可以改善CIA大鼠的足肿胀,降低关节炎指数,并减少IL-17、TNF-α、γ-干扰素等炎症相关因子表达[21-22]。雷公藤甲素和雷公藤红素都可以抑制中性粒细胞介导的炎症反应,减少TNF-α和IL-6的分泌,从而发挥抑制RA的作用[23]。也有研究显示雷公藤红素可通过诱导破骨细胞前体细胞(osteoclast precursors cells,OCPs)凋亡,抑制炎性细胞浸润,减少RA小鼠的骨侵蚀和骨破坏[24]。
3 雷公藤多苷抑制RA的作用机制
文献调研发现,雷公藤多苷可通过抑制血管生成、维持调节性T细胞(regulatory T cells,Treg)和辅助性T细胞17(T helper type 17,Th17)之间的平衡、抑制MMP表达和促进FLS凋亡等机制发挥治疗RA的作用,见图2。
3.1 抑制血管生成
在RA的疾病进展过程中,增生的滑膜需要更多的血液供应,血管内皮生长因子(vascular endothelial growth factor receptor,VEGF)是新生滑膜血管形成的关键因素,VEGF能增强血管的通透性并促进血管增生,加重疾病进展。在此过程中,一些趋化因子如C-X-C基序趋化因子配体13(C-X-C motif chemokine ligand 13,CXCL13)等通过与C-X-C基序趋化因子受体5(C-X-C motif chemokine receptor 5,CXCR5)的结合,促进内皮细胞中VEGF的表达和血管生成[25]。此外,脂肪酸结合蛋白4(fatty acid-binding protein,FABP4)是一种调节炎症和血管生成的新型脂肪因子,M1极化巨噬细胞分泌的FABP4也能促进滑膜炎症和血管生成,从而加剧RA的进展[26]。因此,通过靶向抑制新生滑膜血管生成,是治疗RA的重要策略[27]。

图2 雷公藤多苷抑制RA的作用机制
许多中药复方或单体成分已被报道具有抗血管生成的作用。如乌头汤可通过作用于磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)相关信号通路抑制RA成纤维细胞MH7A中VEGF等促血管生成因子的表达,从而抑制血管生成,改善CIA大鼠的滑膜增生症状[28]。白藜芦醇可以减少活性氧积累,抑制炎症反应和细胞增殖,刺激滑膜组织细胞凋亡,同时减缓缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)介导的血管生成[29]。研究表明雷公藤多苷与环磷酰胺合用可以降低RA患者血清中VEGF及VEGF受体的表达,提高治疗效果[30];也有研究表明雷公藤多苷可以减少VEGF诱导的管腔形成,抑制滑膜组织的血管生成[31]。因此,抑制新生滑膜血管生成,是雷公藤多苷发挥治疗RA作用的重要机制。
3.2 调节Treg和Th17细胞之间的平衡
具有促炎作用的Th17细胞和具有免疫调节作用的Treg细胞之间的失衡,是RA的一个重要特征。CD4+T细胞亚群Th17通过产生炎症因子介导了RA的炎症反应。巨噬细胞和树突状细胞衍生的转化生长因子-β(transforming growth factor-β,TGF-β)和IL-1β、IL-6等促进了Th17的分化,抑制了调节性T细胞Treg的分化,导致T细胞的稳态失衡和炎症的发生[32]。Zhang等[33]利用结肠炎大鼠模型探究了雷公藤多苷抗炎的作用机制,发现雷公藤多苷减少了外周血、淋巴结和脾脏中的IL-17A+CD4+Th17细胞,但是却增加了叉头框蛋白P3阳性(forkhead box protein P3,Foxp3+)及CD25+Treg细胞水平,证明雷公藤多苷的抗炎作用与调节Treg和Th17细胞之间的平衡有关。马衍慧等[34]选取60例RA患者来探究雷公藤多苷对外周血中Th17和Treg细胞构成比的影响,研究发现雷公藤多苷能够通过下调miR-146a表达水平从而减少Th17细胞构成比,增加Treg细胞构成比,进而缓解RA患者的病情。因此,雷公藤多苷可以通过调节Treg和Th17细胞之间的平衡,发挥治疗RA的作用。
3.3 抑制MMP表达和促进FLS凋亡
除了抑制血管生成以及调节Treg和Th17细胞之间的平衡外,雷公藤多苷还可以通过减少MMP表达和促进FLS凋亡等途径抑制滑膜炎症和滑膜增生。MMP是主要由FLS分泌的炎症介质,可以降解细胞外基质,参与了滑膜炎症,Cai等[35]发现雷公藤多苷可以降低IL-1β诱导的大鼠滑膜细胞中MMP1和MMP9的表达,从而减轻炎症,因此,抑制MMP的表达也是雷公藤多苷治疗RA的机制之一。此外,滑膜细胞的异常增生是RA的特征性病理改变之一,研究发现,雷公藤多苷可以通过调控TNF受体相关因子6(TNF receptor associated factor 6,TRAF6),抑制丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的活化抑制FLS增殖,并且通过激活半胱氨酸天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinase 3,Caspase-3)促进滑膜细胞凋亡[36]。由此可知,雷公藤多苷可以通过促进FLS凋亡发挥治疗RA的作用。
4 雷公藤多苷主要活性成分抑制RA的作用机制
研究表明,雷公藤多苷主要活性成分可通过调节细胞自噬,调控核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)、Janus激酶(janus kinase,JAK)/信号转导-转录活化因子(signal transducers and activators of transcription,STAT)、Toll样受体4(Toll-like receptors 4,TLR4)/核因子κB(nuclear factor kappa-B,NF-κB)、环二核苷酸合成酶-干扰素基因刺激因子(cyclic GMP-AMP synthase-stimulator of interferon genes,cGAS-STING)信号通路活化和调节Treg和Th17细胞之间的平衡等多种途径发挥抑制RA的作用(图3)。

图3 雷公藤多苷主要活性成分抑制RA的作用机制
4.1 调节细胞自噬
自噬在包括RA在内的多种自身免疫性疾病的发生发展中起着重要作用,已被证明参与了RA的血管翳生成、滑膜炎症和骨破坏,抑制巨噬细胞和FLS的自噬可以减轻RA的关节症状。雷公藤多苷主要活性成分对细胞自噬的调节已有广泛的报道。Xie等[37]使用关节炎成纤维滑膜细胞MH7A研究了雷公藤甲素对RA的作用,发现雷公藤甲素可以通过激活蛋白激酶B(protein kinase B,PKB,也称Akt)信号通路抑制MH7A细胞的自噬,进而抑制滑膜细胞迁移和侵袭,维持氧化还原平衡,减轻关节炎症。而雷公藤红素可能对细胞自噬具有促进作用,Hu等[38]发现雷公藤红素可以靶向和结合核受体Nur77,并促进Nur77从细胞核到损伤线粒体的转位,最终导致损伤线粒体被溶酶体上的自噬相关分子识别并通过自噬途径进行清除,从而抑制炎症反应。因此,雷公藤多苷及其主要活性成分可以通过调控自噬来抑制RA炎症,但是雷公藤甲素和雷公藤红素对细胞自噬有着不同的调节作用。
4.2 抑制NLRP3炎性小体活化
NLRP3是介导炎症过程的一类重要受体,NLRP3的激活会促进IL-1β和IL-18的成熟和分泌,诱导细胞焦亡和炎症反应[39]。研究表明,雷公藤甲素和雷公藤红素都可通过抑制NLRP3炎性小体的活化发挥抗炎活性。吴薇等[40]发现雷公藤甲素可以在体外改善高糖诱导的足细胞上皮-间充质转分化的作用,这种作用是通过下调高糖诱导的NLRP3炎症小体激活,进而减少下游效应分子Caspase-1、IL-1β、IL-18等蛋白的表达实现的。与雷公藤甲素类似,雷公藤红素也可以调控NLRP3炎症小体的激活产生抗炎作用[41-42]。Jing等[43]发现雷公藤红素可以通过调节NF-κB信号通路抑制NLRP3炎症小体的激活,从而降低弗氏佐剂诱导的大鼠血清和人单核THP-1细胞中IL-1β和IL-18的分泌,减轻RA的炎症反应。
4.3 调控JAK/STAT信号通路
JAK/STAT通路是细胞生长、分化、炎症反应和凋亡过程的一个重要信号通路,JAK包括JAK1、JAK2、JAK3和TYK2 4种亚型,在结合相应的配体活化后,通过激活下游的STAT发挥作用。研究显示JAK/STAT信号通路介导的炎症反应参与了RA的发病过程,针对JAK激酶的靶向小分子抑制剂目前已被批准用于RA的临床治疗,而雷公藤多苷及其主要活性成分也可以通过调控JAK/STAT通路来缓解炎症。研究发现,雷公藤甲素可以通过调控JAK2/STAT3信号通路改善RA患者FLS的炎症及细胞迁移,抑制炎性细胞因子表达和FLS增殖[44-45]。此外,研究表明雷公藤甲素可通过调控JAK/STAT信号通路的激活减轻炎症从而治疗系统性红斑狼疮[46]。因此,对JAK/STAT通路的调控是雷公藤多苷的一个重要的抗炎活性机制,但雷公藤多苷的主要活性成分是否直接靶向JAK/STAT通路仍有待更深入的研究。
4.4 调控TLR信号通路
TLR是机体识别病原微生物的主要模式识别受体之一。TLR在识别病原分子后,通过招募接头蛋白接头蛋白髓样分化因子88(myeloid differentiation primary response protein,MyD88)和Toll受体相关的干扰素激活蛋白(TIR-domain-containing adapter-inducing interferon-β,TRIF)等,进一步激活NF-κB和MAPK,从而诱导炎性细胞因子的释放,产生机体抵御外来微生物入侵的免疫反应[47]。研究发现,雷公藤红素可降低IL-1β诱导的IL-6、前列腺素E2(prostaglandin E2,PGE2)和一氧化氮等炎症因子的上调,并通过抑制TLR2/NF-κB信号通路的激活,减轻软骨细胞的炎症反应,减少软骨细胞细胞外基质的降解,有效缓解骨关节炎的滑膜炎症和骨流失,改善骨关节炎[48]。雷公藤甲素可降低RA模型大鼠滑膜组织中TLR4、NF-κB和p-NF-κB蛋白及mRNA的表达量,抑制滑膜TLR4/NF-κB信号通路的激活,从而降低炎性因子TNF-α、IL-4、IL-6的产生,改善RA模型大鼠的关节炎性症状[49]。因此,雷公藤多苷及其主要活性成分可通过调节TLR信号通路的激活发挥抑制RA的作用。
4.5 调控cGAS-STING信号通路
cGAS-STING通路是固有免疫中一条重要的信号调节通路,cGAS蛋白是新鉴定的一种模式识别受体,可以结合病原微生物的双链DNA,并产生第2信使cGAMP,后者可通过结合STING,进而诱导TANK结合激酶1(TANK-binding kinase 1,TBK1)和NF-κB的激活,产生I型干扰素和其他炎症因子[50]。cGAS-STING信号通路的异常激活可能导致机体产生异常的炎症反应和疾病,多种自身免疫性疾病的发生发展已被证明与cGAS-STING的异常激活有关[51]。最近的研究表明,RA患者的滑膜细胞和滑膜组织中存在dsDNA的积累和cGAS-STING信号通路的激活,介导了RA患者的滑膜炎症,参与了RA的病理进程[52-54]。而雷公藤甲素可以降低FLS和巨噬细胞中cGAS和STING蛋白的表达,进而抑制下游I型干扰素和炎性因子的分泌,发挥抑制RA的作用[55-56]。Trex1是一种主要的胞质核酸外切酶,可通过降解细胞质中多余的DNA来阻止内在自身免疫应答的启动。基因敲除小鼠由于不能有效降解胞质中的DNA,会激活cGAS-STING等免疫信号通路,出现自身免疫病表型。研究发现,雷公藤红素可以抑制STING下游TBK1-干扰素调节因子3(interferon regulatory factor 3,IRF3)的活化,并抑制下游Ⅰ型干扰素的产生[57],提示雷公藤多苷及其主要活性成分的抗炎作用与cGAS-STING信号通路相关。
4.6 调节Treg和Th17细胞平衡
与雷公藤多苷的作用机制类似,研究表明,雷公藤甲素也可以通过调节Treg和Th17细胞之间的平衡,改善RA的症状。体内动物实验结果表明,雷公藤甲素可以改善胶原诱导的RA模型小鼠脾脏中Treg/Th17细胞的失衡情况。在CIA大鼠的实验中,雷公藤甲素可以下调RA模型大鼠Th17细胞相关细胞因子IL-17和特异性转录因子视黄酸相关孤儿受体γt(retinoic acid-related orphan receptor γt,RORγt)mRNA和蛋白的表达,上调Treg细胞相关细胞因子IL-10和特异性转录因子Foxp3的蛋白表达,进而调节Th17和Treg细胞的平衡[58]。因此,对Treg和Th17细胞平衡的调节,是雷公藤多苷的主要活性成分治疗RA的重要机制。
4.7 调控转录水平
雷公藤多苷的主要活性成分雷公藤甲素可以干扰p53、NF-κB、热休克因子1(heat shock factor 1,HSF-1)等多种转录因子的活性,有研究已经鉴定得到转录因子TFⅡH的XPB亚基是雷公藤甲素发挥作用的靶点之一。雷公藤甲素通过抑制XPB的ATP酶活性导致转录受到抑制,这在部分程度上解释了雷公藤甲素的抗炎和抗肿瘤等活性的机制[59-61]。同时由于转录因子TFⅡH是RNA聚合酶II发挥转录活性的重要元件,而RNA聚合酶II介导的转录参与了细胞增殖和生长等多种重要的生命过程,所以雷公藤甲素对RNA聚合酶II活性的抑制,可能也是其对机体产生毒性的机制。但是目前对雷公藤多苷的其他主要成分是否直接靶向转录因子调控转录仍不清楚。另一方面,雷公藤甲素对转录的调控并不能完全解释雷公藤多苷对炎症信号通路的调控机制。因此,雷公藤多苷及其主要活性成分抑制RA的具体机制和作用靶标仍有待进一步研究。
5 结语
RA是一种发病机制复杂的自身免疫病,目前临床的治疗药物包括非甾体类抗炎药、糖皮质激素类药物以及改善病情的抗风湿药(disease-modifying anti-rheumatic drugs,DMARDs),DMARDs类药物包括传统合成的药物甲氨蝶呤(methotrexate,MTX)、柳氮磺吡啶,以及一些新兴的生物制剂和靶向药物等[62-64]。得益于对RA发病机制的深入研究,新的治疗方法逐渐被应用于临床,如靶向IL-6的生物疗法和针对JAK激酶的小分子抑制剂等,均表现出令人欣喜的治疗效果[65-66]。除此之外,植物药如雷公藤多苷、青藤碱、白芍总苷等也对RA的关节炎性症状具有明显的治疗效果[67-69],其中雷公藤多苷由于其独特的抗炎和调节免疫的活性,已被批准用于治疗包括RA在内的多种免疫和炎症性疾病,中成药雷公藤多苷片是目前临床上广泛应用的一类治疗RA和肾病综合征等疾病的药物。
尽管疗效确切,目前对于雷公藤多苷治疗RA的作用机制研究仍不充分,仍需进一步深入研究其作用机制。首先,雷公藤多苷的主要活性成分已被证明可以影响TLR、JAK/STAT、NLRP3炎性小体、cGAS-STING等信号通路介导的炎症信号活化(图4),但是其通过减轻炎症来治疗RA的关键作用靶标尚不清楚。其次,目前分子层面对于雷公藤多苷治疗RA机制的研究多关注于其主要活性成分雷公藤甲素和雷公藤红素,但是单体的作用是否能反映整体中药的作用特点仍有待商榷。此外,雷公藤多苷的各个主要成分之间是如何相互协调共同发挥抗RA的活性仍缺乏相关的研究。针对雷公藤多苷及其主要活性成分治疗RA的作用机制的深入研究,将为雷公藤多苷的临床应用提供更加坚实的理论指导。值得注意的是,雷公藤多苷在临床使用时,疗效和毒性并存,活性靶标往往也可能是其产生毒副作用的主要作用环节。因此,阐明雷公藤多苷的活性作用靶标,也将为理解雷公藤多苷的毒副作用机制提供参考,而且为临床上通过使用不同作用机制的药物配伍来增效减毒提供理论依据。
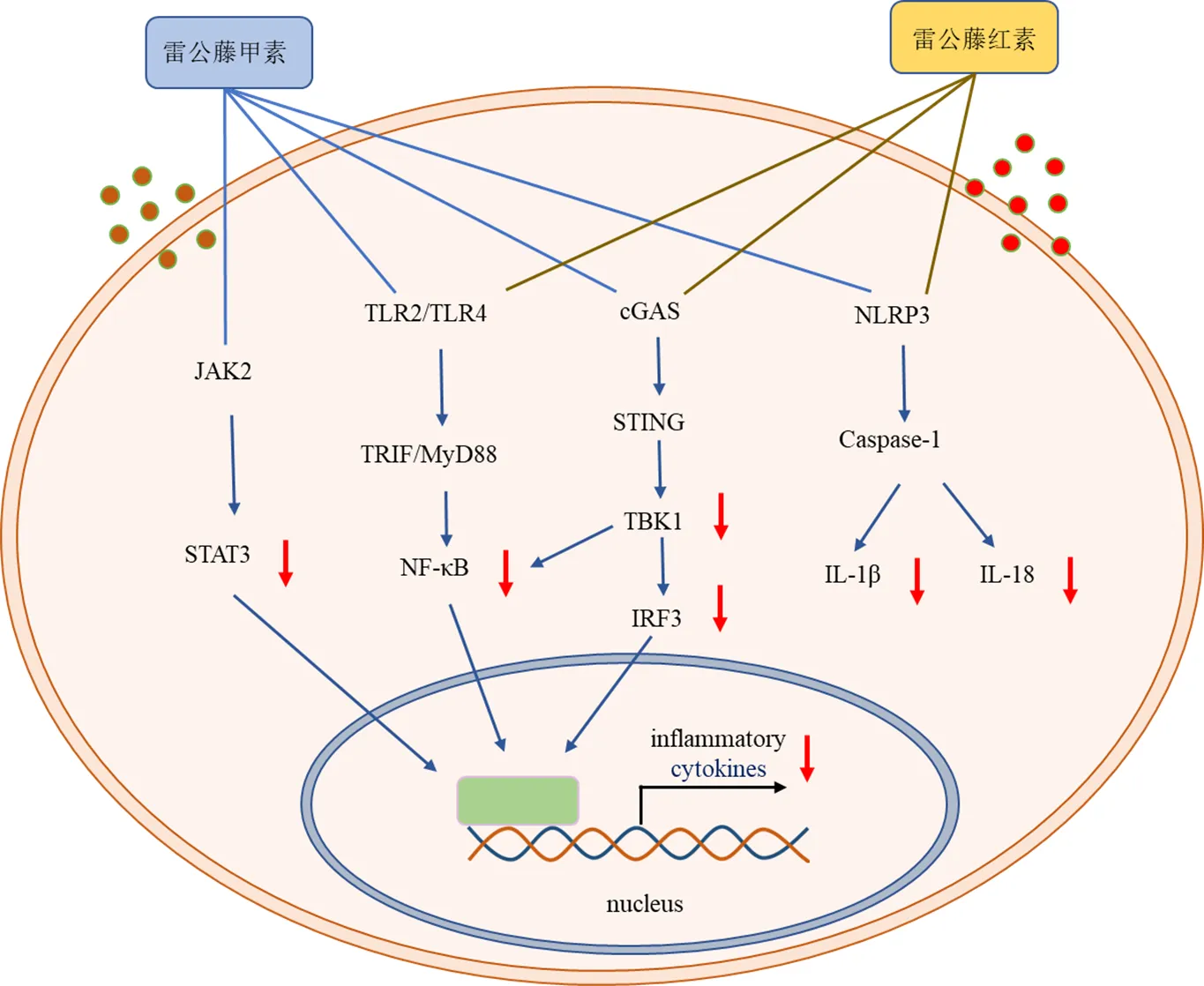
图4 雷公藤多苷主要活性成分调控炎症相关信号通路
利益冲突 所有作者均声明不存在利益冲突
[1] McInnes I B, Schett G. Pathogenetic insights from the treatment of rheumatoid arthritis [J]., 2017, 389(10086): 2328-2337.
[2] Scherer H U, Häupl T, Burmester G R. The etiology of rheumatoid arthritis [J]., 2020, 110: 102400.
[3] 林娜, 姜泉, 刘维, 等. 雷公藤多苷/雷公藤片治疗类风湿关节炎用药指南 [J]. 中国中药杂志, 2020, 45(17): 4149-4153.
[4] 姜淼, 张海波, 丁樱. 雷公藤多苷药理作用及临床应用研究进展 [J]. 中华中医药学刊, 2021, 39(3): 59-63.
[5] Weyand C M, Goronzy J J. The immunology of rheumatoid arthritis [J]., 2021, 22(1): 10-18.
[6] Mueller A L, Payandeh Z, Mohammadkhani N,. Recent advances in understanding the pathogenesis of rheumatoid arthritis: New treatment strategies [J]., 2021, 10(11): 3017.
[7] Fukui S, Iwamoto N, Takatani A,. M1 and M2 monocytes in rheumatoid arthritis: A contribution of imbalance of M1/M2 monocytes to osteoclastogenesis [J]., 2017, 8: 1958.
[8] Croia C, Bursi R, Sutera D,. One year in review 2019: Pathogenesis of rheumatoid arthritis [J]., 2019, 37(3): 347-357.
[9] Huang Y, Wang H, Ba X,. Decipher manifestations and Treg/Th17 imbalance in multi-staging rheumatoid arthritis and correlation with TSDR/RORC methylation [J]., 2020, 127: 1-11.
[10] Sun W, Meednu N, Rosenberg A,. B cells inhibit bone formation in rheumatoid arthritis by suppressing osteoblast differentiation [J]., 2018, 9(1): 5127.
[11] Dahdah A, Habir K, Nandakumar K S,. Germinal center B cells are essential for collagen-induced arthritis [J]., 2018, 70(2): 193-203.
[12] Radu A F, Bungau S G. Management of rheumatoid arthritis: An overview [J]., 2021, 10(11): 2857.
[13] 叶敏, 万军, 王李俊, 等. 中药通过调节肠道菌群治疗类风湿关节炎的研究进展 [J]. 中草药, 2022, 53(22): 7279-7284.
[14] 许玲夏, 何东仪. 雷公藤及其衍生物对类风湿性关节炎的疗效和作用机制研究进展 [J]. 时珍国医国药, 2022, 33(7): 1703-1706.
[15] 王晓月, 张依, 陈文佳, 等. 从临床多组学整合调控网络探究雷公藤多苷片治疗类风湿关节炎的“效-毒”关联机制 [J]. 中国实验方剂学杂志, 2023, 29(5): 49-57.
[16] 陆婷, 饶艳婷, 张瑾, 等. 雷公藤多苷片治疗类风湿关节炎的疗效及作用机制 [J]. 中药材, 2021, 44(9): 2214-2218.
[17] Zhu Y T, Zhang L Y, Zhang X F,.glycosides ameliorates collagen-induced arthritis and aberrant lipid metabolism in rats [J]., 2022, 13: 938849.
[18] 刘东京, 肖颖, 吴季霖. 三七总皂苷联合雷公藤多苷对胶原诱导关节炎大鼠血清白细胞介素-1β、肿瘤坏死因子-α表达及滑膜新生血管的影响 [J]. 中国医学工程, 2018, 26(7): 12-16.
[19] Song X Q, Zhang Y, Dai E Q. Therapeutic targets of thunder God vine (Hook.) in rheumatoid arthritis (Review) [J]., 2020, 21(6): 2303-2310.
[20] 白雪, 付瑞嘉, 乐世俊, 等. 雷公藤治疗类风湿性关节炎研究进展 [J]. 中草药, 2020, 51(1): 265-275.
[21] 马俊福, 孟庆良, 郑福增, 等. 雷公藤内酯醇对胶原诱导性关节炎大鼠γ-干扰素和白细胞介素-17A表达的影响 [J]. 北京中医药大学学报, 2020, 43(7): 592-598.
[22] 范文强, 吕书龙, 马玲, 等. 雷公藤甲素治疗类风湿关节炎的作用机制及安全性分析 [J]. 中草药, 2019, 50(16): 3866-3871.
[23] 袁凯. 雷公藤甲素、雷公藤红素通过调节中性粒细胞活性治疗类风湿关节炎的机制研究 [D]. 北京: 北京中医药大学, 2017.
[24] 周伟, 刘志刚, 宋卫中. 雷公藤红素对类风湿关节炎小鼠骨侵蚀的影响 [J]. 中国临床药理学杂志, 2021, 37(18): 2476-2480.
[25] Tsai C H, Chen C J, Gong C L,. CXCL13/CXCR5 axis facilitates endothelial progenitor cell homing and angiogenesis during rheumatoid arthritis progression [J]., 2021, 12(9): 846.
[26] Guo D, Lin C X, Lu Y H,. FABP4 secreted by M1-polarized macrophages promotes synovitis and angiogenesis to exacerbate rheumatoid arthritis [J]., 2022, 10(1): 45.
[27] Wang Y, Wu H, Deng R. Angiogenesis as a potential treatment strategy for rheumatoid arthritis [J]., 2021, 910: 174500.
[28] Ba X, Huang Y, Shen P,. WTD attenuating rheumatoid arthritis via suppressing angiogenesis and modulating the PI3K/AKT/mTOR/HIF-1α pathway [J]., 2021, 12: 696802.
[29] Yang G L, Chang C C, Yang Y W,. Resveratrol alleviates rheumatoid arthritis via reducing ROS and inflammation, inhibiting MAPK signaling pathways, and suppressing angiogenesis [J]., 2018, 66(49): 12953-12960.
[30] 李娜, 崔娟. 雷公藤多苷联合环磷酰胺对类风湿关节炎患者血清VEGF、VEGFR2表达水平的影响 [J]. 慢性病学杂志, 2017, 18(1): 72-74.
[31] 王靖霞, 刘春芳, 李逸群, 等. 雷公藤多苷片抑制实验性类风湿关节炎血管新生的作用研究 [J]. 中国中药杂志, 2019, 44(16): 3441-3447.
[32] McInnes I B, Schett G. The pathogenesis of rheumatoid arthritis [J]., 2011, 365(23): 2205-2219.
[33] Zhang C, Ju J Y, Wu X H,.polyglycoside ameliorated TNBS-induced colitis in rats via regulating Th17/treg balance in intestinal mucosa [J]., 2021, 14: 1243-1255.
[34] 马衍慧, 章建峰, 刘丽敏. 雷公藤多苷下调miR-146a表达以改善类风湿关节炎患者Th17和Treg细胞数目失衡的机制研究 [J]. 全科医学临床与教育, 2021, 19(8): 684-687.
[35] Cai A J, Qi S W, Su Z W,.glycosides inhibit inflammatory mediators in the rat synovial RSC-364 cell line stimulated with interleukin-1β [J]., 2015, 3(6): 763-766.
[36] 王友庆. 雷公藤多苷通过调控TRAF6表达缓解类风湿关节炎及其机制研究 [D]. 杭州: 浙江中医药大学, 2022.
[37] Xie C M, Jiang J, Liu J P,. Triptolide suppresses human synoviocyte MH7A cells mobility and maintains redox balance by inhibiting autophagy [J]., 2019, 115: 108911.
[38] Hu M J, Luo Q, Alitongbieke G,. Celastrol-induced Nur77 interaction with TRAF2alleviates inflammation by promoting mitochondrial ubiquitination and autophagy [J]., 2017, 66(1): 141-153.e6.
[39] Wang L, Hauenstein A V. The NLRP3 inflammasome: Mechanism of action, role in disease and therapies [J]., 2020, 76: 100889.
[40] 吴薇, 刘不悔, 万毅刚, 等. 雷公藤甲素抑制NLRP3炎症小体活化改善高糖诱导的足细胞上皮-间充质转分化 [J]. 中国中药杂志, 2019, 44(24): 5457-5464.
[41] 景铭, 王美灵, 张媛媛, 等. 雷公藤红素调控NLRP3炎症小体改善大鼠代谢相关脂肪性肝病研究 [J]. 药物评价研究, 2022, 45(4): 624-632.
[42] 谷佳, 石雅宁, 邱韵, 等. 基于网络药理学和实验验证探讨雷公藤红素抗血管重塑的作用机制[J]. 中草药, 2023, 54(15): 4874-4881.
[43] Jing M, Yang J J, Zhang L R,. Celastrol inhibits rheumatoid arthritis through the ROS-NF-κB-NLRP3 inflammasome axis [J]., 2021, 98: 107879.
[44] 王杰, 刘健, 文建庭, 等. 雷公藤甲素抑制类风湿关节炎患者的成纤维样滑膜细胞的炎症和迁移: 基于circRNA 0003353/JAK2/STAT3信号通路 [J]. 南方医科大学学报, 2022, 42(3): 367-374.
[45] Lin J J, Tao K, Gao N,. Triptolide inhibits expression of inflammatory cytokines and proliferation of fibroblast-like synoviocytes induced by IL-6/sIL-6R-mediated JAK2/STAT3 signaling pathway [J]., 2021, 41(1): 133-139.
[46] 汤艳华, 刘玲, 刘炬, 等. 雷公藤内酯醇调控JAK/STAT信号通路对系统性红斑狼疮模型小鼠炎症免疫的影响 [J]. 中药材, 2021, 44(8): 1976-1980.
[47] Arleevskaya M I, Larionova R V, Brooks W H,. Toll-like receptors, infections, and rheumatoid arthritis [J]., 2020, 58(2): 172-181.
[48] 杨光夏. 雷公藤红素调控TLR2/NF-κB信号通路治疗骨关节炎的机制研究 [D]. 南京: 南京中医药大学, 2022.
[49] 陈颖婷, 何柯新, 王云秀, 等. 雷公藤内酯醇对类风湿关节炎大鼠TLR4/NF-κB信号通路的调控作用研究 [J]. 国际检验医学杂志, 2019, 40(17): 2053-2057.
[50] Zhang X W, Bai X C, Chen Z J. Structures and mechanisms in the cGAS-STING innate immunity pathway [J]., 2020, 53(1): 43-53.
[51] Decout A, Katz J D, Venkatraman S,. The cGAS-STING pathway as a therapeutic target in inflammatory diseases [J]., 2021, 21(9): 548-569.
[52] Uggenti C, Lepelley A, Crow Y J. Self-awareness: Nucleic acid-driven inflammation and the type I interferonopathies [J]., 2019, 37: 247-267.
[53] Wang J N, Li R R, Lin H B,. Accumulation of cytosolic dsDNA contributes to fibroblast-like synoviocytes-mediated rheumatoid arthritis synovial inflammation [J]., 2019, 76: 105791.
[54] Shen H T, Jin L L, Zheng Q Q,. Synergistically targeting synovium STING pathway for rheumatoid arthritis treatment [J]., 2023, 24: 37-53.
[55] 许阿兰, 龙瑛婕, 王祥, 等. 雷公藤甲素对类风湿性关节炎患者滑膜成纤维细胞cGAS-STING信号通路的影响 [J]. 中华中医药杂志, 2022, 37(2): 1087-1090.
[56] Xu A L, Yang R X, Zhang M F,. Macrophage targeted triptolide micelles capable of cGAS-STING pathway inhibition for rheumatoid arthritis treatment [J]., 2022, 30(9): 961-972.
[57] 刘逸煊. 雷公藤红素改善Trex1−/−小鼠自身免疫性疾病 [D]. 福州: 福建师范大学, 2020.
[58] 黄谣. 基于Treg/Th17细胞失衡探讨雷公藤甲素治疗RA的作用和机制研究 [D]. 武汉: 华中科技大学, 2021.
[59] Titov D V, Gilman B, He Q L,. XPB, a subunit of TFIIH, is a target of the natural product triptolide [J]., 2011, 7(3): 182-188.
[60] Hayashi M, Madokoro H, Yamada K,. Novel antibody-drug conjugate with anti-CD26 humanized monoclonal antibody and transcription factor IIH (TFIIH) inhibitor, triptolide, inhibits tumor growth via impairing mRNA synthesis [J]., 2019, 11(8): 1138.
[61] Liang X, Xie R X, Su J F,. Inhibition of RNA polymerase III transcription by triptolide attenuates colorectal tumorigenesis [J]., 2019, 38(1): 217.
[62] 杨丽, 刘荣华, 黄四碧, 等. 类风湿性关节炎的发病机制及治疗药物研究进展 [J]. 中国药房, 2021, 32(17): 2154-2159.
[63] 杨琴, 杨进锋, 杨玉涛, 等. 类风湿关节炎药物及手术治疗的研究进展 [J]. 中华中医药学刊, 2023, 41(1): 133-136.
[64] Tanaka Y. Recent progress in treatments of rheumatoid arthritis: An overview of developments in biologics and small molecules, and remaining unmet needs [J]., 2021, 60(Suppl 6): vi12-vi20.
[65] Ogata A, Kato Y, Higa S,. IL-6 inhibitor for the treatment of rheumatoid arthritis: A comprehensive review [J]., 2019, 29(2): 258-267.
[66] Harrington R, Al Nokhatha S A, Conway R. JAK inhibitors in rheumatoid arthritis: An evidence-based review on the emerging clinical data [J]., 2020, 13: 519-531.
[67] Liu W W, Zhang Y J, Zhu W N,. Sinomenine inhibits the progression of rheumatoid arthritis by regulating the secretion of inflammatory cytokines and monocyte/ macrophage subsets [J]., 2018, 9: 2228.
[68] Li H, Cao X Y, Dang W Z,. Total glucosides ofprotects against collagen-induced mouse arthritis via inhibiting follicular helper T cell differentiation [J]., 2019, 65: 153091.
[69] Liu X, Wang Z, Qian H,. Natural medicines of targeted rheumatoid arthritis and its action mechanism [J]., 2022, 13: 945129.
Research progress on mechanisms ofglycosides and its active ingredients against rheumatoid arthritis
CUI Dong-xiao1, YUE Shi-jun1, XU Ding-qiao1, FU Rui-jia1, LIU Wen-juan1, ZHANG Sai1, MA Wen-fu2, TANG Yu-ping1
1. Key Laboratory of TCM Compatibility of Shaanxi Administration of Traditional Chinese Medicine, Shaanxi University of Chinese Medicine, Xi’an 712046, China 2. School of Life Sciences, Beijing University of Chinese Medicine, Beijing 102488, China
glycosides (TG) are total glycosides extracted from the roots of Leigongteng (). Tripterygium Glycosides Tablet (雷公藤多苷片) is a Chinese patent medicine with definite effect in the treatment of rheumatoid arthritis (RA). Triptolide and celastrol are the main active ingredients in TG. Modern studies have found that the mechanisms of TG against RA include inhibition of angiogenesis, regulation of balance between regulatory T (Treg) and T helper type 17 (Th17) cells, inhibition of matrix metalloproteinase expression and promotion of apoptosis of fibroblast-like synoviocytes. Moreover, as the main active ingredients of TG, triptolide and celastrol can inhibit RA by regulating autophagy, inhibiting the activation of inflammatory signaling pathways. This article firstly reviewed the pathogenesis of RA, and then focused on summarizing and elaborating the mechanisms of TG and its active ingredients against RA, with view to providing reference for the research on TG against RA.
glycosides; triptolide; celastrol; rheumatoid arthritis; anti-inflammatory; mechanism of action
R285
A
0253 - 2670(2023)20 - 6913 - 09
10.7501/j.issn.0253-2670.2023.20.034
2023-04-20
陕西中医药大学学科创新团队项目(2019-YL10);陕西省教育厅一般专项科研计划项目(22JK0350)
崔东晓,讲师,从事中药抗炎和免疫药理研究。E-mail: 2051143@sntcm.edu.cn
通信作者:唐于平,教授,从事中药药效物质及配伍关系研究。E-mail: yupingtang@sntcm.edu.cn
[责任编辑 潘明佳]
