经典名方清胃散基准样品浓缩干燥工艺及关键质量属性的研究
2023-10-19卞海雯严国俊曹杰楠夏梦莹高武锋潘金火
卞海雯,严国俊, 2*,曹杰楠,夏梦莹,高武锋,潘金火,盛 华
经典名方清胃散基准样品浓缩干燥工艺及关键质量属性的研究
卞海雯1,严国俊1, 2*,曹杰楠1,夏梦莹1,高武锋1,潘金火1,盛 华3*
1. 南京中医药大学药学院,江苏 南京 210023 2. 江苏省经典名方工程研究中心,江苏 南京 210023 3. 东部战区总医院药剂科,江苏 南京 210002
对清胃散基准样品的浓缩干燥工艺进行考察,确定其浓缩干燥工艺,并对清胃散基准样品中关键质量属性(critical quality attributes,CQA)进行研究。通过考察不同浓缩干燥方法,比较样品中异阿魏酸、盐酸小檗碱、盐酸巴马汀及丹皮酚的含量相对于标准煎液的保留率,确定清胃散基准样品的浓缩干燥工艺,结合前期研究出的煎煮工艺,制备15批清胃散基准样品。利用超快速液相色谱-四极杆-飞行时间质谱(ultra fast liquid chromatography-quadrupole time of flight mass spectrometry,UFLC-Q-TOF/MS)分析清胃散基准样品中的化学成分及入血原型成分,结合文献研究初步确定清胃散基准样品CQA。确定了清胃散基准样品的浓缩干燥工艺为原方煎煮液加药液量0.05 g/mL的β-环糊精直接喷雾干燥。分析出清胃散基准样品中化学成分有135个,入血原型成分28个,初步推测决定清胃散基准样品CQA的化学成分有黄连碱、盐酸小檗碱、盐酸巴马汀、表小檗碱、丹皮酚。建立的浓缩干燥工艺在保证最大程度清胃散标准煎液有效成分的基础上适用于现代生产工艺;并且为后续基准样品CQA的确认及制剂开发奠定基础,从而可以更全面地评价清胃散制剂质量的优劣。
经典名方;清胃散;基准样品;浓缩;干燥;关键质量属性;异阿魏酸;盐酸小檗碱;盐酸巴马汀;丹皮酚;UFLC-Q-TOF/MS
清胃散出自金代李东垣的《兰室秘藏》[1],由黄连(1.2 g)、地黄(1.2 g)、当归(1.2 g)、牡丹皮(2 g)及升麻(4 g)5味中药组成,主治“因服补胃热药,致使上下牙疼痛不可忍,牵引头脑、满面发热,大痛”[2]。本研究前期通过对金代时期的清胃散处方剂量、药材基源、药材炮制及水煎煮工艺的考证,还原经典名方清胃散的标准煎液制备方法为原方饮片9.6 g,粉碎成最粗粉,加水150 mL,武火加热至沸,文火保持微沸煎煮20 min,静置后,倾出上清液,放至室温,定容至100 mL。目前对经典名方清胃散的研究多为文献考证及药理作用,未见其基准样品相关工艺研究的报道[3]。
基准样品一般为煎液、浓缩浸膏或干燥品,本课题组通过前期文献考证及实验研究已经确定清胃散煎煮工艺,且本课题组欲将清胃散基准样品定为干燥粉末,因此,本研究选择不同浓缩方式及干燥方式对清胃散煎液进行浓缩干燥,通过比较不同方式所得样品中指标性成分含量及保留率,进而选出最佳浓缩干燥工艺。从而确定合理且完整的清胃散基准样品浓缩干燥工艺,便于后续的质量标准及制剂研究。《人用药物注册技术要求国际协调委员会药物研发指导原则》(ICH Q8)[4]中提出药品关键质量属性(critical quality attributes,CQA)的概念。中药制剂根据其复杂体系的特征和药用物质的分类,CQA的提取和确认应以保证药物有效性和安全性为前提,基于药物本身的性质、制备工艺、制剂要求和整体性特征表述研究的基础上,全面考虑,以提取完整的能表征药品性质的质量控制指标,为企业生产过程控制和药品质量标准建立提供依据[5]。
中药复方制剂成分复杂,不同于西药单个或几个特定成分,所以其质量的控制一直是一个共同探索的问题,目前大都是检测主要成分或特征成分的含量高低来评价某一复方制剂的质量。而对经典名方清胃散进行CQA的研究和确认可以从更全面的角度去评价其质量的优劣。
1 仪器与材料
1.1 仪器
TD6001型分析天平,天津市天马仪器有限公司;MS-105DU型电子天平,梅特勒-托利多国际股份有限公司;FA1104N型电子天平,上海精密科学仪器有限公司;Biosafer-SB25-12DTD型超声波清洗机,赛飞(中国)有限公司;400Y型多功能粉碎机,永康市铂欧五金制品有限公司;AE-1106A型电陶炉,佛山市顺德区爱卡生活电器有限公司;LC-20型快速液相色谱仪,岛津公司;Triple TOFTM5600型高分辨质谱系统,上海爱博才思分析仪器贸易有限公司;MX-S型可调式混匀仪,北京大龙实验室;1736R型多功能高速离心机,基因有限公司;HH-2型数显恒温水浴锅,常州国华电器有限公司;HWS-24型电热恒温水浴锅,上海一恒科学仪器有限公司;DHG-9023A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;LW-015型喷雾干燥机,上海利闻科学仪器有限公司;FD-1A-50型冷冻干燥机,上海利闻科学仪器有限公司;SY-2000型旋转蒸发仪,上海亚荣生化仪器厂;SHZ-III真空泵,上海亚荣生化仪器厂。
1.2 药材与试剂
甲醇、乙腈,色谱级,安徽天地高纯溶剂有限公司;甲酸,ACS(色谱级),上海阿拉丁生化科技股份有限公司;乙腈、甲酸,质谱纯,美国默克公司;β-环糊精,上海源叶生物科技有限公司;纯净水,华润怡宝饮料(中国)有限公司;磷酸,分析纯,南京化学试剂有限公司;无水乙醇,分析纯,上海泰坦化学有限公司;冰乙酸,分析纯,上海阿拉丁生化科技股份有限公司。对照品异阿魏酸(批号111698-201904,质量分数99.3%,供含量测定用)、盐酸小檗碱(批号110713-201814,质量分数86.7%,供含量测定用)、盐酸巴马汀(批号110732-201913,质量分数85.7%,供含量测定用)、丹皮酚(批号110708-201908,质量分数99.8%,供含量测定用),以上对照品均购买于中国食品药品检定研究院。变态辣辣椒粉(批号20220715-102),购买于渝里香旗舰店。清胃散基准样品所用药材来源信息见表1,均经南京中医药大学药学院刘训红教授鉴定,当归为为伞形科当归属植物当归(Oliv.) Diels的干燥根,黄连为毛茛科黄连属植物黄连Franch.的干燥根茎,牡丹皮为毛茛科芍药属植物牡丹Andr.的干燥根皮,升麻为毛茛科类叶升麻属植物大三叶升麻Kom.的干燥根茎,地黄为玄参科地黄属植物地黄Libosch.的干燥块根。
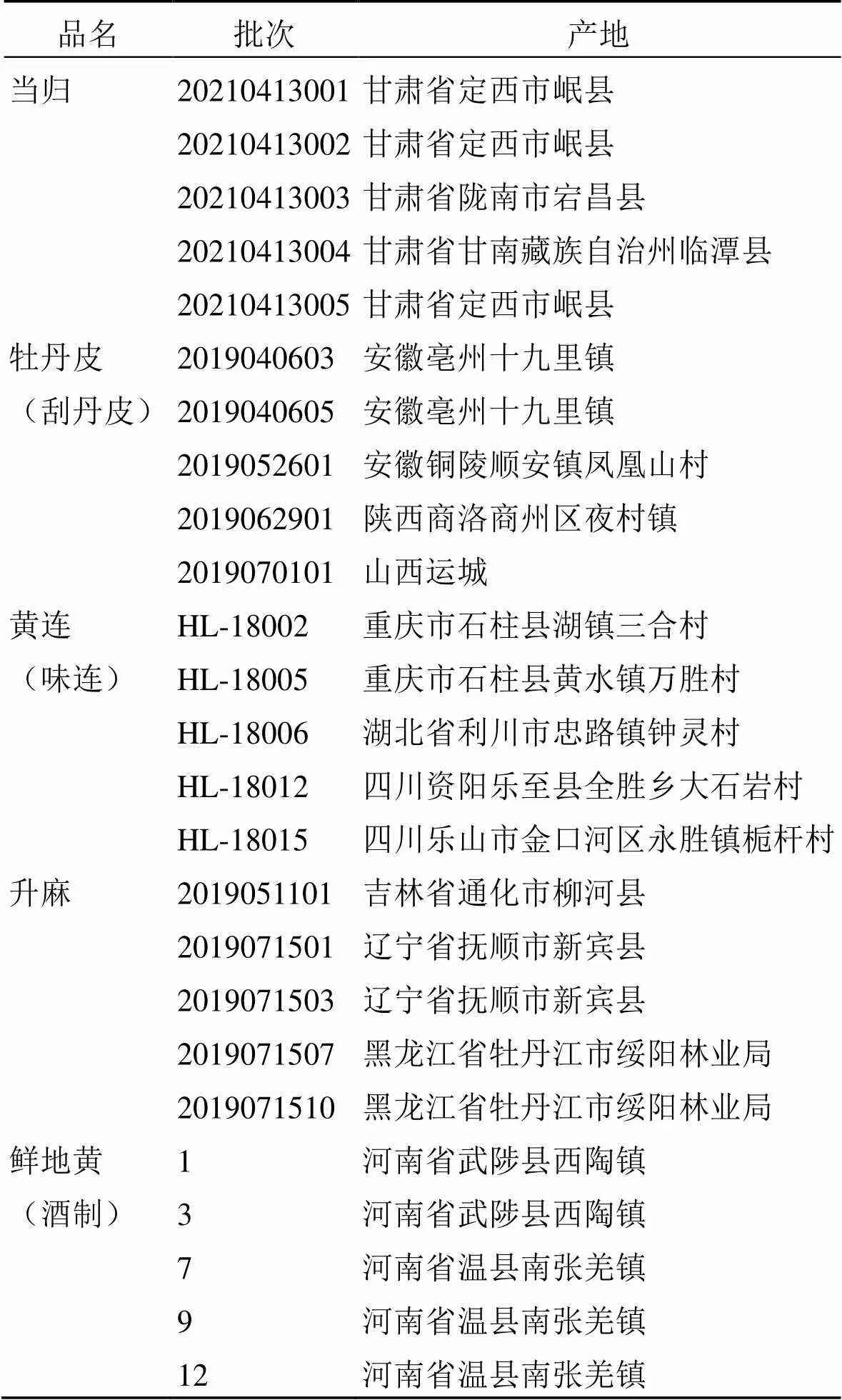
表1 清胃散基准样品药材信息
1.3 动物
SPF级雄性SD大鼠,体质量(160±20)g,共18只,购于南京市江宁区青龙山动物繁殖场,动物许可证号:SCXK(浙)2019-20Z2,动物质量合格证号:20210628Aazz0100000510,所有动物实验遵循南京中医药大学有关实验动物管理和使用的规定,均符合3R原则。
2 方法与结果
2.1 清胃散基准样品的制备
将15批清胃散基准样品(分别编号S1~S15,药材组合方式见表2)按照前期考察出的水煎煮工艺进行煎煮,采用单处方量(9.6 g饮片)煎煮液(100 mL)加药液量5%的β-环糊精(g/mL)直接喷雾干燥的工艺,得到相对应的基准样品。

表2 清胃散基准样品制备投料方式
2.2 指标成分异阿魏酸、盐酸小檗碱、盐酸巴马汀及丹皮酚的测定
2.2.1 色谱条件 Waters Symmetry C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.15%甲酸水溶液,梯度洗脱:0~15 min,10%~15%乙腈;15~40 min,15%乙腈;40~50 min,15%~20%乙腈;50~75 min,20%~26%乙腈;75~78 min,26%~35%乙腈;78~85 min,35%乙腈;85~91 min,35%~90%乙腈;91~97 min,90%~10%乙腈;97~100 min,10%乙腈;体积流量1.0 mL/min;检测波长330 nm;柱温30 ℃;进样体积20 μL。
2.2.2 对照品溶液的制备 分别取异阿魏酸对照品8.60 mg、盐酸小檗碱对照品4.66 mg、盐酸巴马汀对照品4.24 mg、丹皮酚对照品9.11 mg,精密称定,置于5 mL量瓶中,加甲醇溶解,制成质量浓度分别为异阿魏酸1.708 0 mg/mL、盐酸小檗碱0.808 0 mg/mL、盐酸巴马汀0.726 7 mg/mL、丹皮酚1.818 4 mg/mL的单一对照品溶液。分别精密移取上述单一对照品溶液适量至25 mL量瓶内,甲醇定容,配制成混合对照品溶液,质量浓度分别为异阿魏酸68.32 μg/mL、盐酸小檗碱32.32 μg/mL、盐酸巴马汀29.07 μg/mL、丹皮酚72.73 μg/mL。
2.2.3 供试品溶液的制备 取清胃散基准样品粉末0.4 g,精密称定,加入75%甲醇10 mL,称定质量,超声(功率500 W、频率45 kHz)45 min,再称定质量,用75%甲醇补足减失的质量,滤过,取续滤液,即得供试品溶液。
2.2.4 线性关系考察 精密吸取“2.2.2”项下单一对照品溶液适量,制成质量浓度为853.980 μg/mL的异阿魏酸对照品溶液、404.022 μg/mL的盐酸小檗碱对照品溶液、72.673 μg/mL的盐酸巴马汀对照品溶液、909.178 μg/mL的丹皮酚对照品溶液,分别精密吸取上述对照品溶液,配制成不同质量浓度的对照品溶液,分别吸取10 μL注入高效液相色谱仪,进行测定,记录峰面积,以对照品质量浓度为横坐标(),峰面积为纵坐标()进行回归,结果分别为异阿魏酸=96 233.0-7 933.5,2=0.999 9,线性范围2.669~85.398 μg/mL;盐酸小檗碱= 46 869.0+9 919.5,2=0.999 9,线性范围1.263~40.415 μg/mL;盐酸巴马汀=46 427.00+79.02,2=1.000 0,线性范围0.227~7.267 μg/mL;丹皮酚=30 872.0-13 914.0,2=0.999 9,线性范围5.682~181.836 μg/mL,可知各成分在各自范围内线性关系良好。
2.2.5 精密度考察 精密称取清胃散基准样品粉末(S1)0.4 g,精密加入水5 mL,超声30 min,放冷,称定质量,加水补足减失的质量,加无水乙醇定容至10 mL,充分混合后过0.45 μm微孔滤膜。在“2.2.1”项下色谱条件连续进样6次,测定,以丹皮酚的保留时间和峰面积为参照,记录异阿魏酸、盐酸小檗碱、盐酸巴马汀和丹皮酚的相对保留时间和相对峰面积,计算其RSD,异阿魏酸、盐酸小檗碱、盐酸巴马汀和丹皮酚相对保留时间的RSD<0.35%,相对峰面积的RSD<2.88%,表明仪器精密度良好。
2.2.6 稳定性考察 精密称取清胃散基准样品粉末(S1)0.4 g,精密加入水5 mL,超声30 min,放冷,称定质量,加水补足减失的质量,加无水乙醇定容至10 mL,充分混合后过0.45 μm微孔滤膜。在“2.2.1”项下色谱条件分别于0、2、4、6、8、10、12、24 h进样,测定,以丹皮酚的保留时间和峰面积为参照,记录异阿魏酸、盐酸小檗碱、盐酸巴马汀和丹皮酚的相对保留时间和相对峰面积,计算RSD,异阿魏酸、盐酸小檗碱、盐酸巴马汀和丹皮酚相对保留时间的RSD<0.15%,相对峰面积的RSD<2.27%,表明该供试品溶液在24 h内均能保持稳定。
2.2.7 重复性考察 精密称取清胃散基准样品粉末(S1)0.4 g,精密加入水5 mL,超声30 min,放冷,称定质量,加水补足减失的质量,加无水乙醇定容至10 mL,充分混合后过0.45 μm微孔滤膜,平行处理6份供试品溶液,在“2.2.1”项下色谱条件进样,测定,以丹皮酚的保留时间和峰面积为参照,记录异阿魏酸、盐酸小檗碱、盐酸巴马汀和丹皮酚的相对保留时间和相对峰面积,计算RSD,异阿魏酸、盐酸小檗碱、盐酸巴马汀和丹皮酚相对保留时间的RSD<0.23%,相对峰面积的RSD<2.87%,表明该方法重复性良好。
2.2.8 加样回收率考察 取6份同一批次清胃散基准样品(S1),其中异阿魏酸、盐酸小檗碱、盐酸巴马汀及丹皮酚的质量分数分别为324.450、2 281.759、775.155、781.870 μg/g,精密称量基准样品粉末,再精密加入一定量的对照品,依法测定,计算其加样回收率,结果异阿魏酸、盐酸小檗碱、盐酸巴马汀及丹皮酚的平均加样回收率分别为102.52%、105.08%、94.92%、99.99%,RSD分别为0.62%、1.62%、1.82%、1.50%,表明该方法回收率较好,方法可行。
2.3 浓缩工艺研究
2.3.1 供试品溶液的制备 按清胃散单处方量的5倍称取饮片48 g,加水750 mL,武火加热至沸后转文火煎煮,趁热滤过,放至室温,定容至500 mL,得样品液。吸取样品液5 mL于10 mL量瓶中,加无水乙醇定容,充分混合后过0.45 μm微孔滤膜,即得浓缩工艺供试品溶液。
2.3.2 浓缩工艺考察
(1)减压浓缩:取100 mL煎煮液于500 mL圆底烧瓶中,水浴75 ℃,压力−0.085~−0.080 MPa,将浓缩液(体积大约为30 mL)倒出后用热水洗涤圆底烧瓶并定容至50 mL。吸取样品液5 mL于10 mL量瓶中,加无水乙醇定容,充分混合后过0.45 μm微孔滤膜,即得。
(2)常压浓缩:取100 mL煎煮液于蒸发皿中,水浴100 ℃,将浓缩液(体积大约为30 mL)倒出后用热水洗涤蒸发皿并定容至50 mL。吸取样品液5 mL于10 mL量瓶中,加无水乙醇定容,充分混合后过0.45 μm微孔滤膜,即得。
2.3.3 实验结果 对不同浓缩方法的清胃散水煎液中的异阿魏酸、盐酸小檗碱、盐酸巴马汀、丹皮酚4种指标成分含量及其保留率进行测定,并进行显著性分析,结果见表3,不同浓缩方法对比HPLC图见图1。结果表明,无论何种浓缩方式,挥发性成分丹皮酚均有较大损耗,且保留率低,故本实验考虑不进行浓缩,直接进行干燥。
2.4 干燥工艺研究
2.4.1 供试品溶液的制备 同“2.3.1”项下供试品溶液的制备方法。
2.4.2 干燥工艺
(1)喷雾干燥:取200 mL水煎液,加β-环糊精10 g,喷雾干燥。精密称取样品约0.4 g,精密加入水5 mL,超声30 min,放冷,称定质量,加水补足减失的质量,加无水乙醇定容至10 mL,充分混合后过0.45 μm微孔滤膜,即得。
(2)冷冻干燥:取水煎液10 mL,冷冻干燥。精密称取样品约0.14 g,精密加入水5 mL,超声30 min,放冷,称定质量,加水补足减失的质量,加无水乙醇定容至10 mL,充分混合后过0.45 μm微孔滤膜,即得。
2.4.3 实验结果 对不同干燥方法所得的清胃散样品中的异阿魏酸、盐酸小檗碱、盐酸巴马汀、丹皮酚4种指标成分含量及其保留率进行测定,并进行统计学分析,结果见表4,不同干燥方法对比HPLC图见图2。从3种指标性成分保留率(除挥发性成分丹皮酚)及总保留率来看,喷雾干燥组均好于冷冻干燥组。冷冻干燥法所得样品虽对于挥发性成分(如丹皮酚等)的保留率较高,但其效率低,时间长,能耗大,成本高,不适于附加值较低的颗粒剂等普通口服制剂的生产,综合考虑,选择加辅料喷雾干燥方式。
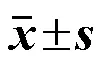
表3 不同浓缩方法所得样品中指标成分含量及其保留率(, n = 3)
与母液组比较:*<0.05;与减压浓缩组比较:#<0.05
*< 0.05mother liquor group;#< 0.05vacuum concentration group
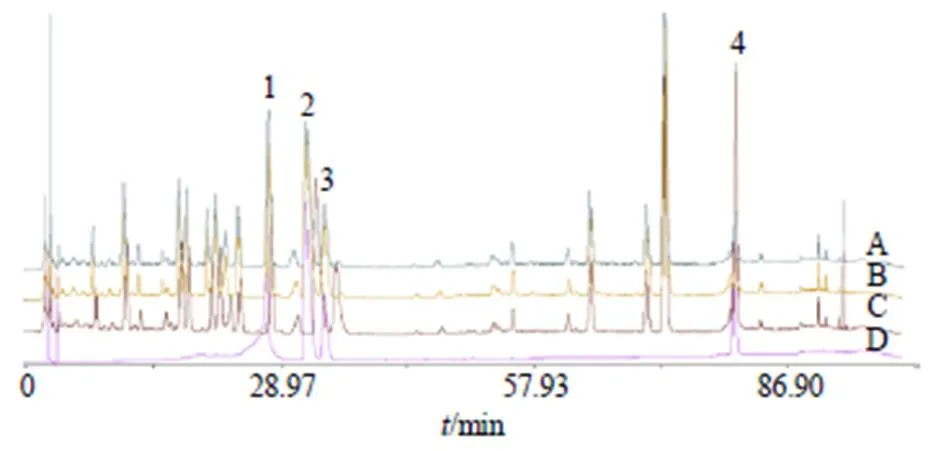
A-常压浓缩 B-减压浓缩 C-母液 D-混合对照品 1-异阿魏酸 2-盐酸小檗碱 3-盐酸巴马汀 4-丹皮酚
2.4.4 干燥工艺的确定 按李东垣古法,清胃散的服用剂量:全方饮片9.6 g,加水150 mL,煎至100 mL,1次服用。经典名方制剂清胃散最终剂型是颗粒剂,服用方法与服用剂量必须同李东垣古法。此处制备药用基准样品时,根据前期实验得出单处方量饮片含固量约为3 g,若按单处方量饮片所得100 mL药液加药液体积5%的β-环糊精,则需加β-环糊精5 g,总固体量约为8 g;若按单处方量饮片所得100 mL药液加药液体积10%的β-环糊精,则需加β-环糊精10 g,总固体量约为13 g。在后期颗粒剂成型过程中,尚需在药用基准样品中加一定比例的矫味剂和稀释剂,如果将颗粒剂设计成单剂量为10 g,此处若按5%的比例加β-环糊精,后期成型时还有加辅料的空间;此处若按10%的比例加β-环糊精,则后期成型时已没有加辅料的空间,除非进一步加大颗粒剂的剂量。根据上述分析,经综合权衡考虑,初定清胃散药用基准样品浓缩干燥工艺为单处方量(饮片9.6 g)煎煮液(100 mL)加药液量5%的β-环糊精直接喷雾干燥。
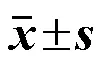
表4 不同干燥方法所得样品中指标成分含量及保留率(, n = 3)
与母液组比较:*<0.05;与喷雾干燥组比较:#<0.05
*< 0.05mother liquor group;#< 0.05spray drying group
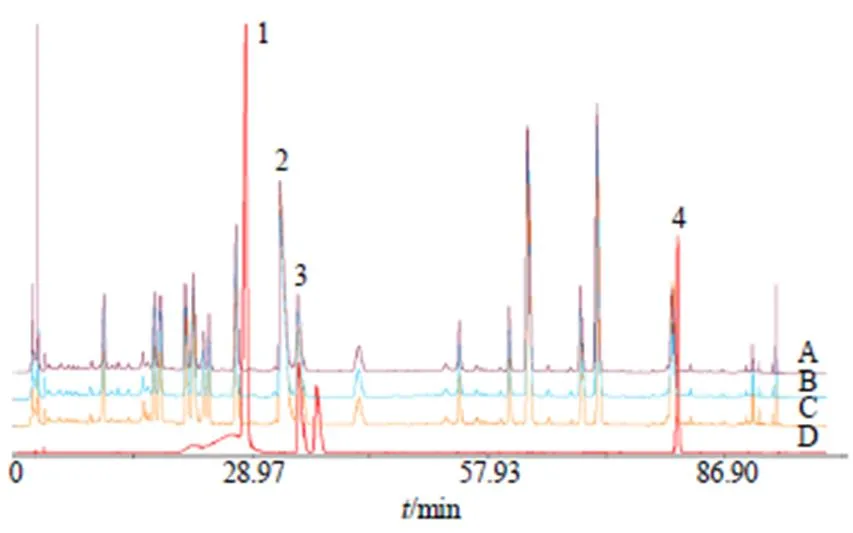
A-冷冻干燥 B-喷雾干燥 C-母液 D-混合对照品 1-异阿魏酸 2-盐酸小檗碱 3-盐酸巴马汀 4-丹皮酚
2.5 CQA研究
2.5.1 色谱条件 Acquity T3色谱柱(50 mm×2.1 mm,1.8 μm);流动相为乙腈-0.1%甲酸水溶液,梯度洗脱:0~2 min,95%乙腈;2~20 min,95%~5%乙腈;20~25 min,5%乙腈;25~27 min,5%~95%乙腈;27~30 min,95%乙腈;体积流量0.4 mL/min;柱温35 ℃;进样体积5 μL。
2.5.2 质谱条件 采用电喷雾离子源(ESI),正负离子模式下采集数据,质量扫描范围为100~150,同时采用触发信息关联采集模式(IDA)的方法对目标离子进行碎裂分析,具体参数如下:雾化气380 kPa,辅助气414 kPa,气帘气276 kPa,辅助加热器温度500 ℃,喷雾电压(IS)−4500 V,去簇电压(DP)−80 V,碰撞电压(CE)−15 V[6]。进样前及进样后,采用校正液对准确质量数进行校正[7]。
2.5.3 供试品溶液的制备 取清胃散基准样品0.4 g,精密称定,加入75%甲醇10 mL,称定质量,超声(功率500 W、频率45 kHz)45 min,称定质量,用75%甲醇补足减失的质量,滤过,取续滤液,即得供试品溶液[6]。
2.5.4 ig液的制备
(1)辣椒水煎液:称取变态辣辣椒粉125 g,加入1000 mL蒸馏水,置于锅中煎煮。共煎煮2次,每次1 h,合并提取液,最终浓缩成1000 mL的辣椒水煎液,保存在4 ℃冰箱中,备用。
(2)清胃散标准煎液:称取原方饮片9.6 g,粉碎成最粗粉,加水150 mL,武火加热至沸,文火保持微沸煎煮20 min,静置后,倾出上清液,放至室温,定容至100 mL,保存在4 ℃冰箱中备用。
2.5.5 血液样品的制备 雄性SD大鼠适应性喂养1周后,随机分为3组:空白组、对照组、给药组。空白组大鼠每日10:00时ig 1次蒸馏水,连续9 d。其余大鼠(对照组和给药组)每日10:00时以10 mL/kg的剂量ig 120 mg/mL的辣椒水煎液,连续ig 9 d(其中给药组第4天开始,在ig辣椒混悬液1 h前,以10 mL/kg的剂量ig清胃散标准煎液)。第9日晚禁食不禁水过夜,第10天ig 1 mL无水乙醇,空白组ig等量蒸馏水。每天记录各组大鼠体质量、体温以及唇、齿、舌、爪的颜色。给药1 h后,腹主动脉取血,置于离心管中,3000 r/min离心15 min,取上清液,即得。向上清液中加入4倍量乙腈沉淀蛋白,置涡旋仪中涡旋90 s,以13 000 r/min离心10 min,取上清液,进样分析。
2.5.6 数据分析方法 由Analyst TF 1.6软件采集数据,通过PeakView 1.2软件进行数据解析。首先通过中药系统药理学数据库和分析平台(Traditional Chinese Medicine Systems Pharmacology Database andAnalysis Platform,TCMSP,https://tcmspw.com/tcmsp. php)[8]构建清胃散中黄连、地黄、当归、牡丹皮、升麻5种药材的化学成分库,借助ChemSpider(https://www.chemspider.com/)、化源网(https:// www.chemsrc.com/)等网站搜集化合物信息及对应的.mol文件。然后,根据测得的数据,以分子式及[M+H]+、[M+NH4]+、[M-H]−、[M+COOH]−等离子对应的精确相对分子质量为关键词,检索构建的5种药材化合物数据库,相对分子质量检索差异设定<5×10−6,对检索得到的结果利用碎片离子进行确证[9]。
2.5.7 大鼠体征及一般行为学观察结果 空白组大鼠鼻、唇、爪、趾、耳朵、舌头呈淡粉色,状态良好,毛发整齐有光泽,饮食正常,小便淡黄色,大便成型,为棕色或棕褐色的湿润粒状;对照组大鼠鼻、唇、爪、趾、耳朵近红色,毛发杂乱、光泽度差,前切牙之间牙龈出现红肿,部分甚至出现溃烂出血的情况,舌头呈红色或红紫色,性情急躁,易被激怒,声音嘶哑,难以捕捉,小便短小呈亮黄色,大便干硬、秘结,呈黑色小粒状,给药后,清胃散给药组大鼠大小便性状发生转变,牙龈红肿、溃烂出血的情况有所缓解,接近空白组。
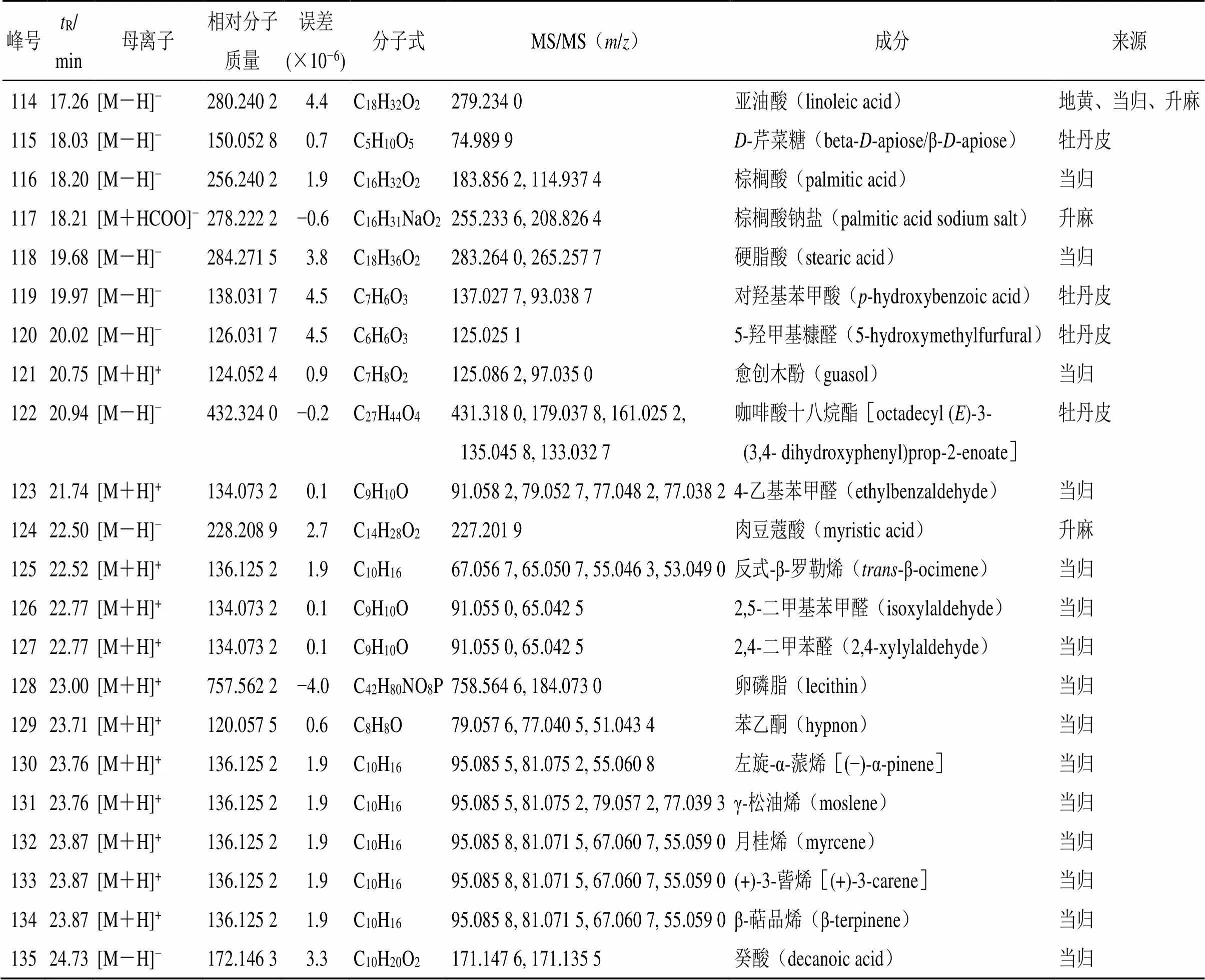
2.5.8 化学成分及入血原型成分研究 清胃散基准样品中共鉴定出135个清胃散化学成分,总离子流图见图3-A,鉴定结果见表5。正离子模式下有52个成分,负离子模式下有83个成分。
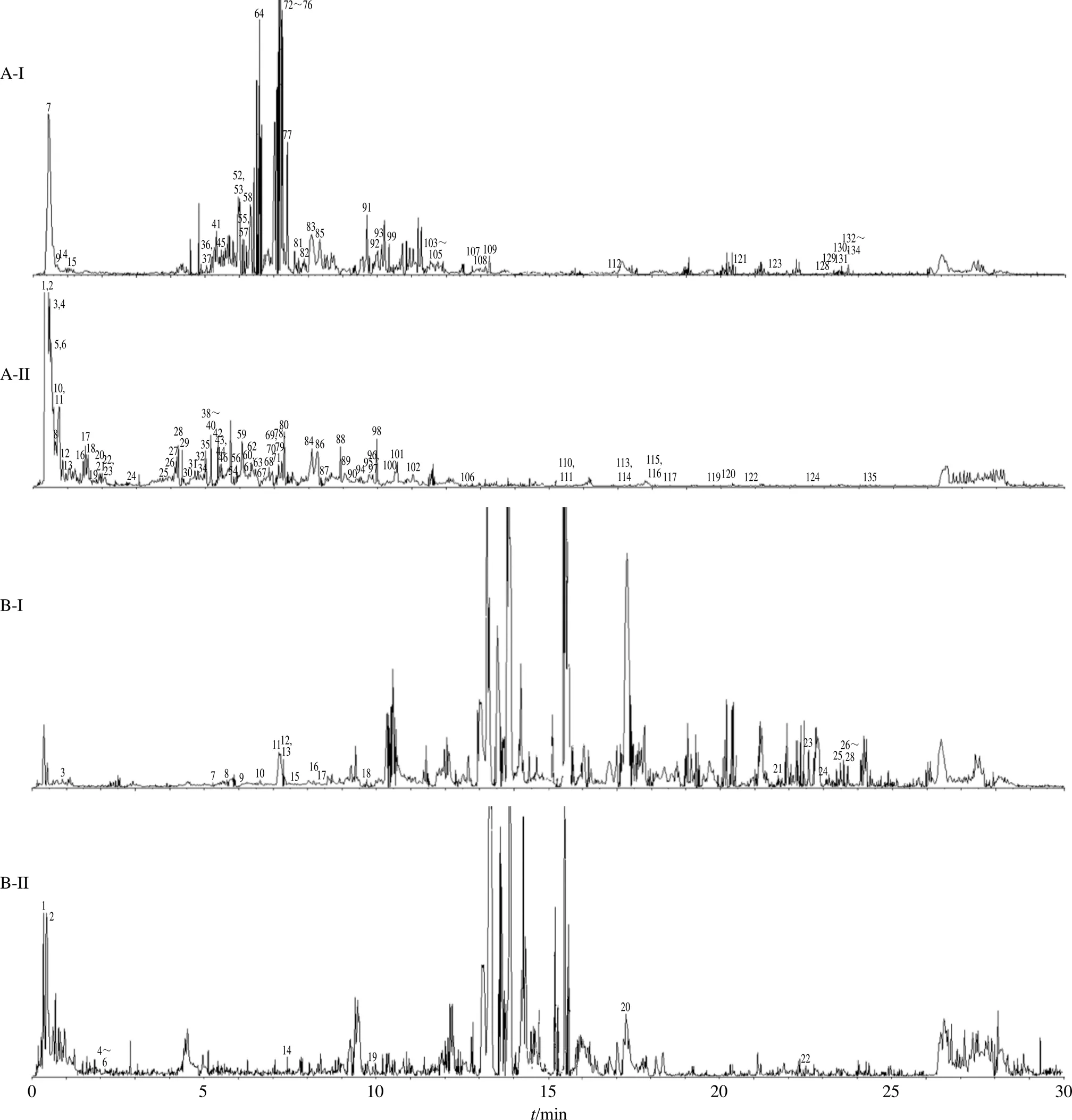
图3 清胃散基准样品(A)、含药血浆(B)在正(I)、负(II)离子模式下的UFLC-Q-TOF/MS总离子流图
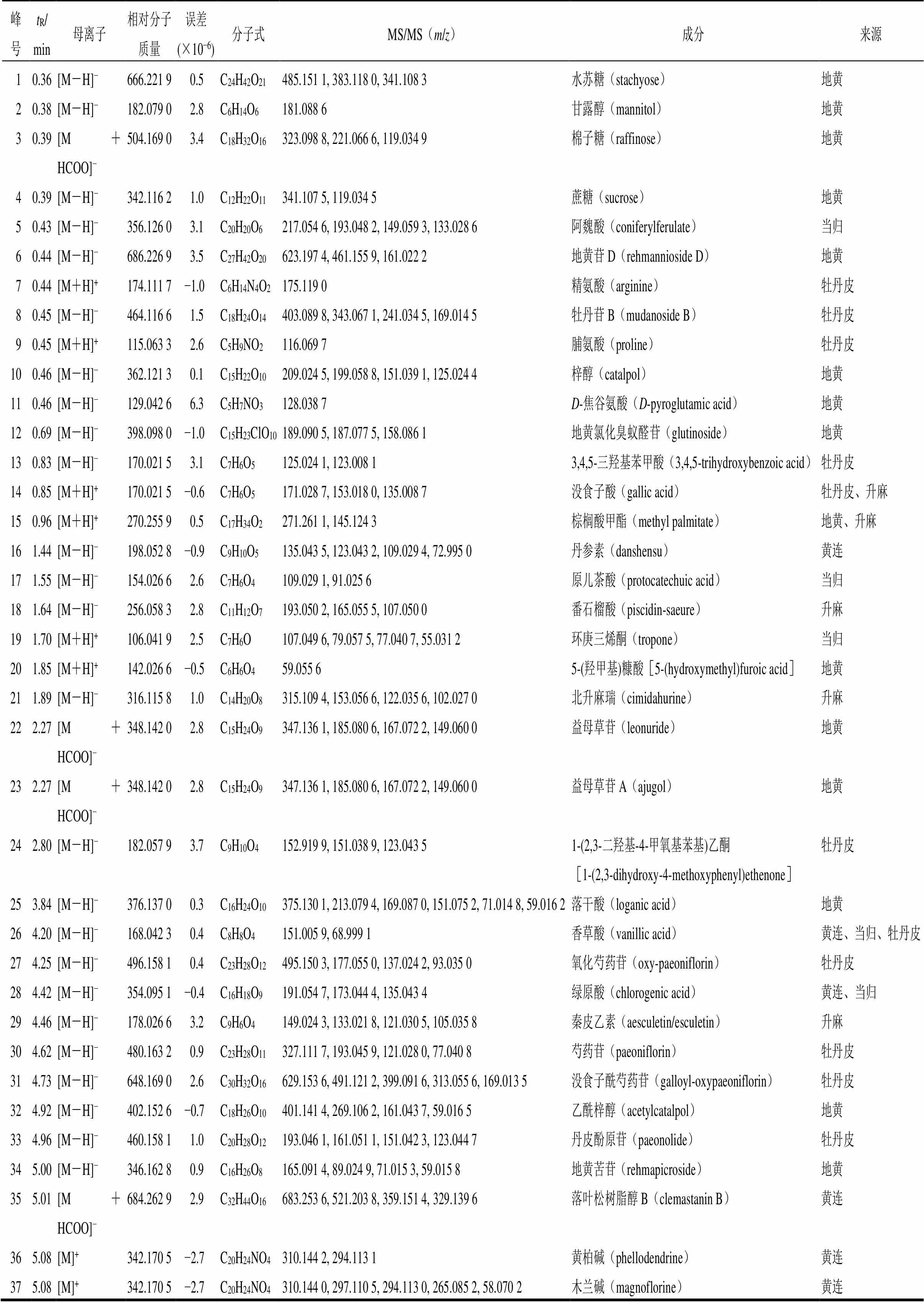
表5 UFLC-Q-TOF/MS对清胃散基准样品化学成分的分析鉴定

续表5
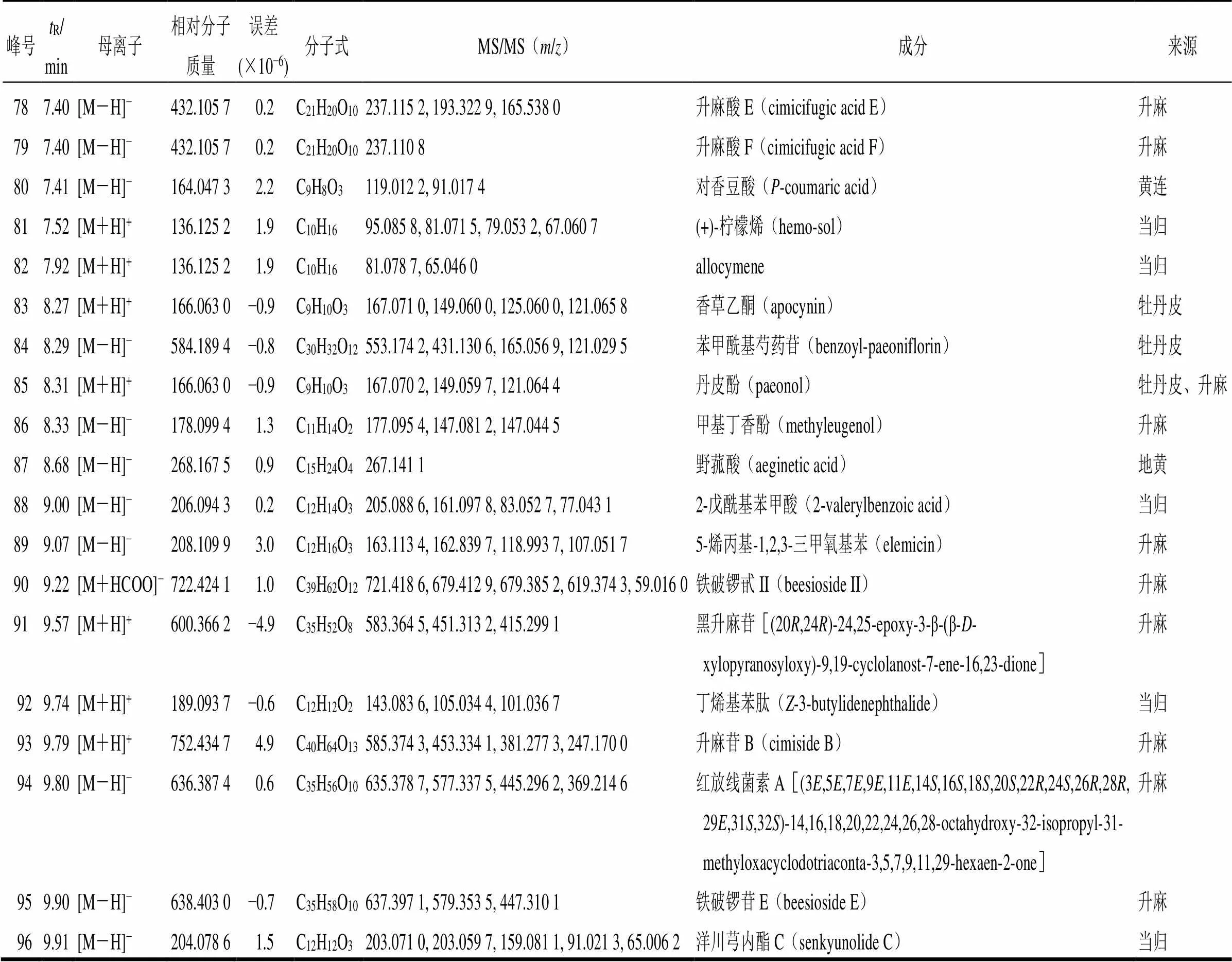
续表5

979.91[M-H]−204.078 61.5C12H12O3203.071 0, 203.059 7, 159.081 1, 91.021 33-亚丁基-7-羟基苯酞(3-butylidene-7-hydroxyphthalide)当归 9810.19[M+HCOO]−674.366 62.1C37H54O11655.354 4, 589.337 0, 523.299 8, 463.282 2, 415.282 0升麻苷(cimicifugoside)升麻 9910.31[M+H]+192.115 0−0.7C12H16O4189.071 3洋川芎内酯(senkyunolide)当归 10010.58[M+HCOO]−620.392 40.5C35H56O9619.345 3, 561.337 5, 487.307 6升麻醇-3-O-β-D-吡喃木糖苷(cimigenol-3-O-β-D-xylopyranoside)升麻 10110.61[M+HCOO]−680.413 60.1C37H60O11679.408 1, 637.395 9, 619.384 7, 579.349 7, 59.016 1铁破锣苷III(beesioside III)升麻 10211.09[M-H]−660.387 40.3C37H56O10659.382 8, 617.366 8, 599.355 2, 581.351 8, 559.330 523-表-26-脱氧乳腺素(23-epi-26-deoxyactein)升麻 10311.33[M+H]+190.099 4−0.9C12H14O2173.095 0, 161.059 7, 145.100 9, 115.054 0, 105.069 8Z-藁本内酯(Z-ligustilide cis-ligustilide)当归 10411.33[M+H]+190.099 4−0.9C12H14O2173.095 0, 161.059 7, 145.100 9丁苯酞[(3S)-3-butyl-3H-isobenzofuran-1-one 当归 3-n-butyl phthalide E-ligustilide] 10511.34[M+H]+662.403 0−6.6C37H58O10585.375 8, 435.325 8, 381.274 2, 239.178 4乙酰升麻醇-3-O-L-阿拉伯糖苷(23-O-acetylshengmanol-升麻 3-O-α-L-arabinopyranoside) 10612.33[M+HCOO]−502.365 80.2C31H50O5487.342 3, 447.340 0, 409.317 3, 395.273 3, 329.223 9ethyl 2-[2-(octadecyloxy)benzoyl]-3-oxobutanoate升麻 10712.59[M+NH4]+486.334 5−4.1C30H46O5487.344 6, 469.332 1, 451.339 37,8-二羟基升麻醇(7,8-didehydrocimigenol)升麻 10812.75[M+NH4]+488.350 2−2.1C30H48O5453.334 4, 447.116 9, 257.189 0升麻醇(cimigenol)升麻 10913.14[M+H]+194.167 1−1.5C13H22O135.117 5, 121.101 6香叶基丙酮(geranylacetone)升麻 11015.78[M-H]−456.360 43.5C30H48O3455.345 8白桦脂酸(mairin)牡丹皮 11115.78[M-H]−456.360 43.5C30H48O3455.345 8齐墩果酸(oleanolic acid)牡丹皮 11216.95[M+H]+256.240 2−2.3C16H32O2192.900 1, 192.872 8, 192.840 5, 160.972 9, 119.956 7软脂酸-D5(hexadecanoic-D5 acid)升麻 11317.26[M-H]−280.240 24.4C18H32O2279.232 3十八碳二烯酸(octadecadienoic acid)当归、升麻
续表5
通过对质谱信息进行比对分析,并根据保留行为结合化学成分库及相关文献,135个成分中有21个来自于黄连、有25个来自于地黄、有27个来自于牡丹皮、有35个来自于当归、有39个来自于升麻。分析鉴定了28个清胃散入血原型成分,总离子流图见图3-B,鉴定结果见表6。
3 讨论
本实验选择不同浓缩方法及干燥方法对清胃散煎液进行浓缩干燥,通过比较不同方法所得样品中指标性成分含量及保留率,进而选出最佳浓缩干燥工艺,从而确定合理且完整的清胃散基准样品浓缩干燥工艺。本实验采用整方研究法,通过液质联用技术对遵照古法制得的清胃散基准样品中化学成分进行了快速表征,通过网络数据库检索样品峰信号一级、二级质谱数据,结合文献资料对比分析[10],共鉴别出清胃散基准样品中135个化学成分,并通过血清药物化学分析出清胃散基准样品28个原型入血成分,其中入血成分有盐酸黄连碱、盐酸小檗碱、盐酸巴马汀、表小檗碱、降氧化北美黄连次碱、丹皮酚、香豆酸、棕榈酸甲酯、益母草苷等。这些化合物的潜在作用靶点较多,在胃热证的治疗中可能发挥重要作用。
大量研究表明[11-17],盐酸黄连碱、盐酸小檗碱、盐酸巴马汀、表小檗碱均来自黄连,对胃热证模型而言,黄连中主要药效物质生物碱具有较强的抗溃疡作用,其中盐酸小檗碱可促进创伤愈合和组织再生,对胃黏膜保护作用效果显著;丹皮酚是牡丹皮中发挥抗炎作用的主要成分,能使白细胞介素-1β(interleukin-1β,IL-1β)等多种细胞因子明显降低,同时使白细胞浸润减轻,表明丹皮酚能较好抑制炎症反应。故初步推测决定清胃散基准样品CQA的化学成分有盐酸黄连碱、盐酸小檗碱、盐酸巴马汀、表小檗碱、丹皮酚。
虽然液质联用技术在中药分析方面具有独特的优势,但其数据分析大多是通过将所得化合物结合文献资料、质谱数据库、化合物保留时间、质谱裂解规律等进行比对[18-23],从而进行鉴定,具有一定的局限性,且鉴定的化合物部分存在同分异构体的情况,为保证实验结果的准确性,需采用对照品比对等手段进一步核对验证。本实验只分析出清胃散基准样品入血成分中的原型成分,代谢成分仍未分析,后续课题组会进一步进行分析鉴定,进一步确认出决定清胃散基准样品CQA的化学成分,为后续制剂研究提供基础。
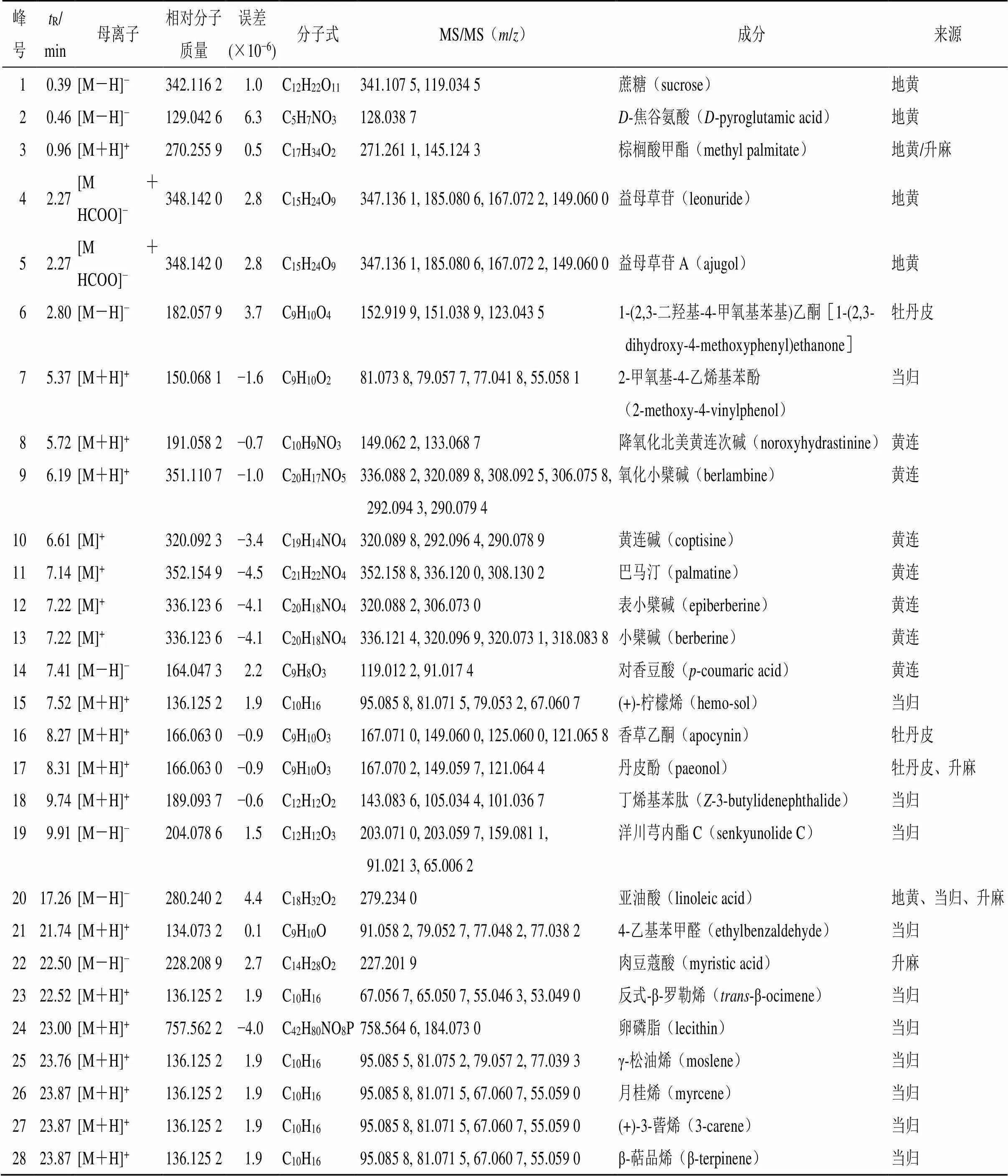
表6 UFLC-Q-TOF/MS对清胃散基准样品体内入血原型成分的分析鉴定
利益冲突 所有作者均声明不存在利益冲突
[1] 金·李东垣著. 李仲平校注. 兰室秘藏 [M]. 北京: 中国医药科技出版社, 2011: 43.
[2] 姚杭琦, 龚苏晓, 李丹, 等. 经典名方清胃散的研究进展 [J]. 药物评价研究, 2019, 42(7): 1474-1479.
[3] 张琦, 黄嘉怡, 钟宛凌, 等. 经典名方清胃散的特征图谱及煎煮工艺研究 [J]. 中国中药杂志, 2020, 45(23): 5607-5613.
[4] ICH: Q8(R2): Pharmaceutical Development [EB/OL]. [2009-08-01]. https://www.ich.org/products/guidelines/ quality/article/quality-guidelines.html.
[5] 国家药典委员会. 中药配方颗粒质量控制与标准制定技术要求(征求意见稿) [EB/OL]. (2016-08-05) [2023- 01-12]. http://www.chp.org.cn/view/ff808081559d1ea301 565ac24962560da=XWJX,2016-08-05.
[6] 祁晓霞, 董宇, 单晨啸, 等. 基于 UFLC-Q-TOF/MS 分析黄芪-丹参药对化学成分研究 [J]. 南京中医药大学学报, 2017, 33(1): 93-96.
[7] 谢彤, 徐建亚, 沈存思, 等. UPLC-MS/MS法同时测定黄芩中8种主要指标性成分的含量 [J]. 南京中医药大学学报, 2016, 32(6): 585-588.
[8] 赵晓霞, 赵巍, 张永文. 中药制剂关键质量属性确认的思考 [J]. 中草药, 2019, 50(17): 4008-4012.
[9] 陈灵, 柳芳, 张相林, 等. 基于网络药理学探讨甘露消毒汤治疗新型冠状病毒肺炎的作用机制 [J]. 中国医院用药评价与分析, 2021, 21(3): 299-305.
[10] 聂欣, 庞兰, 鲜静, 等. 整合文献计量学、血清药物化学及网络药理学辨识经典名方化肝煎关键质量属性研究 [J]. 中草药, 2022, 53(2): 382-394.
[11] 孟颖. 经典名方“清胃散”物质基准制备工艺及化学成分研究[D]. 南京: 南京中医药大学, 2021.
[12] 孟颖, 蒋志涛, 严国俊, 等. UPLC-Q-TOF-MS、GC-MS联合网络药理学及分子对接技术分析经典名方清胃散治疗牙周炎的作用机制 [J]. 中国中药杂志, 2022, 47(10): 2778-2787.
[13] Li B, Shang J C, Zhou Q X. Study of total alkaloids fromon experimental gastric ulcers [J]., 2005, 11(3): 217-221.
[14] 山丽梅, 赵艳玲, 孔维军, 等. 左金丸及其类方对胃热证大鼠胃黏膜损伤及相关因子的影响 [J]. 解放军药学学报, 2010, 26(2): 99-103.
[15] 张树蓉, 赵宏苏, 佟沫儒, 等. 牡丹皮化学成分、药理作用及其质量标志物 (Q-Marker) 的预测分析 [J]. 中草药, 2022, 53(16): 5215-5224.
[16] Fu P K, Yang C Y, Tsai T H,.improves lipopolysaccharide-induced acute lung injury in rats through anti-inflammation [J]., 2012, 19(13): 1206-1215.
[17] 郝艺铭, 霍金海, 王涛, 等. UPLC-Q-TOF/MS技术分析黄连中非生物碱类成分 [J]. 中药材, 2020, 43(2): 354-358.
[18] 洪智慧, 杜伟锋, 杨莹, 等. 基于UPLC-Triple-TOF/ MS分析续断“发汗”前后化学成分 [J]. 中草药, 2020, 51(5): 1233-1241.
[19] 李剑豪, 杨天歌, 张娜, 等. UPLC-Q-TOF-MSE技术结合UNIFI筛查平台快速分析刺梨籽中化学成分 [J]. 质谱学报, 2020, 41(1): 76-86.
[20] 丁腾, 孙宇宏, 杜霞, 等. 经典名方百合地黄汤的化学成分与网络药理学研究 [J]. 中草药, 2019, 50(8): 1848-1856.
[21] 谈梦霞, 陈佳丽, 邹立思, 等. 麦冬与山麦冬中多元指标成分的比较分析 [J]. 中国中药杂志, 2018, 43(20): 4084-4092.
[22] 甘小娜, 王辉俊, 李廷钊, 等. 黑果枸杞化学成分的UPLC-Triple TOF/MS分析及其总花色苷类含量测定 [J]. 食品科学, 2021, 42(18): 185-190.
[23] 张纪红, 吴卫东, 刘建庭, 等. 基于UPLC-Q-TOF/MS技术活血止痛胶囊化学成分的快速分析 [J]. 中草药, 2020, 51(12): 3139-3146.
Study on concentration and drying process and key quality attributes of benchmark samples of classical prescription Qingwei San
BIAN Hai-wen1, YAN Guo-jun1, 2, CAO Jie-nan1, XIA Meng-ying1, GAO Wu-feng1, PAN Jin-huo1, SHENG Hua3
1. School of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China 2. Jiangsu Province Engineering Research Center of Classical Prescription, Nanjing 210023, China 3. Eastern Theater Command General Hospital, Nanjing 210002, China
To investigate the concentration and drying process of Qingwei San (清胃散) benchmark samples and study its critical quality attributes (CQA).Different concentration and drying methods were performed to compare the retention rates of isoferulic acid, berberine hydrochloride, palmatine hydrochloride and paeonol in the samples relative to the standard decoction, which can determine the concentration and drying process of Qingwei San benchmark samples. A total of 15 batches of benchmark samples were further prepared with the previous processing method. The ultra fast liquid chromatography-quadrupole time of flight mass spectrometry (UFLC-Q-TOF/MS) analysis was performed to analyze the chemical components and blood prototype components in the benchmark sample of Qingwei San, combined with preliminary research to tentatively identify the CQA of Qingwei San benchmark samples.The concentration and drying process of the Qingwei San benchmark samples was determined to be direct spray drying with 0.05 g/mL β-cyclodextrin. Moreover, 135 chemical components and 28 prototype components were analyzed in Qingwei San benchmark samples, and coptisine, berberine hydrochloride, palmatine hydrochloride, epiberberine, and paeonol were the potential CQA of Qingwei San benchmark samples.The concentration and drying process of Qingwei San standard decoction was established in this study, which may provide a reference for subsequent CQA confirmation of Qingwei San benchmark samples and formulation development, enabling a comprehensive evaluation of the quality of Qingwei San formulations.
classic prescription; Qingwei San; benchmark samples; concentration; drying; critical quality attributes; isoferulic acid; berberine hydrochloride; palmatine hydrochloride; paeonol; UFLC-Q-TOF/MS
R283.6
A
0253 - 2670(2023)20 - 6616 - 13
10.7501/j.issn.0253-2670.2023.20.007
2023-03-16
国家自然科学基金项目资助(81773910);国家自然科学基金项目资助(82074004);江苏高校“青蓝工程”项目资助(2020)
卞海雯,硕士研究生,研究方向为中药药剂。Tel: 18851092597 E-mail: 1415540607@qq.com
通信作者:严国俊,教授,博士生导师,研究方向为中药饮片及制剂品质传递过程及评价方法。Tel: 13770598093 E-mail: yanguojun@njucm.edu.cn
盛 华,主管药师,研究方向为中药学专业。Tel: 13770718720 E-mail: 21991949@qq.com
[责任编辑 郑礼胜]
