基于电子鼻快速检测生鲜猪肉的异味
2023-10-19李思懿粘颖群谭建庄卞宝国任向蕾李春保
李思懿,粘颖群,谭建庄,卞宝国,杜 宏,任向蕾,李春保,
(1.南京农业大学食品科技学院 国家肉品质量控制与新资源创制全国重点实验室,江苏南京 210095;2.淮安拾分味道食品有限公司,江苏淮安 211700)
我国作为猪肉生产与消费大国,猪肉产量与销量均位居全球首位。然而在实际生产中,相关质检部门经常收到关于屠宰加工的猪肉有异味的投诉举报,进而给消费者和生产企业造成了严重不良影响。为避免异味猪肉轻易进入市场,高效严格的检测与筛选显得十分重要。因此,如何大批量快速检测生鲜猪肉的异味已成为亟待解决的关键问题。
猪肉异味通常有性气味、饲料气味、药品味、病理性气味和其他特殊气味[1]。目前检测生猪肉异味的方法主要是现场检疫人员的感官检测,通过结合猪胴体的生理、病理变化,从而作出初步判断[2]。但感官评定具有主观性,需要对于评定人员进行严格的挑选和训练[3-4]。而且在一定条件下测定结果会受到评定人员的感官阈值影响,另外还会受到检测员年龄、性别等因素的影响。除了现场的感官检验,在实际生产实践中也会用到实验室检验[2],但其检验时间长、操作复杂,也需要借助一定的感官分析。因此,研究人员开始探索其他的快速检测方法。Verplanken等[5]研究了一种通过便携式气相色谱-质谱仪用顶空固相微萃取技术来快速检测公猪肉异味的方法;Borggaard 等[6]提出了基于激光二极管热解吸离子源串联质谱(LDTD-MS/MS)的新设备来快速检测猪肉异味;此外,一些光谱技术比如拉曼光谱技术[7-8]也被提出可用作猪肉异味的快速区分。但由于这些方法中仪器的检测成本较高,国内工厂目前实际的操作水平有限等问题[9],可能需要考虑其他便携性更好、成本更低和可靠性更高的分析技术。
电子鼻是一种快速且灵敏的气体分析仪器,它包含一系列具有部分特异性的电子化学传感器和适当的模式识别系统,能够识别简单或复杂的气味[10]。电子鼻凭借其对挥发性化合物的快速稳定检测分析能力,在食品领域中应用非常广泛[11]。在肉制品中,电子鼻在风味辨别[12]、新鲜度和腐败度评估[13]、质量分级[14]等方面均有较好的研究成果。顶空气相色谱-离子迁移色谱(HS-GC-IMS)[15]是一种拥有快速响应能力的气相分离与检测技术,由于集束毛细管柱的出现,使其分析速度大幅提高,很好地弥补了气相色谱-质谱联用法(GC-MS)低效的缺陷,同时解决了低含量挥发性化合物难以准确检测的问题。现已广泛应用于食品分类、食品新鲜度的鉴别,以及食品中主要香气和异味化合物的鉴定[16]。然而,现有的关于异味肉的研究仍有一定不足:一方面只集中在加工肉制品上,对生鲜肉的研究较少;另一方面,现阶段生猪肉异味的检测主要还是以感官评价为主,没有明确的异味检测指标。客观的检测方法虽然有些是基于仪器设备的,但并未对异味建立系统分析,使得对于异味肉的客观检测仍停留于实验室阶段,难以应用于实际生产。
针对以上问题,本实验以两种部位的正常和异味生猪肉为研究对象,使用电子鼻直观地分析样品的风味特征,并进行分类鉴定;再使用HS-GC-IMS 数据分析正常猪肉与异味猪肉挥发性风味物质的差异,辅助验证评估电子鼻技术的可行性,达到通过电子鼻快速鉴定异味生猪肉的目的,为快速鉴定异味生猪肉提供参考。
1 材料与方法
1.1 材料与仪器
杜长杂交猪 300 头,45 kg 左右,115 日龄左右,江苏省淮安市拾分味道食品有限公司提供,将当天宰杀的生猪胴体冷却后,分成正常组和病理异味组(根据受过专业培训的饲养员评估),分割取得其梅花肉和后腿肉,切分成10 g 的肉块后真空包装,储存于-20 ℃备用;GC-IMS 标品 山东海能科学仪器有限公司。
冰箱 德国西门子公司;AUY120 电子分析天平 日本岛津公司;PF10446 纯水机 美国THERMO公司;BMFSJ01 小型全自动料理机 金华市贝蜜电子商务有限公司;PEN3 型便携式电子鼻 德国埃尔森斯检测公司;FlavourSpec®顶空气相离子迁移谱联用仪 德国G.A.S.公司。
1.2 实验方法
1.2.1 样品制备 将猪肉样本从-20 ℃冷库取出放至4 ℃低温冷藏室进行解冻,低温解冻3 h,此时样品已基本解冻。用手术刀将肉样表面少量未剔除的筋膜和肉皮剔去,放入小型绞肉机进行搅碎,得到碎肉样品。
1.2.2 电子鼻测定 参考任向蕾等[17]的方法,并稍作改动。每份样品中称取5 g(±0.1 g)碎肉,移入20 mL 顶空瓶中并立即密封,25 ℃条件下水浴30 min,室温条件下(25 ℃)放置30 min,至瓶内气体平衡,将注射器针头插入待测顶空瓶吸取气体,气体通过滤膜进入电子鼻检测系统,再取另一针头插入同一顶空瓶,以保持瓶内气压平衡。参数设置为:样品间隔时间1 s,清洗时间60 s,归零时间10 s,样品准备时间5 s,检测时间120 s,载气流速200 mL/min,进样量200 mL/min。PEN3 型电子鼻传感器性能如表1 所示。
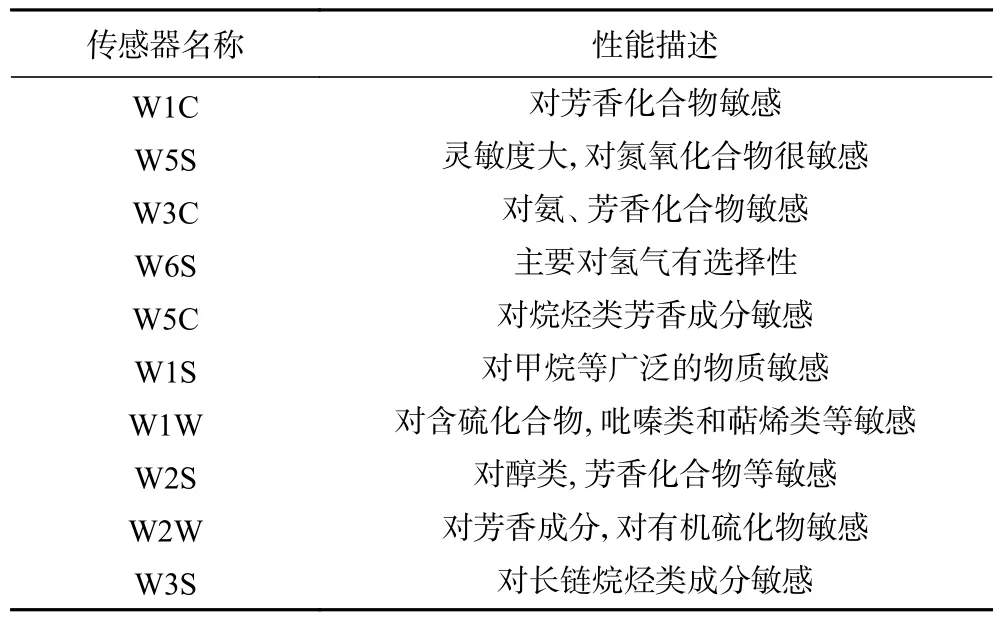
表1 PEN3 型电子鼻传感器性能说明Table 1 Performance description of PEN3 portable electronic nose sensors
1.2.3 HS-GC-IMS 测定 参考Zhou 等[18]的方法,并稍作改动。每份样品中称取5 g(±0.1 g)碎肉,移入20 mL 顶空瓶中并立即密封。采用自动顶空进样,FlavorSpec®GC-IMS 仪的参数设定为:进样体积500 μL,孵育时间30 min,孵化温度40 ℃,进样针温度60 ℃,孵化转速500 r/min。色谱柱:FS-SE-54(5%-苯基)(1%-乙烯基)-甲基聚硅氧烷宽孔毛细管柱(15 m×0.53 mm,膜厚1 μm。Chromatographie GmbH,Langerwehe,Germany)。分析时间30 min,色谱柱温度60 ℃,载气N2(纯度≥99.999%)。载气流速:初始流速2 mL/min,8 min 时流速为10 mL/min,10 min 时流速为50 mL/min,线性流速升至150 mL/min 时保持运行时间10 min。IMS 条件:采用流速150 mL/min 的N2(纯度99.999%)作为IMS 的漂移气体,漂移管温度设置为45 ℃。GC-IMS 样品上样后,经过孵育进行顶空进样。样品随着载气进入仪器,首先经过气相色谱进行初次分离,随后进入离子迁移管,待测分子在电离区电离后,在电场和逆向漂移的作用下迁移,实现二次分离,得到样品的可挥发性物质的信息。
1.3 数据处理
1.3.1 电子鼻特征值提取 从电子鼻采集到的传感器数据得知,可以采集单个样本120 s 时间内10 个传感器的响应变化值,即单个样本可以获得120×10的信号矩阵,提取电子鼻传感器响应的第100~103 s作为特征值用于主成分分析(PCA)和线性判别分析(LDA)。参照陈少霞[19]的方法,将第100~103 s 的平均值作为特征值用于随机森林(RF)模型分析。
1.3.2 主成分分析和线性判别分析 PCA 是一种基于最大方差和最小相关性的无监督的分类方法,对数据库中最重要的信息进行主成分提取。一般是进行数据缩减,将特征向量方向缩减为低维(二维或三维)并投影到可视化空间,以实现立方体的降维分类[20]。LDA 也是电子鼻中比较常用的分类方法,其分类原则是利用原始变量的线性组合,使类间方差和类内方差之间的比值最大化,以达到类别识别的目的[21]。因此,在电子鼻中,利用PCA 和LDA 从检测到的传感器信号中提取特征值进行训练和转换后,可分别得到相应的可视化分类图。
1.3.3 随机森林 本实验选取200 个样品(100 个正常猪肉样品,100 个异味猪肉样品)用于随机森林模型的训练集,100 个样品(50 个正常猪肉样品,50 个异味猪肉样品)作为测试集,来验证随机森林模型的准确性。
随机森林(RF)算法是一种集成学习的方法,它首先使用一组决策树,然后结合预测得到更准确的分类结果[22]。因此RF 具有较低的复杂性和快速计算等优点[23]。本研究使用 MATLAB 仿真软件中的TreeBagger 函数,对提取的特征数据进行分析和建模。TreeBagger 函数用Bootstrap 重采样产生决策树。Bootstrap-aggregated(bagged)的结果能够减小过拟合效应并且改善泛化能力[24]。
本研究使用的TreeBagger 语句为 Net=Tree-Bagger(nTrees,X,Y,Method,leaf):
式中,nTrees 是决策树数;X 是训练样本中的属性;Y 是训练样本中的标签;Method='classification',leaf 是最小叶子数。
通常通过观测OOB(out-of-bag)误差值如何随着决策树数目的变化来获得决策树的最佳数量。一般来说,使用更多的决策树代表OOB 效果越好[22]。本研究中,设立n=50 时,对于整个预测模型来说足以获得稳定的OOB 分类误差。因此,本实验中采用50 棵决策树,最小叶子数为1,来建立模型。
最后得到分类预测模型,MATLAB 的分类预测语句为:
式中,X_test 为测试样本的属性;label 是预测的标签。
1.3.4 统计分析 所有指标每组至少进行 20 个生物学重复。电子鼻数据使用PEN3 型自带软件Winmuster 进行PCA、LDA 和Loading 图分析;分类模型RF 采用Matlab 软件(2021a)分析;采用OriginPro 2021 软件进行电子鼻和GC-IMS 相关性的绘制;HS-GC-IMS 采用设备自带的LAV 分析软件及Reporter 插件,以及包含NIST 库和GC-IMS 数据库的Library Search 定性软件进行样品分析;使用IBM SPSS Statistics 22.0 软件进行数据方差分析,使用Duncan’s 多重比较进行均值的显著性差异分析,实验结果采用平均值±标准偏差的形式来表示,P<0.05 表示差异显著。
2 结果与分析
2.1 电子鼻结果分析
2.1.1 电子鼻对不同部位正常猪肉和异味猪肉的响应变化 图1 为电子鼻的10 个传感器对不同部位的正常猪肉和异味猪肉的信号图。由于正常生肉的风味较为清淡,挥发物浓度不高,所以传感器的响应值不太大。从图中可以看出,正常猪肉和异味猪肉的响应信号存在一定差异。其中传感器W1S、W1W、W2W 对异味组猪肉的响应值高于正常组(P<0.05),而W1C、W3C、W5C 传感器对正常组猪肉的响应值更高(P<0.05)。其中W1S、W1W、W2W 分别对含硫化合物、芳香物质和烃敏感,W1C、W3C、W5C 对芳香族化合物敏感,初步推测它们可能是引起异味猪肉与正常猪肉之间风味差异的物质。
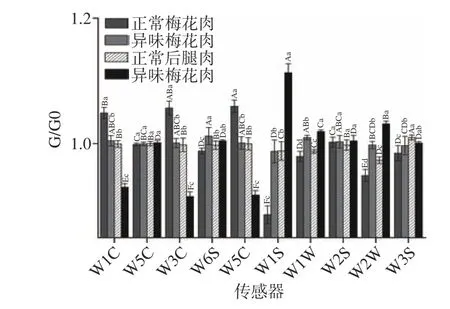
图1 电子鼻对不同部位正常猪肉和异味猪肉的传感器响应信号Fig.1 Sensor response signal of electronic nose for normal and off-flavoured pork in different cuts
2.1.2 不同部位正常猪肉与异味猪肉的主成分分析(PCA)和线性判别分析(LDA)不同部位的正常猪肉与异味猪肉的电子鼻传感器PCA 和LDA 分析结果如图2 所示,第一主成分和第二主成分贡献率分别为96.39%、1.62%和79.81%、9.57%,贡献率之和分别为98.01%和89.38%,说明主成分分析能够解释样品的整体风味信息。从图中来看,正常肉和异味肉数据点区分明显,由此说明电子鼻在一定程度上可以将梅花肉和后腿肉的两种部位中正常肉和异味肉区分,且从置信椭圆间的距离来看,后腿肉比梅花肉的区分效果更好。

图2 不同部位正常猪肉和异味猪肉的PCA 和LDA 分析Fig.2 PCA and LDA analysis of normal and off-flavoured pork from different cuts
为了进一步确定各个传感器的贡献率,如图3(a)所示,可知W1S、W5C、W3C、W1C、W2W 所占权重较大,说明这五个传感器在区分正常肉和异味肉间起重要作用。将传感器响应值进行雷达图分析,如图3(b)所示,在梅花肉和后腿肉中,W1S、W5C、W3C、W1C、W2W 均在区分正常肉和异味肉差异中起到了重要作用。
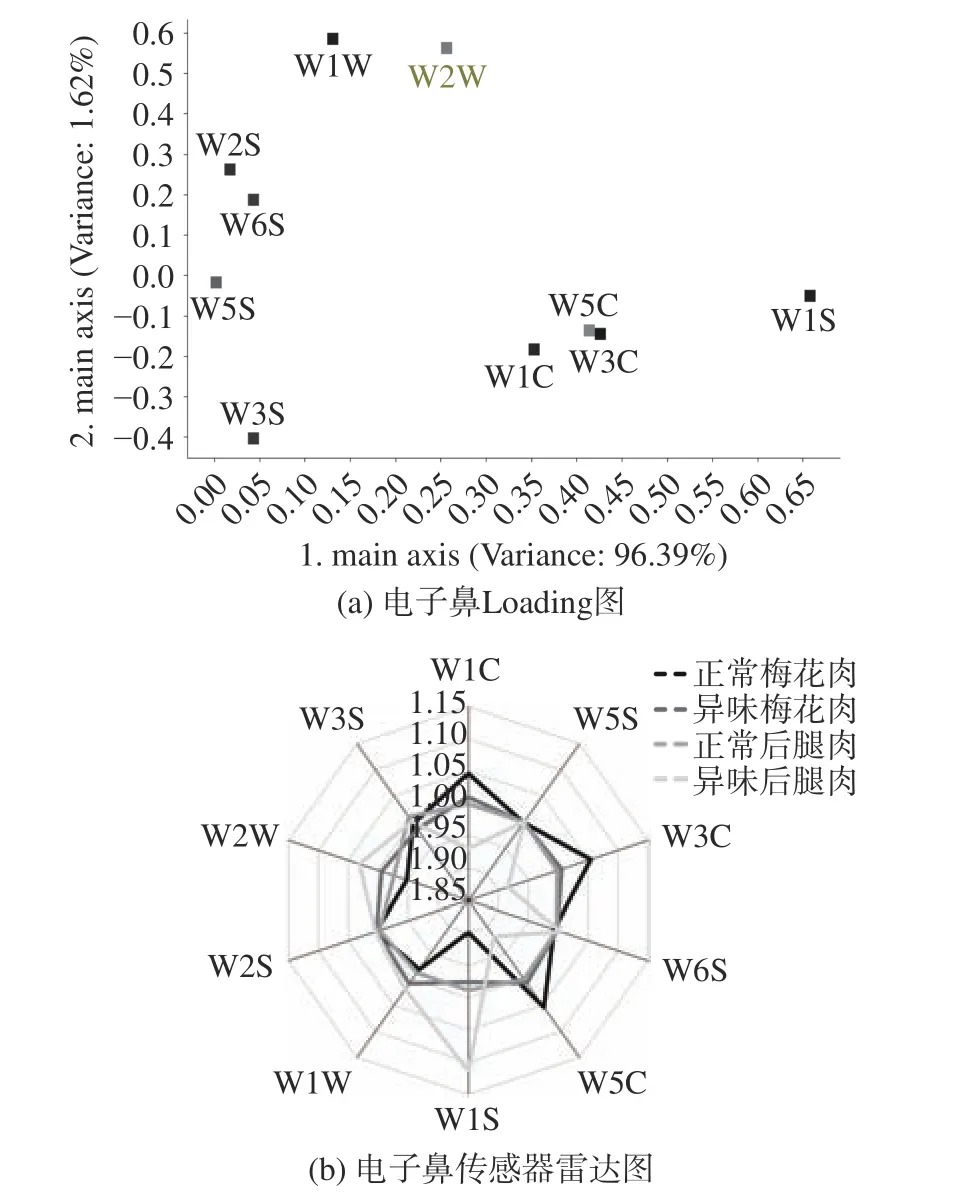
图3 不同部位正常猪肉和异味猪肉的Loading 图与传感器雷达图Fig.3 Loading diagram and sensor radar diagram of normal and off-flavoured pork in different cuts
2.1.3 随机森林(RF)模型区分正常猪肉与异味猪肉 使用随机森林进行分类,结果如图4 所示,梅花肉训练集总准确率为100%,测试集总准确率为81%,后腿肉训练集总准确率为100%,测试集总准确率为91%。
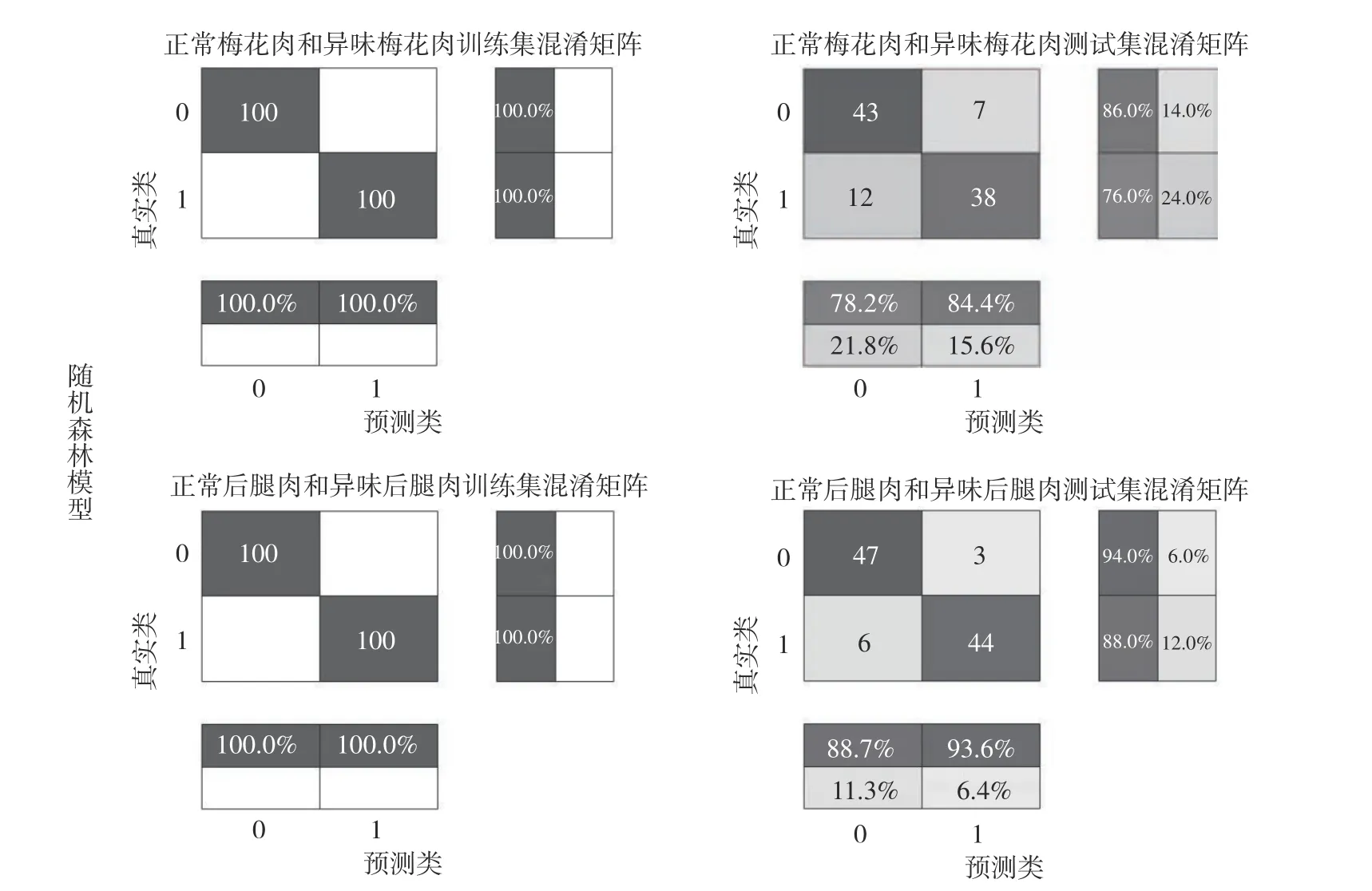
图4 不同部位正常肉与异味肉两种预测模型混淆矩阵Fig.4 Confusion matrix of two prediction models for normal and off-flavorued pork in different cuts
从图4 的混淆矩阵中可以看出,后腿肉测试集的随机森林预测模型中,仅有3 个正常猪肉样品被错误的划分到异味猪肉当中;梅花肉测试集的随机森林预测模型中,有7 个正常猪肉样品被错误的划分到异味猪肉当中。因此,后腿肉比梅花肉更适合用于两种异味肉的鉴定模型。
总的来说,无论是哪种分类方法,后腿肉的分类准确率都要明显高于梅花肉组。由此可以看出,基于电子鼻技术对于鉴定生猪肉异味是可行的,同时为识别异味生猪肉提供了可参考的方法。
2.2 HS-GC-IMS 结果分析
2.2.1 挥发性成分物质HS-GC-IMS 二维谱图分析 使用HS-GC-IMS 中配套分析软件LAV 中的Reporter 插件分别对梅花肉、后腿肉中正常肉和异味肉的二维谱图进行对比分析(图5)。选取正常组的谱图作为参比,异味组谱图减扣参比后,减扣后的背景为白色;若物质浓度高于参比,则为红色;若物质浓度低于参比,则为蓝色,颜色深浅反映了其含量的高低程度。将谱图进行归一化处理后,横坐标表示离子迁移时间(ms),1.0 处竖线为RIP 峰(Reaction Ion Peak,反应离子峰)[25];纵坐标表示气相色谱保留时间(s);二维谱图中每个点位均代表一种挥发性有机物,而化合物的性质与含量决定了点的数量(单体、二聚体)。从图5 可以看出,样品中的挥发性有机物均在1000 s 内完成了气相分离,正常组和异味组挥发性物质的含量存在一定差异,异味组大多数挥发性物质含量高于正常组,少部分低于正常组。为了明确两组样品中的差异性物质,接下来选取所有峰来进行定性分析。

图5 不同部位正常猪肉与异味猪肉HS-GC-IMS 二维差异对比谱图Fig.5 HS-GC-IMS two-dimensional difference spectrum of normal pork and off-flavoured pork in different cuts
2.2.2 挥发性成分物质定性分析 根据挥发性物质的保留时间和迁移时间,通过NIST 库和GC-IMS 数据库对其进行二维定性。所得结果如表2 所示。猪肉样品中共鉴定出挥发性风味物质50 种,主要为酮类11 种,醛类10 种,酯类8 种,酸类5 种,醇类6种,其他类物质9 种(包括含硫含氮物)以及未定性物质1 种,包括单体和部分物质的二聚体。
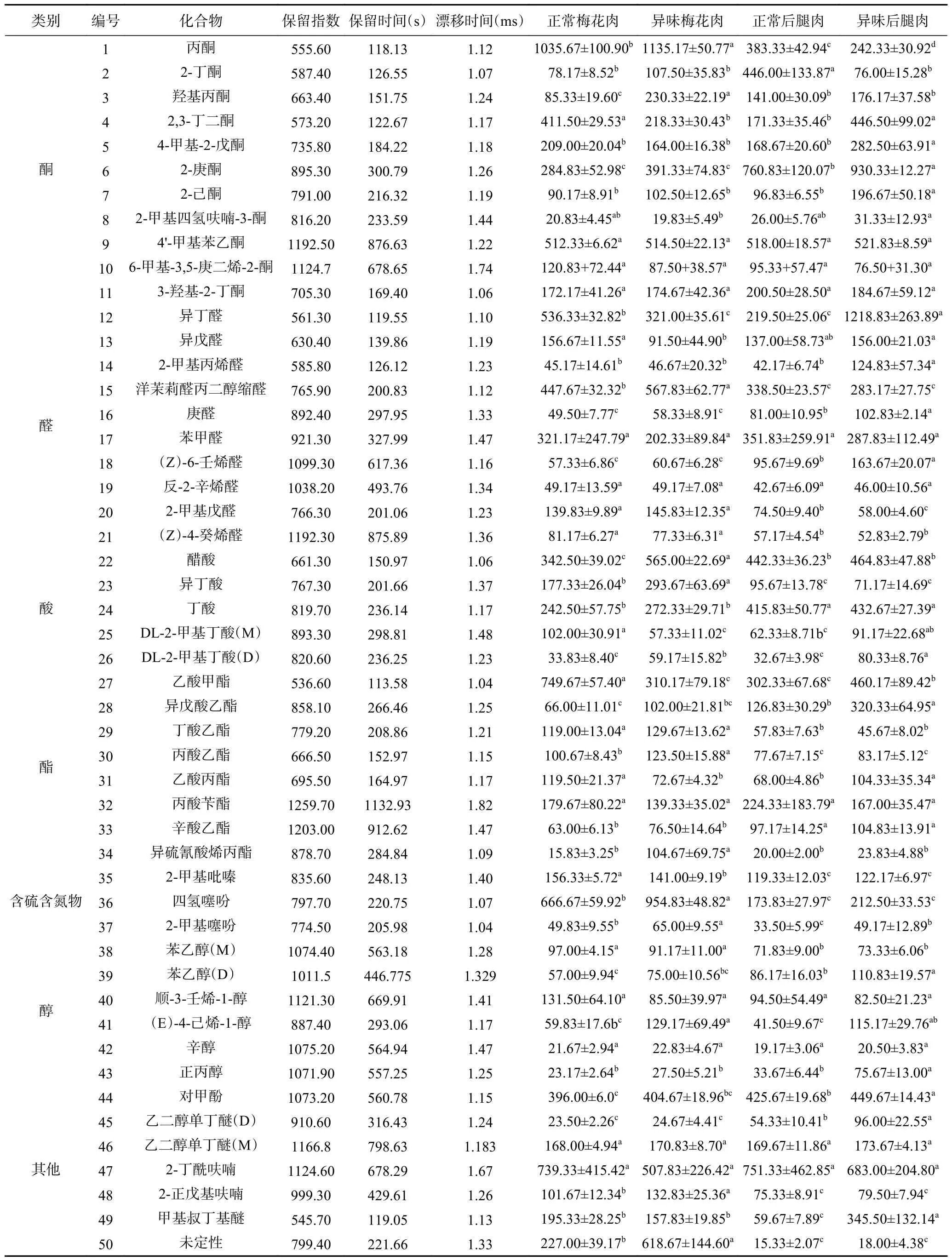
表2 HS-GC-IMS 分析样品挥发性化合物结果Table 2 HS-GC-IMS analysis of sample volatile compounds results
从表中可清晰看到正常猪肉与异味猪肉差距较为明显,具体体现在挥发性化合物累积含量上有明显的不同。在挥发性物质中,醛、酮类物质所占比例较大。比较不同部位正常猪肉与异味猪肉的挥发性化合物相对含量可以发现,主要差异体现在醛类、酮类、酯类和醇类中。
醛类物质因其挥发性强,而成为了猪肉中重要的风味来源,也是形成肉类特征风味的主要因素[26]。不同部位正常猪肉与异味猪肉之间,醛类物质相对含量有明显差异。在异味后腿肉中,异丁醛、2-甲基丙烯醛相对含量显著高于正常组(P<0.05),推测可能是因为这两种醛的碳原子数都是4,而C4醛会产生强烈的刺激性气味[27]。酮类物质也对肉与肉制品风味的形成有着重要影响[28],通常由不饱和脂肪酸热氧化或降解以及氨基酸降解产生[29]。比较正常猪肉与异味猪肉中酮类物质相对含量,可以发现不论是梅花肉还是后腿肉,酮类物质都有明显差异,异味组的酮类物质总体相对含量都大于正常组样品(P<0.05)。有研究认为,猪肉风味间的差异可能主要来自酮类的定性定量差异[30]。因此推测酮类可能是正常猪肉与异味猪肉风味差异的重要影响因素之一。其中,2-丁酮、2-己酮作为饱和酮通常具有水果味、奶酪味和脂肪味[31],2-丁酮和2-己酮在后腿肉正常组中相对含量分别显著高于异味组(P<0.05)和低于异味组(P<0.05),由此推测二者可能是影响风味的重要化合物。
酯类化合物主要来自酸和醇的酯化反应[32],其中后腿肉异味组中异戊酸乙酯相对含量比正常组多(P<0.05),梅花肉正常组中乙酸甲酯相对含量显著高于异味组(P<0.05),推测可能因为异戊酸乙酯作为长链酯,主要提供肉的脂肪气味[33],是肉香的主要来源;乙酸甲酯作为短链酯通常具有果香味[34],这种气味的差异可能是形成异味的原因。醇类物质主要由不饱和脂肪酸氧化得到[35],大多数物质都属于猪肉正常风味物质。直链的一级醇随着碳链的增长,风味强度会逐渐增加[36]。酸类物质主要来自于脂肪的水解,但可能因为其含量比较低,所以对于风味的贡献不如醛和酮[37]。梅花肉异味组中,2-戊基呋喃相对含量更高(P<0.05),2-戊基呋喃被认为具有强烈的肉味和植物芳香味[38],因为阈值低,所以对猪肉风味有重大贡献,可能是引起正常组和异味组风味差异的物质。另有研究报道,四氢噻吩[39]等含硫化物[40]、乙酸、丁酸[41]等酸类属于异味物质,本实验中异味猪肉中它们的相对含量也较高,使得挥发性物质丰度高,同时这与上述电子鼻传感器对于含硫化合物等物质更敏感的结果趋于一致。
2.3 挥发性成分物质PLS-DA 分析
PLS-DA 是一种具有监督模式识别的多元统计分析方法[42],通过PLS-DA,可以用于构建正常组和异味组挥发性物质之间的相关模型[43]。以所有样品中的全部风味物质为自变量,对其进行PLS-DA 分析,结果如图6(a)所示,PLS-DA 得分图表明各组样品之间的挥发性成分存在显著差异。同时使用交叉验证和置换检验来评价模型的性能指标[44],由图6(b)可知,数据经过PLS-DA 分析,R2X=0.685,R2Y=0.92,Q2=0.868,R2X,R2Y 分别表示模型所能解释X 和Y 矩阵信息的百分比,Q2>0.5,表示这个模型可靠[45]。监督模型通过200 次排列测试进一步验证,R2=0.186,Q2=-0.437,说明该模型的稳定性较好,没有出现过拟合现象。

图6 不同部位正常猪肉与异味猪肉 PLS-DA 分析图Fig.6 PLS-DA analysis of normal and off-flavoured pork from different cuts
挥发性化合物对已构建的分析模型的贡献大小可以由图6(c)的PLS 载荷图反映,挥发性化合物离中心原点和主要化合物越近,说明它对已构建的模型贡献最大。从图6(c)可以看出,2-丁酮等化合物在载荷图上的位置与后腿肉正常组在得分图中的位置相近,表明它是后腿肉正常组中的主要挥发性化合物,因此初步筛选出正常猪梅花肉的特征性挥发化合物为乙酸甲酯、顺-3-壬烯-1-醇、6-甲基-3,5-庚二烯-2-酮;异味猪梅花肉的特征性挥发物为 2-正戊基呋喃;正常猪后腿肉的特征性挥发物为 2-丁酮;异味猪后腿肉的特征性挥发物为正丙醇、异戊酸乙酯、2-己酮、(Z)-6-壬烯醛。
投影中的变量重要性VIP 用于解释因变量权重,当值超过1.0 时,通常认为在PLS-DA 判别过程中具有重要作用[46]。再根据各个化学组分的色谱峰强度建立变量重要性投影值,描述变量的贡献程度,结果如图6(d)所示,VIP 评分>1.0 的挥发性化合物共24 种,除去其中的样品“none(即表1 中未定性化合物)”,共鉴定出23 种VIP 评分>1.0 的挥发性化合物。综上,乙酸甲酯、2-丁酮、2-己酮、正丙醇、异戊酸乙酯、2-正戊基呋喃是区分正常组和异味组的挥发性标志物。
2.4 电子鼻和HS-GC-IMS 结果之间的相关性
Da 等[47]通过电子鼻区分不同产地红烧肉的瘦肉和脂肪部分,发现电子鼻信号与检测到的挥发性化合物的相对含量显著相关,进而证实了电子鼻在鉴别不同风味红烧肉方面的能力。本研究使用Origin 来绘制挥发性化合物与电子鼻关键传感器的相关性热图(图7)。从图中可知,电子鼻的W1S、W5C、W3C、W1C 和W2W 传感器对正常组和异味组的挥发性标志物得到了有效识别。其中,正丙醇、2-己酮,异戊酸乙酯、(Z)-6-壬烯醛与W1C、W3C、W5C 传感器都呈极显著正相关(P<0.01),和W1S 呈极显著负相关(P<0.01),2-正戊基呋喃和W1C、W3C 呈显著负相关(P<0.05),和W5C 和W1S 呈极显著负相关和正相关(P<0.01)。2-丁酮和W2W 与呈正相关(P<0.05),乙酸甲酯与W1S 呈正相关(P<0.05)。除挥发性标志物外,在其他的醛类、酮类、酯类和醇类物质中,也有明显的相关性。此外,四氢噻吩等含硫化合物和W2W 传感器也具有正相关性(P<0.05)。与上述表1 电子鼻的性能结果完全吻合。Wen 等[48]通过电子鼻和GC-IMS 数据的相关性分析得出了牛肉干风味特征的信息,并认为二者结果的高度相关性有利于探索一种使用电子鼻进行实际样品分析的方法。本研究中电子鼻传感器响应与挥发性关键物质水平之间的显著相关性直接证明了电子鼻传感器区分正常猪肉与异味猪肉的挥发性风味的可靠性,与Wen 等[48]的研究结果一致。
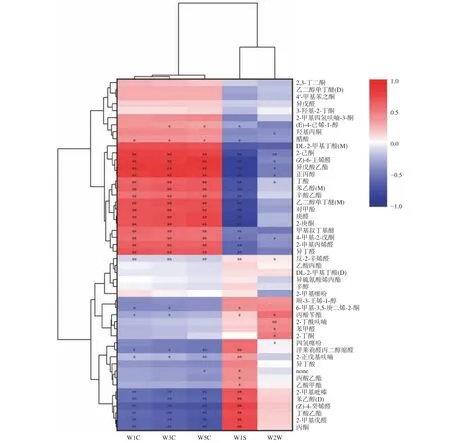
图7 挥发性化合物与电子鼻传感器的相关性热图Fig.7 Correlation heatmap of volatile compound levels and electronic nose sensor response
3 讨论
目前快速鉴定异味猪肉的方法主要还是通过选择和培训专业人员进行感官分析。一旦完成培训,评估员就可以在生产线上通过嗅闻判断是否存在异味[9]。然而仅仅依靠感官检测并不现实,而电子鼻成本低且效率高,被认为是一种适合作为现场生产线上实时检测异味肉的有力工具[49]。此前有报道[50]研究了电子鼻在屠宰线上快速分类异味公猪的潜力。但该研究仅限于雄烯酮和粪臭素,而这两种物质并不能代表全部的异味来源[51]。本实验在电子鼻成功鉴定正常猪肉和异味猪肉的基础上,同时筛选出异味猪肉的挥发性标志物,为建立完整的生猪肉异味评价标准体系提供了参考,对于在屠宰环节现场快速鉴别出异味猪肉提供了参考方法,对于生产企业和检测部门来说具有重要的经济价值和社会意义。然而,电子鼻虽然可以快速大批量进行异味肉无损检测,但仍有不足之处:传感器稳定性差且信息冗余;后期模式识别技术有待完善等。因此,后续研究中应加强对电子鼻的新型稳定传感材料以及数据处理方法的深入研究。
4 结论
本研究采用电子鼻对不同部位的正常猪肉和异味猪肉进行鉴别分析,通过PCA 和LDA 的结合,可将正常猪肉和异味猪肉很好地区分,还筛选出了其中五个适合鉴别异味的关键传感器。在此基础上,采用随机森林(RF)建立了正常猪肉和异味猪肉快速鉴定模型,发现利用电子鼻进行异味生猪肉判定,其准确率在80%~100%之间。基于HS-GC-IMS 技术,也验证了电子鼻结果的可靠性,证实了电子鼻在鉴别正常猪肉与异味猪肉中的应用价值。
