超声辅助双水相提取绞股蓝皂苷工艺及其降糖活性分析
2023-10-19周飙,胡斌,柳鑫,周蕾
周 飙,胡 斌,柳 鑫,周 蕾
(武汉市第四医院,药剂科,湖北武汉 430034)
绞股蓝,又名五叶参、七叶胆等,来源于葫芦科绞股蓝属(Gynostemma)绞股蓝[Gynostemma pentaphyllum(Thunb.)Makino],具有清热解毒、补气生津之功效,有“南方人参”、“不老长寿药草”的美誉[1-2]。绞股蓝可全草入药,含有丰富的多糖、黄酮、皂苷、氨基酸类成分,其中皂苷类成分是绞股蓝的主要活性成分[3-4]。绞股蓝皂苷含有人参皂苷Rb1、Rb3、Rd、绞股蓝皂苷A 等200 多种成分,含量远高于人参,具有降糖[5]、降脂[6]、改善脂肪肝[7]等作用。因此,绞股蓝常被开发为茶饮、绞股蓝总甙片、绞股蓝饮料、绞股蓝口服液等,具有良好的医药和市场价值。绞股蓝皂苷的提取常采用水提法、酶法、超声波法等,但活性成分含量较低,后期纯化工艺复杂,其相关提取技术有待进一步改善[8]。
双水相体系(Aqueous Two-phase System,ATPS)由两相互不相溶的溶剂组成,利用组分在双水相体系内的分配系数差异进行高效快速提取与纯化[9]。双水相体系提取条件温和,可保留分子的生物活性,常用于酶、多肽、核酸、多糖等大分子的提取分离[10]。相较于传统的提取方法,双水相提取法具有分相快、条件温和、操作方便快捷等优点,是一项效率高、应用前景广阔的提取技术[11]。因此,双水相体系也常用于中药活性成分的提取与纯化,如桃花总黄酮[12]、陈皮黄酮[13]、甘草三萜皂苷[14]等。研究结果表明,双水相体系可快速高效地提取中药活性成分,避免了繁杂的纯化过程,且活性成分含量高、生物活性强[15]。
植物细胞壁常含有丰富的纤维素、木质素、果胶等,质地坚固,延展性强,溶胀破壁效率低[16]。超声作为一项高效的细胞破壁技术,有利于活性成分快速释放与溶解[17]。将超声与双水相提取技术联用提取绞股蓝皂苷,将有利于改善绞股蓝皂苷的提取纯化工艺及生物活性,更充分挖掘绞股蓝资源。因此,本实验拟通过超声辅助双水相提取绞股蓝皂苷,采用响应面法获得最佳提取工艺,并分析活性成分含量、降糖活性,为绞股蓝皂苷资源的开发与利用提供科学依据。
1 材料与方法
1.1 材料与仪器
绞股蓝 葫芦科绞股蓝属(Gynostemma)绞股蓝[Gynostemma pentaphyllum(Thunb.)Makino]全草,原产地四川(批号202011011),留样保存于武汉市第四医院药剂科,天济中药材饮片有限公司;硫酸铵、磷酸氢二钾、磷酸氢二钠、磷酸二氢钠、碳酸钠、磷酸二氢钾、香草醛、冰乙酸、人参皂苷Rb3、绞股蓝皂苷A、绞股蓝皂苷XLIX、绞股蓝皂苷XVII(以上均为分析纯)、甲醇(色谱纯)美国Sigmaaldrich 公司;α-葡萄糖苷酶(100 U/mg)、阿卡波糖、对硝基苯基-α-D-吡喃葡萄糖苷(PNPG)分析纯,上海源叶生物科技有限公司;高氯酸、无水乙醇 分析纯,北京市通广精细化工公司;磷酸缓冲盐水溶液(pH7.3)、蒸馏水 自制。
Varioskan LUX 多功能酶标仪、Agilent 1260-6460 高效液相色谱质谱联用仪 美国Thermo Fisher Scientific 公司;TGL-16M 台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;多功能粉碎机 皇代电器有限公司;KQ5200DE 型数控超声波清洗器 昆山市超声仪器有限公司;BKQ-B5011 高压灭菌锅 济南来宝医疗器械有限公司;XPR105DR/AC 万分之一电子精密天平、XPR226DRQ 十万分之一电子精密天平 瑞士Mettler Toledo 公司;FD-1D-50 真空冷冻干燥机 上海达洛科学仪器有限公司;Gen Pure 超纯水系统 德国TKA 公司。
1.2 实验方法
1.2.1 双水相溶剂的制备 称取适量的盐(硫酸铵、磷酸氢二钾、磷酸氢二钠、磷酸二氢钠、碳酸钠),置于锥形瓶中,随后加水溶解,分别加入30%(w/w)乙醇,获得双水相体系,备用,如表1。

表1 不同组分双水相体系的制备Table 1 Preparation of ATPSs with different components
1.2.2 绞股蓝皂苷的提取 绞股蓝药材粉碎后,过80 目筛,备用。精确称取绞股蓝粉末M1(g),置于锥形瓶,加入上述不同的双水相体系中,摇匀,超声提取。以超声功率300 W、液料比30:1(mL/g)、超声时间50 min、提取温度50 ℃作为提取条件,70%乙醇提取溶剂作为对照。过滤双水相体系,静置分层,取少许上、下相溶液,4 ℃冷藏,备用,用于绞股蓝皂苷分配系数测定。取剩余的上相溶液,冻干,制备绞股蓝皂苷提取物,并称重,记录重量M2(g)。精确称取绞股蓝皂苷,置入容量瓶中,加70%乙醇超声溶解,定容,摇匀,制成1.0 mg/mL 样品溶液,4 ℃冷藏,备用,用于绞股蓝皂苷含量与得率测定。
1.2.3 双水相溶剂的选择 分别考察不同双水相溶剂对绞股蓝皂苷含量(%)、得率(%)、分配系数的影响,以绞股蓝皂苷得率为指标,选择双水相溶剂。
1.2.4 单因素实验 以20%乙醇(w/w)、30%硫酸铵(w/w)分别作为有机溶剂、无机盐,液料比30:1 mL/g、超声时间50 min、提取温度50 ℃作为初始提取条件,并依据1.2.2 所述提取方法进行实验。按照乙醇、硫酸铵质量分数(w/w)分别为10%、20%、30%、40%、50%,液料比分别为10:1、15:1、20:1、25:1、30:1 mL/g,超声时间分别为30、40、50、60、70 min,提取温度分别为30、40、50、60、70 ℃进行单因素实验,考察乙醇质量分数、硫酸铵质量分数、液料比、超声时间、提取温度对绞股蓝皂苷得率的影响。
1.2.5 响应面优化试验 以单因素实验结果为基础,选取液料比、超声时间、提取温度作为自变量,绞股蓝皂苷得率(y1)为响应值,利用Box-Behnken Design(BBD)设计三因素三水平的响应面优化试验,如表2。

表2 响应面试验因素水平设计Table 2 Factors and levels of response surface methodology
响应面二次回归模型方程如下:
式中:β0为回归截距,βj、βjj、βij分别为回归系数,ei为正态随机误差。
1.2.6 绞股蓝皂苷的分配系数、含量与得率测定
1.2.6.1 标准曲线绘制 精密称量人参皂苷Rb1标准品,置于容量瓶中,加80%乙醇超声溶解后,定容,摇匀,配制成0.1~1.0 mg/mL 人参皂苷Rb1标准品溶液,4 ℃冷藏备用。参照Milad 等[18]报道的测定方法,以人参皂苷Rb1浓度(C,mg/mL)、吸光度(y2)分别为横、纵坐标,绘制皂苷含量测定的标准曲线方程:y2=3.4264C+0.1547(R2=0.9962)。在0.1~1.0 mg/mL浓度范围内,人参皂苷Rb1浓度与吸光度呈现良好的线性关系。
1.2.6.2 绞股蓝皂苷的分配系数测定 参照1.2.6.1项下方法,取1.2.2 项下的上、下相溶液测定吸光度,根据标准曲线方程y2,计算双水相溶剂上、下相皂苷的浓度,获得绞股蓝皂苷分配系数y3:
式中:C上、C下为上、下相绞股蓝皂苷的浓度,mg/mL。
1.2.6.3 绞股蓝皂苷的含量与得率测定 参照1.2.6.1项下方法,取1.2.2 项下样品溶液测定吸光度,根据标准曲线方程y2,计算样品溶液中皂苷浓度,获得绞股蓝皂苷含量y4和得率y5:
式中:C样为样品溶液浓度,1.0 mg/mL;M1、M2分别为绞股蓝粉末、上相绞股蓝提取物质量,g。
1.2.7 人参皂苷Rb3、绞股蓝皂苷A、XLIX、XVII的含量与得率测定 配制人参皂苷Rb3、绞股蓝皂苷A、XLIX、XVII 标准品溶液,利用HPLC 对绞股蓝皂苷提取物进行含量测定,以峰面积、浓度(mg/mL)为变量绘制标准曲线。同1.2.2 项下制备最佳工艺条件下绞股蓝皂苷提取物(ATPS7 组)、绞股蓝乙醇提取物(M7 组),并配制样品溶液。按照下述HPLC 条件测定绞股蓝皂苷各成分浓度,并依据式(3~4)计算人参皂苷Rb3、绞股蓝皂苷A、绞股蓝皂苷XLIX、绞股蓝皂苷XVII 的含量与得率[19]。
绞股蓝皂苷成分测定的HPLC 色谱条件:Kromasil 100-5 C18色谱柱(5 μm,150×4.6 mm);流动相为甲醇(A)-0.1%甲酸水溶液(B);洗脱模式:0~5 min(甲醇:10%→20%),5~40 min(甲醇:20%→40%);流速0.5 mL/min;柱温30 ℃;波长203 nm;进样量10 μL。
1.2.8 分子对接 运用Autodock vina 将人参皂苷Rb3、绞股蓝皂苷A、绞股蓝皂苷XLIX、绞股蓝皂苷XVII 对接α-葡萄糖苷酶(α-glucosidase,PDB ID:6FZY),验证绞股蓝皂苷降糖的药效物质基础,并选取与α-葡萄糖苷酶结合能最优的构象分析做图。
1.2.9 降糖活性测定 精密称取1.2.7 项下绞股蓝皂苷提取物(ATPS7 组)、绞股蓝乙醇提取物(M7组),制备成不同浓度的样品溶液,以阿卡波糖为阳性药物,浓度范围为10~120 μg/mL。以PNPG 为底物,反应体系参照He 等[20]报道的方法,并在405 nm波长处,测定各孔的吸光度,计算α-葡萄糖苷酶活性的抑制率I,如式(5):
式中:Ab、Ac、Ay分别为不加酶体系、不加样品体系、样品体系的吸光度。
1.3 数据处理
2 结果与分析
2.1 双水相体系的选择
绞股蓝皂苷由皂苷苷元与糖基组成,极性较大,可溶于水、甲醇、乙醇等。双水相体系通过乙醇和盐对水分子的激烈竞争,形成上、下相。基于不同类型的无机盐形成的双水相体系具有各异的物理化学特性,通过疏水键、氢键、离子键、生物亲和作用等相互作用,可选择性提取皂苷,如茶皂素[21]、人参皂苷[22]、薯蓣皂苷[23]等。如图1 所示,不同类型ATPS 对绞股蓝皂苷的得率均高于70%乙醇。乙醇-硫酸铵体系绞股蓝皂苷的得率最高为7.3%,皂苷含量为58.1%;乙醇-碳酸钠体系的绞股蓝皂苷得率最低为6.02%,皂苷含量为55.5%。可能原因是,碳酸钠分子溶解度较低,皂苷分子与离子间作用力相对较弱,导致提取效率降低;同时,下相的极性变小,适合皂苷分子分配至下相,从而使得皂苷得率降低[21]。分配系数测定结果表明,绞股蓝皂苷在乙醇-硫酸铵体系的分配系数为10.4,高于乙醇-碳酸钠体系的分配系数5.9。故选择乙醇-硫酸铵体系作为提取绞股蓝皂苷的溶剂体系。
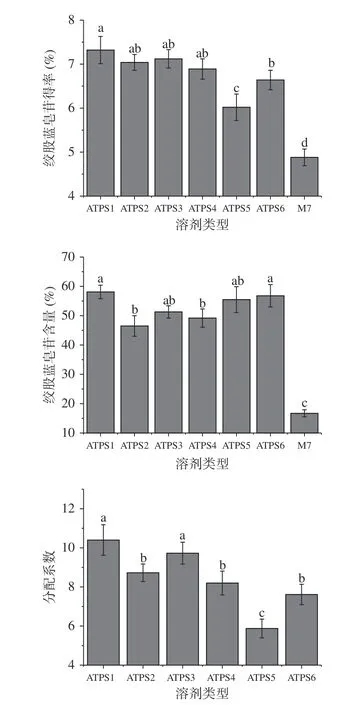
图1 不同双水相体系的绞股蓝皂苷得率、含量及分配系数Fig.1 Yield,content and partition coefficient of gypenosides by using different ATPSs
2.2 单因素实验结果
2.2.1 乙醇质量分数的选择 乙醇是乙醇-硫酸铵双水相体系重要的组成成分,与水可无限互溶,但含有憎水基团和亲水基团,可影响双水相体系分相能力、目标成分的得率[10]。如图2 所示,随着乙醇质量分数增加,乙醇-硫酸铵体系对绞股蓝皂苷得率呈先增加后降低的趋势,皂苷最高得率为7.37%。可能原因是,当硫酸铵质量分数为30%(w/w)时,乙醇质量分数为10%(w/w),乙醇憎水基团与铵离子、硫酸根、水分子等产生的排斥力无法平衡亲水基团与水分子的亲和力,从而无法分相[22]。随着乙醇质量分数增加至20%,上相亲水能力增强,使得溶剂体系分相。同时,上相极性增加有利于绞股蓝皂苷的溶出,并富集于上相。当乙醇质量分数高于30%时,乙醇质量分数过大,增加了上相的脂溶性,降低了绞股蓝皂苷的溶出而得率降低[24]。故选择乙醇质量分数为30%。
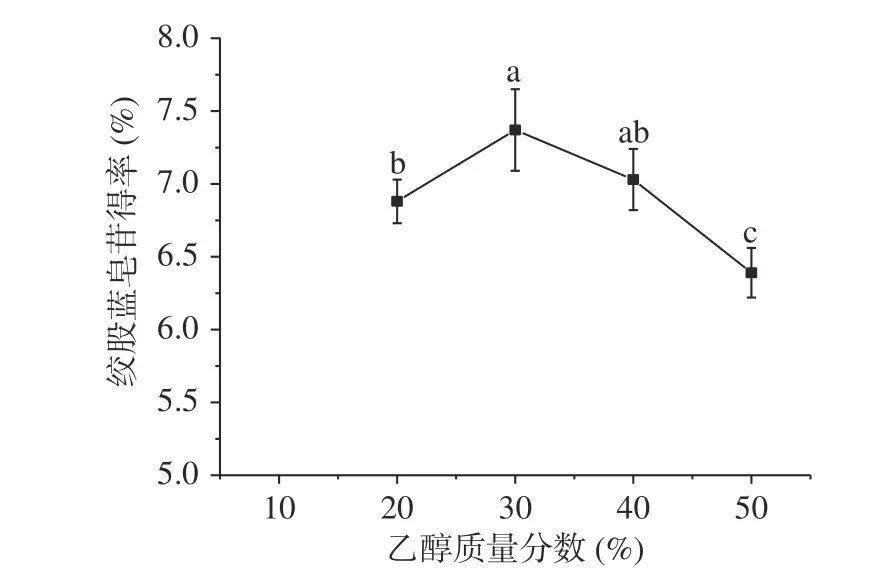
图2 乙醇质量分数对绞股蓝皂苷得率的影响Fig.2 Effects of ethanol mass fraction on the yield of gypenosides
2.2.2 硫酸铵质量分数的选择 硫酸铵易溶于水,以离子形式存在于体系,是乙醇-硫酸铵双水相体系下相的重要组成部分[14]。如图3 所示,随着硫酸铵质量分数增加,乙醇-硫酸铵体系对绞股蓝皂苷得率呈先降低后基本不变的趋势,皂苷最高得率为7.48%。可能原因是,当下相盐离子质量分数为10%时,水分子对铵离子、硫酸根离子、乙醇亲水基团具有很强的亲和力,铵离子、硫酸根离子与乙醇间的排斥力较弱从而无法分相[14]。随着硫酸铵的量逐渐增加,下相盐离子的亲水力增强,促使体系分相;同时,使下相获得更多水分子而极性和体积增加[23]。因此,绞股蓝皂苷在下相富集增加。上相的体积减小,脂溶性增强,绞股蓝皂苷得率降低。当盐离子浓度过高达到40%时,下相无机盐饱和析出,无法增加下相离子浓度和极性[25]。故选择硫酸铵质量分数为20%。

图3 硫酸铵质量分数对绞股蓝皂苷得率的影响Fig.3 Effects of (NH4)2SO4 mass fraction on the yield of gypenosides
2.2.3 液料比的选择 在中药提取过程中,溶剂的提取能力是有限的,可直接影响活性成分的得率[15]。如图4 所示,随着液料比增加,乙醇-硫酸铵双水相体系对绞股蓝皂苷得率呈现先快速增加后逐渐降低的趋势,皂苷最高得率为7.74%。可能原因是,绞股蓝细胞壁由纤维素、木质素、果胶等构成,具有坚固性和延展性[16]。当液料比低于25:1 时,溶剂相对较少,提取能力有限,而原料偏多,细胞组织无法充分溶胀。随着液料比增加,溶剂充分渗透至粉末和细胞组织内,渗透压增加使细胞壁破裂,有利于皂苷溶出和富集从而得率提升。当液料比超过25:1(mL/g)时,溶剂过多会阻碍超声破壁效率,并促使多糖、蛋白质、氨基酸等溶出,使得绞股蓝皂苷得率和含量降低。溶剂过多,亦无法充分挖掘其提取能力,易造成资源浪费[26]。故选择液料比为25:1(mL/g)。

图4 液料比对绞股蓝皂苷得率的影响Fig.4 Effect of liquid-solid ratio on the yield of gypenosides
2.2.4 超声时间的选择 达玛烷型皂苷是绞股蓝重要的活性成分,具有良好的降糖[5]、降脂[6]、改善脂肪肝[7]等作用,但其结构不稳定[27]。超声是一项高效的细胞破壁技术,将其与双水相提取技术有机结合,被广泛用于中药成分的提取。如图5 所示,随着超声时间增加,双水相体系对绞股蓝皂苷得率呈现先大幅增加后缓慢降低的趋势,皂苷最高得率为7.53%。可能原因是,绞股蓝细胞壁坚固又极具延展性,阻碍了细胞组织内成分的溶出。当时间低于50 min 时,超声破壁效率低,延长超声时间有利于绞股蓝皂苷的溶出。当时间超过50 min 时,超声消耗了大量的能量,亦降解了部分不稳定的达玛烷型皂苷,从而使绞股蓝皂苷得率降低[17]。故选择超声时间为50 min。

图5 超声时间对绞股蓝皂苷得率的影响Fig.5 Effect of ultrasonic time on the yield of gypenosides
2.2.5 提取温度的选择 提高提取温度是促进分子运动,提升中药成分得率的重要手段。然而,达玛烷型皂苷结构不稳定,易降解,对温度较敏感[8,27]。如图6 所示,随着提取温度增加,双水相体系对绞股蓝皂苷得率呈现先缓慢增加后快速下降的趋势,皂苷最高得率为7.61%。可能原因是,当温度低于50 ℃时,升高温度可加快皂苷分子的热运动,有利于其充分溶出和扩散,因此绞股蓝皂苷得率上升。当温度超过50 ℃时,温度偏高,加快了部分绞股蓝皂苷降解。同时,高温易使双水相体系上相乙醇挥发,降低了上相溶剂的体积和提取能力,从而绞股蓝皂苷得率快速下降[28]。故选择提取温度为50 ℃。

图6 提取温度对绞股蓝皂苷得率的影响Fig.6 Effect of extraction temperature on the yield of gypenosides
2.3 响应面试验优化工艺及结果分析
表3 为响应面试验设计及绞股蓝皂苷得率结果,利用Design-expert 12 软件拟合,获得绞股蓝皂苷得率y1(%)与液料比(A)、超声时间(B)、提取温度(C)三因素的多项式回归方程:
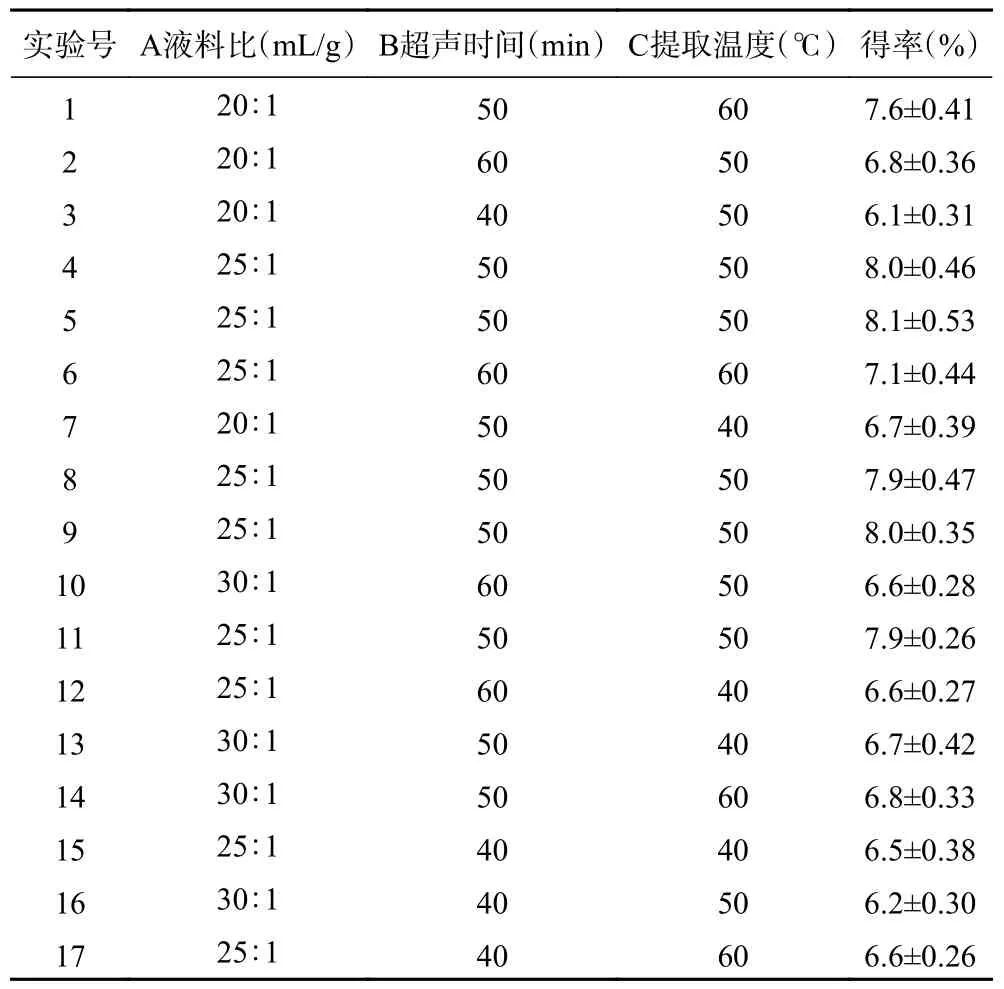
表3 试验设计及绞股蓝皂苷得率Table 3 Experimental design and the yield of gypenosides
式中A、B、C、AC、A2、B2、C2对绞股蓝皂苷的影响显著(P<0.05),AB、BC 的影响不显著(P>0.05)。如表4 所示,模型P值<0.05、失拟项P失拟项>0.05、F失拟项>0.5,表明双水相提取绞股蓝皂苷的得率模型拟合度较高;模型决定系数R2=0.9796,RAdj2=0.9534,表明该模型与绞股蓝皂苷得率的相关度较好,可用于预测分析;三因素的F值顺序为FC>FB>FA,其对模型的影响次序为提取温度>超声时间>液料比。

表4 方差分析结果Table 4 Results of variance analysis
响应面曲面图的坡度陡峭程度和等高线的密集程度,可反应自变量之间的相互作用。响应面坡度越陡峭、等高线越密集,表示两因素相互影响较显著,反之影响较小。在交互作用研究中,各因素之间相互作用如图7 所示。影响绞股蓝皂苷得率的各交互作用因素顺序为AC>BC>AB。
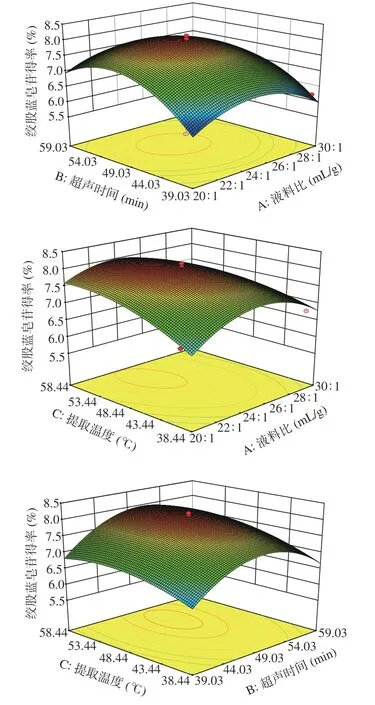
图7 液料比、超声时间、提取温度对绞股蓝皂苷得率的响应面分析图Fig.7 Response surface analysis of liquid-solid ratio,ultrasonic time and extraction temperature on the yield of gypenosides
利用Design-expert 12 软件拟合,最佳提取工艺为液料比27.75:1 mL/g、超声时间51.39 min、提取温度51.76 ℃,绞股蓝皂苷得率为8.04%。考虑实验的可操作性,最佳工艺条件调整为:液料比28:1 mL/g、超声时间52 min、提取温度52 ℃。在上述最佳工艺下条件下,ATPS7 组乙醇-硫酸铵双水相体系提取绞股蓝皂苷得率为7.91%,近似于模型预测值8.04%,误差为0.13%,远高于M7 组70%乙醇提取绞股蓝皂苷得率5.38%。表明该模型适用于绞股蓝皂苷的提取,乙醇-硫酸铵双水相体系是高效提取绞股蓝皂苷的溶剂。
2.4 绞股蓝皂苷成分含量测定
绞股蓝主要的活性成分是绞股蓝皂苷,具有良好的降糖[5]、降脂[6]、改善脂肪肝[7]等作用。绞股蓝皂苷结构主要为达玛烷型四环三萜类型,可分为人参皂苷和绞股蓝皂苷两类。人参皂苷Rb3、绞股蓝皂苷A、绞股蓝皂苷XLIX、绞股蓝皂苷XVII 是绞股蓝皂苷的主要活性成分[27]。绞股蓝皂苷HPLC 图谱如图8,双水相提取绞股蓝皂苷各成分的标准曲线、得率、含量如表5~表6 所示。乙醇-硫酸铵双水相提取的绞股蓝皂苷中绞股蓝皂苷XLIX、人参皂苷Rb3、绞股蓝皂苷A、绞股蓝皂苷XVII 得率分别为0.83%、0.09%、1.42%、4.04%,含量分别为6.54%、0.71%、11.18%、31.87%,均高于70%乙醇提取的绞股蓝皂苷各成分得率和含量。从活性成分得率和含量,进一步证实了乙醇-硫酸铵双水相提取绞股蓝皂苷的技术优势。可能原因是,乙醇-硫酸铵双水相体系中,静电作用、疏水作用、生物亲和作用等更有利于绞股蓝皂苷成分溶出;并通过上下相的极性差异进行分配,富集于上相,故达到高效提取绞股蓝皂苷的效果[29-30]。

图8 绞股蓝皂苷双水相提取物(A)、乙醇提取物(B)、标品(C)色谱图Fig.8 HPLC chromatogram of the aqueous two-phase extract(A),the ethanol extract (B) and standard substance (C)of gypenosides

表5 绞股蓝皂苷XLIX、人参皂苷Rb3、绞股蓝皂苷A、绞股蓝皂苷XVII 标准曲线方程Table 5 Standard curve equation for determination of gypenoside XLIX,ginsenoside Rb3,gypenoside A and gypenoside XVII

表6 绞股蓝皂苷XLIX、人参皂苷Rb3、绞股蓝皂苷A、绞股蓝皂苷XVII 得率与含量Table 6 The yield and content of gypenoside XLIX,ginsenoside Rb3,gypenoside A and gypenoside XVII
2.5 分子对接技术筛选α-葡萄糖苷酶活性的绞股蓝皂苷
通过抑制ɑ-葡萄糖苷酶的活性可以降低餐后血糖值,有助于降低糖尿病的发病率[20]。在分子研究中,分子对接技术常用于筛选生物活性化合物,发挥着重要作用。分子对接结果显示如图9,绞股蓝皂苷XLIX、人参皂苷Rb3、绞股蓝皂苷A、绞股蓝皂苷XVII 与α-葡萄糖苷酶具有良好的结合能力,其结合能分别为-9.4、-7.7、-7.7、-7.7 kcal/mol。结果表明,绞股蓝皂苷XLIX、人参皂苷Rb3、绞股蓝皂苷A、绞股蓝皂苷XVII 作为绞股蓝的主要活性成分,具有良好的体外降血糖潜力。

图9 人参皂苷XLIX(A)、绞股蓝皂苷Rb3(B)、绞股蓝皂苷A(C)、绞股蓝皂苷XVII(D)与α-葡萄糖苷酶分子对接结果Fig.9 Results of molecular docking between ginsenoside XLIX(A),gypenoside Rb3 (B),gypenoside A (C),gypenoside XVII(D) and α-glucosidase
2.6 绞股蓝皂苷降糖活性测定
如图10 所示,ATPS7 组绞股蓝皂苷抑制α-葡萄糖苷酶半数抑制浓度(IC50)为20.2 μg/mL,优于M7 组IC50值39.1 μg/mL、对照组阿卡波糖IC50值31.3 μg/mL。结果表明绞股蓝皂苷具有良好的降糖活性,乙醇-硫酸铵双水相体系提取的绞股蓝皂苷降糖活性更强,可能与其皂苷含量较高有关。从降糖活性角度出发,进一步表明乙醇-硫酸铵双水相体系是提取绞股蓝皂苷的良好溶剂体系,可选择性提取活性成分,保留生物活性。
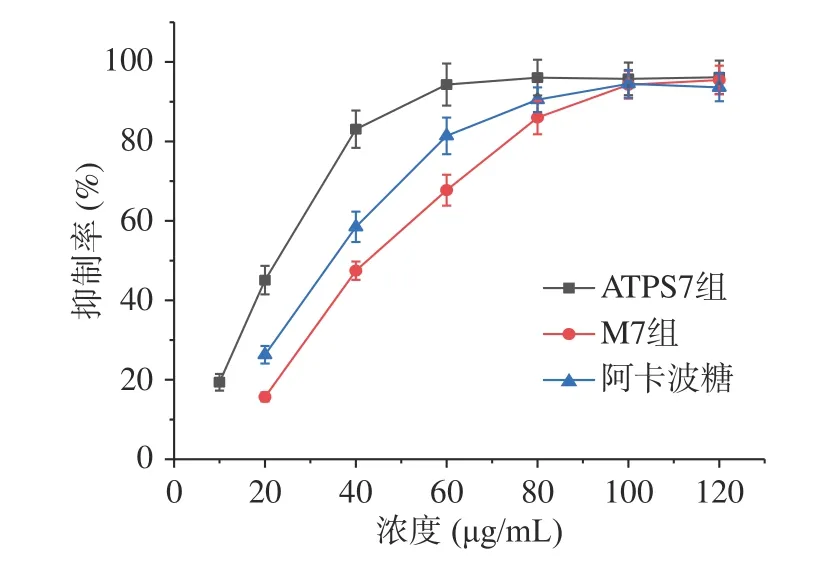
图10 绞股蓝皂苷双水相提取物、乙醇提取物对ɑ-葡萄糖苷酶活性的抑制率Fig.10 Inhibition rate of the aqueous two-phase extract,the ethanol extract from gypenosides on ɑ-glucosidase activity
3 结论
皂苷类成分是绞股蓝的主要活性成分,具有降糖、降脂、改善脂肪肝和肥胖等作用。双水相体系作为新型提取技术,提取效率高,避免了反复低效的萃取过程,且条件温和,可保留活性分子的生物活性。本实验制备了分别含硫酸铵、磷酸氢二钾、磷酸氢二钠等6 种不同的双水相体系用于提取绞股蓝皂苷,以绞股蓝皂苷得率为响应值,筛选了乙醇-硫酸铵双水相体系为最佳提取溶剂,并优化了乙醇、硫酸铵质量分数。通过单因素实验和BBD 响应面法,考察了液料比、超声时间、提取温度。结果显示,在最佳提取工艺(28:1 mL/g、超声时间52 min、提取温度52 ℃)条件下,绞股蓝皂苷得率为7.91%,接近模拟值8.04%。在最佳工艺条件下,主成分绞股蓝皂苷XLIX、人参皂苷Rb3、绞股蓝皂苷A、绞股蓝皂苷XVII 得率分别为0.83%、0.09%、1.42%、4.04%,优于乙醇提取的绞股蓝皂苷。分子对接结果表明,绞股蓝皂苷XLIX、人参皂苷Rb3、绞股蓝皂苷A、绞股蓝皂苷XVII 可与α-葡萄糖苷酶有效的结合,结合能分别为-9.4、-7.7、-7.7、-7.7 kcal/mol,具有良好的降糖潜力。双水相提取的绞股蓝皂苷抑制α-葡萄糖苷酶活性IC50为20.2 μg/mL,优于乙醇提取的绞股蓝皂苷。通过α-葡萄糖苷酶活性抑制实验,进一步验证了双水相提取保留生物活性优势。结果表明双水相提取的绞股蓝皂苷得率、含量、活性均优于传统的乙醇提取方法。因此,乙醇-硫酸铵双水相体系对绞股蓝皂苷具有良好的提取能力,为绞股蓝皂苷资源的开发与利用提供科学依据。
