兔出血症病毒1、2型双重TaqMan探针荧光定量PCR检测方法的建立和应用
2023-10-19王冠萱陈萌萌仇汝龙范志宇宋艳华魏后军徐为中钱莺娟
王冠萱, 陈萌萌, 仇汝龙, 范志宇, 胡 波, 宋艳华, 魏后军, 葛 雷, 徐为中, 王 芳, 钱莺娟
(1.江苏省农业科学院兽医研究所/农业农村部兽用生物制品工程重点实验室,江苏南京 210014;2.南京农业大学动物医学院/教育部动物健康与食品安全国际合作联合实验室/农业农村部动物细菌学重点实验室,江苏南京 210095)
兔出血症(rabbit hemorrhagic disease,RHD)是一种急性、烈性、高度接触性传染病[1-4],由兔出血症病毒(rabbit hemorrhagic disease virus,RHDV)引起。于1984年首次在中国发现[2],并迅速传播至欧洲、澳大利亚、非洲等地[3,5-6],该疾病死亡率高达90%,严重危害养兔业的发展[3]。2010年,一种新的RHDV毒株在法国被发现,不同于经典RHDV毒株的血清型,被命名为RHDV2[7]。目前,RHDV2在欧洲、亚洲、非洲、澳大利亚、北美等地广泛流行[5,8],并逐渐取代经典RHDV和RHDVa成为当地的优势毒株[8-9]。我国于2020年出现由RHDV2毒株引起的RHD暴发[10],由于目前使用的针对经典RHDV毒株制备的疫苗对RHDV2的交叉保护效果有限[11-12],导致RHDV2在国内迅速流行,国内呈现经典RHDV和RHDV2这2种基因型共同流行的情况。
RHDV是杯状病毒科(Calicivirus)[13]兔病毒属(Lagovirus)成员,目前引起RHD的RHDV有GI.1和GI.2这2个基因型。截至2010年,经典RHDV分离株属于GI.1基因型。 2010年,在欧洲发现了一种新的变异RHDV,该毒株在系统发育和抗原方面与GI.1基因型不同,被命名为RHDV2或RHDVb,属于GI.2基因型[7,14]。RHDV为单股正链RNA病毒[1],基因组全长为7437个核苷酸,衣壳由单个结构蛋白VP60构建[15],包含有2个开放阅读框(ORF)[16]。
感染RHDV1和RHDV2的家兔临床症状相似,均会出现死亡、厌食、发热等症状,剖检可见肝脏出血、坏死,脾肿大,全身弥漫性血管内凝血(DIC)[3,17-18]等,所以仅靠临床症状无法准确区分,需要依靠分子生物学诊断技术进行鉴别[19]。TaqMan RT-qPCR技术与普通RT-PCR相比,具有污染少、定量准确、实时检测、敏感性高等优点[20-21],而且可以在同一个反应管中同时检测多种基因,大大提高了反应效率[21]。因此本研究采用TaqMan RT-qPCR 技术建立一种可以在同一个反应管中鉴别RHDV1和RHDV2型病原的方法,以便于临床和实际生产中兔出血症的快速诊断和防控。
1 材料与方法
1.1 病毒株与样品
兔出血症病毒1型(RHDV1)、兔出血症病毒2型(RHDV2)、轮状病毒(Rotavirus,RV)、兔支气管败血波氏菌、兔多杀性巴氏杆菌、绿脓杆菌、沙门氏菌cDNA由笔者所在实验室保存。临床待检样品来自2021年12月之后山东、福建等地养兔场送检的疑似RHDV感染兔肝脏及笔者所在实验室模拟动物试验中获取的鼻肛拭子。
1.2 试剂与仪器
RNAiso Plus(病毒RNA提取试剂)从TaKaRa公司购买,HiScriptⅡ Q RT SuperMix for qPCR (+gDNA wiper)(反转录试剂)、AceQ qPCR Probe Master Mix(TaqMan荧光定量试剂盒)均从诺唯赞生物有限公司购入;凝胶成像仪从上海天能(Tanon)科技有限公司购入。 电泳仪购自(Bio- Rad)公司。QuantStudio 1 荧光定量 PCR 仪从美国Applied Biosystems公司购入。PCR 仪从艾本德(Eppendorf)中国有限公司购入。
1.3 引物和探针
根据GenBank中的RHDV1分离株WF 2007(登录号:FJ794180)和RHDV2分离株SC 2020/04(登录号:MT383749)的基因序列,利用Primer Express3.0.1软件针对保守VP60基因序列设计2组特异性引物和TaqMan探针(表1)。引物和探针由生工生物工程(上海)股份有限公司合成。
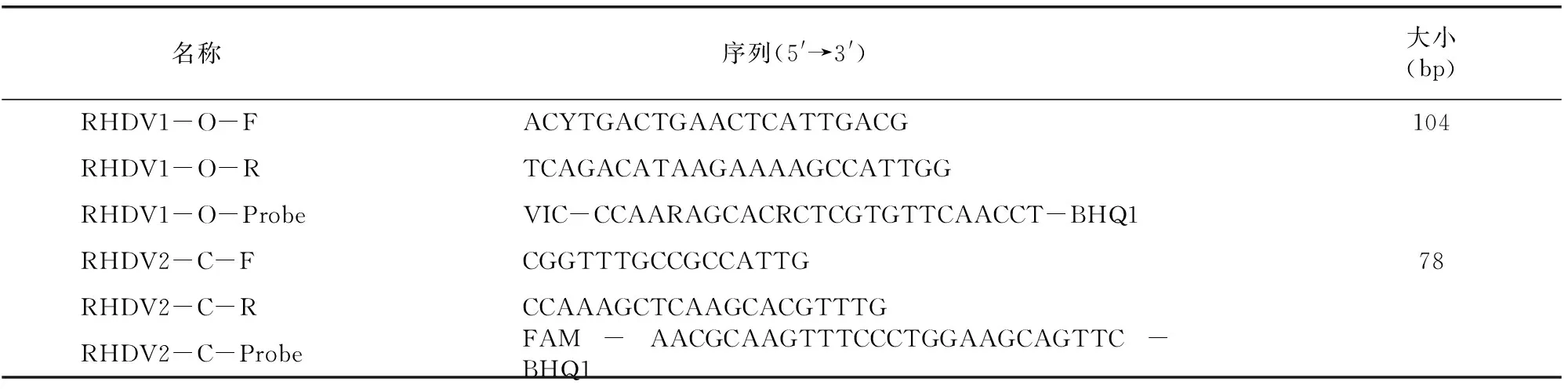
表1 RHDV1型和RHDV2型TaqMan qPCR 特异性引物与TaqMan探针
1.4 标准质粒的构建
采用RHDV1分离株WF2007、RHDV2分离株SC 2020/04的VP60基因全长引物克隆目的基因,将获得的基因序列连接到pMD18-T载体上,将筛选验证成功的pMD18-T-WF2007-VP60、pMD18-T-SC2020-VP60质粒送去生物公司进行测序,将测序结果进行比对符合预期结果。测定重组质粒浓度并计算拷贝数,用ddH2O稀释为1×1010copies/μL,作为模板标准品。
1.5 双重 TaqMan qPCR体系和反应条件的优化
以“1.4”节中质粒标准品为模板,按照TaqMan荧光定量试剂盒说明书进行扩增,总反应体系为 20 μL。对退火温度(55~65 ℃)、引物浓度(0.1~1 μL)、探针浓度(0.1~1 μL)进行优化,确定最佳反应体系和条件。
1.6 双重 TaqMan qPCR 标准曲线的建立
将“1.4”节中稀释后的2种质粒标准品1 ∶ 1混合后进行10倍倍比稀释,选择1×108~1×104copies/μL 5个梯度质粒标准品作为阳性模板进行扩增。根据荧光定量 PCR 仪自带软件 Quant StudioTMDesign &Analysis Software 自动生成标准曲线。
1.7 特异性试验
以兔多杀性巴氏杆菌、兔支气管败血波氏菌、沙门氏菌、绿脓杆菌、轮状病毒(RV)的基因组DNA为模板,以双蒸水为阴性对照,以构建的RHDV1型和RHDV2型标准品质粒1 ∶ 1混合后作为阳性对照模板,进行荧光定量PCR特异性检测。
1.8 敏感性试验
以1×108copies/μL作为2种质粒标准品的起始浓度,进行10倍倍比稀释,使用1×108~1×101copies/μL 的混合质粒作为反应模板,以ddH2O为阴性对照模板,进行TaqMan RT-qPCR和普通RT-PCR扩增,检测其敏感性。
1.9 重复性试验
以1×106~1×104copies/μL的混合质粒为模板进行TaqMan RT-qPCR扩增,分别进行组内和组间重复性试验,整理CT值并计算变异系数,评价其重复性。
1.10 临床样本的检测
使用本研究建立的TaqMan双重荧光定量 RT-PCR 方法和普通RT-PCR方法对2021年12月之后收到的来自山东、福建等地的疑似RHDV感染的家兔肝脏样品、鼻肛拭子以及以及笔者所在实验室模拟动物实验的样本进行检测,比较本研究建立的方法与常规 RT-PCR 方法的检出率。
2 结果与分析
2.1 双重 TaqMan qPCR 反应体系及参数优化
优化后的20 μL反应体系:2×AceQ qPCR Probe Master Mix10 μL,1型上下游引物各0.4 μL(10 μmol/L),2型上下游引物各0.2 μL(10 μmol/L),RHDV-1-Probe 0.2 μL(10 μmol/L),RHDV-2-Probe 0.2 μL(10 μmol/L),50×ROX ReferenceⅠ 0.4 μL,质粒cDNA模板2 μL,dd2O 6 μL。反应程序:95.0 ℃预变性5 min;95.0 ℃10 s,60 ℃ 30 s,40个循环。
2.2 双重 TaqMan qPCR 标准曲线的建立
将10倍倍比稀释的1×108~1×104copies/μL混合质粒按照优化后的反应体系和参数进行扩增,软件自动生成标准曲线(图1):RHDV1型标准曲线决定系数r2=0.999,标准方程为y= -3.347x+14.764,目的基因的扩增效率为98.952%;RHDV2型标准曲线决定系数r2=0.999,标准方程为y= -3.331x+9.833,目的基因的扩增效率为99.615%。结果显示,本研究建立的兔出血症病毒1、2型TaqMan双重荧光定量 PCR 方法有良好的线性关系。

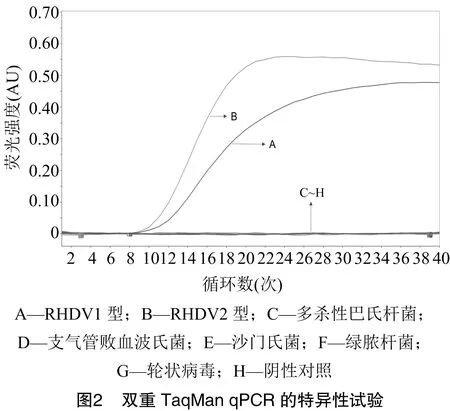
2.3 双重 TaqMan qPCR 的特异性试验
用“1.5”节优化好的体系及参数对兔支气管败血波氏菌、兔多杀性巴氏杆菌、沙门氏菌、绿脓杆菌、轮状病毒(RV)进行检测,同时设置阴阳性对照,结果(图2)显示,除RHDV1型、RHDV2型产生特异性的扩增曲线外,其他病原体及双蒸水均不产生扩增曲线,说明该方法具有良好的特异性。
2.4 双重 TaqMan qPCR 的敏感性试验
选取稀释度为1×108~1×101copies/μL的质粒作为模板进行TaqMan RT-qPCR和常规RT-PCR扩增。RT-qPCR扩增结果显示,该方法的敏感性可达到100~1 000 copies/μL;普通RT-PCR结果显示,当质粒pMD-18T-WF浓度在1×104copies/ μL、pMD-18T-SC浓度在1×103copies/μL 时有模糊的目的条带出现。由此可见,TaqMan qPCR 的灵敏度约为常规PCR的10~100倍(图3)。

2.5 双重 TaqMan qPCR 的重复性检测
2种重组质粒分别选取106、105、104这3 个稀释度,每个稀释度重复3次,进行重复性试验。并根据荧光定量PCR 得到的CT值,计算结果见表2。结果显示,组内和组间的重复试验变异系数在0.01%~1.61%之间,说明该双重荧光定量PCR方法重复性良好。

表2 双重 TaqMan qPCR 的重复性试验
2.6 临床样本检测
利用已经建立的TaqMan RT-qPCR和常规 RT-PCR 方法分别对来自全国不同兔场疑似RHDV感染的49份临床样品以及笔者所在实验室保存的42份鼻肛拭子进行检测。TaqMan RT-qPCR方法检测49份临床肝脏样品,检出14份RHDV1型,19份RHDV2型,2份RHDV1、2型混合感染;检测42份鼻肛拭子样品,检出3份RHDV1型,19份RHDV2型;用常规RT-PCR方法检出12份RHDV1型,15份RHDV2型;鼻肛拭子中检出0份RHDV1型,10份RHDV2型(表3)。 结果显示,本试验建立的双重荧光定量PCR方法的敏感性显著高于普通RT-PCR。

表3 临床样品的检测结果
3 讨论
2020年至今,RHDV2型已在我国发生了广泛的流行,相比于RHDV1型,RHDV2型不仅感染成年家兔,还可以感染幼年家兔和野兔[12],严重危害养兔业的发展和自然生态环境。目前,我国已有建立的单独检测RHDV1型的诊断方法,如RT-PCR方法[22]、ELISA方法[23]等,但均无法应用于RHDV2型的检测。笔者所在实验室建立了单独检测RHDV2型的TaqMan qPCR方法[19],但是无法同时检测2种不同血清型的RHDV,不利于疫病的检测和诊断。因此,建立一种可以同时检测RHDV1型和RHDV2型的方法来应对RHD的诊断和防控十分必要。
应用软件Primer Express 3.0分别针对RHDV1型和RHDV2型保守的VP60序列设计引物和探针,筛选出最合适的引物和探针,并优化反应条件和反应体系,成功建立了双重TaqMan RT-qPCR方法。绘制RHDV1型和RHDV2型标准曲线,决定系数r2均为0.999,可见线性关系良好;使用该TaqMan RT-qPCR 方法检测RHDV1型、RHDV2型时,与兔多杀性巴氏杆菌、兔支气管败血波氏菌、沙门氏菌、绿脓杆菌、轮状病毒均无交叉反应,说明该方法特异性良好;该方法对RHDV1型、RHDV2型的灵敏度可以达到1 μL 100~1 000拷贝数,比笔者所在实验室建立的鉴别经典 RHDV 与 RHDV2的普通 RT-PCR 方法[24]灵敏10~100倍;重复试验结果表明,组内和组间重复性试验CV值在0.01%~1.61%之间,说明该方法有良好的重复性。
综上,本试验建立的TaqMan双重 RT-qPCR方法可以在同一个反应管中检测RHDV1型和RHDV2型,具有特异性好、敏感性高的优点,可以很大程度上提高临床检测效率,有助于实际生产中对RHD的诊断和防控,为开发快速诊断试剂盒奠定了基础。
