锂离子电池在NaCl溶液中浸泡放电的效果分析
2023-10-19方广成李秀文王思瑞
方广成,李秀文,王思瑞,孙 旭
锂离子电池在NaCl溶液中浸泡放电的效果分析
方广成,李秀文,王思瑞,孙 旭
(上汽通用汽车有限公司广德分公司,安徽 广德 242200)
浸泡在NaCl溶液中进行化学放电是一种常见的故障锂电池安全处置方式,为了摸清锂电池浸泡在NaCl溶液中的放电效果和失效表现,文章对某型号锂离子电池单体和模组进行不同浓度的NaCl溶液浸泡试验,通过电池电压变化、极耳腐蚀表现探究浸泡过程中发生的化学反应与NaCl溶液浓度的关系。结果表明,锂离子电池的放电速率、腐蚀速率与NaCl溶液浓度呈正相关。即浓度越高,放电速率和极耳腐蚀速率越快,且锂离子电池模组中不同位置的电池单体表现差异较大,中间位置的电池电压放电速率明显高于两侧,靠近模组正极侧的电池单体腐蚀速率远超过负极侧。
锂离子电池;电池模组;NaCl溶液;化学放电
近年来,随着我国新能源汽车产业的蓬勃发展,动力锂离子电池的使用量也快速上升[1]。由于存在使用不当或产品合格率问题,市场上也出现了许多需要报废回收的故障锂电池,这些动力锂电池动辄几百伏的电压远远超过了人体安全电压,在对这些电池进行处置前应先将其放电至安全稳定的状态。谢英豪等[2]通过拆解不同电压的锂离子电池单体,发现当电池电压小于1 V时,拆解过程安全不起火,认为电压低于1 V的电池单体是安全的。常见的放电方式包括使用负载进行物理放电和浸泡在导电溶液(多为NaCl溶液)中化学放电两种。由于故障电池状态不稳定,物理放电连接线束的过程存在风险,并且物理放电存在电压回弹的情况[3],往往难以将电池电压放至安全电压以下,因此,将电池浸泡在导电溶液中进行化学放电更加适合故障电池。
本文通过研究锂电池单体和锂电池模组在NaCl溶液中的放电效果,得到较为合适的浓度和时间,为故障电池的安全处置提供数据支持。
1 试验部分
1.1 材料与仪器
试验选用12个同型号的电池单体和3个同型号的电池模组(均为宁德时代生产的811体系三元锂离子电池)。电池单体为方形硬壳电池,如图1所示;电池模组由12个电池单体串联组合,从模组负极开始依次编号为1-12,模组实物如图2所示;模组内单体连接方式如图3所示。试验中使用的电压采集设备为福禄克17B+数字万用表和电压采集板卡,测量过程中人员佩戴绝缘手套。NaCl溶液通过称重天平进行配重,称重天平型号为梅特勒TCS-300,试验所用仪器仪表均在校准有效期内。

图1 电池单体实物图

图2 电池模组实物图(左负右正)
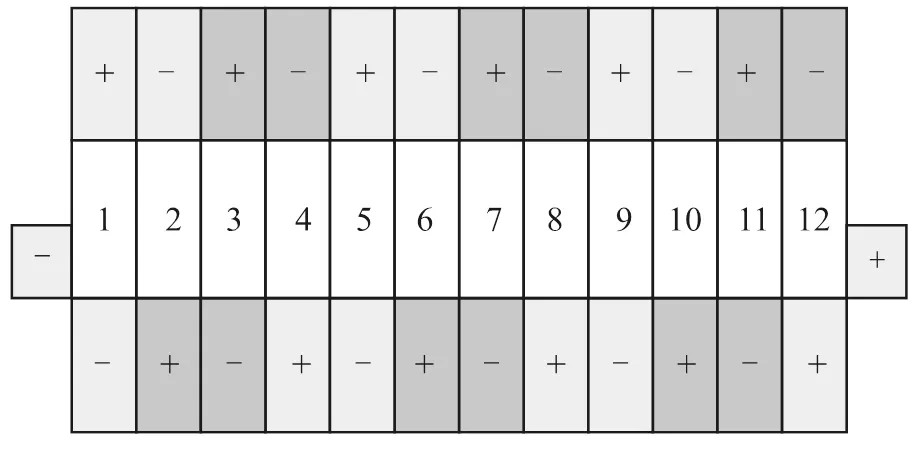
图3 电池模组内单体连接示意图
1.2 试验方案
试验分为两部分进行,首先将电池单体浸泡在不同浓度的NaCl溶液中,如图4所示,根据试验结果从放电效率和经济性能等方面考量得到最佳浓度,再将电池模组浸泡在该浓度的NaCl溶液中,如图5所示,获得模组及模组中不同位置电池单体的相关表现数据。

图4 电池单体浸泡

图5 电池模组浸泡
1.2.1电池单体试验
将电池单体充满电后放置在四组不同浓度的NaCl溶液中,四组溶液的质量分数分别设定为2.5%,5%,7.5%,10%,为排除偶然因素的影响,在每组溶液中放置3个测试样品。每间隔1 h测量一次电池电压,考察电池单体在不同浓度NaCl溶液中的放电效果。
1.2.2电池模组试验
根据第一部分试验获得的结果,选定合适的NaCl溶液浓度,将电池模组充满电后放置在该浓度溶液中。每间隔1 h测量一次电池模组电压和模组内每个电池单体的电压,考察电池模组以及模组中不同位置电池单体的放电效果,如表1所示。
表1 溶液浓度分组设定
试验电池编号电池的荷电状态/%NaCl溶液质量分数/% 电池单体1,2,31002.5 4,5,61005 7,8,91007.5 10,11,1210010 电池模组1,2,3100根据单体试验结果确定
2 结果与分析
2.1 电池单体在不同质量分数NaCl溶液中的表现
对电池单体电压降至安全值所用时间进行统计,如表2所示。
表2 电池单体降至安全电压值用时统计
试验电池编号NaCl溶液质量分数/%电压降至1 V以下用时/h 电池单体1#2#2.541 2.543 3#2.544 4#523 5#522 6#521 7#7.516 8#7.517 9#7.517 10#1014 11#1013 12#1014
由表2可知,2.5%、5%、7.5%、10%四组不同浓度NaCl溶液用时平均值分别是42.7 h、22 h、16.7 h、13.7 h,可知放电速率与NaCl溶液质量分数成正相关,图6为电池单体降至1V的用时与溶液浓度关系曲线,在NaCl溶液浓度超过5%之后,锂电池放电速率不再有明显提升,因此从节约成本的角度考虑,选择5%质量分数的NaCl溶液较为合适。
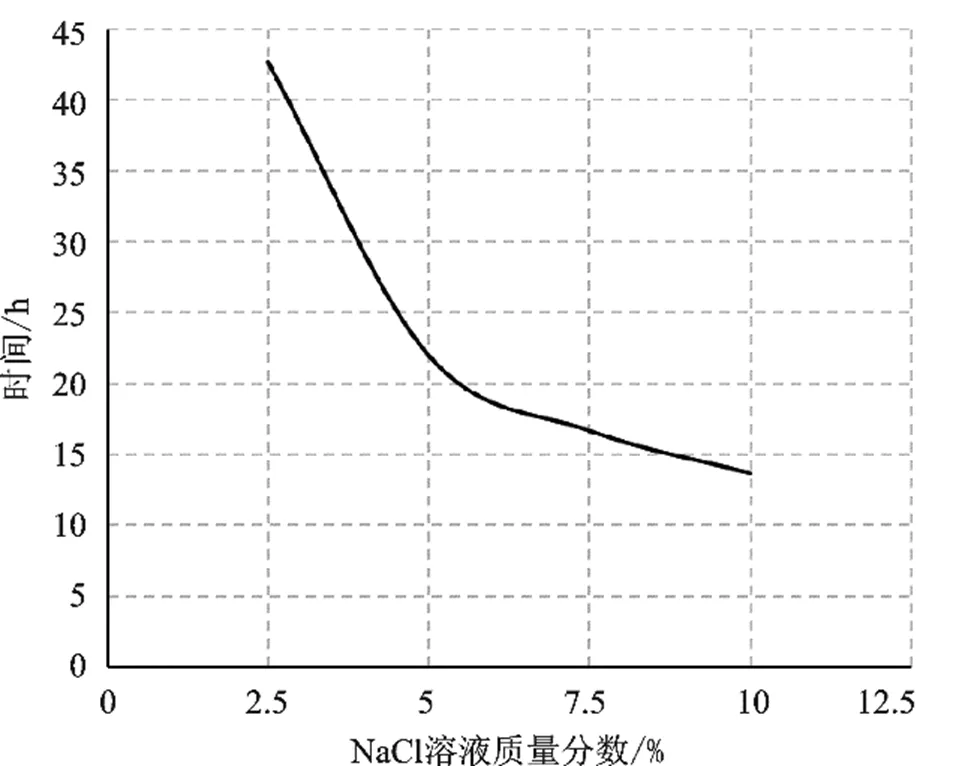
图6 电池单体降至安全电压值用时与溶液浓度关系曲线
根据四组电池单体电压平均值变化曲线,如图7所示,放电过程大体可以分为三个阶段,分别是平缓期、快速下降期、缓速下降期。
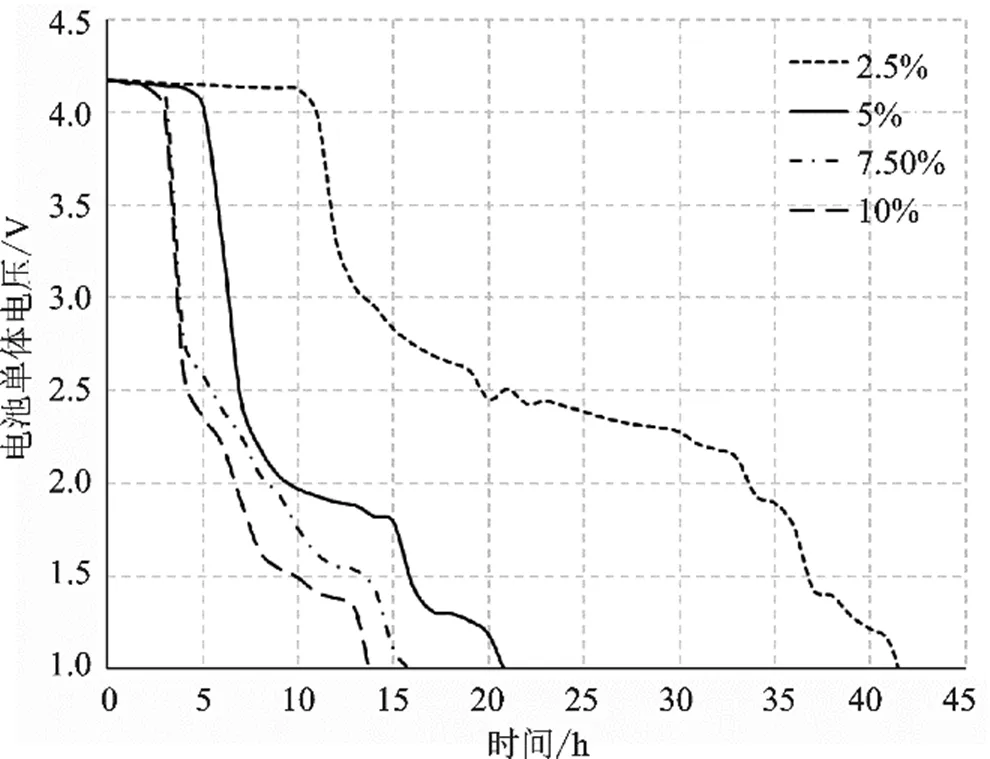
图7 电池单体电压变化曲线
平缓期电压基本稳定,此时可观察到电池负极产生大量气泡,正极产生少量气泡并被逐渐腐蚀,其原理是电池对NaCl溶液进行电解,在正极和负极分别产生了氢气和氯气,化学式见式(1),试验室顶部布置的高精度氢气传感器数值上升也证明了确实有氢气的产生。
NaCl+H2O→NaOH+H2↑+Cl2↑ (1)
反应产生的氯气溶于水后形成次氯化钠,继而腐蚀电池正极极耳并形成Al(OH)3沉淀物,化学式见式(2)和式(3)。
Cl2+NaOH→NaClO+NaCl+H2O (2)
NaClO+Al+H2O→Al(OH)3↓+NaCl (3)
四组用时分别为11 h、5 h、3 h和3 h,可见NaCl溶液浓度越高,该阶段持续的时间就越短。
快速下降期电压迅速降低,推断是由于随着电池正极被腐蚀产生孔洞,溶液进入电池内部与电解液发生反应,电解液主要由溶剂和锂盐所组成,锂盐中的F6LiP遇水会产生强腐蚀性的HF,其化学式见式(4),产生的HF作为电解质进一步推动放电[4-5]。
F6LiP+H2O→POF3↑+HF+LiF (4)
缓速下降期间电压下降速率变慢,从曲线可知该阶段一般发生在电压低于2.5 V以后,此时电池内部锂盐几乎被反应消耗殆尽,没有锂离子从电池负极穿过隔膜前往正极,电池也就难以放电,剩余少量电解液继续与水缓慢反应,电池电压缓慢降低。
2.2 电池模组在5% NaCl溶液中的表现
三个电池模组浸泡在5% NaCl溶液中的各项表现基本一致,以1号模组为例进行分析,其腐蚀情况如图8所示,模组中各个电池单体的电压变化曲线如图9所示,其特点包括:
1)越靠近模组正极的电池单体汇流排腐蚀越快,浸泡8 h后8-12号单体表面的汇流排几乎腐蚀殆尽,9-12号单体正极耳完全溶解,负极耳还有所保留,这与第一部分试验中电池单体的正负极耳腐蚀情况一致,靠近模组负极的汇流排表面附着大量Al(OH)3沉淀物;
2)各电池单体的放电速率并不是均匀的,与其在模组中的位置呈强相关,可以明显看出中间快两边慢。中间位置的4-7号单体在5 h后电压骤降至0 V左右,猜测是因为中间位置的热量聚积导致温度上升加快了放电速率。靠近模组正极侧的9-12号在11 h后正极耳完全溶解导致电压数值波动较大,无法准确测量。1号电芯在电压低于3.4 V以后放电趋于停止,这是因为Al(OH)3沉淀物在极耳表面形成的保护层阻止了放电;
3)另外,从直观的现象来看,当浸泡2 h后,溶液开始进入单体内部,电解液与水反应释放了大量的热,使用测温枪测得水温达到65 ℃,也有学者在进行电池包级别的开盖盐水浸泡试验时出现了因长时间高温使得电气件升温着火的现象[6],由此可见电池能量越大其释放的热量越大,因此为了降低风险,在对电池包或系统级别的高能量动力电池放电时不应盲目追求高放电效率,而是应适当降低溶液浓度,削弱反应强度,缓慢释放热量。
由上述可知,由于连接各电池单体的汇流排腐蚀断裂,直接测量模组正负极电压为0 V,但这并不意味着模组中的各个单体电压为0 V,在进行拆解等操作时应当单独测量每一个电池单体的电压,以确保每个单体都处于安全稳定的状态。

图8 电池模组腐蚀情况(左负右正)
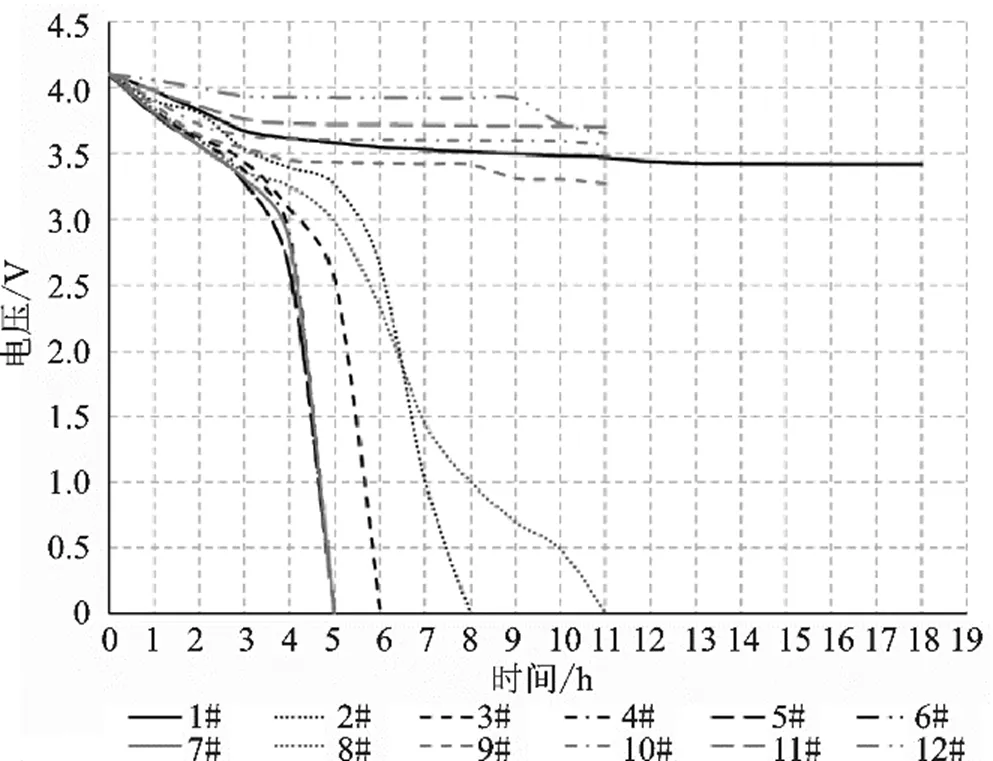
图9 电池模组内各单体电压变化曲线
3 结论
本文通过对锂电池浸泡在不同浓度NaCl溶液中的极耳腐蚀、电压变化等试验现象和数据进行分析,得出以下结论:
1)锂电池在NaCl溶液中的放电过程分为平缓期、快速下降期和缓速下降期三个阶段。放电速率与溶液浓度呈正相关,但浓度超过5%后放电速率不再有明显提升,因此,推荐选择5%浓度的NaCl溶液进行浸泡。对电池包或系统级别的浸泡放电时,应适当降低溶液浓度,减缓热量释放以降低风险。
2)锂电池模组中各单体的放电速率和腐蚀速度与其在模组中的位置强相关,中间位置的单体放电速度快于两侧,靠近正极的单体腐蚀快于负极。
3)本文仅对一款特定型号的811体系三元锂电池进行了研究,存在一定局限性,但考虑到目前电动汽车行业内主流使用的三元锂和磷酸铁锂电池电解液的锂盐均为六氟磷酸锂,溶剂也基本相同,因此,推断这些锂电池在NaCl溶液中也会发生于类似的反应,而有无其它区别于这款锂电池的情况还有待进一步研究。
[1] 陈军.废旧锂离子动力电池的拆解及梯次利用初探[J].机械化工,2019(16):149.
[2] 谢英豪,欧彦楠,余海军,等.废旧车用动力电池安全放电研[J].工业安全与环保,2017,43(9):44-47.
[3] 余海军,张铜柱,刘媛,等.车用动力电池回收拆解的安全与环境技术[J].工业安全与环保,2014,40(3):77- 79,92.
[4] LIU M,VATAMANU J,CHEN X,et al.Hydrolysis of LiPF6-Containing Electrolyte at High Voltage[J].ACS Energy Letters,2021,6(6):2096-2102.
[5] 张建刚,胡波,唐天东,等.电解质六氟磷酸锂的制备与检测[J].无机盐工业,2013,45(6):51-53.
[6] 宗磊,盛军.锂离子动力电池系统的浸水试验及分析[J].北京汽车,2020(1):22-26.
Analysis of the Effect for Immersion Discharge of Lithium-ion Batteries in NaCl Solution
FANG Guangcheng, LI Xiuwen, WANG Sirui, SUN Xu
( SAIC-General Motor Company Limited, Guangde Branch, Guangde 242200, China )
Discharge by soaking in NaCl solution is a common safe way to dispose of faulty lithium batteries. In order to find out the discharge effect and failure performance of lithium batteries immersed in NaCl solution, the article carries out immersion experiments on a certain type of lithium-ion battery monomer and module with different concentrations of NaCl solution. The relationship between the chemical reactions occurring during immersion and the concentration of NaCl solution is explored through changes in cell voltage and manifestations of polar ear corrosion. The results show that the discharge rate and corrosion rate are positively correlated with the concentration of NaCl solution. That is, the higher the concentration, the faster the discharge rate and the corrosion rate of the electrode lug. The performance of the battery cells at different positions in the module varies greatly. The battery voltage drop rate at the middle position is significantly higher than that at both sides, and the corrosion rate of the cells near the positive side of the module is much faster than that at the negative side.
Lithium-ion battery; Battery module; NaCl solution; Chemical discharge
TM911
A
1671-7988(2023)19-17-05
10.16638/j.cnki.1671-7988.2023.019.004
方广成(1994-),男,助理工程师,研究方向为新能源汽车动力电池试验检测,E-mail:guangcheng_fang@ saic-gm.com。
