“金花菌”(Aspergillus chevalieri)发酵牡丹花瓣过程中挥发性物质及酚酸类物质变化
2023-10-18李学震刘光鹏马艳蕊姚旖旎孟园赵岩和法涛
李学震,刘光鹏,马艳蕊,姚旖旎,孟园,赵岩,和法涛
(中华全国供销合作总社 济南果品研究所,山东 济南,250220)
牡丹花(PaeoniasuffruticosaAndr.)作为食用性花卉深受大众的喜爱,尤其在女性群体中还可用作传统中医药治疗月经不调和腹痛[1]。现代研究表明,牡丹花瓣中富含多酚和黄酮类物质,这些物质与清除自由基[2]、抑制癌细胞[3]、消炎[4]和降低血糖[5]等活性密切相关。酚酸类物质在植物中的合成途径主要包括磷酸戊糖途径、莽草酸途径和苯丙素途径,它们通常带有一个或多个芳香环,且至少有一个羟基基团[6]。黄酮类物质是通过至少2个碳原子连接多个酚羟基苯环结构,它们是牡丹花瓣中主要的天然色素,特别是花青素能应用到食品中[7]。牡丹花的香气主要由醛类、醇类、酯类和烷烃类构成,还有少数酮类、酸类、烯烃类物质,这些香气成分中醇类物质对牡丹香气有较大贡献[8-9]。
茯砖茶在我国有400多年的历史,“金花菌”是从其中分离出来的一类有益菌,它也是茯砖茶漫长发酵过程中的优势菌[10]。有研究表明,在茯砖茶发酵过程中“金花菌”能显著降低碳水化合物、氨基酸、有机酸、核苷等化合物的含量,增加有机酸类化合物含量,同时提供木香、花香、冬青油香、蘑菇香和果香[11-12]。目前,“金花菌”的研究大多集中在茯砖茶发酵、菌株胞外活性物质鉴定和菌种分类学的研究上[13]。因此,“金花菌”在花茶发酵、酒类、醋类、调味品的酿造与功能食品的开发方面还有待进一步研究。在之前的研究中,我们在茯砖茶中分离出“金花菌”,该菌株能在牡丹花瓣上生长,并能提高牡丹花瓣多酚、黄酮的提取得率,并赋予花瓣“金花菌”的清香。因此,我们进一步研究该菌株发酵牡丹花瓣过程中酚类物质和香气的变化规律,为牡丹花瓣的加工和品质控制提供可靠依据。
1 材料与方法
1.1 实验材料与试剂
“金花菌”(Aspergilluschevalieri)分离自茯砖茶,保藏于中国普通微生物菌种保藏管理中心(CGMCC),保藏号:CGMCCNo.23051;牡丹花(干燥),山东省悦如农业发展有限公司;马铃薯葡萄糖(potato dextrose broth,PDB)培养基,北京索莱宝生物科技有限公司;甲醇、乙腈、甲酸均为色谱纯,上海麦克林生化科技有限公司;NaCl(分析纯),天津大茂化学试剂厂;没食子酸、儿茶素、阿魏酸等分析标准品,上海源叶生物科技有限公司。
1.2 仪器与设备
SPL-250型气相离子迁移色谱仪,德国G.A.S.公司;Thermo Vanquish UHPLC型高效液相色谱仪、Q-Exactive HF型高分辨质谱,赛默飞世尔科技有限公司;ME-104型分析天平,梅特勒托利多仪器有限公司;BSC-150型恒温培养箱、YXQ-LS-100A型立式压力蒸汽灭菌器,上海博讯实业有限公司医疗设备厂;ZWYR-2112B型恒温调速摇床柜,上海智诚分析仪器制造有限公司。
1.3 实验方法
1.3.1 “金花菌”种子液的制备
取保藏于-80 ℃冰箱的“金花菌”液体种子,接入PDB培养基中活化5~7 d,培养温度28 ℃,摇床转速180 r/min,待菌丝布满摇瓶中,根据GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》,得到菌落数约为1.8×109CFU/mL的种子液。
1.3.2 “金花菌”发酵牡丹花瓣的制备
取20 g牡丹花瓣于三角瓶中,置于灭菌锅中100 ℃灭菌10 min,加入16 mL“金花菌”种子液,发酵温度28 ℃,分别设置A组(未发酵)、B组(发酵3 d)、C组(发酵5d)、D组(发酵7 d)、E组(发酵9 d)、F组(发酵11 d)(每组设置3个平行)。发酵好的牡丹花瓣放入50 ℃干燥箱内烘干,研磨过60目筛,置于干燥器内备用。
1.3.3 GC-IMS检测挥发性成分
参考刘强等[14]的方法并稍作修改。分别称取0.5 g各组别花瓣粉末于20 mL顶空进样瓶中,加入1 mL饱和NaCl溶液,每组设置3个平行,以500 r/min的转速,在60 ℃条件下孵育15 min后开始进样。
GC-IMS条件:MXT-5气相色谱柱(60 m×0.25 mm,0.25 μm),IMS温度45 ℃,色谱柱温度60 ℃,进样针温度85 ℃,载气/漂移气N2(纯度99.999%),分析时间20 min,进样体积500 μL。
气相色谱条件:0~2 min,漂移气150 mL/min,载气2 mL/min;2~10 min,漂移气150 mL/min,载气2~10 mL/min;10~20 min,漂移气150 mL/min,载气10~100 mL/min。
1.3.4 HPLC-MS酚类物质定性和定量检测
参考GARCIA等[15]的方法并稍作修改。分别称取0.1 g各组别花瓣粉末加入4 mL 70%(体积分数)甲醇溶液超声波提取10 min,提取2次,1 mL上清液过0.22 μm滤膜装入进样瓶中,每组设置3个平行。色谱条件:色谱柱为Sigma HPLC Column色谱柱(500 mm×3.0 mm×2.7 μm),柱温30 ℃,流速0.3 mL/min,0.1%(体积分数)的甲醇水为流动相A,乙腈为流动相B,进样量10 μL。
1.3.5 数据处理与分析
GC-IMS仪器中配备的Vocal软件进行数据查看、定性和图谱分析,使用软件内置的IMS数据库和Hanon数据库进行物质定性分析;Gallery插件、Reporter插件和Dynamic PCA插件分别用于指纹图谱的绘制、图谱差异对比和主成分分析(principal component analysis,PCA)。SPSS 22.0软件用于数据统计与分析。
2 结果与分析
2.1 牡丹花瓣发酵前后挥发性成分定性分析
图1是不同发酵时间的牡丹花瓣GC-IMS二维图谱,分离的每个点代表一种物质[16]。表1中显示了通过GC-IMS技术在不同发酵时间的牡丹花瓣中共检测出51种挥发性成分,定性检出33种,其中包括醛类9种、醇类8种、萜烯类6种、酸类4种、酮类3种、吡嗪类2种、酯类1种。3-辛醇、2-呋喃甲醇、2-甲基-1-丁醇、顺-3-己烯醇(叶醇)、己醛、α-蒎烯等物质在牡丹花香气检测的文章中鲜有报道[8-9]。

a-未发酵;b-发酵3 d;c-发酵5 d;d-发酵7 d;e-发酵9 d;f-发酵11 d
2.1.1 牡丹花发酵前后挥发性物质差异性分析
利用Vocal软件内置的Reporter插件制作不同发酵时间牡丹花瓣样品中挥发性物质差异图谱(经过归一化处理)。如图2所示,选取未发酵的牡丹花瓣图谱作为参比,若二者所含挥发性物质相似,扣除背景色后显示为白色,若呈现蓝色则代表该物质的浓度低于参比,若呈现红色则代表该物质浓度高于参比[17]。图2中可以看到发酵牡丹花瓣中出现了红色斑点(图2-a),随着发酵时间的迁移,红色斑点逐渐增多(图2-c~图2-f),这表明发酵过程中产生了挥发性物质并与发酵时间密切相关。

a-未发酵;b-发酵3 d;c-发酵5 d;d-发酵7 d;e-发酵9 d;f-发酵11 d
2.1.2 牡丹花发酵前后挥发性物质变化规律分析
为了更好地分析牡丹花瓣发酵过程中挥发性物质的变化规律,采用了指纹图谱比较牡丹花发酵前后挥发性物质的差异,检出但未能定性的挥发性物质用数字表示[18]。如图3(a区域)所示,发酵前后牡丹花瓣含量相似的挥发性物质有2-己酮、2-呋喃甲醇、异戊醇、2-甲基丁酸甲酯、莰烯、丙醛、顺式已烯-3-醇(叶醇)、2-庚酮、α-蒎烯、正壬醛等物质。图3(b区域)显示的是发酵后含量减少的物质,其中环己酮、2-甲基-1-丁醇和物质12是在发酵5 d开始减少,β-蒎烯、庚醛、戊烯酸、丁酸和物质4、13在发酵3 d开始减少,值得注意的是牡丹花瓣中的丁酸在发酵后(特别是5~11 d)完全消失,这表明牡丹花瓣的挥发性物质在发酵过程中可能发生了转化。图3(c区域)中2,5-二甲基吡嗪、2,3-二甲基吡嗪和月桂烯等物质在发酵5 d后开始增加,2-乙基-1-己醇、2-甲基戊醇、2-糠醛和丙烯醛等物质在发酵3 d开始增加,然而3-辛醇只有在发酵11 d的牡丹花瓣中有明显检出。
2.1.3 牡丹花发酵前后主成分分析
PCA已经广泛应用于食品品质控制中,它是通过将多个变量进行正交变换,将原有复杂信息简化成少量综合性指标的同时保证原信息损失少,进而在原始变量中阐明变量之间元素的突出关系[19]。如图4所示,PC1和PC2贡献值分别为65%和13%,解释累积贡献值为78%,能将未发酵、发酵3 d和发酵5~11 d的牡丹花瓣清晰区分,证明发酵前后的牡丹花瓣中挥发性物质有明显区别,特别是发酵5~11 d。

a-没食子酸的标准品色谱图;b-儿茶素的标准品色谱图;c-阿魏酸的标准品色谱图;d-芦丁的标准品色谱图;e-没食子酸的样品色谱图;f-儿茶素的样品色谱图;g-阿魏酸的样品色谱图;h-芦丁的样品色谱图
2.2 牡丹花瓣发酵前后酚酸类物质变化
图4是部分多酚物质标准品和样品的液相色谱图,所有样品含量均在检测范围内。由表2可知,发酵前后的牡丹花瓣共有21种酚酸类物质检出,不同组别的总酚酸物质呈现出先增加后缓慢降低的变化规律,发酵5 d时总酚酸含量最高为3 449.65 μg/g。其中没食子酸,原儿茶酸,肉桂酸,异栎素在发酵过程中一直呈现上升趋势(P<0.05);儿茶素,原花青素B1、B2,丁香酸,绿原酸在添加“金花菌”种子液3 d后一直呈现下降趋势(P<0.05),这表明通过“金花菌”发酵可以使牡丹花瓣中酚酸类物质发生转化。然而,阿魏酸、芦丁、咖啡酸、槲皮素、水杨酸、异鼠李素、山奈酚、对豆香酸和龙胆酸呈现先增加后减少的趋势,其中,芦丁在接种“金花菌”前后含量明显升高(P<0.05),这有可能是“金花菌”自有的酚酸物质。值得注意的是,只有肉桂酸是通过“金花菌”发酵产生的;没食子酸甲酯在发酵前后及发酵过程中没有显著性差异(P>0.05);表儿茶素和金丝桃苷发酵前后具有显著性差异(P<0.05),但在发酵过程中无显著动态变化(P>0.05)。
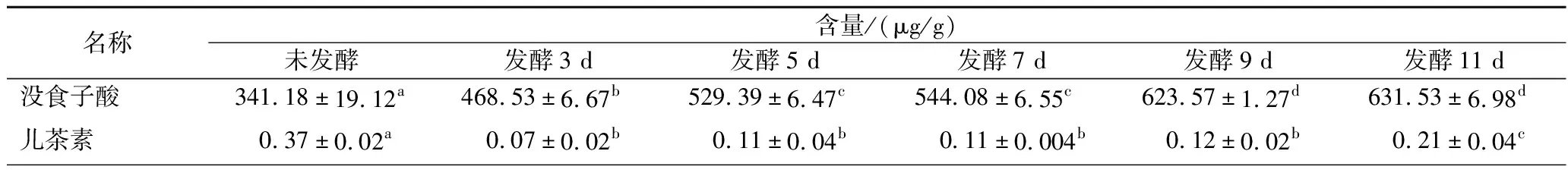
表2 发酵前后牡丹花瓣多酚种类及含量Table 2 Species and content of polyphenols in peony petals before and after fermentation
2.3 牡丹花发酵前后聚类分析
在面对较多数据指标时,单因素分析往往不能满足综合评价需求,这时就要考虑多因素分类分析[20]。聚类分析是将研究对象按照品质特性相似程度聚合在一起,并按照综合性多品种聚合,最终完成分析过程[21]。采用TBTools[22]软件对发酵前后牡丹花瓣酚酸类物质进行系统聚类分析,结果如图6所示。发酵前后牡丹花瓣用21种酚酸含量作为聚类变量,样品可分为3类,B、C、D即发酵3、5、7 d分为第一类,总酚含量较高,酚类物质较为丰富;E、F即发酵9、11 d为第二类,总酚含量略低,酚类物质主要由原儿茶酸、没食子酸、金丝桃苷、肉桂酸和异栎素提供;A即未发酵的牡丹花瓣为第三类,总酚含量最低,酚类物质主要有原花青素B1、原花青素B2、儿茶素、表儿茶素、绿原酸、丁香酸提供。PCA结果同样能证明上述观点,将牡丹花瓣发酵前后及发酵过程中多酚变化较好区分,PC1和PC2的累计贡献率为78.5%。

a-聚类分析图;b-PCA图
3 结论
牡丹花作为药食同源食材,其花瓣是挥发性物质和酚酸类物质的主要来源。利用GC-IMS技术和HPLC-MS技术可以对发酵前后的牡丹花瓣中挥发性成分进行检测和分析。GC-IMS在6个样品中共检出51种挥发性成分,定性出33种,主要为醛类和醇类物质,其次为萜烯类和酸类物质。HPLC-MS技术在6个样品中共检出21种酚酸类物质,发酵5 d时总酚含量最高。利用PCA和聚类分析能将发酵前后和发酵不同阶段的牡丹花瓣挥发性物质和酚酸类物质变化进行区分。综上,发酵前后及发酵过程中的牡丹花挥发性物质和酚酸类物质含量有显著性差异(P<0.05),并随着发酵时间的迁移牡丹花瓣中挥发性物质和酚酸类物质发生动态变化。因此,采用聚类分析和PCA可以为发酵牡丹花瓣茶的加工利用和挥发性物质及酚酸类物质的动态变化研究提供可靠依据。
