油菜蜂花粉发酵工艺及生物活性研究
2023-10-18段倩倩程妮赵丞曹炜
段倩倩,程妮,2*,赵丞,曹炜,2
1(西北大学 食品科学与工程学院,陕西 西安,710069)2(陕西省蜂产品工程技术研究中心,陕西 西安,710065)
蜂花粉是蜜蜂将采集来的花粉掺入唾液和花蜜粘成的一种不规则颗粒物,其富含多糖、蛋白质、不饱和脂肪酸、酚类化合物等物质,被称为人类营养的膳食补充剂[1],是一种极具开发价值的食物资源。这些营养物质和功能性成分介导多种生物效应,如抗氧化、抗癌和免疫调节等[2]。然而,蜂花粉由于特殊的腥味和花粉过敏的症状,大大降低了蜂花粉的可接受程度,且蜂花粉坚韧的细胞壁也限制了其内容物的释放,因此,可以有效改善其感官特性、提高其生物有效性和生物活性,对蜂花粉资源开发具有重要意义。

目前,蜂花粉在食品中的应用主要是直接食用、压成片剂或作为辅料添加到其他产品中,对于蜂花粉发酵,改善产品感官特性等也有报道,但是,发酵的微生物、花粉的植物来源以及发酵条件不同,对发酵结果也会有影响。此外,目前尚未有研究关注油菜蜂花粉发酵前后的抗氧化、抑菌和体外抗炎活性。因此,本文选用植物乳杆菌和鼠李糖乳杆菌2种益生菌来发酵油菜蜂花粉,采用单因素试验和正交设计对发酵工艺进行优化,旨在改善蜂花粉口感、提高蜂花粉营养成分和生物学活性,为油菜蜂花粉进一步深加工提供理论参考。
1 材料和方法
1.1 材料与仪器
植物乳杆菌、鼠李糖乳杆菌冻干性菌粉,山东中科嘉亿生物工程有限公司提供;油菜蜂花粉,蜂农处,且经孢粉学鉴定确定其植物源;MRS肉汤、MRS固体培养基,北京奥博星生物技术有限公司;琼脂培养基,自制;透明质酸酶、透明质酸钠、牛血清白蛋白,上海源叶生物科技有限公司;葡萄糖、芦丁、没食子酸等标准品,上海阿拉丁生化科技有限公司;DNS试剂,广检(广州)检测科技有限公司;其余试剂均为国产分析纯或生物制剂。
SHA-B恒温摇床,常州国华电器有限公司;CXG-1微生物培养箱,上海青浦沪西仪器厂;UV1800分光光度计,上海仪电分析仪器有限公司;52AA旋转蒸发仪,上海亚荣生化仪器厂;FD-1C-50冻干机,北京博医康实验仪器有限公司;超净工作台,苏净集团苏州安泰空气技术有限公司;PHS-3C pH计,上海佑科仪器有限公司。
1.2 实验方法
1.2.1 菌种的活化和培养
植物乳杆菌和鼠李糖乳杆菌冻干型菌粉在室温下解冻,按照1%(体积分数)的接种量接种于10 mL MRS肉汤培养基中,于37 ℃活化12 h,将菌种分别接种到MRS液体培养基中,混合均匀并培养至对数生长期。
1.2.2 油菜蜂花粉处理
采用75%(体积分数)的食用酒精喷洒油菜蜂花粉,边喷边翻动,花粉密封2~3 h。取出后,其表面覆盖8层灭菌纱布,置于40 ℃烘箱中,使乙醇完全挥发,备用。
1.2.3 单因素发酵试验
乳酸菌接种量分别为3%、5%、7%、10%和15%(质量分数);添加水量分别为20%、25%、30%、35%、40%、45%、45%和50%(质量分数);发酵时间为0、24、48、72、96和120 h;发酵温度为33、35、37、39和42 ℃;植物乳杆菌与鼠李糖乳杆菌菌液比例分别为1∶1、1∶2、1∶3、1∶5、2∶1、3∶1和5∶1(体积比,下同),将对数生长期的菌株接入蜂花粉中,测定发酵后乳酸菌活菌数和pH,同时进行感官评价。
1.2.4 乳酸菌发酵油菜蜂花粉工艺优化
根据单因素试验结果,选择确定乳酸菌接种量(%)、添加水量(%)、发酵温度(℃)、植物乳杆菌和鼠李糖乳杆菌菌液比例设计L9(34)正交设计,以乳酸菌活菌数和感官评分为指标对发酵工艺进行优化。因素水平如表1。

表1 发酵工艺优化正交设计水平表Table 1 Orthogonal test level of fermentation process optimization
1.2.5 验证实验
用正交试验设计确定的最佳条件进行蜂花粉发酵,测定所得结果,比较其与实验组的差异。
1.2.6 显著性和相关性分析
采用SPSS 26.0软件对代表性指标进行正交优化分析,得出蜂花粉的最优发酵方案。对所测活性指标进行显著性差异分析(P<0.05),运用Origin 2022软件作图。
1.3 测定方法
1.3.1 乳酸菌活菌计数
乳酸菌活菌计数依据GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》进行测定。
1.3.2 发酵蜂花粉pH的测定
准确称取5 g蜂花粉样品,加入15 mL蒸馏水,振摇混匀后使用pH计测定pH值。
1.3.3 感官评价
感官评分标准如表2所示。

表2 发酵油菜蜂花粉感官评定标准Table 2 Sensory evaluation criteria of fermented rape bee pollen
1.3.4 还原糖含量的测定
参考曾志恒等[10]的方法,采用DNS法测定还原糖含量,葡萄糖标准曲线对应方程为:y=0.574 8x-0.006 6(R2=0.996 4)。
1.3.5 蛋白质含量的测定
发酵前后蜂花粉经浸泡和抽提回流后脱脂,烘干后以1∶10(g∶mL)加入缓冲溶液(0.02 mol/L PBS溶液[NaCl],pH 7.4),4 ℃搅拌提取24 h,于4 ℃,12 000 r/min,离心15 min,得到蛋白质提取液。采用考马斯亮蓝法测定花粉中粗蛋白的含量[11]。牛血清标准蛋白曲线对应方程为:y=0.316 3x-0.001 8(R2=0.997 5)。
1.3.6 抗氧化活性的测定
蜂花粉乙醇提取液的制备:各称取发酵前后的蜂花粉样品10 g与75%乙醇按料液比1∶10混合后超声提取45 min后,热回流提取2 h,抽滤,滤液浓缩后用75%乙醇定容至100 mL。
总酚、总黄酮含量测定参考SEIFZADEH等[12]的方法,总酚以没食子酸为标准品,没食子酸标准曲线对应方程为:y=12.034x+0.047 3(R2=0.993 3)。总黄酮以芦丁为标准品,芦丁标准曲线对应方程为:y=1.129 1x+0.002 2(R2=0.992 9)。
总抗氧化能力的测定参考何亮亮等[13]的方法,以FeSO4绘制标准曲线(0~0.4 mmol/L),蜂花粉总抗氧化能力以FeSO4当量表示,FeSO4标准曲线对应方程为:y=1.667 2x+0.001 7(R2=0.991 9)。
Fe2+螯合率测定参考何亮亮等[13]的方法,4 mL样品稀释液加入50 μL FeSO4(2 mmol/L)和Ferrozine(5 mmol/L)混匀后于37 ℃水浴反应30 min,于562 nm处测定吸光度,以蒸馏水为空白,Fe2+螯合率的计算如公式(1)所示:
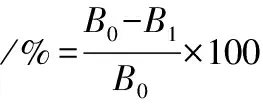
(1)
式中:B0,4 mL 75%乙醇溶液代替样品吸光度值;B1,样品溶液吸光度值。
DPPH自由基清除能力参考HARA等[14]的方法测定。分别吸取0.2 mL发酵前后蜂花粉乙醇提取稀释液,加入0.04 mg/mL的DPPH乙醇溶液5 mL,混匀后在室温避光反应30 min,于517 nm处测定吸光度值。DPPH自由基清除率的计算如公式(2)所示:
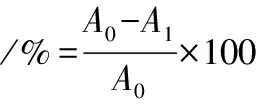
(2)
式中:A0,0.2 mL 95%乙醇溶液代替样品吸光度值;A1,样品溶液吸光度值。
1.3.7 抗炎活性的测定
参考HAN等[15]的方法,通过测量发酵前后蜂花粉对透明质酸酶催化反应的抑制作用间接评估其抗炎活性。A、B管中加入0.5 mL样品溶液,C、D管加入0.5 mL蒸馏水,A、C管加入0.5 mL透明质酸酶溶液(500 U/mL),B、D管加入0.5 mL醋酸缓冲液(pH 5.6,0.1 mol/L),37 ℃保温20 min,各管加入100 μL 2.5 mol/L的CaCl2溶液,37 ℃保温20 min,A、C管加入0.5 mg/mL透明质酸钠盐0.5 mL,B、D管加入0.5 mL醋酸缓冲液,37 ℃静置反应40 min,各加入0.5 mL蒸馏水、0.1 mL 5 mol/L NaOH溶液、0.5 mL乙酰丙酮溶液,沸水浴15 min、冰浴10 min、室温10 min后加入1 mL P-DAB显色剂,加无水乙醇定容至8 mL,混匀室温放置30 min后于530 nm处测定吸光度值,以去离子水作空白,透明质酸酶抑制率根据公式计算于530 nm处测定吸光度值,透明质酸酶抑制率的计算如公式(3)所示:
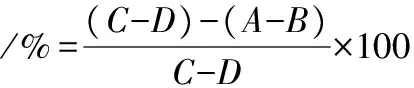
(3)
式中:A、B、C、D分别为对应管在530 nm处的吸光度值。
1.3.8 蛋白质变性抑制实验
参考文献[16]的方法,稍作改动。2.8 mL、2%牛血清白蛋白(溶于pH 5.5、0.1 mol/L醋酸盐缓冲液中),于37 ℃保温20 min,加入一定量待测定样品,定容至5 mL,于70 ℃水浴20 min后迅速冷却至室温,于660 nm处测定样品吸光度,记为As。用蒸馏水代替待测样品作为对照组测定吸光度记为Ac。蛋白质变性抑制率的计算如公式(4)所示:
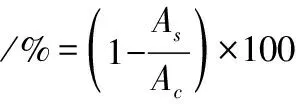
(4)
1.3.9 抑菌活性的测定
采用牛津杯法测定发酵前后蜂花粉抑菌活性。将100 μL OD值为0.3~0.36菌悬液用移液枪注入到已灭菌的琼脂培养基上,无菌条件下用玻璃棒涂布均匀,将5只无菌的牛津杯均匀放入培养皿中。吸取200 μL蜂花粉醇提液加入牛津杯中,3只平行,其余2只牛津杯中分别加入体积分数80%甲醇和无菌的9 g/L NaCl溶液。上述过程严格按照无菌操作进行,培养皿置培养箱37 ℃培养24 h。观察各皿抑菌效果,量取抑菌圈直径,结果取平均值[17]。
2 结果与分析
2.1 单因素试验结果
添加水量、发酵时间、发酵温度、乳酸菌接种量、菌液比例对发酵蜂花粉的影响如图1所示,乳酸菌利用蜂花粉中营养物质生长繁殖,其生长代谢情况直接影响了发酵蜂花粉的感官、理化特性和有益菌数。
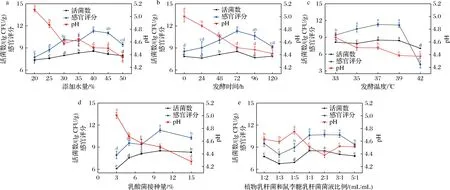
a-添加水量;b-发酵时间;c-发酵温度;d-发酵菌接种量;e-植物乳杆菌和鼠李糖乳杆菌菌液比例
2.1.1 添加水量的确定
水分是发酵中影响微生物代谢活动的一项重要因素。由图1-a可以看出,当加水量为40%~45%时,蜂花粉感官评分较高,pH适宜,且加水量为40%时,发酵蜂花粉活菌数最高。但加水量>40%后,由于蜂花粉营养成分被稀释,发酵蜂花粉感官特性变差,活菌数量也逐渐减少,故确定蜂花粉的最佳添加水量为40%。
2.1.2 发酵时间的确定
图1-b显示,发酵蜂花粉的pH随着发酵时间的延长呈现先降低后稳定的趋势,到72 h后趋于稳定,活菌数和感官评分随着发酵时间先升高,发酵时间超过72 h后,活菌数和感官评分却明显降低。这主要是因为发酵时间短,活菌数含量低、酸度低,使发酵的特殊风味还未形成;发酵时间过长时,产酸多、酸味重,且可供发酵的营养物质有限,活菌数和感官评分也会明显下降[18]。
2.1.3 发酵温度的确定
由图1-c可以看出,当发酵温度为35~39 ℃时,发酵蜂花粉感官评分没有显著差异,均保持较高水平,发酵温度为37 ℃时,活菌数最高,为8.52 lg CFU/g。发酵温度较低时,蜂花粉发酵不充分,苦味明显;发酵温度过高时,不利于乳酸菌生长,蜂花粉色泽由金黄色变为褐色,且会产生刺激性气味,严重影响发酵蜂花粉感官品质,因此,蜂花粉发酵温度选择37 ℃为宜。
2.1.4 乳酸菌接种量的确定
乳酸菌的接种量对发酵蜂花粉的发酵程度、口感和风味会产生一定的影响,由图1-d可知,当乳酸菌接种量为10%时,油菜蜂花粉活菌数较多,感官评分较高,pH适宜,此时发酵蜂花粉酸甜适中。接种量太低会使蜂花粉发酵缓慢,乳酸菌不能充分利用其营养成分,产酸低,口感差,且易造成杂菌污染;乳酸菌浓度高,会使蜂花粉偏酸,且接种量太高会增加经济成本,因此,菌接种量应该选择10%。
2.1.5 菌液比例的确定
由图1-e可知,不同的菌液比例(植物乳杆菌∶鼠李糖乳杆菌)对蜂花粉的感官评分、活菌数和pH具有显著影响。当植物乳杆菌∶鼠李糖乳杆菌为1∶1、2∶1时,活菌数和感官评分达到较高值,分别为8.52、8.50 lg CFU/g和10.63、10.70分。实验结果表明,当植物乳杆菌接种过量或者鼠李糖乳杆菌接种量较多,都会影响蜂花粉的发酵,当菌液比例为2∶1时,能达到较好的发酵结果。
2.2 正交试验设计结果
正交试验设计结果见表3。
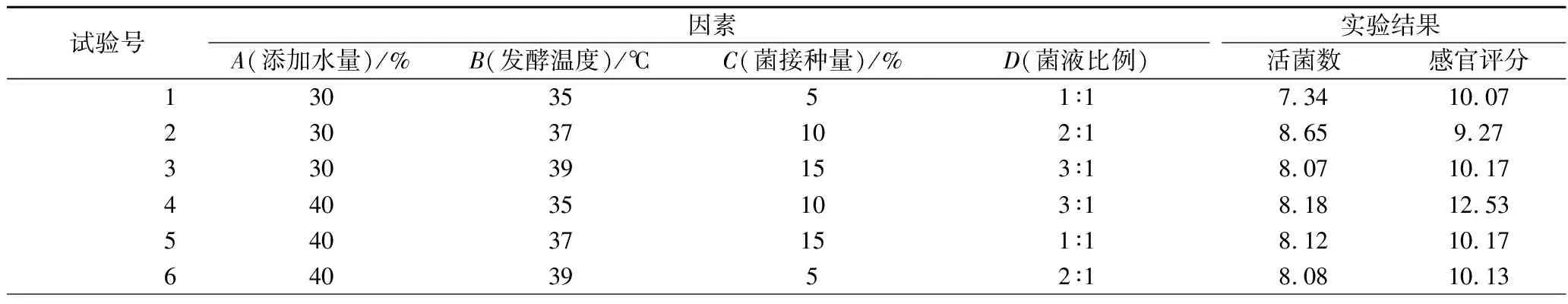
表3 正交试验设计结果Table 3 Orthogonal design results
由表3可知,通过正交设计优化乳酸菌发酵工艺参数,由极差分析可以看出,对发酵蜂花粉活菌数的影响由大到小的顺序为添加水量>发酵温度>菌液比例(植物乳杆菌∶鼠李糖乳杆菌)>乳酸菌接种量,发酵最优水平为A3B2C2D2。对感官评分的影响由大到小的顺序为菌液比例(植物乳杆菌∶鼠李糖乳杆菌)>添加水量>发酵温度>乳酸菌接种量,发酵最优水平为A2B1C2D3。由于4个因素对于发酵蜂花粉影响程度不一致,导致其最优方案也不同。因素A对于乳酸菌活菌数而言,取A3(50%)较好,但是取A3时,因为加水量较多,感官评分较低,因此从感官角度应该选择A2。因素B是2个指标中较重要的因素,从活菌数来说取B2(37 ℃)最好,但取B2时感官分数低,由于因素B2对乳酸菌活菌数的影响大于对感官的影响,因此选择B2。因素C对于2个指标都是取C2(10%)好;因素D从感官角度出发,应取D3(植物乳杆菌∶鼠李糖乳杆菌=3∶1),但对活菌数而言取D2好,由于因素D3对感官评分的影响大于对活菌数的影响,因此选择D3。综合来说,油菜蜂花粉发酵工艺的最佳组合为A2B2C2D3,即添加水量40%,发酵温度37 ℃,乳酸菌接种量10%,植物乳杆菌与鼠李糖乳杆菌菌液比例为3∶1。
2.3 验证实验
添加水量40%,发酵温度37 ℃,乳酸菌接种量10%,植物乳杆菌∶鼠李糖乳杆菌=3∶1时,油菜蜂花粉发酵72 h后,发酵蜂花粉的乳酸菌活菌数为8.37 lg CFU/g,感官评分为11.79,优于其他实验组。
2.4 发酵对油菜蜂花粉营养成分和生物活性成分的影响
根据最优发酵条件完成油菜蜂花粉的发酵,其营养和生物活性成分的变化见表4,发酵后蜂花粉的水溶性蛋白含量降低,为2.24 g/100 g,可能是发酵过程中乳酸菌将蜂花粉中大分子的蛋白质降解为小分子的多肽和氨基酸。

2.5 发酵对油菜蜂花粉抗氧化活性的影响
由表5可知,发酵后油菜蜂花粉抗氧化活性显著增强(P<0.05),发酵后总抗氧化能力为0.29 mmol FeSO4/g,是发酵前的1.26倍。发酵后油菜蜂花粉对DPPH自由基清除率、Fe2+螯合率分别为68.79%、76.56%,较发酵前分别提高了10.49%、23.19%。孙旭等[7]研究发现,茶花粉经乳酸菌发酵后对自由基的清除能力提高了28.73%;类似的研究如MENG等[23]使用植物乳杆菌和嗜酸乳杆菌发酵枇杷汁后发现其抗氧化活性也显著增加。总体来看,抗氧化活性的变化与多酚类物质的变化趋势相一致,当发酵的菌种合适时,这些物质不但不会影响微生物,反而会被微生物代谢成生物活性更高且利于人体吸收的小分子物质。此外,某些乳酸菌会产生胞外酶,使酚类物质之间实现相互转化,从而改变其抗氧化活性[24]。
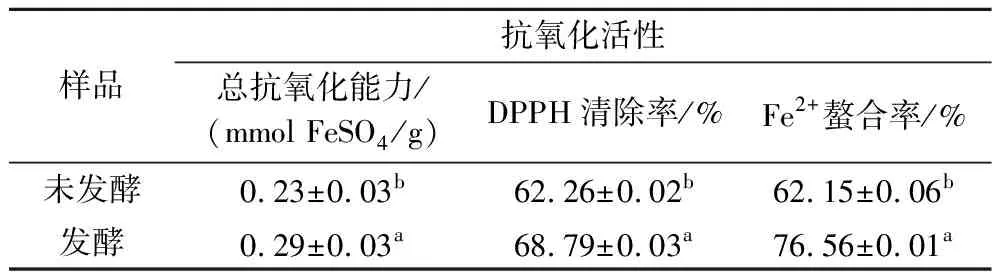
表5 发酵对油菜蜂花粉抗氧化活性的影响Table 5 Effect of fermentation on antioxidant activity of rape bee pollen
2.6 发酵前后抗炎活性变化
透明质酸酶可降解细胞质基质中的透明质酸,并且具有较低的降解其他直链糖胺聚糖的能力[25],与炎症、过敏具有很强的相关性[16]。因此,透明质酸酶活性抑制试验是评价体外抗炎活性的一项指标。油菜蜂花粉发酵前后抗炎活性结果如图2所示。发酵后的蜂花粉对透明质酸酶活性抑制率为46.08%,较发酵前的13.73%提高了3.36倍。有研究证实多酚类、黄酮类可以有效抑制透明质酸酶活性,而且乳酸菌还具有生物转化作用,可能是通过代谢增加了某种具有生物活性物质的含量,从而增强了其抗炎活性[26]。炎症被认为是一种主要的生理防御机制,有助于身体保护自身免受不同的刺激[27]。组织蛋白的变性是炎症和关节炎疾病的原因之一,因此抑制蛋白质变性被认为是衡量体外抗关节炎活性的重要指标[28]。比较发酵前后的样品抑制蛋白变性结果发现,发酵可以有效提高蜂花粉的抗炎活性。发酵后的蜂花粉抑制蛋白质变性较发酵前提高了24.65%,导致这一结果可能的原因是乳酸菌发酵积累的代谢产物具有一定的抗炎作用,或者蜂花粉经发酵后,生物活性物质释放,进一步促进了其抗炎作用。
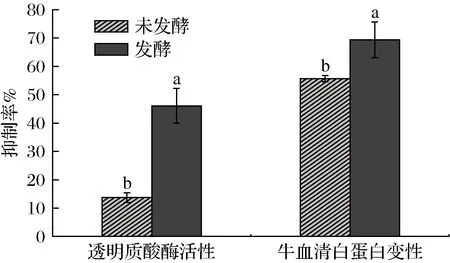
图2 透明质酸酶活性和牛血清白蛋白变性抑制实验结果Fig.2 Experimental results of hyaluronidase activity and denaturation inhibition of bovine serum albumin
2.7 发酵对油菜蜂花粉抑菌活性的影响
发酵前后蜂花粉对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌3种食源性微生物的抑制活性试验结果见表6。

表6 发酵对3种食源性微生物抑菌活性的影响Table 6 Effect of fermentation on bacteriostatic activity of three food borne microorganisms

3 结论
研究结果表明,油菜蜂花粉发酵的最佳条件为添加水量40%,发酵温度37 ℃,乳酸菌接种量10%,植物乳杆菌∶鼠李糖乳杆菌=3∶1。在最优条件下,发酵72 h后的蜂花粉色泽呈金黄色,酸甜适宜,具有轻微香气,活菌数为8.37 lg CFU/g,感官评分为11.79。而且发酵油菜蜂花粉总酚、总黄酮的含量提高了16.09%、51.02%;还原糖含量和蛋白质含量显著降低,分别为43.75、2.24 g/100 g。油菜蜂花粉经发酵后,总抗氧化能力为0.29 mmol FeSO4/g,是发酵前的1.26倍;DPPH自由基清除率、Fe2+螯合率较发酵前分别提高了10.49%、23.19%。对透明质酸酶活性抑制率从发酵前的13.73%提高至46.08%,抑制蛋白质变性的能力提高了24.65%。且发酵后的油菜蜂花粉对食源性微生物抑菌活性显著增强。综上所述,乳酸菌发酵不仅能改善油菜蜂花粉的感官品质,也可增加其内容物的溶出,且抗氧化、体外抗炎和抑菌活性有所增强。因此,发酵可作为增强油菜蜂花粉功能和开发油菜蜂花粉健康品的重要加工方法之一,为蜂花粉的深加工提供进一步理论指导。
