表没食子儿茶素没食子酸酯通过PI3K/Akt 通路抑制胰腺癌细胞糖酵解的实验研究
2023-10-18胡立娟
高 静,王 丰,胡立娟
胰腺癌是消化系统常见的恶性肿瘤,因早期症状不明显以及发生转移较早等特点,80%的患者在确诊时已错过了接受根治性手术的时机,加之胰腺癌对放化疗不敏感,其5 年生存率低于10%,患者确诊后的平均生存期短,其发病率与死亡率相近[1]。在我国,胰腺癌的发病率和死亡率呈上升态势[2]。代谢重编程是胰腺癌的主要特征之一。早在上世纪二十年代,德国生化学家瓦博格发现肿瘤细胞与正常细胞能量代谢的方式不同[3]。正常细胞靠氧化磷酸化获取能量,而肿瘤细胞即使在氧气充足的情况也利用糖酵解获取能量,肿瘤细胞的这种特性被称为瓦博格效应(Warburg effect)。瓦博格效应不仅能为肿瘤细胞提供能量,糖酵解途径中的三碳化合物还为肿瘤细胞内大分子的生物合成提供了物质基础,促进肿瘤的生长。
表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是绿茶的主要成分,具有抗病毒、抗氧化、抗衰老、抗肿瘤等功效。研究表明,EGCG 可以抑制肿瘤进展的多种生物学过程,包括抑制细胞增殖、侵袭、转移及血管生成,其还诱导细胞的凋亡和细胞周期阻滞[4]。胰腺癌细胞高表达胰岛素受体和胰岛素样生长因子I 受体,当两受体被激活后,可通过下游磷脂酰肌醇3 激酶(PI3K)-Akt 和细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)两条信号通路进行细胞信号转导。PI3K-Akt信号通路参与细胞增殖、分化、凋亡的调控,其异常激活通常与恶性肿瘤的形成密切相关,也与肿瘤细胞的侵袭和转移相关。研究表明EGCG 可抑制胰岛素受体和胰岛素样生长因子I 受体的激活[5]。作为谷氨酸脱氢酶的抑制剂,其可通过抑制谷氨酰胺代谢通路从而抑制癌细胞的生长[6]。EGCG 能否通过抑制PI3K-Akt 通路影响胰腺癌细胞的生长和瓦博格效应目前尚不清楚。本研究以人胰腺癌PANC-1 细胞为研究对象,旨在观察EGCG 对胰腺癌细胞增殖和糖酵解的影响。
1 材料与方法
1.1 材料 人胰腺癌细胞系PANC-1(#CC2401)购自中国科学院上海细胞库。DMEM 培养基、胎牛血清(FBS)和胰蛋白酶购自美国Gibco 公司,无葡萄糖无酚红DMEM(#D6540)和青霉素链霉素购自北京索莱宝科技有限公司,EGCG(#E4143)购自美国Sigma 公司。CCK8 增殖毒性检测试剂盒(#C0037)购自北京碧云天公司。葡萄糖乳酸检测试剂盒购自南京建成生物技术有限公司,磷酸化PI3K 和Akt 抗体购自美国CST 公司,己糖激酶-2(HK-2)、磷酸果糖激酶(PFK)、乳酸脱氢酶(LDH)和β-actin 抗体购自美国Sanata Cruz 公司,偶联辣根过氧化物酶(HRP)的山羊抗兔抗体和山羊抗小鼠抗体购自上海良森生物科技有限公司,小鼠抗山羊抗体购自北京中杉金桥生物技术有限公司。增强化学发光底物检测试剂盒购自美国Perkin Elmer 公司。
1.2 方法
1.2.1 细胞培养 将人胰腺癌PANC-1 细胞用含10% FBS、100 U/mL 青霉素和100 mg/L 链霉素的DMEM 高糖培养基培养于37 ℃,5%CO2的培养箱中。
1.2.2 CCK8 法检测EGCG 对PANC-1 细胞增殖的影响 用0.25%胰酶将PANC-1 细胞消化成单细胞悬液,以每孔5×103个细胞接种于96 孔板,置于37 ℃,5% CO2的培养箱中培养24 h。用不含血清的DMEM 稀释EGCG,使其终浓度分别5、25、50、100、200 μmol/L,96 孔板中每孔加入100 μL 不同浓度的EGCG 溶液,每个浓度5 个复孔,阴性对照组加入不含血清的DMEM,于37 ℃、5%CO2培养箱中分别孵育24、48、72 h。到达孵育时间后,于96 孔板中每孔加入10 μL CCK8 溶液,继续培养2 h 后,于酶标仪中在450 nm 处测定各孔的光密度(OD)值。按以下公式计算细胞增殖抑制率(%)=(1-实验孔OD值/对照孔OD 值)×100%。
1.2.3 葡萄糖乳酸试剂盒检测EGCG 对PANC-1细胞糖酵解的影响 将PANC-1 细胞经胰腺消化制成单细胞悬液后,均匀接种于6 孔板,待细胞融合密度达到90%以上,将无葡萄糖无酚红DMEM配置成含11.1 mmol/L 葡萄糖的溶液,再用此溶液配制不同浓度的EGCG,将终浓度分别为5、13、25、50、100 μmol/L 的EGCG 孵育PANC-1 细胞6 h,对照组为含11.1 mmol/L 葡萄糖的无酚红DMEM 溶液,收集细胞上清液,根据葡萄糖乳酸检测试剂盒说明书的使用说明,检测上清液中葡萄糖乳酸的量。因为细胞上清液中不含乳酸,所以检测到的乳酸含量即为细胞糖酵解代谢产生的乳酸量,因细胞上清液中初始葡萄糖浓度为11.1 mmol/L,而本研究检测到的葡萄糖是细胞消耗葡萄糖后的剩余量,故细胞消耗的葡萄糖需用原始葡萄糖减去检测到的葡萄糖量,即为细胞消耗的葡萄糖。为抵消细胞群落大小不一可能给实验结果带来的影响,收集同组细胞,检测细胞裂解后的蛋白浓度,用细胞蛋白总量去校正葡萄糖消耗和乳酸生成。
1.2.4 Western blot 法检测EGCG 对糖酵解酶和磷酸化PI3K/Akt 表达的影响 将PANC-1 单细胞悬液接种于6 孔板,细胞密度达90%以上,用不含血清的DMEM 培养基配制终浓度分别为5、13、25、50、100 μmol/L 的EGCG,于37 ℃,5% CO2的培养箱中孵育细胞6 h,裂解细胞,收集蛋白。取20 μg蛋白进行SDS-PAGE 电泳,用Western blot 法测糖酵解酶和磷酸化PI3K/Akt 的表达。一抗4 ℃孵育过夜,二抗室温孵育2 h,以β-actin 作为内参,增强化学发光底物试剂盒检测曝光,结果应用NIH Image J软件进行分析。
1.3 统计学方法 数据用SPSS 22.0 行统计学分析,符合正态分布的计量数据用均数±标准差(±s)表示,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 EGCG 对PANC-1 细胞增殖的抑制作用CCK-8 结果显示,不同浓度的EGCG 均能有效抑制PANC-1 细胞的增殖,且抑制作用随着EGCG 浓度的升高和作用时间的延长而增强,呈现出剂量依赖性和时间依赖性(P<0.05),见表1。
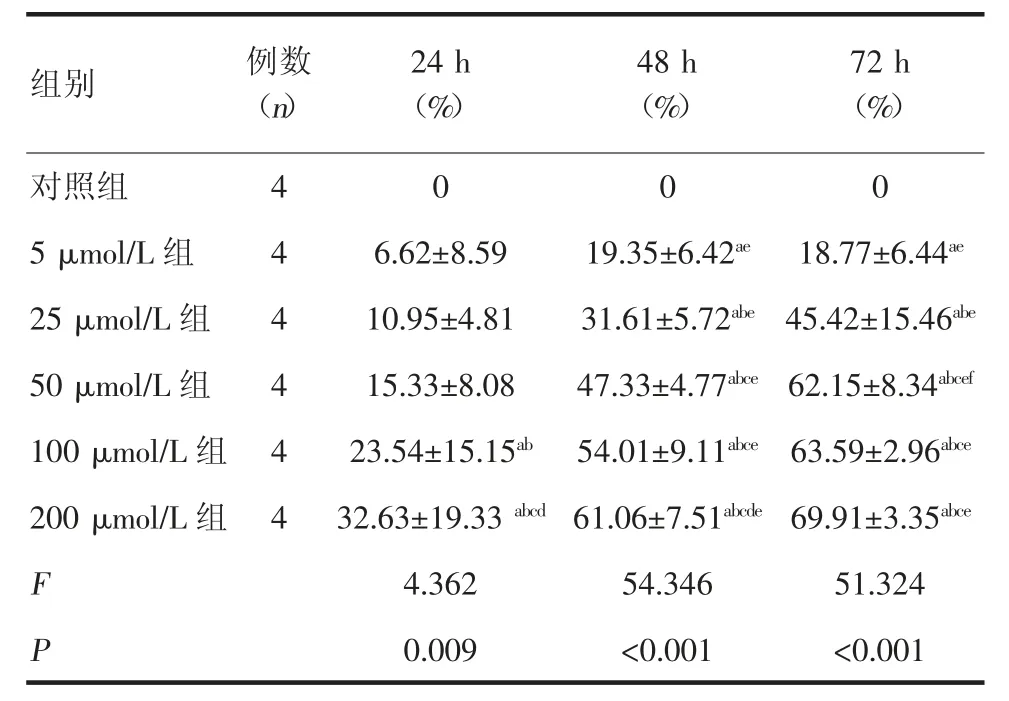
表1 EGCG 对PANC-1 细胞增殖抑制率的影响
2.2 EGCG 对PANC-1 细胞糖酵解的影响 胰腺癌PANC-1 细胞在6 h 培养条件下的葡萄糖消耗量为(34.66±9.54)nmol/μg 蛋白,EGCG 作用6 h 后在低浓度条件下可减少细胞葡萄糖的消耗,但无统计学差异。随着EGCG 浓度升高,达到50 μmol/L 时,EGCG抑制PANC-1 细胞葡萄糖消耗,且具有统计学差异(P<0.05),EGCG 对乳酸生成的影响亦是在低浓度时无统计学差异,达到50 μmol/L 时,EGCG 对乳酸生成的抑制具有统计学差异(P<0.05),见表2。
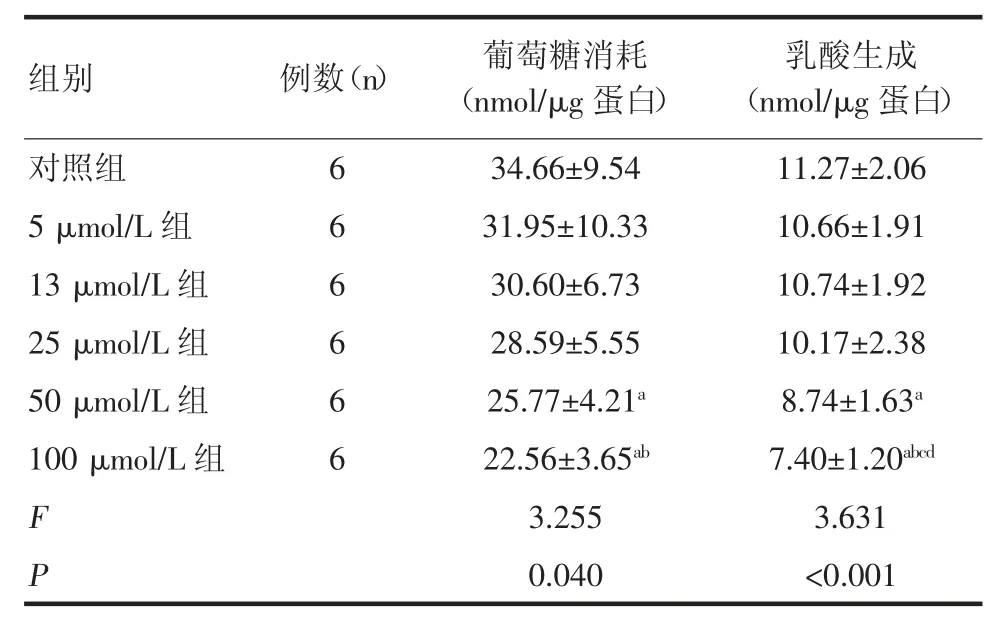
表2 EGCG 对PANC-1 细胞葡萄糖消耗和乳酸生成的影响
2.3 EGCG 对PANC-1 细胞糖酵解酶和磷酸化PI3K/Akt 表达的影响 EGCG 抑制了糖酵解酶HK-2、PFK 和LDH 的表达,浓度达到25 μmol/L 时具有统计学意义,且随着EGCG 浓度升高,抑制作用越明显。EGCG 作为胰岛素受体和胰岛素样生长因子I 受体的抑制剂,可抑制受体表达及受体后信号通路的激活,本研究结果显示EGCG 抑制了磷酸化PI3K 和Akt 的表达,且其抑制作用具有剂量依懒性,即EGCG 浓度越高,抑制作用越明显,见图1和表3。

图1 EGCG 对糖酵解酶和磷酸化PI3K/Akt表达的影响

表3 EGCG 对糖酵解酶和磷酸化PI3K/Akt 表达的影响
3 讨论
EGCG 是绿茶中含量最多的茶多酚,也是绿茶儿茶素类的主成分。EGCG 是一类既亲水又亲脂的两性分子,可经口服、灌胃、静脉注射等不同途径进入血液循环,其吸收程度会因给药途径不同而有所差异。在大鼠体内研究中,EGCG 静脉注射的相对生物利用度高于灌胃给药,而在小鼠体内多数为灌胃给药,肠黏膜是EGCG 浓度最高的部位,且EGCG的生物利用度明显高于大鼠。EGCG 在体内经历了广泛的生物转化,主要包括甲基化、硫酸化和葡萄糖醛酸化反应,其排泄方式因给药途径不同及作用对象的不同而有所差异。小鼠灌胃EGCG 后主要通过粪便排泄,而大鼠静脉注射EGCG 后主要通过胆汁排泄。EGCG 具有广泛的抗炎、抗氧化、抗纤维化、抗重塑和组织保护特性,有助于治疗各种疾病,特别是癌症、神经、心血管、呼吸和代谢疾病[7]。EGCG长期以来被认为可以抑制多种类型的肿瘤[8-10],EGCG 可直接作用于肿瘤细胞,但因其在体内的吸收、分布、代谢、排泄会影响生物利用度及进一步的功能发挥,因此目前主要通过化学修饰法和酶法修饰提高EGCG 的脂溶性或利用脂质体和纳米制剂提高稳定性,进而改善其生物利用度。最近的研究表明EGCG 对皮肤癌、肺癌、乳腺癌、结肠癌、肝癌、胃癌和前列腺癌有潜在的化疗疗效[11-12]。由于EGCG与细胞内信号通路和核转录因子的多种相互作用,其可抑制肿瘤进展的多种生物学过程,包括细胞增殖和肿瘤生长、侵袭、转移以及血管生成,并诱导转化细胞的凋亡和细胞周期阻滞[13-14]。EGCG 还可抑制血管内皮生长因子受体、血小板衍生生长因子受体、胰岛素受体和胰岛素样生长因子I 受体的激活,根据不同的细胞环境,作用于不同的靶点。本研究探索了EGCG 单独作用于胰腺癌PANC-1 细胞,观察其对细胞增殖的抑制作用,结果显示EGCG 对PANC-1 细胞增殖的抑制作用具有剂量和时间依赖性。
肿瘤细胞与正常细胞不同,它们具有迅速应对缺氧和低营养条件的适应性反应,由此引起的肿瘤细胞能量代谢变化的现象,称为代谢重编程[15]。肿瘤细胞的代谢重编程主要表现在两个方面:糖代谢异常和谷氨酰胺代谢异常。Warburg 效应在包括胰腺癌在内的许多肿瘤中都存在,与正常细胞相比,肿瘤细胞需摄取更多的葡萄糖,并通过糖酵解将其转化为乳酸,糖酵解为肿瘤细胞的生长和分裂提供能量和大量的中间代谢物,其产物乳酸作为代谢底物可被细胞摄取再次利用[16]。多种肿瘤细胞均存在大量消耗并利用谷氨酰胺的代谢特点,表现出“谷氨酰胺依赖”的现象[17]。谷氨酰胺进入三羧酸循环,为细胞提供中间代谢产物和能量,代谢产物是合成嘌呤、嘧啶核苷酸、脂肪酸和其他氨基酸的碳源和氮源。EGCG 作用于谷氨酰胺代谢途径的关键酶即谷氨酸脱氢酶,用于在葡萄糖剥夺或糖酵解抑制期间杀死谷氨酰胺上瘾的癌细胞[18]。研究表明PI3K-Akt信号通路在人类肿瘤谱中普遍失调,该通路可调节肿瘤细胞的增殖和存活,并与肿瘤的代谢重编程密切相关。本研究探索了EGCG 能否通过PI3K-Akt信号通路抑制胰腺癌细胞的糖酵解,结果显示EGCG 达到50 μmol/L 时可抑制胰腺癌PANC-1 细胞的糖酵解,随着浓度升高,抑制作用越明显,EGCG 抑制了糖酵酶HK-2、PFK 和LDH 的表达,同时抑制了磷酸化PI3K 和Akt 的表达。
综上所述,EGCG 能抑制胰腺癌细胞的增殖和糖酵解,其作用机制可能是通过抑制PI3K/Akt 通路实现。
