基于氧化石墨烯的无酶循环放大荧光信号法检测DNA
2023-10-18肖雪,龙磊,左芳
肖 雪,龙 磊,左 芳
(西南民族大学化学与环境学院化学基础国家民委重点实验室,四川 成都 610041)
DNA 作为生物体内储藏遗传信息的主要分子[1],对其快速准确的分析在疾病诊断、基因治疗和分子医学等研究中至关重要,与疾病相关的DNA 通常只在生物提取物中以微量存在,因此,建立快速灵敏的方法来分析特定序列的DNA 具有重要作用.基于此,研究者们已开发大量DNA 检测方法,如:比色分析法[2-4]、电化学分析法[5-6]、表面增强拉曼散射法[7-8]、荧光分析法[9-11],在以上分析方法中,荧光法具有易于操作、耗时短、检测限低等优势[3,10],因此,在检测DNA 方面具有较大的应用价值.
氧化石墨烯(graphene oxide,GO)是一种具有优异的光电性质的二维碳纳米材料,其可修饰性、水分散性强,在一定距离内能猝灭荧光基团的荧光,因此,是优良的荧光猝灭剂[12-13].此外,GO 与单链DNA(single stranded DNA,ssDNA)和双链DNA 或折叠良好的DNA 之间的结合力表现出明显的差异,因此,GO 能特异性识别核酸单双链[14-15].基于以上性质,在荧光生物检测体系中GO 已被广泛地作为荧光猝灭基底实现了对癌症标志物、金属离子、生物毒素等的分析检测[16-20].如Yang 等以GO 作为荧光猝灭剂构建荧光生物传感平台实现了ssDNA 的检测,在该研究中,在无靶物DNA 的空白组,与靶物序列互补的探针DNA 直接附着在GO 表面,探针上荧光基团的荧光被猝灭,在存有靶物DNA 的检测组,靶物与探针杂交形成双链,探针链远离GO,荧光信号增强,通过加入靶物前后体系荧光信号差值可实现靶物DNA 的定量分析[21].该设计中探针链直接吸附在GO 表面,两者间具有较强的相互作用力,结合靶物后不易从GO 表面释放,获得较低的检测灵敏度.Ihara 等设计一条“capture DNA”使探针DNA 与GO 不直接相连,加入待测物后通过链置换反应探针链更易从GO 上脱离,以此提高检测灵敏度[22].此外,为改善加入靶物后探针不易从GO 上释放的问题,我们在之前的研究中设计了一种发卡结构的荧光探针,使探针“部分”与GO 相连以提高检测灵敏度[20].以上方法中靶物与探针为1∶1反应,灵敏度低,为检测灵敏度的进一步提高,研究者们使用生物酶来复制目标或循环利用靶物,如重组酶聚合酶扩增放大[23]、聚合酶链置换放大[24]、核酸外切酶放大[25-26].但这些方法中用到的生物酶通常具有不稳定,成本高,反应条件要求严格等缺点.因此,发展无酶信号放大方法具有重要意义.近年来,一种非酶DNA 电路发卡组装,催化发卡结构组装(catalyzed hairpin assembly,CHA)[27-28],可循环放大检测信号策略,已在核酸扩增反应的末梢发挥放大和介导信号的重要作用[29-30].
本研究利用CHA 循环放大信号,结合链置换反应提高基于GO 的荧光法的检测灵敏度以实现ssDNA 的灵敏检测.在CHA 中,存在一对核酸发卡结构,加入启动子前,两个发卡结构不相互作用,输入启动子单链核酸后发卡结构被打开并催化形成双链,由于一条启动子链可以触发多个发夹结构的级联杂交,因此可实现循环放大信号.本研究以靶物ssDNA 作为CHA 启动子,加入ssDNA 后引发无酶信号放大,随后,GO 上荧光探针与CHA 反应产生的双链通过链置换反应结合并从GO 上释放.因此,通过加入靶物ss-DNA 前后荧光信号差可实现ssDNA 的灵敏检测.
1 实验部分
1.1 仪器
Dual-FL 荧光光谱仪(HORIBA,日本)用于测定荧光,DF-101S 恒温水浴锅(巩义市予华,中国)用于控制反应温度,AR224CN 电子天平(奥豪斯,中国)用于称量,KQ5200E 超声波仪(昆山市超声,中国)用于分散溶液.
1.2 试剂
DNA 序列于生工生物技术有限公司购买(上海,中国),详见表1.GO 于先丰纳米科技有限公司购买(南京,中国),其他试剂于成都科龙化工试剂厂购买(成都,中国).
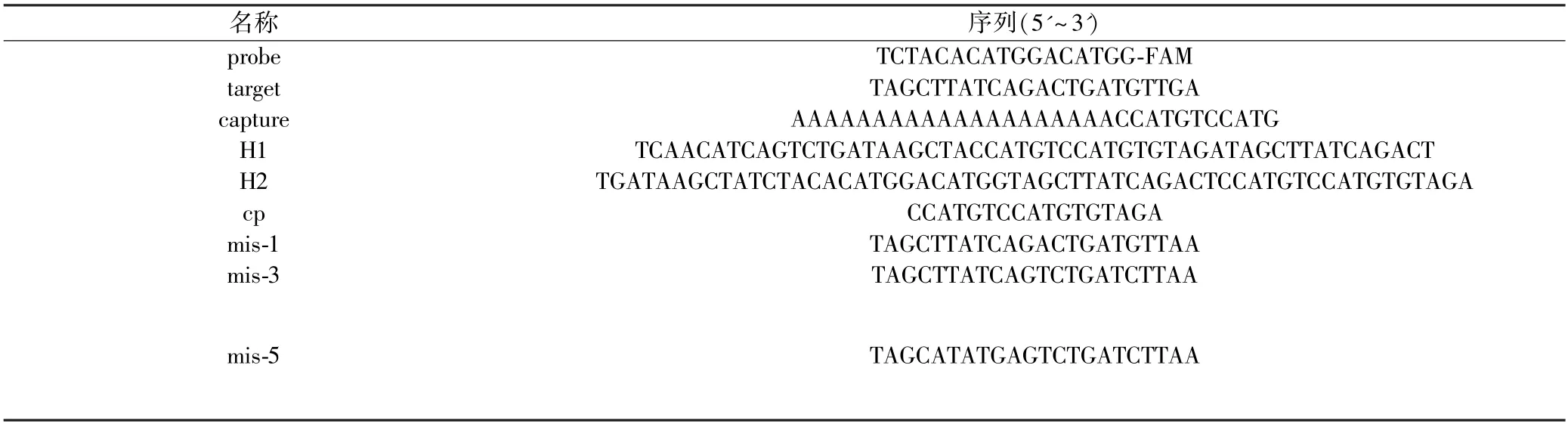
表1 DNA 序列Table 1 DNA sequence
1.2 实验方法
溶液1:probe、capture、pH 为7.0 的磷酸缓冲液(20 mM MgCl2、1 M NaCl)和超纯水,漩涡混匀,先在室温下孵育30 min,而后加入GO 溶液,再室温反应30 min.
溶液2:H1、H2、target、pH 为7.0 的磷酸缓冲液(20 mM MgCl2、1 M NaCl)和超纯水,漩涡混匀,室温孵育30 min.
将以上溶液1 和溶液2 混合,37 ℃反应30 min,测定荧光强度(参数设置:激发波长为480 nm,发射波长为521 nm).
2 结果与讨论
2.1 检测原理及可行性分析
本文以ssDNA 为检测对象,如图1所示,probe DNA 通过capture DNA 单链部分与GO 耦合,荧光染料吸附在GO 表面,系统荧光为猝灭状态.通过该设计,既保证了荧光染料的荧光的有效猝灭,同时加入靶物后probe DNA 更易从GO 上释放,从而提高检测灵敏度.在CHA 循环体系中,包括H1 和H2 两个DNA 发卡结构,H1 和H2 碱基序列部分互补,当启动链不存在时,H1 和H2 分别在各自分子内部分杂交呈独立稳定状态;当加入作为启动链的target DNA 后,target DNA 与H1 通过链置换打开H1 的颈部形成target DNA-H1 双链,而H1 未与target DNA 杂交的单链部分和H2 互补,因此,H1 和H2 随后形成更为稳定的双链.H1 和H2 杂交完成后,target DNA 被释放,游离状态的target DNA 又能激发新的H1 和H2 杂交,循环放大信号得以实现.最后,H2 未与H1 杂交的单链部分与probe DNA 杂交形成H1-H2-probe DNA 三链复合体, probe DNA 与GO 分离,荧光信号快速恢复.基于此,target DNA 的定量分析可以通过加入靶物前后体系荧光信号变化值实现.本文首先考察了加入GO、target DNA 前后传感系统荧光强度变化以验证该方案的可行性.如图2,未加入GO 时,系统荧光信号强,加入GO 后,由于capture DNA 与probe DNA部分杂交,修饰在probe DNA 上的荧光基团靠近GO表面,荧光基团与GO 间的荧光共振能量转移使系统荧光强度降低,而加入target DNA 后,probe DNA、H1和H2 杂交形成H1-H2-probe DNA 复合体,probe DNA远离GO,可检测到系统荧光强度升高.此外,引入与probe DNA 互补的DNA(cp DNA)后系统荧光强度变化如图2,加入与target DNA 相同浓度的cp DNA 后,荧光恢复微弱,因此CHA 可有效放大检测信号.

图1 检测原理图Fig.1 Detection schematic diagram
2.2 实验条件优化
为找到实验的最优条件,probe DNA、capture DNA、H1、H2 浓度被固定为50 nM,考察GO 浓度、加入target DNA 后反应温度及时间对检测信号的影响.
2.2.1 GO 浓度的优化
首先,对不同浓度的GO 对检测信号的影响进行研究.由图3(a)可知,GO 浓度逐渐增大时,加入target DNA 前后体系荧光信号都在减小,这是因为GO浓度越大,被吸附在GO 上的probe DNA 就越多,荧光信号被猝灭多,并且加入靶物后形成H1-H2-probe DNA 的三链复合物也越少,检测到的荧光信号就越弱.由图3(b)可知,GO 浓度为60 mg/mL 时,加入target DNA 前后系统的荧光信号差值达到最大(F0为未加入target DNA 时系统荧光强度,F 为加入target DNA 后系统荧光强度),所以在该方案中GO 最佳浓度确定为60 mg/mL.

图3 GO 浓度的优化(a)不同浓度的GO 加入target DNA 前后体系的荧光信号;(b)不同浓度的GO 对荧光信号差的影响Fig.3 The optimization of the GO concentration(a) Fluorescence intensity of the system with/without target DNA under different GO concentrations;(b) The influence of different concentrations of GO on the fluorescence signal changes
2.2.2 实验温度的优化
反应温度是影响DNA 间杂交的重要因素.因此,本研究考察了加入target DNA 后不同反应温度下体系荧光信号的变化.如图4,反应在37 ℃时,加入靶物前后荧光信号差明显高于常温下.所以将该方案中加入target DNA 后体系的反应温度确定为37 ℃.

图4 不同反应温度对荧光信号变化的影响Fig.4 The influence of different reaction temperatures on changes in fluorescence intensity
2.2.3 实验时间的优化
在优化完以上两个影响因素后,加入靶物后不同反应时间(10、30、50、70、90 min)对荧光信号变化的影响被考察.如图5,随着反应时间的增长,加入target DNA 后传感系统的荧光强度逐渐增大.这是因为当加入GO 时,荧光信号在极短的时间内被猝灭,而加入target DNA 后,H1-H2-probe DNA 的复合物逐步增多,使得整个体系荧光信号增强并最终趋于平稳.如图5所示,在反应30 min 后荧光信号差达到最大,因此,以30 min 作为最佳反应时间.
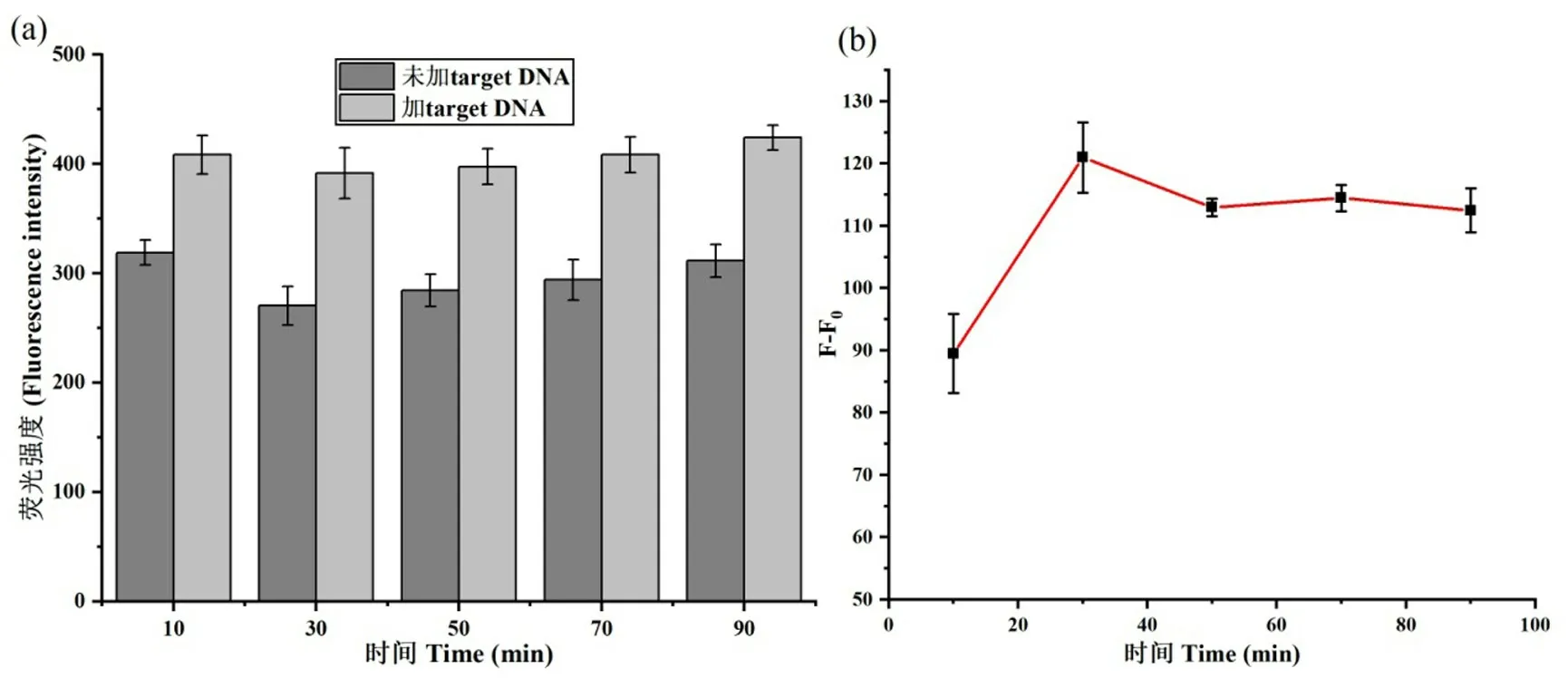
图5 反应时间的优化(a)不同反应时间下加入target DNA 前后体系荧光信号;(b)不同反应时间对荧光信号变化的影响Fig.5 The optimization of the reaction time(a) The fluorescence intensity of the system with/without target DNA under different reaction time;(b) The influence of different reaction times on fluorescence intensity changes
2.3 target DNA 的定量检测
为检验本文建立的方法是否可用于定量检测ss-DNA,在优化后的实验条件下,我们测定了加入不同浓度target DNA 后传感系统荧光信号的变化.如图6所示,target DNA 浓度在0.5~14 pM 范围内,检测体系F-F0(相同条件下,加入靶物前后系统荧光信号差)和target DNA 浓度呈良好的线性关系(线性方程F-F0=25.825c-0.901,相关系数R2=0.993),通过线性方程计算得该方法的检测限为0.055 pM.因此本方法可以实现ssDNA 的灵敏检测.
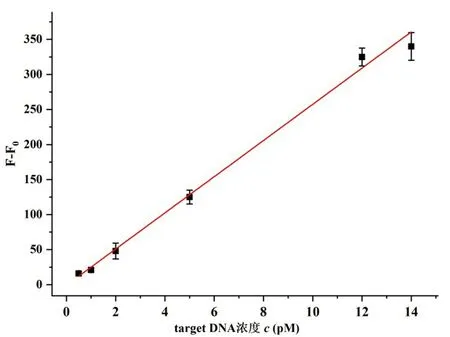
图6 荧光信号变化(F-F0)与target DNA(c)浓度的线性拟合图Fig.6 The linear relationship between fluorescence intensity changes(F-F0) and the target DNA concentration(c)
2.4 方法的选择性
最后,为考察本方法检测ssDNA 的特异性,研究了加入相同浓度的target DNA 及与靶物部分碱基错配的DNA(mis-1、mis-3、mis-5,与target DNA 分别为1个碱基错配、3 个碱基错配、5 个碱基错配,序列见表1.1)后系统荧光信号变化.实验结果如图7所示,加入target DNA 后系统产生的荧光信号变化显然强于具有碱基错配的mis-1、mis-3、mis-5 序列,因此该方法具有较好的选择性.此外,为考察该方案是否可用于实际样的检测,我们采用加标法测试了靶物DNA 在人体尿液中的回收率,实验结果表明(表2),靶物DNA 的回收率在90%~118%之间(n=3),该方法在实际应用中具有较高的回收率.
图7 不同碱基错配的DNA 序列对荧光信号的影响Fig.7 The influence of DNA sequences with different base mismatches on fluorescence signals

表2 人体尿液中ssDNA 的测定Table 2 Determination of ssDNA in human urine
3 总结
本文以GO 为荧光猝灭基底,结合链置换反应,利用CHA 循环放大信号构建了一种无酶信号放大荧光生物分子检测平台.在优化后的实验条件下,可定量灵敏检测ssDNA,线性范围为0.5~14 pM,检测限为0.055 pM.该检测方法方便快捷,可以广泛应用于生化分子分析和分子医学等领域,此外,通过改变DNA 探针分子的序列,该方法也可以用于检测microRNA、小分子和蛋白质等.
