硫辛酸对果蝇帕金森病模型神经元的作用及其机制*
2023-10-18熊江福张祥明石彩群张春林
熊江福, 张祥明, 石彩群, 张春林*
(贵州医科大学 基础医学院 生物学系, 贵州 贵阳 550025)
帕金森病(Parkinson's disease,PD)是一种常见的中老年人神经系统退行性疾病[1],主要病理学特征是多巴胺(dopamine,DA)神经元的丢失及残存神经元中路易小体(Lewy body,LB)的出现[2-3]。PD发生的具体机制尚不完全清楚,但研究表明PD的发生会伴有DA神经元中α-突触核蛋白(α-synuclein,α-syn)异常聚集、氧化应激、线粒体功能障碍等[4]。目前,临床上还没有针对PD病因的治疗药物,PD传统药物主要是DA制剂和DA受体激动剂,长期使用会出现剂末现象和异动症等严重副作用[5]。因此,寻找针对病因、疗效好、副作用少、成本低廉及能够对PD进行疾病修饰治疗(disease modification therapy,DMT)的药物在PD治疗中具有重要意义[6]。α-硫辛酸(α-lipoic acid, α-LA)是线粒体能量代谢的辅助因子[7],具有抗氧化作用,且能够透过血脑屏障对中枢神经系统具有保护作用[8]。研究显示,α-LA对6-OHDA以及鱼藤酮诱导的PD细胞模型的细胞活性、氧化应激损伤、线粒体功能障碍等具有显著的改善作用;此外,α-LA能够改善鱼藤酮诱导的PD模型大鼠的行为学,提高PD大鼠纹状体的DA含量,降低活性氧(reactive oxygen species,ROS)水平,保护线粒体功能[9-11]。异常表达、聚集的α-syn能通过自噬-溶酶体途径(autophagy-lysosome pathway,ALP)降解[12-14],α-LA除了具有显著的抗氧化作用外,其还能够上调细胞自噬水平,从而产生对细胞的保护作用[15-16]。果蝇是用于研究各种疾病的理想小型模式生物之一,过表达α-syn果蝇表现出上爬能力异常、DA神经元丢失、ROS水平上升、线粒体功能障碍等类似人类PD的病理学特征[17-18]。本实验利用过表达SNCA.A30P的PD果蝇模型,探讨分析α-LA对PD果蝇模型的行为学以及DA神经元的保护作用,检测α-LA对PD果蝇模型氧化应激水平、线粒体功能、自噬以及α-syn表达的影响,进一步分析α-LA的神经保护作用,并探索其降低α-syn聚集表达水平的细胞分子机制,为α-LA的临床治疗PD提供实验依据。
1 材料和方法
1.1 材料
1.1.1实验动物 果蝇23868(w*;UAS-2xEGFP;elav-GAL4)、8147(w*;UAS-SNCA.A30P;购自Blomington Drosophila Stock center)、工具果蝇(pin/cyo;T3/T6)、Atg5 RNAi(FBgn0029943)、Atg8a RNAi(FBgn0052672)果蝇(浙江大学昆虫所黄建华研究员惠赠)。
1.1.2试剂与仪器 α-LA(美国 Sigma),ROS、丙二醛(MDA)、谷胱甘肽(GSH)、超氧化物歧化酶(SOD)及三磷酸腺苷(ATP)检测试剂盒(南京 建成),兔源酪氨酸羟化酶(tyrosine hydroxylase,TH)抗体(美国 Invitrogen),鼠源GAPDH抗体(中国 康城),鼠源ACTIN抗体(美国 ABclonal),鼠源α-syn抗体(美国 Life Techmologies) ,鼠源NADH脱氢酶(泛醌)铁硫蛋白3(NDUFS3)抗体(英国 Abcam),鼠源自噬相关蛋白8a(autopahgy-related gene8a, ATG8a)抗体(美国 Santa Cruz Biotechnology),兔源自噬相关蛋白5(autopahgy-related gene5, ATG5)抗体(美国Novus Biologicals),羊抗兔二抗、羊抗鼠二抗(美国LI-COR公司),荧光羊抗兔二抗、antifade reagent(美国 Invitrogen);果蝇恒温培养箱(宁波江南仪器),组织细胞破碎仪(美国Next Advance),多功能凝胶成像系统(美国 Bio-Rad),高速冷冻离心机(金坛金城硕华仪器),低速离心机(湖南湘仪实验室仪器),恒温磁力搅拌器(金坛富华仪器),水浴箱、瞬时离心机、立式压力蒸汽灭菌器(金坛金城硕华仪器),微量加样器(德国 Eppendof),转膜仪、电泳仪(美国 Bio-Rad);Odyssey双色红外荧光成像系统(美国LI-COR),激光共聚焦显微镜(日本 Olympus)。
1.2 方法
1.2.1果蝇培养基配制 取1 L去离子水加热至100 ℃,取琼脂4.25 g、酵母26.5 g、玉米面50 g、白糖7.25 g、红糖60 g溶于300 mL水中搅拌均匀后加入1 L热水中,加入的同时继续搅拌直至再次沸腾;加入1.75 g对羟基苯甲酸甲酯,继续加热3~5 min,待冷却至70 ℃,加入丙酸6 mL搅拌,使用果蝇食物加料机将食物装入不同果蝇培养管中。在正常果蝇培养基的基础上,加入2.15 mmol/L α-LA制成加药果蝇培养基。
1.2.2果蝇杂交 将8147(UAS-SNCA.A30P)处女果蝇与23868(elav-Gal4)雄性果蝇置于同一果蝇瓶内,果蝇杂交的后代即是PD果蝇。根据果蝇产卵情况,2~3 d将果蝇倒入新的果蝇瓶内。本实验所使用的果蝇GAL4/UAS系统是一种转基因技术体系,其原理是利用特定的启动子或增强子,在果蝇神经元激活酵母转录激活子GAL4的表达,GAL4又以同样的方式引起GAL4反应元件UAS-SNCA.A30P的转录。只有将GAL4转基因品系果蝇与UAS-靶基因品系果蝇进行杂交,才可能产生表达靶基因的后代。UAS-SNCA.A30P和elav-Gal4分别与工具果蝇(pin/cyo,T3/T6)杂交,得到+/cyo;elav-GAL4/T6和UAS-SNCA.A30P/pin;+/T3,再将两品系杂交得到UAS-SNCA.A30P/cyo;elav-GAL4/T3,该品系最后分别与UAS-Atg5RNAi和UAS-Atg8aRNAi杂交最后得到Atg5 RNAi和Atg8a RNAi的PD果蝇。
1.2.3分组 以Elav-GAL4>UAS-SNCA.A30P果蝇品系作为模型(PD)组,Elav-GAL4果蝇品系作为对照(control)组,Elav-GAL4>UAS-SNCA.A30P果蝇品系培养于α-LA加药培养基中作为干预实验(LA)组;敲降Atg5(Atg5 RNAi)或Atg8a(Atg8a RNAi)后,Atg5 RNAi和Atg8a RNAi的PD果蝇培养于α-LA加药培养基中作为Atg5降低+LA组和Atg8a降低+LA组,挑选杂交后羽化0~2 d的雄性果蝇培养于不同培养基中,25 ℃培养箱中培养。
1.2.4果蝇寿命实验 为了研究α-LA对PD果蝇模型寿命的影响,control组、PD组以及LA组果蝇分别培养在含有不同果蝇食物的果蝇管中,收集不同组刚羽化的雄性果蝇各150只,每组3管,每管50只果蝇,25 ℃培养箱中培养,每3 d换新的果蝇食物并记录死亡果蝇数。
1.2.5果蝇上爬能力检测 取在不同培养基中培养的果蝇,二氧化碳麻醉,随机挑选20只放入20 cm长、15 cm宽的果蝇管中,室温放置30 min,让果蝇充分苏醒,在果蝇管距离管底8 cm处划线,轻轻敲击果蝇管底,使果蝇全部掉在管底,记录10 s内爬过8 cm处果蝇数,每组重复10次。上爬率(%)=爬过8 cm处果蝇数/总果蝇数×100%。
1.2.6果蝇脑部氧化应激指标(ROS、MDA、GSH、SOD)含量检测 取在不同培养基中培养25 d的不同组果蝇40只,PBS中取下果蝇脑部组织破碎,10 000 r/min离心20 min,取上清。BCA试剂盒检测蛋白浓度,2′,7′-二氯二氢荧光素(2′,7′-dichlorodihydrofluorescein,DCFH) 法检测ROS含量,5,5′-二硫代-双-(2-硝基苯甲酸)(5,5'-dithiobis-2-nitrobenoicacid,DTNB)法检测GSH含量,硫代巴比妥酸(thiobarbituric acid)法检测MDA含量,氯化硝基四氮唑蓝(nitrobluetetrazolium,NBT)法检测SOD含量。
1.2.7果蝇脑部PAL、PPM1/2、PPM3、PPL1、PPL2 PA神经元簇检测 显微镜下PBS中取解剖果蝇大脑,4%多聚甲醛中固定10 min,吸取固定液加入PBST洗3次,每次10 min,1%胎牛血清封闭1 h,PBST洗5 min,1∶1 000一抗孵育(24 h),PBST洗3次,每次10 min,1∶2 000二抗孵育(1.5 h),加1滴DAPI于载玻片上,将果蝇大脑放于其中,盖片。20倍镜下激光共聚焦显微镜观察结果,蓝色荧光为DAPI染色,标记细胞核作为背景;绿色荧光为TH染色,标记DA经元;最后两结果合并(MERGE)观察。
1.2.8果蝇脑部ATP含量检测 随机取各组40只果蝇,PBS中取头部,加入裂解液100 μL,组织破碎后4 ℃离心20 min,10 000 r/min,取上清。不透明96孔板中加入100 μL ATP检测工作液,室温放置5 min。在对应孔中加入样品20 μL,轻轻吹打混匀,间隔2 s后用化学发光检测仪检测相对光单位(RLU),根据标准曲线计算出样品中ATP浓度。
1.2.9Western blot检测果蝇脑部α-syn、NUDFS3、TH、Atg5、Atg8a蛋白表达水平 不同组果蝇随机取40只,剪取头部,提取蛋白,BCA法检测各组蛋白浓度,定量上样。SDS-PAGE胶电泳分离蛋白,将蛋白转印至PVDF膜,5%脱脂牛奶封闭1 h,分别加入1∶2 000的一抗。4 ℃孵育过夜,TBS洗3次,加1∶4 000的二抗室温孵育2 h,TBS洗3次后,Odyssey双色红外荧光成像系统扫描成像,Image studia软件分析结果。
1.3 统计学分析

2 结果
2.1 α-LA对PD果蝇寿命的影响
生存曲线分析结果表明,与contro组比较,contrL+LA组果蝇的生存率变化不明显,差异无统计学意义(P>0.05);与control组相比,PD组果蝇生存率明显降低(P<0.001);与PD组相比,LA组果蝇生存率延长(P<0.05)。见图1。以上结果提示α-LA可延长PD果蝇的寿命。
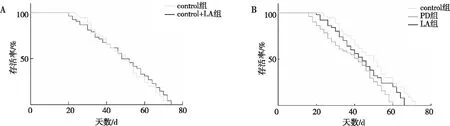
注:A为正常果蝇在加入α-LA培养基与未加入α-LA培养基寿命比较;B为PD果蝇在加入α-LA培养基与未加入α-LA培养基寿命比较。
2.2 α-LA对PD果蝇上爬能力的影响
与control组比较,control+LA组果蝇的上爬率无明显变化,差异无统计学意义(P>0.05)。在培养20 d后,与control组相比,PD组果蝇上爬率明显下降(P<0.001);与PD组相比,LA组果蝇上爬率明显升高(P<0.001)。见图2。提示α-LA可提高PD果蝇上爬能力。
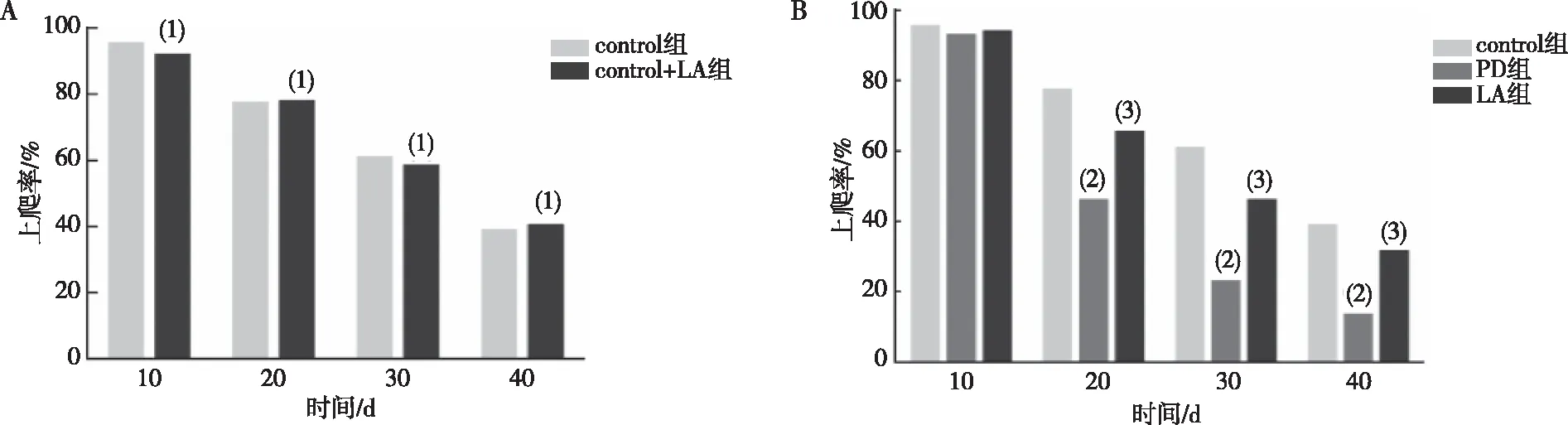
注:A为正常果蝇在加入α-LA培养基与未加入α-LA培养基不同时间点的上爬率比较;B为PD果蝇在加入α-LA培养基与未加入α-LA培养基不同时间点的上爬率比较; (1)与control组相比,P>0.05;(2)与control组相比,P<0.001;(3)与PD组相比,P<0.001。
2.3 α-LA对PD果蝇脑内α-syn表达水平的影响
与PD组比较,LA组果蝇脑内α-syn表达水平明显减少(P<0.01),见图3。以上结果提示α-LA可降低PD果蝇脑内α-LA的表达。
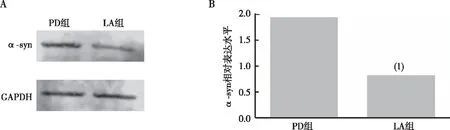
注:A、B分别为PD组与LA组果蝇脑部α-syn蛋白的Western blot结果及相对含量统计;(1)与PD组相比,P<0.01。
2.4 α-LA对PD果蝇脑部ATP水平的影响
与control组比较,PD组果蝇脑内ATP含量明显减少(P<0.001);与PD组相比,LA组果蝇脑内ATP水平明显增加(P<0.01)。见图4。以上结果提示α-LA可增加PD果蝇脑部ATP水平。
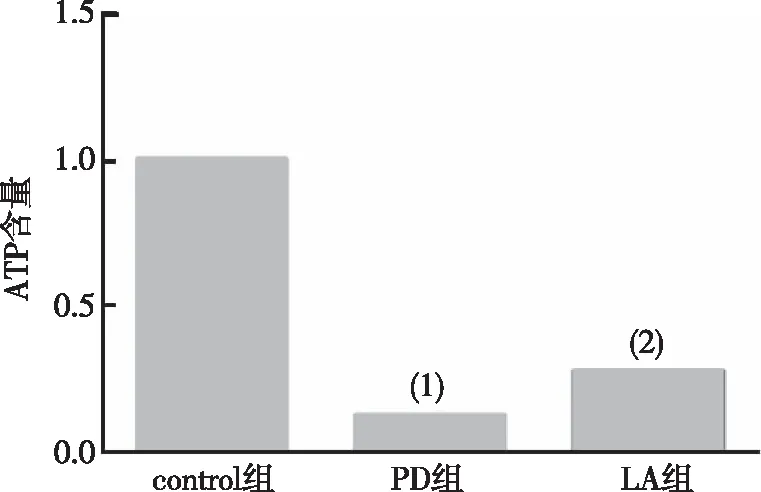
注:(1)与对control组比较,P<0.001;(2)与对PD组比较,P<0.01。
2.5 α-LA对PD果蝇脑部NUDFS3表达的影响
与contro组比较,PD组果蝇脑内NUDFS3表达水平下降(P<0.05);与PD组比较,LA组果蝇脑内NUDFS3表达增高(P<0.05)。见图5。以上结果提示α-LA提高PD果蝇脑部NUDFS3表达。
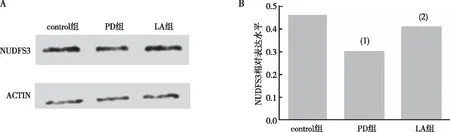
注:A、B为各组果蝇NDUFS3蛋白的Western blot结果及相对含量统计;(1)与control组比较,P<0.05;(2)与对PD组比较,P<0.05。
2.6 α-LA对PD果蝇脑部ROS、MDA、GSH及SOD的影响
与control组比较,PD组果蝇脑内ROS水平明显上升(P<0.01);与PD组相比,LA组果蝇脑内ROS水平下降(P<0.05)。见图6A。与control组比较,PD组果蝇脑内MDA含量明显升高(P<0.001);与PD组比较,LA组果蝇脑内MDA水平下降(P<0.05);见图6B。与control组比较,PD组果蝇脑内GSH含量降低(P<0.05);与PD组比较,LA组果蝇脑内GSH水平下降(P<0.05);见图6C。与control组比较,PD组果蝇脑内SOD含量明显降低(P<0.01);与PD组比较,LA组果蝇脑内SOD含量明显上升(P<0.01);见图6D。以上结果提示α-LA降低PD果蝇脑部氧化应激水平。

注:A~D分别为各组果蝇脑部ROS、MDA、GSH及SOD含量统计;(1)与control组比较,P<0.01;(2)与PD组比较,P<0.05; (3)与control组比较,P<0.001; (4)与control组比较,P<0.05;(5)与对PD组比较,P<0.01。
2.7 α-LA对PD果蝇大脑DA神经元的影响
2.7.1果蝇脑内TH表达水平 与control组比较,PD组果蝇脑内TH水平降低(P<0.05);与PD组相比,LA组果蝇脑内TH水平升高(P<0.05)。见图7。
2.7.2α-LA对DA神经元的影响 免疫荧光结果显示,PD组果蝇脑内PPL1和PPL2 DA神经元及总DA数量明显低于control组(P<0.01);LA组果蝇脑内PPL1和PPL2 DA神经元及总DA神经元数量多于PD组(P<0.05)。其他神经元簇并无明显影响(P>0.05)。见图8。

注:A为各组别果蝇脑内DA神经元分布(20×),红色箭头所指为PPL1和PPL2神经元簇;B为各组别果蝇脑内不同DA神经元簇数量统计;C为不同组果蝇脑内总DA神经元数量统计;D为果蝇脑内DA神经元分布标准图;(1)与control组比较,P<0.05;(2)与对PD组比较,P<0.05。
2.8 α-LA对PD果蝇脑内Atg5及Atg8a的影响
与control比较,PD组果蝇脑内Atg5、Atg8a表达水平下降(P<0.05、P<0.01);与PD组比较,LA组果蝇脑内Atg5、Atg8a表达水平上升(P<0.05、P<0.05);见图9A—D。α-LA对Atg5 RNAi或Atg8a RNAi后PD果蝇脑内α-syn蛋白的影响,如图9E—F所示,与PD组比较,LA组果蝇脑内α-syn含量下降(P<0.05);与PD组比较,Atg5降低+LA组和Atg8a降低+LA组果蝇脑内α-syn含量无明显变化(P>0.05)。以上结果提示α-LA可提高PD果蝇脑内自噬水平、降低α-LA聚集。

注:A、C为各组果蝇Atg5蛋白的Western blot结果及相对表达统计;B、D为各组果蝇Atg8a蛋白的Western blot结果及相对表达统计;E、F为各组果蝇脑内α-syn蛋白的Western blot结果及相对表达统计;(1)与control组比较,P<0.05,(2)与PD组比较,P<0.05;(3)与control组比较,P<0.01;(4)与PD组比较,P>0.05。
3 讨论
α-LA具有抗氧化作用,能保护细胞和细胞内线粒体不受氧化应激的损伤,并且能够透过血脑屏障,从而对神经元产生保护作用[17]。相关研究表明,α-LA能够提高鱼藤酮诱导的PD大鼠模型纹状体DA量以及GSH含量,并且降低脂质过氧化和蛋白质羰基含量;同时,α-LA能够改善PD模型大鼠行为学,并且延缓DA神经元的丢失[9-11]。这些结果都证明α-LA能保护PD中多巴胺神经元,从而维持多巴胺含量,减缓PD的运动症状。PD患者最主要的运动症状包括行动迟缓、肌肉僵硬、静止性震颤、步态不稳等。果蝇是理想的模式生物,其大脑中存在DA能神经元簇,DA神经递质的合成与人类同源,并且果蝇的多巴神经系统同样参与运动的控制[18-19]。在果蝇DA神经元过表达突变的α-syn时,果蝇表现出寿命明显降低、上爬能力丢失严重等类PD表现[20-22];本研究在PD果蝇中通过上爬实验、绘制生存曲线实验证明α-LA能够抑制突变α-syn造成的运动障碍。
α-syn在中枢神经系统中高表达,主要定位于神经元的细胞质和突触前膜末端。相关研究表明α-syn聚集会导致线粒体功能障碍[13-16]。过表达α-syn或者α-syn的突变会导致线粒体损伤,线粒体损伤使ROS水平上升,ROS水平升高加剧α-syn聚集,形成恶性循环[20-21]。在果蝇DA神经元过表达突变的α-syn,果蝇同样表现出脑内线粒体损伤、氧化应激水平升高等类症状[20-22]。α-LA作为抗氧化剂,具有显著的抗氧化功能。相关研究表明α-LA在多种PD模型中发挥抗氧化作用,保护细胞和线粒体不受ROS的损伤[9-11];同时,α-LA还能够降低α-syn的水平[22]。本研究通过检测果蝇脑部α-syn的蛋白含量验证了α-LA降低α-syn的作用,同时通过对氧化应激标志物ROS、MDA、SOD、GSH等的检测,证实了α-LA的抗氧化功能,通过ATP水平和NDUFS3表达水平证实α-LA能够降低α-syn对线粒体的损伤。本研究在转基因PD果蝇中证实了α-LA具有线粒体保护和降低α-syn水平的双重作用,其机制可能是α-LA抑制了α-syn对线粒体的破坏,从而降低果蝇脑部氧化应激水平,减轻α-syn与氧化应激相互加剧的恶性循环。α-syn的异常聚集具有神经元毒性,DA神经元是其主要目标[23]。在过表达α-syn突变的果蝇中,受损的神经元也是DA神经元[17],与人类PD特征一致。果蝇脑部TH表达水平检测与免疫荧光染色果蝇大脑DA神经元结果一致,进一步结果显示PD果蝇受损的DA神经元簇主要是PPL1和PPL2,两结果说明α-LA具有神经保护作用,能够降低α-syn对果蝇DA神经元的损伤。
有研究发现,PD患者的大脑神经元中可检测到异常溶酶体以及自噬体的存在,且抑制溶酶体形成,α-syn的水平会急剧上升,反之自噬水平的上升会降低α-syn的聚集。而过表达正常或A30P、A53T突变都会抑制自噬的发生[24-25]。这些结果表明自噬和α-syn异常聚集具有非常密切的关系,因此自噬溶酶体通路可能是PD病理学机制以及药物靶点开发的一个关键点。果蝇存在与哺乳动物同源的自噬过程以及调控基因,如Atg13、Atg14、Atg5、Atg8等[26]。本实验通过检测α-syn含量,结果显示α-LA干预后,PD果蝇脑内α-syn含量降低。进一步检测果蝇自噬溶酶体标志性蛋白Atg5和Atg8a,结果显示α-LA干预后Atg5和Atg8a的表达水平上升;利用果蝇杂交分别得到Atg5 RNA i和Atg8a RNAi 果蝇品系,自噬RNAi果蝇品系与PD果蝇杂交得到自噬RNAi PD果蝇,α-LA干预后α-syn含量无变化。以上结果说明,α-LA可能通过提高自噬水平降低α-syn聚集。
综上所述,本研究利用SNCA.A30P突变转基因帕金森病果蝇模型证实了,α-LA不仅能够降低果蝇脑内氧化应激水平对神经元线粒体的损伤,从而产生保护神经保护作用,还能提升果蝇脑内自噬水平,加强自噬对突变α-syn的降解,减轻α-syn对DA神经元的毒性,最终减少DA神经元数量的损失,改善果蝇行动能力、延长果蝇寿命。本研究结果对α-LA的临床应用提供了实验理论依据。
