石榴皮多酚通过调控miR-4316表达抑制肺癌细胞增殖、迁移及侵袭实验研究
2023-10-18施胜钰王旭文赵良伟杜燕青江明刘重斌
施胜钰,王旭文,赵良伟,杜燕青,江明,刘重斌
1. 浙江中医药大学附属湖州中医院普外科,浙江 湖州 313000
2. 浙江中医药大学附属湖州中医院泌尿外科,浙江 湖州 313000
3. 浙江中医药大学附属湖州中医院麻醉科,浙江 湖州 313000
4. 湖州师范学院,浙江 湖州 313000
2020 年全球肺癌新发病例超220 例,死亡病例达179 万例,肺癌是全球癌症致死的首位原因[1]。尽管肺癌的诊断方法、手术技术和化疗方案不断进展,但由于肿瘤转移复发率高,其5 年生存率仍然较低[2]。微小RNA(miRNA)是在转录后调控中发挥作用的小型非编码RNA,研究报道miRNA 异常表达与细胞增殖、细胞周期、细胞凋亡以及肿瘤转移等生物学过程相关,是肿瘤治疗的潜在靶点[3]。胃癌中miR-4316 表达降低,上调miR-4316 通过降低血管内皮生长因子A(VEGF-A)表达可抑制胃癌迁移和集落形成能力[4]。膀胱癌中miR-4316 具有抑癌作用,长链非编码RNA(lncRNA)钙调素类蛋白样3 基因反义RNA1(CALML3-AS1)通过抑制miR-4316 表达促进膀胱癌发生[5]。然而,miR-4316 在肺癌中的作用仍有待阐明。石榴皮多酚广泛存在于石榴的皮、果肉和籽中,具有抗氧化、抗肿瘤、调节血脂、抗炎等有益作用[6-7]。研究报道石榴皮多酚具有抵抗前列腺癌及乳腺癌的作用,可能与石榴皮多酚对细胞生长具有一定抑制作用有关,且可以促进细胞凋亡[8-9]。但石榴皮多酚在肺癌中的抗癌作用未见报道。本研究首先分析了miR-4316 在肺癌中的表达作用,并探索石榴皮多酚是否通过调控miR-4316 表达在肺癌中发挥抗肺癌功能。
1 材料与方法
1.1 组织来源将浙江中医药大学附属湖州中医院2018 年1 月—2019 年12 月行手术切除的45 例肺癌患者及癌旁组织纳入研究(男25 例,女20 例;年龄48~75 岁,中位年龄57 岁),排除术前进行放射治疗及化学治疗的患者。所有组织保存在液氮中直到使用。样本采集和使用均获得书面知情同意。本研究经浙江中医药大学附属湖州中医院伦理委员会批准(伦理编号:2021-041-A)。
1.2 细胞及试剂肺癌A549 细胞系购自中国科学院上海细胞库;细胞计数试剂盒(CCK-8)、RPMI-1640 培养基、RIPA 缓冲液购自北京索莱宝生物公司;miRNA 逆转录试剂盒、miRNA 荧光定量专用预混剂购自南京诺唯赞生物公司;miRNA 模拟物(mimics)、miRNA 抑制物(anti-miRNA)及各自阴性对照(miR-NC、anti-miR-NC)、Trizol 试剂购自上海生工生物公司;Transwell 小室购自美国BD 公司;脂质体2000 购自美国Invitrogen 公司;一抗和酶标二抗购自美国Abcam 公司。
1.3 方法
1.3.1 RT-qPCR 检测miR-4316 表达用Trizol 试剂从肺癌组织中提取总RNA,以总RNA 为模板通过miRNA 逆转录试剂盒进行cDNA 反转录。采用miRNA 荧光定量专用预混剂进行RT-qPCR。U6 作为miR-4316 的内参,用相对定量方法(2-ΔΔCt)计算miR-4316 表达量。miR-4316 上游引物5′-AAC GAG ACG ACG ACA GAC-3′,下游引物5′-GGT GAG GCT AGC TGG TG-3′;U6 上游引物5′-AAC GAG ACG ACG ACA GAC-3′,下游引物5′-GCA AAT TCG TGA AGC GTT CCA TA-3′。
1.3.2 细胞培养及分组A549 细胞在含10%胎牛血清RPMI-1640 培养基置于含5%CO2、95%湿度、37 ℃温箱孵育,细胞80%汇合时1∶3 传代。取对数期A549 细胞按照2×104个/孔接种24 孔板,在细胞50%汇合时用脂质体2000 将miR-NC、miR-4316 mimics 分别转染A549 细胞以上调miR-4316 表达,分为miR-NC 组、miR-4316 组。同时,将antimiR-NC、anti-miR-4316 分别转染A549 细胞,收集转染48 h 细胞备用。参照王春梅等[9]实验方法制备石榴皮多酚,用含0 mg/mL、0.5 mg/mL、1 mg/mL、2 mg/mL 石榴皮多酚的培养液分别孵育A549 细胞72 h,依次记为对照组、石榴皮多酚-低组、石榴皮多酚-中组、石榴皮多酚-高组。用含2 mg/mL 石榴皮多酚的培养液分别孵育转染anti-miR-NC、antimiR-4316 的A549 细胞72 h,依次记为石榴皮多酚+anti-miR-NC 组、石榴皮多酚+anti-miR-4316 组。
1.3.3 CCK-8 检测未转染A549 细胞以及转染miR-NC、miR-4316 mimics、anti-miR-NC 或antimiR-4316 的A549 细胞接种96 孔板,贴壁后,按照1.3.2 分组,首先进行72 h 的石榴皮多酚的培养液孵育,然后进行2 h CCK-8(浓度10%)培养液孵育,吸光度(A)用分光光度计在450 nm 下测定。抑制率(%)=(1-实验A/对照A)×100%。
1.3.4 平板克隆实验每组取5×102个细胞接种6 孔板,37 ℃培养2 周后,用甲醇固定细胞集落,结晶紫染色20 min,计数大于50 个细胞的集落数。
1.3.5 划痕愈合实验将各组细胞接种于6 孔板,细胞单层采用移液枪头划伤(10 μL),然后细胞采用磷酸缓冲盐溶液(PBS)进行2 次清洗,清洗完毕在培养基(无血清)中孵育48 h。在测量开始及24 h 后以显微镜对划痕宽度进行拍照测量,划痕愈合率(%)=(初始划痕宽度-24 h 划痕宽度)/初始划痕宽度×100%。
1.3.6 Transwell 实验侵袭实验:准备好无血清培养基重悬的细胞悬液(2×105个细胞)后进行细胞接种,并将剂量为200 μL 的血清培养液置入其下室,共同置入培育箱,持续24 h 后完成培养液丢弃操作后将浓度为4%多聚甲醛置入并完成固定,染色剂采用结晶紫染色液,染色剂使用剂量为400 μL,浓度为0.5%,显微镜仪器对被侵袭的细胞进行观察并记录数量。
1.3.7 Western Blot 检测MMP-2、MMP-9 蛋白表达向各组细胞中加入RIPA 缓冲液,在冰上反应30 min,蛋白离心和定量后,将上清液按照30 μg/泳道在SDS-PAGE 凝胶上分离进行蛋白检测。将蛋白湿转到PVDF 膜,用5%脱脂牛奶在37 ℃下阻断1 h,并暴露于MMP-2 兔多克隆抗体(ab37150)、MMP-9兔多克隆抗体(ab73734)、GAPDH 兔多克隆抗体(ab9485)中4 ℃孵育过夜。用山羊抗兔IgG 酶标二抗(ab205718)在37 ℃下孵育1 h。洗膜3 次后进行化学发光显色,相对灰度值的检测采用Image J 软件。
1.4 统计学方法以SPSS25.0 对本研究中所有统计资料进行分析,确定符合正态分布的计量资料采用均数±标准差()表示,t检验2 组间数据,单因素方差检验多组间数据,LSD-t检验组间数据比较。以P<0.05 为差异有统计学意义。
2 结果
2.1 miR-4316 在肺癌组织中的表达见表1。肺癌组织中miR-4316 表达较癌旁组织低(P<0.05)。
表1 miR-4316 在肺癌组织中的表达()

表1 miR-4316 在肺癌组织中的表达()
注:①与癌旁组织比较,P<0.05
?
2.2 miR-4316 过表达对肺癌A549 细胞增殖、迁移及侵袭的影响见图1~2、表2。与miR-NC 组比较,miR-4316 组A549 细胞抑制率、miR-4316 表达水平更高,克隆形成数、划痕愈合率、侵袭数、MMP-2蛋白水平及MMP-9蛋白水平表达更低(P<0.05)。
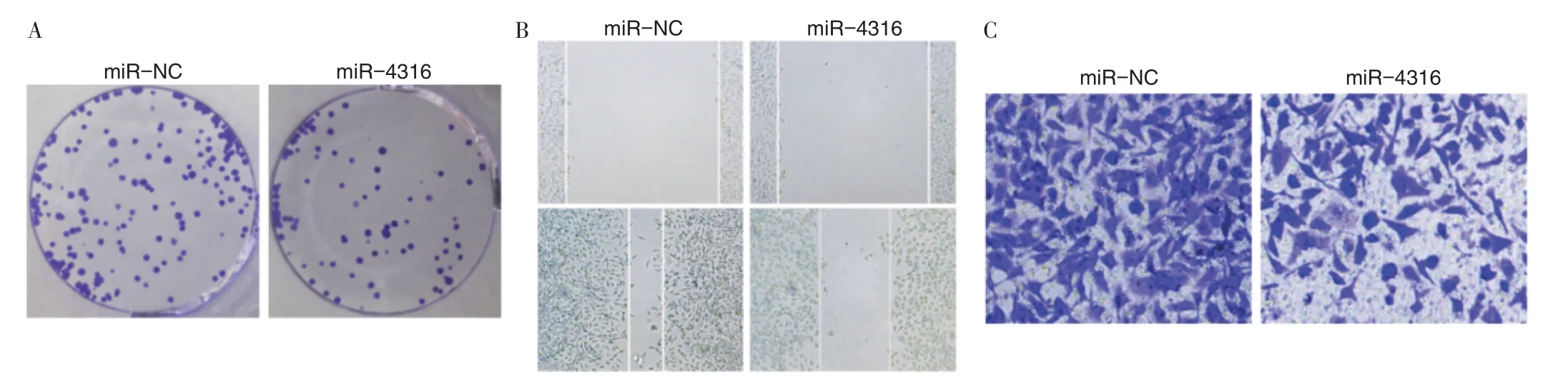
图1 miR-4316 过表达对肺癌A549 细胞克隆形成数、划痕愈合率及侵袭数的影响(×100)
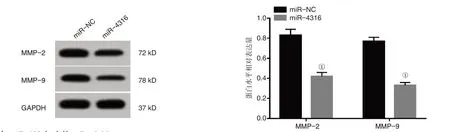
图2 miR-4316 过表达对肺癌A549 细胞迁移侵袭相关蛋白表达的影响
表2 miR-4316 过表达对肺癌A549 细胞增殖、迁移和侵袭的影响()
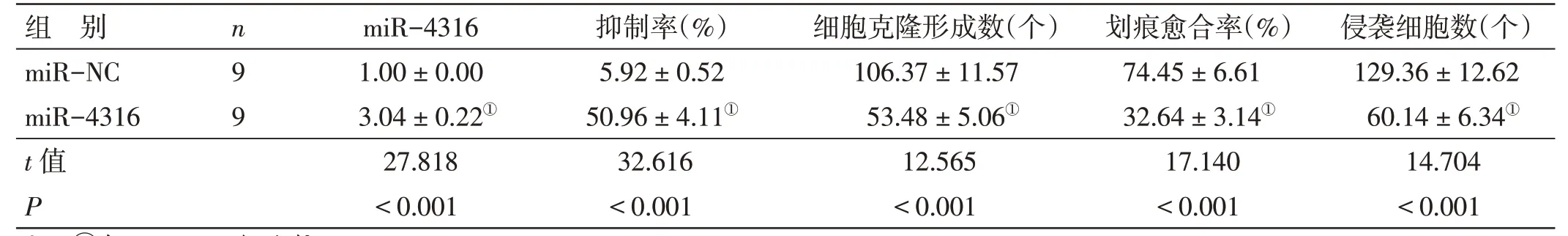
表2 miR-4316 过表达对肺癌A549 细胞增殖、迁移和侵袭的影响()
注:①与miR-NC 组比较,P<0.05
?
2.3 石榴皮多酚对肺癌A549 细胞增殖的影响见表3。石榴皮多酚-低、中、高组A549 细胞抑制率均较对照组高,克隆形成数较对照组低(P<0.05),且具有剂量依赖性。
表3 石榴皮多酚对肺癌A549 细胞增殖的影响()

表3 石榴皮多酚对肺癌A549 细胞增殖的影响()
注:①与对照组比较,P<0.05;②与石榴皮多酚-低组比较,P<0.05;③与石榴皮多酚-中组比较,P<0.05
?
2.4 石榴皮多酚对肺癌A549 细胞迁移侵袭的影响见图3、表4。石榴皮多酚-低、中、高组较对照组A549 细胞划痕愈合率、侵袭数、MMP-2 蛋白水平、MMP-9 蛋白表达水平低(P<0.05)。
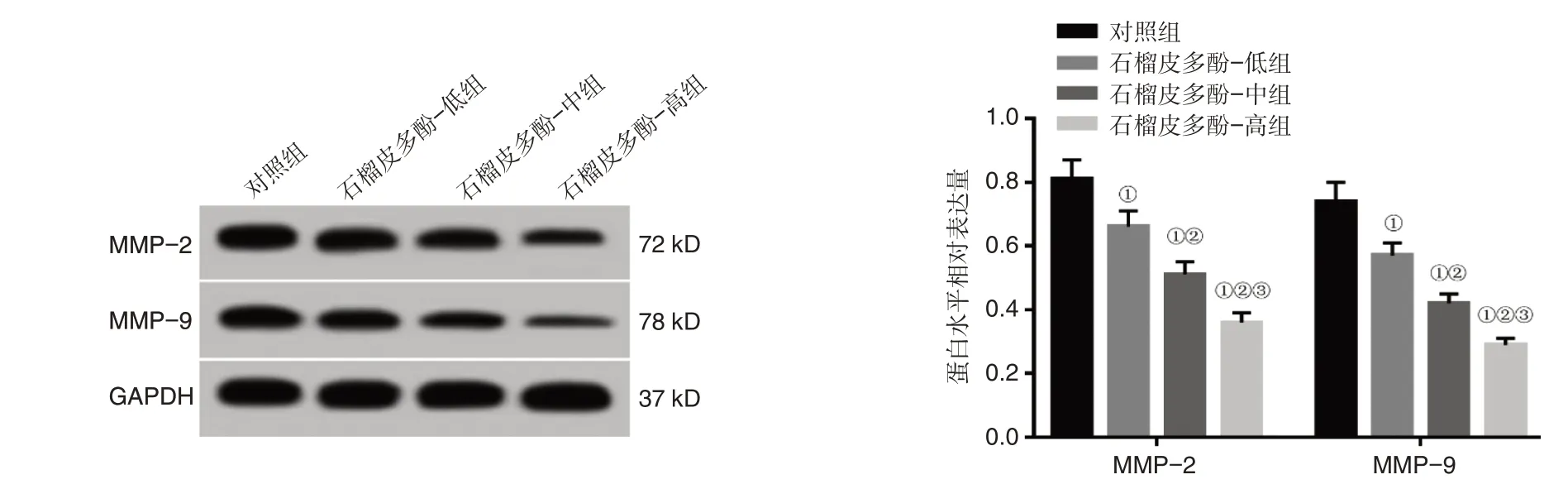
图3 石榴皮多酚对肺癌A549 细胞迁移侵袭相关蛋白表达的影响
表4 石榴皮多酚对肺癌A549 细胞迁移侵袭的影响()
注:①与对照组比较,P<0.05;②与石榴皮多酚-低组比较,P<0.05;③与石榴皮多酚-中组比较,P<0.05
?
2.5 石榴皮多酚对肺癌A549 细胞miR-4316 表达的影响见表5。石榴皮多酚-低、中、高组A549细胞miR-4316 较对照组高(P<0.05)。
表5 石榴皮多酚对肺癌A549细胞miR-4316表达的影响()
注:①与对照组比较,P<0.05;②与石榴皮多酚-低组比较,P<0.05;③与石榴皮多酚-中组比较,P<0.05
?
2.6 下调miR-4316 表达逆转了石榴皮多酚(2mg/mL)对肺癌A549 细胞增殖、迁移及侵袭的作用见图4、表6。石榴皮多酚+anti-miR-4316 组A549 细胞抑制率、miR-4316 表达水平较石榴皮多酚+anti-miR-NC组低(P<0.05),克隆形成数、划痕愈合率、侵袭数、MMP-2 蛋白水平、MMP-9 蛋白表达水平较石榴皮多酚+anti-miR-NC 组高(P<0.05)。
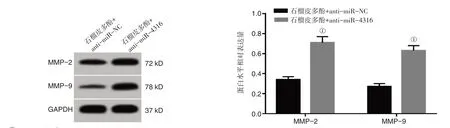
图4 下调miR-4316表达逆转了石榴皮多酚对肺癌A549细胞迁移及侵袭相关蛋白表达的作用
表6 下调miR-4316表达逆转了石榴皮多酚对肺癌A549细胞增殖、迁移及侵袭的作用()
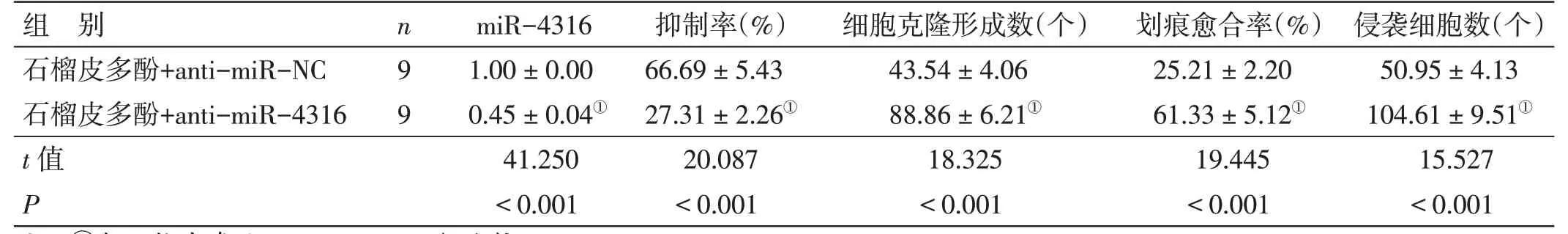
表6 下调miR-4316表达逆转了石榴皮多酚对肺癌A549细胞增殖、迁移及侵袭的作用()
注:①与石榴皮多酚+anti-miR-NC 组比较,P<0.05
?
3 讨论
研究表明miR-4316 在乳腺癌组织表达降低,沉默环状RNA 肌凝蛋白9B(circMYO9B)通过增加miR-4316 表达能够延缓肿瘤生长,抑制乳腺癌细胞增殖和转移[10]。甲状腺癌组织中miR-4316 水平表达低,有利于甲状腺癌细胞的增殖、周期进展及侵袭[11]。在肝癌中miR-4316 低表达还参与细胞的增殖、上皮间质转化和迁移[12]。此外,结直肠癌患者外周血中miR-4316 表达升高可能是其早期诊断标志物[13]。本研究检测到肺癌组织中miR-4316 表达下调,这暗示miR-4316 低表达可能参与肺癌进展。功能测定显示,过表达miR-4316 可降低肺癌细胞克隆形成能力,抑制细胞增殖、迁移及侵袭。MMP-2 和MMP-9 是Ⅳ型胶原降解酶,其能破坏基底膜和细胞外基质促进肿瘤细胞侵袭,MMP-2 和MMP-9 表达上调与肺癌等多种人类癌症的高转移潜能有关[14-15]。本研究中过表达miR-4316 显著抑制MMP-2 和MMP-9 表达,这与其抗转移作用吻合,表明miR-4316 在肺癌中发挥抑癌功能。
石榴皮多酚具有抗增殖、抗血管生成、抗炎、抗转移等抑癌活性,研究报道从石榴中提取的多种多酚可诱导乳腺癌细胞毒性,抑制细胞侵袭和迁移能力[16]。石榴皮多酚通过调节雷帕霉素靶蛋白(mTOR)/S6K 信号通路来抑制前列腺癌细胞迁移和集落形成[17]。石榴皮多酚还通过阻断肝癌细胞周期进展和诱导线粒体凋亡,抑制细胞生长[18]。此外,有报道称低剂量的石榴皮多酚对卵巢癌细胞亦具有较强抗增殖作用[19]。本研究发现石榴皮多酚以剂量依赖方式降低肺癌细胞克隆形成能力,抑制细胞增殖、迁移和侵袭,同时下调MMP-2 和MMP-9 表达水平,这提示石榴皮多酚具有抗肺癌功能。近年研究表明,miRNA 与中药有效成分的抗肿瘤作用密切相关[20-21]。例如,氧化苦参通过促进miR-367-3p 表达来抑制肺癌进展[22]。黄芩苷通过影响miR-126 的表达抑制乳腺癌细胞的侵袭及转移[23]。本研究发现石榴皮多酚处理后肺癌细胞miR-4316 表达显著增加,提示miR-4316 可能是石榴皮多酚防治肺癌的新靶标。进一步分析发现,下调miR-4316 表达显著减弱石榴皮多酚处理对肺癌细胞克隆形成、MMP-2 及MMP-9表达,还可以抑制细胞的迁移、增殖及侵袭,说明抑制肺癌的发展可以通过石榴皮多酚上调miR-4316表达来完成。但是否有其他miRNA 介导石榴皮多酚的抗癌作用仍需要不断探索。
综上所述,石榴皮多酚通过上调miR-4316 表达来抑制肺癌细胞恶性生物学行为,这些发现确定了石榴皮多酚和miR-4316 之间的新关系,为石榴皮多酚在肺癌治疗中的应用提供重要依据,也可能为抗肺癌药物开发提供新思路。
