花椒园对套作莲花白生长及生理特性的影响
2023-10-18李春梅汪扬媚阿约扯贵祝铭谦刘永胜
李春梅,汪扬媚,阿约扯贵,祝铭谦,刘永胜
(1.凉山彝族自治州林业草原科学研究院,四川 凉山 615000;2.凉山彝族自治州农业科学研究院,四川 凉山 615000;3.凉山州森林木绿化有限责任公司,四川 凉山 615000)
花椒为芸香科花椒属落叶小乔木,耐旱喜阳,分布在山西、河北、陕西、云南、四川等地区,分布广泛,在我国东北南部、五岭北坡、西藏东南地区均有栽培。
受市场价格影响,近几年四川省凉山彝族自治州(以下简称凉山州)花椒栽培面积扩大。据不完全统计,凉山州现有花椒面积约为136 460 hm2,投产面积81 062.3 hm2,盛果期面积36 439.4 hm2,盛产面积仅为总面积的26.70%,凉山州花椒投产面积平均产鲜花椒仅5 670 kg/hm2左右,千粒重仅有9.87 g/hm2,与汉源县花椒差距较大,经济收入差额达18 万元/hm2。
花椒的单一大规模种植在一定年限后会出现一些生态环境问题,包括群落结构简单、土壤板结、土壤肥力降低、生物多样性减少、水土流失较重等。另外,花椒纯林表现出的树体生长不良、树势过早衰退、产量下降等问题同样困扰着农户。因此,要解决大面积种植带来的恶劣影响,应采用适宜可持续发展的花椒农林复合种植模式,维护园地生态环境,推动花椒经济林健康可持续发展[1-2]。
研究花椒树及其凋落物的化感作用多采用水浸法,粉碎凋落物后浸提,培养种子和幼苗,观察形态指标和初期种子萌发及幼苗生长的抗性生理反应。这种单一变量的处理方式可能会使自然状态下产生的化感物质进一步集中,也可能会与花椒林实际化感效应存在差异。盆栽试验缺乏真实的林下环境,相比大田试验,其研究结果能为生产实践提供更有力的理论支撑,能得出更准确的结果,更具参考和推广价值。文章以莲花白为研究对象,利用大田试验,探索花椒林中复合种植植物在自然状态下的生长状况,研究花椒中的化感物质对莲花白的作用机理,以期推动花椒园区的生态运作及其可持续发展。
1 材料与方法
1.1 试验地概况
试验田位于西昌市普诗乡四呷村一组,东经102°25′47.54″,北纬27°51′54.82″,海拔2 036 m,属亚热带高原季风气候,年平均气温17.5 ℃,年平均相对湿度61%,年平均降水量1 100 mm,年总日照时数1 627~2 562 h,无霜期230~306 d。
1.2 供试材料
莲花白种子购自凉山州的园艺公司,2018 年5—6 月经过催芽处理后,播种于200 穴的育苗盘中(2.4 cm×2.4 cm),待其生长适应30 d 后选健壮的幼苗移栽,确保株高、茎粗基本一致。供试土壤为当地农耕土壤表层(0~20 cm),土壤基本理化性质如表1、表2 所示。

表1 供试土壤性质

表2 供试土壤元素含量
1.3 试验设计
本试验采取单因子随机区组试验的方式。由于花椒多种于山坡、丘陵地带,试验田小区很难保证统一尺寸。以6 m×2 m 为参考,精准测量设置的小区面积,设置冠幅边缘(X1)、花椒冠幅内(X2)以及无花椒树(CK)三因子试验。本试验中花椒冠幅约为3 m,定义2~3 m 为花椒树冠幅边缘(X1),花椒树下2 m 内为花椒冠幅内(X2)。莲花白的种植行距与间距均为40 cm。2021 年8 月29 日移苗,利用HH2 便携式土壤水分测定仪(mL2x,GBR)监测土壤含水量,使土壤含水量控制在80%左右。分别于移苗后20 d(9 月18 日幼苗期)、30 d(9 月28 日莲座期)、40 d(10 月8 日结球期)取样测定不同处理条件下莲花白的生长、生理指标,待花椒采收时测定产量及千粒重。
1.4 指标测定及方法
1.4.1 形态指标
植株移栽时,用精确到0.1 cm 的直尺测量株高,用精确到0.01 mm 的游标卡尺测量地径,以后每隔7 d 测量一次株高和地径,到盛花期时计算株高和地径增加量(n=5)。
1.4.2 生物量测定
参考相关学者的方法测定植株盛花期的生物量。将植物采收后分成地上和地下2 个部分,用蒸馏水漂洗干净,放入105 ℃的烘箱内杀青0.5 h,然后置于75 ℃的环境中烘干至恒重,接着用精度为0.000 1 g 的电子天平称生物量。
1.4.3 莲花白叶片抗性生理的测定
样品提取:取莲花白叶片,用去离子水洗净后用洁净的滤纸将叶片表面水分吸净,用电子天平称取莲花白鲜样0.100 0 g 于预冷的研钵中,加预冷的0.05 mol/L 磷酸缓冲液8 mL(pH 值7.8),在冰浴上研磨成匀浆,用磷酸缓冲液将研钵冲洗干净,将清洗液转移至离心管内,在4 ℃下15 000 r/min 离心15 min 后静置,取上清液待测。
超氧化物歧化酶(SOD)活性:取上清液50 μL,参照Chen(2015)的方法测定。SOD 活性以抑制NBT光化还原的50%为1 个酶活性单位表示,SOD 总活性=SOD 总活性/蛋白质总浓度。
过氧化物酶(POD)活性:比色杯中加入上清液1 mL,参考Zhang 等(2020)的方法测定。
过氧化氢酶(CAT)活性:取20 mL 试管,移取缓冲液1.5 mL、酶提取液0.2 mL 和蒸馏水1 mL 于其中,参考Fang(2019)的方法测量。
1.5 数据统计分析
利用微软Excel 2010 初步整理数据,利用SPSS 20.0 软件(SPSS Inc.,USA)统计分析,利用Shapiro-Wilk 法对数据分布进行正态性检验。若通过,进一步采用Levene 法进行方差齐性检验以及各处理或各指标的单因素方差分析(方差齐采用LSD 法进行多重比较,若方差不齐则采用Tamhane法进行多重比较,显著性水平设定为0.05);若未通过,采用非参数测试(克鲁斯克—瓦利斯法)。利用OriginPro 2019 软件制图,采用微软Excel 2010制表。
衡量花椒对莲花白的化感作用,用威拉姆森提出的敏感指数RI作为衡量指标,如下式。
式中:T为处理值,C为对照值,当RI>0 为促进作用,RI<0 为抑制作用,RI的绝对值代表化感作用强度的大小。其作用强度用SPSS 17.0(SPSS Inc.,USA)分别对数据进行One-way ANOVA 分析,若差异显著(P<0.05),采用LSD法进行多重比较。
2 结果分析
2.1 对莲花白形态生长的影响
莲花白球叶数及地上部分鲜重的变化如表3所示。由于花椒树的影响,出现离花椒树距离越近抑制趋势越明显的情况(p<0.05)。20 d 时X1、X2处理的莲花白球叶数较CK 无显著差异(p>0.05),但地上部分鲜重较CK 处理表现为显著降低趋势,较CK 处理分别降低了13%和23%。30 d 和40 d时,X1 和X2 处理莲花白球叶数及生物量与CK 相比均为显著减少。随着生长时间的延长,花椒树对莲花白球叶数及鲜重的抑制作用呈更明显的趋势。40 d 时,X2 球叶数和鲜重的化感抑制指数最高,分别为-0.36 和-0.30,说明在花椒树冠幅内,花椒树降低了莲花白生物量的积累,对莲花白的生长表现为抑制作用。
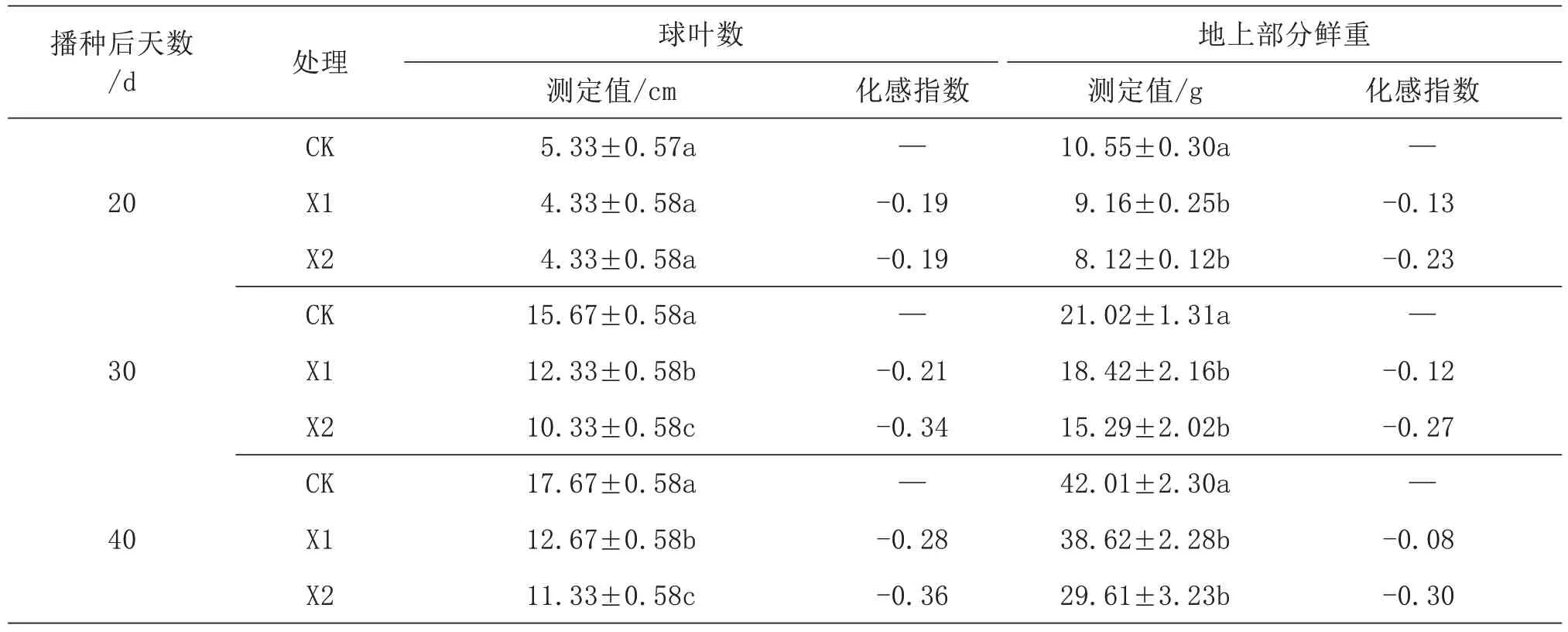
表3 不同条件下莲花白的球叶数、地上部分鲜重
2.2 对花椒籽粒产量的影响
由表4 可以看出,与莲花白球叶数和地上部分鲜重不同,花椒树下复合种植莲花白会显著提高花椒千粒重,且在X1、X2 处达到显著水平(p<0.05),X1、X2 处理花椒千粒重较CK 分别增加了20.88%、30.93%,说明花椒树下套作莲花白不仅有一定莲花白产出,更能提高花椒产量。
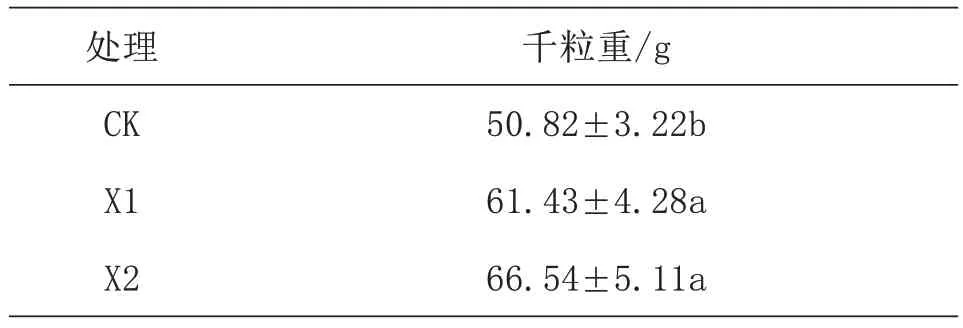
表4 不同条件下的花椒千粒重
2.3 对抗氧化酶活性的影响
由图1 可以看出,花椒树对莲花白SOD 活性的影响随着距离花椒树越近呈现出显著的升高趋势。在莲花白生长初期(20 d),仅X2 处理较CK 显著增加了16.01%,X1 和X2 处理随着时间的延长呈现明显的上升趋势。处理末期(40 d),X1 和X2 处理较CK 增加了30.86%和48.32%。
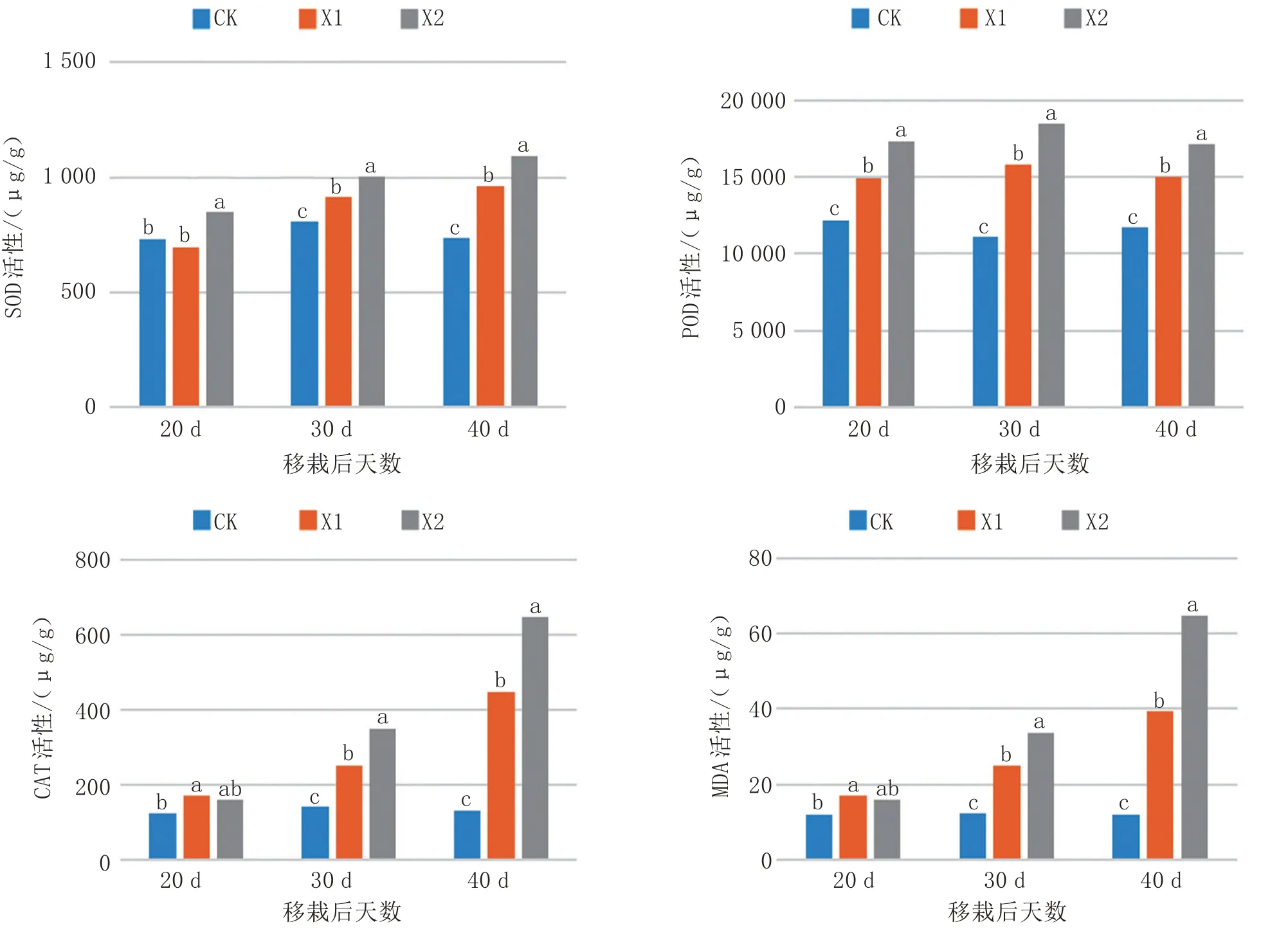
图1 不同处理对莲花白球抗氧化酶和丙二醛含量的影响
莲花白POD 活性相比于SOD 活性表现更为敏感。在处理初期(20 d),X1 和X2 处理较CK 表现为显著的升高趋势,分别增加了23.02%和42.37%,POD 活性增加的趋势一直保持到莲花白生长末期。
类似于SOD 活性和POD 活性的表现,莲花白CAT 活性与花椒树的距离也成正比,花椒树下种植的莲花白CAT 活性比空白地带种植的莲花白高。移栽40 d 后,X1 和X2 处理莲花白CAT 活性较CK处理显著提高,高达242.07%和394.72%。
综上可知,花椒树下的莲花白叶片抗氧化酶活性(SOD、POD 和CAT 酶活性)整体表现为促进作用,可能与花椒树化感作用胁迫下莲花白抗氧化酶系统被激活有关。
2.4 对莲花白丙二醛含量的影响
由图1 可知,20 d 时仅X1 处理MDA 含量相比于CK 显著升高,随着莲花白生长,30 d 和40 d 时,X1 和X2 处理MDA 含量与CK 相比均表现为显著升高趋势。X2 处理较CK 增加了175.19%和452.01%,且达到极显著水平(p<0.05),说明花椒树冠幅下种植莲花白会导致莲花白叶片膜脂过氧化,对于莲花白生长表现为抑制作用。
3 结论
花椒与作物复合种植模式可优化种植结构,实现生态效益和经济效益的全面提升。椒园复合种植不仅可以形成园区良好的生态环境,而且对花椒生长有一定的促进作用,可提高花椒产量,但花椒树冠幅下莲花白种植的抑制作用比较明显,因此建议在花椒树冠幅的边缘栽植。
4 讨论
各处理莲花白超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性表现出不同程度的增强,但莲花白叶片中丙二醛(MDA)含量表现为显著的升高,尤其表现在花椒树冠幅下种植的莲花白叶片中,可能是因为即使SOD、POD 和CAT 活性有所升高,仍不能有效清除多余的H2O2,导致膜脂过氧化,造成细胞膜系统破坏,继而影响莲花白生长。王启等(2021)[3]利用花椒叶浸提液试验紫云英种子所得结果相似。Radwan 等(2020)研究发现,化感物质中的一些多酚类化合物会破坏细胞膜的功能,可能是受体植物的保护酶活性会受到化感物质影响,导致活性氧增高,从而破坏细胞膜结构。在这项试验中,种植在花椒树冠幅的莲花白叶片MDA 含量明显增加,表明这种种植方式对莲花白叶片的细胞膜有明显的过氧化损害,所以抑制莲花白生长的主要原因可能是膜质过氧化伤害[4-5]。
