广藿香内生真菌Ogataea sp.RW-S10次级代谢产物研究
2023-10-17阮武郭教岑马青云杨理谢晴宜吴友根赵友兴
阮武, 郭教岑, 马青云, 杨理, 谢晴宜,3, 吴友根*, 赵友兴*
广藿香内生真菌sp.RW-S10次级代谢产物研究
阮武1, 郭教岑1, 马青云2, 杨理2, 谢晴宜2,3, 吴友根1*, 赵友兴2*
(1. 海南大学园艺学院,海口 570228;2. 中国热带农业科学院热带生物技术研究所,海口市热带天然产物研究与利用重点实验室,海口 571101;3. 中国热带农业科学院海南热带农业资源研究院,海口 571101)
为挖掘广藿香()内生真菌活性代谢产物,采用多种柱色谱分离方法从广藿香内生真菌sp. RW- S10的次级代谢产物中分离得到7个化合物,根据波谱数据分别鉴定为ogataearin (1)、phenylalaninol (2)、对羟基苯乙酮(3)、(dethio)(methylsulfanyl)gliotoxin (4)、-苯乙基乙酰胺 (5)、lumichrome (6)和dehydroxypaxilline (7),其中化合物1为新化合物。化合物1具有-葡萄糖苷酶抑制活性,其IC50值为39.38mol/L。
广藿香;内生真菌;次级代谢产物;抗菌活性
广藿香()为唇形科(Labiatae)刺蕊草属植物,原产于东南亚地区,由于其在医学和经济上的重要性,被记录在《中华人民共和国药典》[1],是著名的“十大南药”之一,在我国广藿香引种可以追溯到近一千多年[2]。广藿香是藿香正气胶囊等30多种中成药的主要原料,在医药生产和应用方面具有广阔的前景[3]。广藿香的化学成分主要含有萜烯、黄酮、醛、醇和生物碱等多种活性化合物,具有抗炎、抗流感、抗氧化等药理作用[4–6]。植物内生真菌能产生与宿主植物类似和结构新颖的次生代谢产物,已成为发现新的天然活性物质的重要资源[7]。研究广藿香内生真菌及其次生代谢产物对于诠释广藿香与内生真菌的生态互作具有重要科学意义。我们前期在对海南广藿香内生真菌的次生代谢产物研究中发现了一些新颖结构的联苯类化合物(3--demethylaltenuisol、(-)-dialtenuisol、(+)-dialtenuisol、altertoxin VII),部分化合物具有抗菌活性[8]。为进一步挖掘广藿香植物内生真菌中新颖活性次生代谢产物,本研究从广藿香(湛香)样品茎中分离筛选到一株内生真菌sp. RW-S10, 对其次生代谢产物采用硅胶柱色谱、ODS柱色谱和半制备高效液相色谱等方法分离得到7个化合物。
1 材料和方法
1.1 材料和仪器
广藿香()品种为‘湛香’,于2019年8月种植于海南大学园艺学院实验基地,2020年7月取样。内生真菌RW-S10从广藿香茎中分离纯化得到。结合菌株生长形态以及菌株ITS序列比对(GenBank accession No. OL455915),鉴定该菌株为sp.,保藏于中国热带农业科学院热带生物技术研究所。
质谱仪(ESI-MS、EI-4000, Micromass Autospec- Uitima-TOF);核磁共振光谱仪(AVANCE-500,德国Bruker公司);紫外光谱仪(UV-2550, 岛津(上海)实验器材有限公司);红外光谱仪(NICOLET 380, Thermo, USA);高效液相色谱仪(安捷伦1260分析型, 美国安捷伦科技有限公司);半制备高效液相色谱仪(SUM-MITP680A, 戴安,美国);酶标仪(ELX-800, Bio Tex公司);实验室超纯水仪(DW 100, 济南欧莱博科学仪器有限公司);旋转蒸发仪(LABORTA 4001,德国HEIDOLPE公司);真空泵(Rotavac valvetec, 德国HEIDOLPE公司);冷却水循环机(CA-111, 日本东京理化器械株式会);反向材料C-18 (日本FU-JI公司);柱色谱硅胶和薄层色谱硅胶板(青岛海洋化工厂产品)。
常规萃取提取分离用乙酸乙酯、甲醇、乙醇、丙酮、四氢呋喃,石油醚、二氯甲烷均为重蒸工业试剂,氘代试剂购自Merck公司;色谱乙腈,色谱甲醇购自天津康科德公司。
1.2 提取和分离
将菌株在PDA培养基(马铃薯200 g, 葡萄糖20 g,琼脂20 g, 蒸馏水1 L, pH 6.5)培养3 d,接种于装有150 mL真菌2号培养基(葡萄糖10 g, 麦芽糖20 g, 味精10 g, 酵母膏3 g, 玉米浆1 g, 甘露醇20 g, MgSO40.3 g, KH2PO40.5 g, 水1 L, pH 6.5)的500 mL三角瓶中,在摇床(180 r/min, 25 ℃)上摇3 d, 制成种子液。将菌种接种于装有真菌2号培养基的1 000 mL三角瓶(每瓶300 mL)中,室温静置发酵35 d后得到发酵产物,用等体积乙酸乙酯萃取3次,得到萃取液,减压浓缩后得到浸膏(33.2 g)。
对浸膏33.2 g运用减压硅胶柱色谱,以石油醚-乙酸乙酯(8:1~0:1)进行极性递增梯度洗脱,分部位收集,薄层硅胶板检测,合并获得13个组分Fr.1~Fr.13。Fr.5用20%~100%甲醇洗脱反相ODS色谱柱,液相分析后合并,得到3个组分Fr.5-1~Fr.5-3。Fr.5-1用25%甲醇做流动相进行HPLC制备,得到化合物2 (1.1 mg);Fr.5-3用40%乙腈做流动相进行HPLC制备,得到化合物3 (8.9 mg)。Fr.11用30%~100%甲醇洗脱反相ODS色谱柱,进行液相分析,再将50%甲醇洗脱下来的组分,用45%甲醇做流动相进行HPLC制备,得到化合物4 (6.0 mg)。Fr.12以石油醚-乙酸乙酯(6:1,4:1)进行正相梯度洗脱,高效液相分析后合并,得到3个组分Fr.12-1~Fr.12-3。Fr.12-1用45%甲醇做流动相进行HPLC制备,得到化合物5 (2.7 mg);Fr.12-2用30%乙腈做流动相进行HPLC制备,得到化合物6 (1.5 mg)。Fr.13用30%~100%甲醇洗脱反相ODS色谱柱,进行液相分析,再将80%甲醇洗脱下来的组分,用60%乙腈做流动相进行HPLC制备,得到化合物7 (5.6 mg)和1 (1.5 mg)。
1.3 结构鉴定
化合物1 褐色油状物,[]D20+39.0 (0.1, MeOH),UV (MeOH)max(log): 213 (3.53), 267 (2.21); ECD (0.74 mM, MeOH)max: 199 (+36.33), 205 (-14.63), 208 (-23.06), 224 (+10.77), 237 (-3.02), 269 (+0.77) nm;HR-ESI-MS955.4102 (理论值为955.4108)处给出[M + Na]+峰,提示分子式为C52H60N4O12,不饱和度为25。红外光谱显示出苯环(1 504、1 452 cm–1)、酰胺(1 742 cm–1)和酯羰基(1 662 cm–1)官能团的特征吸收峰。1H NMR谱显示5个苯环质子信号:H7.28~7.26 (2H, m, H-9, H-13), 7.12~7.11 (2H, m, H-10, H-12), 7.20~7.19 (1H, m, H-11);2个甲基质子信号:H1.17 (3H, d,= 6.8 Hz, H-6), 2.75 (3H, s, H-3);1个亚甲基质子信号:H3.10 (2H, d,= 5.6 Hz, H-7)和2个次甲基质子信号:H4.54 (1H, t,= 5.6 Hz, H-2), 3.78 (1H, q,= 6.8 Hz, H-5)。13C NMR、DEPT和HSQC谱图显示13个碳信号,包括1个酰胺羰基(C165.6)、1个酯羰基(C167.1)、1个单取代苯基(C135.5, 129.7, 128.8, 127.6)、1个sp3亚甲基(C36.1)、2个sp3次甲基(C62.2, 72.8)和2个甲基(C16.9, 32.1)。以上数据与文献[9]中的beauvericin的核磁数据相似,beauvericin是由3个D-Hiv-L--Me-Phe单元环化而成。结合分子式推测化合物1是由4个相同结构单元环化而成。进一步比较化合物1与beauvericin的核磁数据, 它们仅有的区别是结构单元C-5位连的基团不同, 化合物1连接1个甲基(-CH3,C16.9),而beauvericin连接的是异丙基。1H-1H COSY(图2)谱中H-2与H2-7、H-5与H3-6的相关信号以及HMBC谱中, H2-7与C-1和C-8、H-2与C-1、C-7和C-8、H3-3与C-2和C-4、H3-6与C-4和C-5的相关信号证实了以上的推测, 从而鉴定了化合物1中结构单元的平面结构。结合分析由高分辨确定的分子式C52H60N4O12,化合物1中结构单元分子式为C13H15NO3,羰基C-1 (C167.1)提示为酯羰基,因此化合物1是由4个-甲基苯丙氨酸-2-羟基丙酰胺通过1位和5位首尾酯化形成二十四元环的新环肽类化合物。ROESY谱(图2)中H-5与H2-7相关暗示H-5与7-CH2位于大环的同侧,从而确定化合物1的相对构型。因此,化合物1结构如图2,命名为ogataearin。
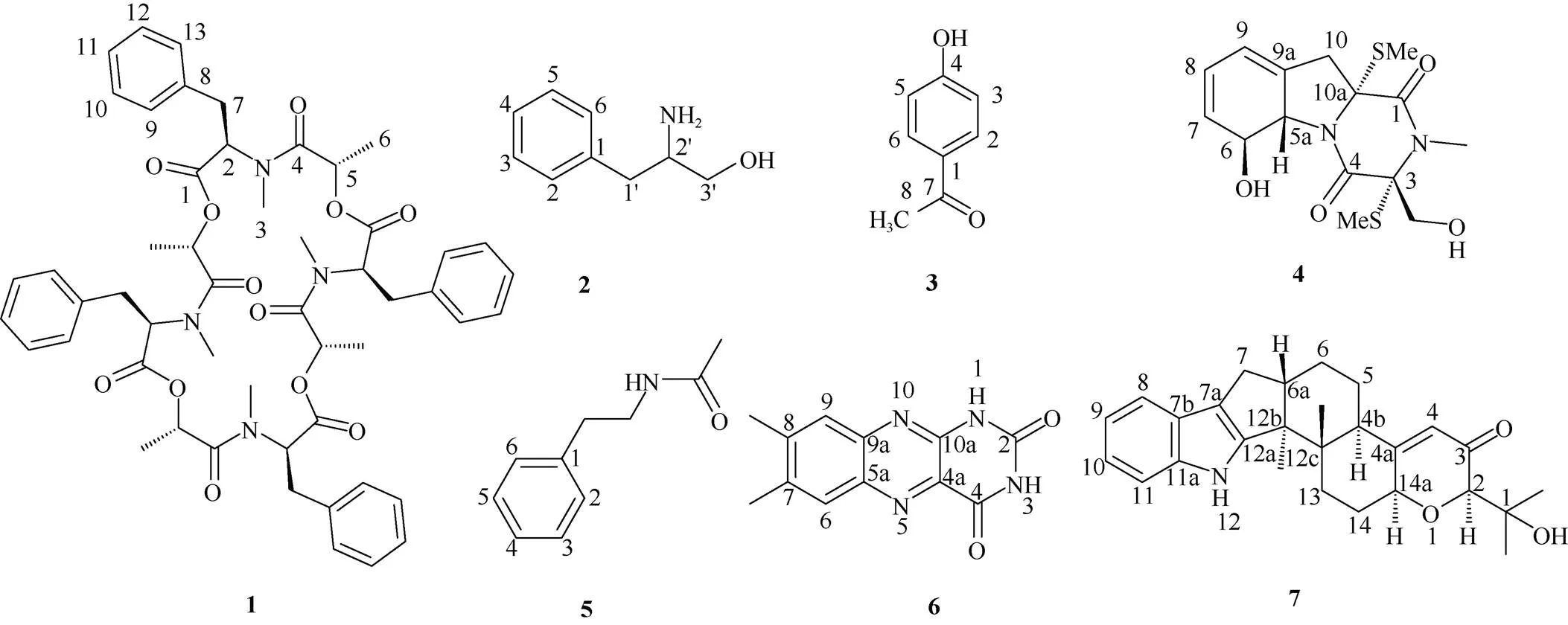
图1 化合物1~7的结构

图2 化合物1的1H-1H COSY、HMBC和ROESY关键相关信号
化合物2 褐色无定形粉末,ESI-MS152 [M + H]+,分子式为C9H13NO。1H NMR (600 MHz, CD3OD):H7.25 (2H, d,= 7.5 Hz, H-2, H-6), 7.21 (2H, t,= 7.5 Hz, H-3, H-5), 7.12 (1H, t,= 7.3 Hz, H-4), 4.60 (1H, s, OH), 4.17 (1H, t,= 6.6 Hz, H-2′), 3.54~3.36 (2H, m, H-3′), 2.44 (2H, d,= 7.6 Hz, H- 1′);13C NMR (151 MHz, CD3OD):C138.3 (C-1), 130.3 (C-2, C-6), 129.8 (C-3, C-5), 127.1 (C-4), 64.3 (C-3′), 55.6 (C-2′), 38.9 (C-1′)。以上数据与文献[10]一致,故鉴定为phenylalaninol。
化合物3 无色油状物,ESI-MS: 137 [M + H]+,分子式为C8H8O2。1H NMR (600 MHz, CD3OD):H7.87~7.85 ( 2H, m, H-2, H-6), 6.83~6.80 (2H, m, H-3, H-5), 3.29 (1H, p,= 1.6 Hz, H-4 ), 2.50 (3H, s, H-8);13C NMR (151 MHz, CD3OD):C199.5 (C-7), 164.0 (C-4), 132.1 (C-1), 130.2 (C-3, C-5), 116.2 (C-2, C-6), 26.3 (C-8)。以上数据与文献[11]一致,故鉴定为对羟基苯乙酮。
化合物4 无定形黄色固体,ESI-MS: 357 [M + H]+, 分子式为C15H20N2O4S2。1H NMR (600 MHz, CD3OD):H5.95 (1H, m, H-9), 5.90~5.87 (1H, m, H-8), 5.64 (1H, dd,= 9.8, 2.1 Hz, H-7), 4.90 (1H, m, H-5a), 4.84 (1H, m, H-6), 4.21 (1H, d,= 11.5 Hz, CH2OH), 3.83 (1H, d,= 11.5 Hz, CH2OH ), 3.27 (1H, s, H-10), 3.08 (3H, s, MeN), 2.92 (1H, s, H-10), 2.23 (3H, s, MeS), 2.21 (3H, s, MeS);13C NMR (151 MHz, CD3OD):C168.5 (C-4), 167.8 (C-1), 134.1 (C-9a), 130.8 (C-7), 124.8 (C-8), 120.8 (C-9), 75.8 (C-6), 74.3 (C-3), 73.1 (C-10a), 70.5 (C-5a), 64.6 (CH2OH), 39.6 (C-10), 29.1 (MeN), 15.2 (MeS), 13.5 (MeS)。以上数据与文献[12]一致,故鉴定为bis(dethio)bis(methylsulfanyl)gliotoxin。
化合物5 白色粉末,ESI-MS:164 [M + H]+, 分子式为C10H13NO。1H NMR (600 MHz, CD3OD):H7.28 (2H, t,= 7.6 Hz, H-2, 6), 7.21~ 7.19 (3H, m, H-3, 4, 5), 3.38 (2H, t,= 7.4 Hz, H-), 2.78 (2H, t,= 7.4 Hz, H-), 1.90 (3H, s, CH3);13C NMR (151 MHz, CD3OD):C173 (CO), 140.5 (C-1), 129.8 (C-3, C-5), 129.5 (C-2, C-6), 127.3 (C-4), 42.1 (C-), 36.5 (C-), 22.5 (CH3)。以上数据与文献[13]一致,故鉴定为-苯乙基乙酰胺。
化合物6 黄绿色无定形粉末,ESI-MS: 243 [M + H]+, 分子式为C12H10N4O2。1H NMR(600 MHz, DMSO-6):H7.88 (1H, s, H-6 ), 7.68 (1H, s, H-9), 2.47 (3H, s, 8-CH3), 2.45 (3H, s, 7-CH3);13C NMR (151 MHz, DMSO-6):C161.1 (C-4), 154.2 (C-2), 144.4 (C-10a), 141.9 (C-9a), 138.4 (C-5a), 138.3 (C-8) 138.2 (C-7), 130.5 (C-4a), 128.7 (C-6), 125.8 (C-9), 20.2 (7-CH3), 19.6 (8-CH3)。以上数据与文献[14]一致,故鉴定为lumichrome。
化合物7 黄绿色粉末,ESI-MS: 420[M + H]+,分子式为C27H33NO3。1H NMR (500 MHz, DMSO-6):H10.70 (1H, s, NH), 7.22~7.19 (2H, m, H-8, H-11), 6.87~6.85 (2H, m, H-9, H-10), 5.67 (1H, t,= 1.9 Hz, H-4), 4.34 (1H, dd,= 10.2, 7.5 Hz, H- 14a), 3.67 (1H, d,= 1.9 Hz, H-2), 2.56~2.54 (2H, m, H-7), 2.47 (1H, m, H-6a), 2.27~2.24 (2H, m, H-6), 1.91~1.89 (2H, m, H-14), 1.70~1.68 (2H, m, H-5), 1.57~1.55 (2H, m, H-13), 1.46 (1H, m, H-4b), 1.14 (3H, s, 12c-Me), 1.10 (3H, s, H-3′), 0.94 (3H, s, H-1′), 0.81 (3H, s, 12b-Me);13C NMR (125 MHz, DMSO-6):C196.5 (C-3), 168.7 (C-4a), 150.1 (C-12a), 140.2 (C-11a), 124.4 (C-7b), 120.9 (C-4), 119.6 (C-10), 118.6 (C-9), 117.8 (C-8), 116.0 (C-7a), 111.9 (C-11), 82.7 (C-2), 74.3 (C-14a), 71.0 (C-1′), 49.9 (C-12b), 48.8 (C-6a), 41.9 (C-4b), 41.8 (C-12c), 31.0 (C-5), 29.8 (C-7), 26.9 (C-14), 26.0 (C-3′), 25.7 (C-13), 25.1 (C- 2′), 23.9 (C-6), 15.8 (12c-Me), 14.7 (12b-Me)。以上数据与文献[15]一致,故鉴定为dehydroxypaxilline。
1.4 抗菌活性测定
采用2倍稀释法[16],将化合物对4种食品常见致病菌(大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、单增李斯特菌)进行抗菌活性筛选,结果显示7个化合物对这4种病原细菌均无抑制作用。
1.5 α-葡萄糖苷酶活性测定
采用PNPG法[17]测定化合物1~7的-葡萄糖苷抑制活性。化合物均用DMSO溶解配制成待测化合物溶液(5 mg/mL)。取70L磷酸盐缓冲液(0.1 mol/L, pH 6.8)于96孔板中,再分别加入20L-葡萄糖苷酶溶液(2 U/mL)和10L待测样品溶液。37 ℃温育15 min后加入20L pNPG溶液(2.5 mmol/mL),在37 ℃放置30 min后加入80L Na2CO3终止液(0.2 mol/L)终止反应,反应总体系为200L。充分混匀后于405 nm处用酶标仪检测各孔吸光度。以金雀异黄酮(反应终质量浓度为0.25 mg/mL)为阳性对照,DMSO (体积分数为0.5%)为阴性对照,实验重复3次。抑制率=[(0)(0)]/(0),式中,为实验组平均吸光度,0为背景对照组平均吸光度,为阴性对照平均吸光度,0为空白对照平均吸光度,计算化合物对-葡萄糖苷酶的抑制率。结果表明,化合物1具有-葡萄糖苷酶抑制活性,抑制率为73.55%,其他6个化合物抑制率均低于30%,化合物1的IC50值为39.38mol/L,阳性对照金雀异黄酮为19.05mol/L。
2 结果和讨论
广藿香是生长于热带和亚热带气候特殊环境的一种植物,对广藿香的化学成分已有较多研究报道,但广藿香内生真菌及其次级代谢产物的研究极少。本研究从广藿香茎中分离得到内生真菌spRW-S10,从其次生代谢产物中分离鉴定出1个新的环肽化合物和6个已知化合物,分别为ogata- earin (1)、phenylalaninol (2)、对羟基苯乙酮 (3)、(dethio)bis(methylsulfanyl)gliotoxin (4)、-苯乙基乙酰胺 (5)、lumichrome (6)和dehydroxypaxilline (7), 大部分为生物碱。广藿香植物中生物碱主要含有广藿香吡啶、表愈创吡啶[18]、大豆脑苷I、大豆脑苷II和尿嘧啶[19],广藿香内生真菌中代谢产生的生物碱与其植物中生物碱结构相差较大,但因内生真菌发酵条件与其在广藿香中的生境条件差异较大,该内生真菌是否对广藿香植物的代谢产物有影响仍有待进一步验证。化合物1具有较好的-葡萄糖苷酶抑制活性,7个化合物对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、单增李斯特菌等4种病原细菌均无抑制作用。本研究加深了对广藿香内生真菌代谢产物的认识,为从广藿香内生真菌中挖掘新颖活性物质奠定了理论基础。
[1] QIAN Z Z, QI P, WANG G R. Main revisions on Chinese pharma- copoeia, Volumn 1 (2005) [J]. Drug Stand China, 2005, 6(1): 25–30. [钱忠直, 齐平, 王国荣. 《中国药典》2005年版(一部)品种主要增修订情况[J]. 中国药品标准,2005, 6(1): 25–30. doi: 10.3969/j. issn. 1009-3656.2005.01.013.]
[2] WU Y G, GUO Q S, ZHENG H Q. Textual research on history of introdution and herbal medicine of[J]. China J Chin Mat Med, 2007, 32(20):2114–2117, 2181. [吴友根, 郭巧生, 郑焕强. 广藿香本草及引种历史考证的研究 [J]. 中国中药杂志, 2007, 32(20):2114–2117, 2181. doi: 10.3321/j.issn:1001-5302.2007.20.007.]
[3] SWAMY M K,SINNIAH U R. Patchouli (Benth.): Botany, agrotechnology and biotechnological aspects [J]. Ind Crops Prod, 2016, 87: 161–176. doi: 10.1016/j.indcrop.2016.04.032.
[4] XIAN Y F, LI Y C, IP S P, et al.Anti-inflammatory effect of patchouli alcohol isolated from Pogostemonis HERBA in LPS-stimulated RAW 264.7 macrophages [J]. Exp Ther Med, 2011, 2(3):545–550.doi: 10. 3892/etm.2011.233.
[5] KIYOHARA H, ICHINO C,KAWAMURA Y, et al. Patchouli alcohol:direct anti-influenza virus sesquiterpene inBenth. [J]. J Nat Med,2012, 66(1):55–61.doi: 10.1007/s11418-011-0550-x.
[6] FENG X X , YU X T , LI W J, et al. Effects of topical application of patchouli alcohol on the UV-induced skin photoaging in mice [J]. Eur J Pharm Sci, 2014, 63(2014):113–123.doi: 10.1016/j.ejps.2014.07.001.
[7] TAN R X, ZOU W X. Endophytes: A rich source of functional meta- bolites [J]. Nat Prod Rep, 2001, 18(4): 448–459. doi: 10.1039/b100918o.
[8] KONG F D, YI T F, MA Q Y, et al. Biphenyl metabolites from the patchouli endophytic fungussp. PfuH1 [J]. Fitoterapia, 2020, 146: 104708. doi: 10.1016/j.fitote.2020.104708.
[9] LÜCKE D, DALTON T, LEY S V,etal. Synthesis of natural and unnatural cyclooligomeric depsipeptides enabled by flow chemistry [J]. ChemEurJ, 2016, 22(12):4206–4217.doi: 10.1002/chem.201504457.
[10] FUJITA T, IIDA A,UESATO S,et al. Structural elucidation of trichosporin-B-Ia, IIIa, IIId and V from[J]. J Antibiot, 1988, 41(6):814–818.doi: 10.7164/antibiotics.41.814.
[11] KWON H C,LEE K R.Phytochemical constituents ofssp.[J]. Arch Pharm Res, 2001, 24(3):194–197.doi: 10.1007/BF02978255.
[12] RODRIGUES B, SAHM B D B, JIMENEZ P C, et al. Bioprospection of cytotoxic compounds in fungal strains recovered from sediments of theBrazilian Coast [J]. ChemBiodiv,2015, 12(3):432–442.doi: 10. 1002/cbdv.201400193.
[13] ZOU X W, LIU S C, ZHENG Z H, et al. Two new imidazolone- containing alkaloids and further metabolites from the Ascomycete fungussp. [J]. Chem Biodivers, 2011, 8(10):1914–1920.doi: 10.1002/cbdv.201000372.
[14] TSUKAMOTO S, KATO H, HIROTA H, et al. Lumichrome: A larval metamorphosis-inducing substance in the ascidian[J]. Eur J Biochem, 1999, 264(3): 785–789. doi: 10.1046/j.1432-1327. 1999.00642.x.
[15] HOSOE T, NOZAWA K,UDAGAWA S I, et al. Structures of new indoloditerpenes, possible biosynthetic precursors of the tremorgenic mycotoxins, penitrems, from[J]. Chem Pharm Bull, 1990, 38(12):3473–3475.doi: 10.1248/cpb.38.3473.
[16] KONG F D, HUANG X L, MAQ Y, et al. Helvolic acid derivatives with antibacterial activities againstfrom the marine-derived fungusHNMF0047 [J]. J Nat Prod, 2018, 81(8): 1869–1876. doi: 10.1021/acs.jnatprod.8b00382.
[17] JONG-ANURAKKUN N, BHANDARI M R, KAWABATA J.- Glucosidase inhibitors from Devil tree () [J]. Food Chem, 2007, 103(4):1319–1323.doi: 10.1016/j.foodchem.2006.10.043.
[18] BÜCHI G, GOLDMAN I M, MAYO D W. The structures of two alkaloids from patchouli oil [J]. J Am Chem Soc, 1966, 88(13): 3109– 3113. doi: 10.1021/ja00965a040.
[19] WANG D H, YIN Z Q, ZHANG Q W, et al. Nonvolatile chemical constituents from[J]. China J Chin Mat Med, 2010, 35(20): 2704–2707. [王大海, 殷志琦, 张庆文, 等. 广藿香非挥发性化学成分的研究 [J]. 中国中药杂志, 2010, 35(20): 2704–2707. doi: 10.4268/cjcmm20102014.]
Study on Secondary Metabolites of Endophytic Fungussp.RW-S10 from the
RUAN Wu1, GUO Jiaocen1, MA Qingyun2, YANG Li2, XIE Qingyi2,3, WU Yougen1*, ZHAO Youxing2*
(1. College of Horticulture, Hainan University, Haikou 570228, China; 2. Haikou Key Laboratory for Research and Utilization of Tropical Natural Products, Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Science, Haikou 571101, China;3. Hainan Academy of Tropical Agricultural Resource, Chinese Academy of Tropical Agricultural Science,Haikou 571101, China)
In order to obtain bioactive metabolites fromendophytic fungus, seven secondary metabolites were isolated and purified from the patchouliendophytic fungussp. RW-S10 by various chromatographic column techniques. Based on spectral data, their structures were identified as ogataearin (1), phenylalaninol (2), parahydroxyacet-ophenone (3), bis(dethio)bis(methylsulfanyl)gliotoxin (4),-phenylethyl acetamide (5), lumichrome (6), and dehydroxypaxilline (7). Compound1 was a new compound and showed-glucosidase inhibitory activity with IC50value of 39.38mol/L.
; Endophytic fungi; Secondary metabolite; Antimicrobial activity
10.11926/jtsb.4650
2022-04-08
2022-07-01
海南省重点研发计划项目(ZDYF2021SHFZ075);财政部和农业农村部国家现代农业产业技术体系专项(CARS-21);农业农村部财政专项项目(NFZX2021);中国热带农业科学院基本科研业务费专项(1630052022030)资助
This work was supported by the Project for Key Research and Development Plan in Hainan (Grant No. ZDYF2021SHFZ075), the Project for National Modern Agricultural Industrial Technology System of Ministry of Finance and Ministry of Agriculture and Rural Affairs (Grant No. CARS-21), the Special Project of Ministry of Agriculture and Rural Affairs (Grant No. NFZX2021), and the Special Project for Basic Scientific Research in Chinese Academy of Tropical Agricultural Sciences (Grant No. 1630052022030).
阮武(1994年生),男,硕士,从事观赏药用植物资源开发与应用研究。E-mail: 190902Z1210001@hainanu.edu.cn
. E-mail: wygeng2003@163.com; zhaoyouxing@itbb.org.cn
