利用饵料微藻表达抗菌肽及其初步应用
2023-10-17潘玉芳杨欢陈怡雯韩冬胡晗华
潘玉芳, 杨欢, 陈怡雯, 韩冬, 胡晗华
利用饵料微藻表达抗菌肽及其初步应用
潘玉芳, 杨欢, 陈怡雯, 韩冬*, 胡晗华*
(中国科学院水生生物研究所,武汉 430072)
为了解抗菌肽在饵料微藻中表达后的抗菌特性,构建海洋微拟球藻()、湖泊微拟球藻()和三角褐指藻()的抗菌肽(源自虹鳟,)表达质粒,分别转化相应的微藻,检测转化子中抗菌肽的表达量和体外抑菌效果,将藻株作为鱼饲料添加剂喂食斑马鱼,初步分析了抗菌肽及藻体自身的岩藻黄素和多不饱和脂肪酸对鱼免疫系统的影响。结果表明,外源抗菌肽在3种微藻中均可以成功表达,体外抑菌试验表明,仅三角褐指藻对水产领域常见致病菌爱德华氏菌()有一定的抑菌效果,然而抗菌肽的表达并未使3种藻株的体外抑菌性增加。添加藻粉对斑马鱼的生长无明显影响,通过检测鱼体肝脏中与抗氧化和免疫相关基因的表达水平及丙二醛的含量,表明添加藻粉可增强斑马鱼的抗氧化和抗炎症能力,表达抗菌肽(PtC组)能进一步提高斑马鱼的免疫力。另外,添加Pt6 (富含岩藻黄素)藻粉组比添加PtC的抗炎效果更显著,表明三角褐指藻中的岩藻黄素和二十碳五烯酸对增强鱼的抗病能力具有潜在作用。
饵料微藻;抗菌肽;免疫;抗氧化;鱼饲料
三角褐指藻()和微拟球藻()都是光合作用效率较高、生物量积累较快的单细胞真核微藻,富含多不饱和脂肪酸,三角褐指藻还富含岩藻黄素和金藻多糖,它们都是重要的经济型微藻[1–2],也是野生环境和水产养殖业的天然饵料。有研究报道,三角褐指藻可以作为鱼粉替代品,对大西洋鲑鱼的生长及饲料转化起到积极作用[2],微拟球藻属是轮虫培养中唯一一种在高密度培养条件下仍能持续不断提供供给的微藻饵料,并且与酵母和人工饲料相比,它们能提供更好的营养组分[3]。三角褐指藻和海洋微拟球藻()的全基因组已公布[4–5],成熟的遗传转化体系已建立[6–8]。微拟球藻属中唯一的淡水种类湖泊微拟球藻()的基因组序列虽然尚未测定,其高效的电击转化遗传体系在本实验室也已经建立[9]。3种微藻中都能成功地表达外源蛋白质,这为将它们改造为高效表达外源蛋白质的生物反应器打下了坚实的基础。
抗菌肽(antimicrobial peptides, AMPs)是一种机体快速合成的具有防御功能的小分子蛋白质,广泛存在于植物、动物和微生物体内[10],对各种细菌、病毒、真菌和寄生虫具有直接的抗菌活性[11]。抗菌肽不易导致耐药菌的出现,是一种可行的抗生素替代品[12]。抗菌肽还具有相当大的免疫功效,可调节动物机体的免疫力[13],在医药、妆化、生物农药、动植物抗病基因工程、天然食品防腐剂、生物饲料添加剂等方面有着广阔的产业化前景[14]。
目前,抗菌肽的获得方式主要从生物体内直接分离提纯、化学合成、酶解和基因工程生产。其中基因工程法常用的抗菌肽表达宿主主要为大肠杆菌和酵母,占异源表达抗菌肽的97.4%[15],但在水产养殖上的应用并不多见。与原核表达系统和酵母表达系统相比,微藻表达系统同样具备培养条件简单,生长周期短,遗传操作简单且能稳定遗传的优点,并且藻细胞安全无毒,既是蛋白质含量丰富、营养配比合理的保健食品,又是许多水产生物的天然饵料,无需再将表达的抗菌肽分离纯化,可以简化生产流程。有研究报道以莱茵衣藻作为微藻表达系统表达抗菌肽[16],然而,莱茵衣藻不含多不饱和脂肪酸,不属于常用的水产饵料,相比于硅藻、微拟球藻和金藻等水产饵料藻,经济价值和成本效益略有不足。
本研究选用虹鳟来源的导管素家族抗菌肽基因1 (GenBank: KP347620.1),去掉信号肽区域和Cathelin结构域,仅保留成熟肽区域的71个氨基酸(Cathelicidins 1蛋白C端的71个氨基酸, 其中66个氨基酸是发挥抗菌效用的主体)命名为Cath-1a。将Cath-1a分别在海洋微拟球藻、湖泊微拟球藻和三角褐指藻中表达,选择高效表达抗菌肽且具有体外抑菌活性的藻株进行扩大培养,作为鱼饲料添加剂喂食斑马鱼,通过测定斑马鱼肝脏组织中抗氧化和免疫相关基因的表达水平及丙二醛(MDA)的含量,探讨添加不同营养成分藻粉的斑马鱼饲料对斑马鱼免疫系统的影响,为商用藻种的筛选提供依据。
1 材料和方法
1.1 材料
试验藻株 试验所用三角褐指藻(CCAP 1055/1和CCMP 631, 简称为Pt1和Pt6)由巴黎高师Chris Bowler教授馈赠。海洋微拟球藻(MBIC 10090)购自于日本生物资源中心(NITE Biological Resource Center, NBRC)。三角褐指藻和海洋微拟球藻的液体培养基为f/2加富(不含硅元素)的人工海水培养基, pH为7.6~7.8。固体培养基由液体培养基稀释1倍后,加入1.2%的琼脂配置而成。湖泊微拟球藻(KR 1998/3)由德国淡水生态和内陆渔业研究所(Institute of Freshwater Ecology and Inland Fisheries, Neuglobsow) Lothar Krienitz教授提供,采用BG11培养基,固体培养基是由液体BG11培养基加1.2%琼脂配制。22℃恒温光照培养箱中连续光照培养,光强约为120mol/(m2·s)。藻株的扩大培养在5 L玻璃瓶中进行,使用空气泵充入经无菌滤膜过滤的空气培养6 d。
试验菌株 大肠杆菌DH5(本实验室保存)用于载体构建,采用LB培养基于37℃振荡(220 r/min)培养。无乳链球菌与爱德华氏菌由中国科学院水生生物研究所谢海峡研究员提供,无乳链球菌使用脑心浸液肉汤(BHI)培养基,爱德华氏菌使用胰蛋白胨大豆肉汤(TSB)培养基,固体培养基由液体培养基加入1.5%的琼脂配置而成。
试验斑马鱼 所用斑马鱼种鱼源自中国科学院水生生物研究所斑马鱼资源中心AB系野生型,在中国科学院水生生物研究所鱼类生理生态学学科组繁育。幼鱼开口期的饵料为草履虫(),孵化15 d后以丰年虫()喂食,选取70日龄的同一批次雄鱼作为试验对象, 试验开始前饥饿处理24 h。
1.2 蛋白原核表达和抗体制备
将Cath-1a原核表达质粒pGEX-4T-1-Cath-1a(Cath-1a的N端融合了谷胱甘肽硫转移酶[GST]标签)通过热激转化法转入BL21(DE3)感受态细胞中,挑取单菌落到含有氨苄抗性和氯霉素抗性的LB培养基中,经菌液PCR鉴定正确的单克隆摇菌至OD600=0.6时,加1.0 mmol/L异丙基-1-硫代-d吡喃型半乳糖(IPTG)诱导表达(20℃, 6 h)。诱导后以13680×离心1 min,取菌沉淀,用1×PBS重悬后,加入等体积的2×SDS loading buffer加热变性制样,用12%分离胶浓度的SDS-PAGE进行电泳分析表达情况。取表达量高的菌株活化后扩大培养并诱导表达,送福因德科技(武汉)有限公司进行抗原纯化, 制备并纯化抗Cath-1a的多克隆抗体。
1.3 表达抗菌肽的转基因藻株构建
pPha-NoVCP载体利用海洋微拟球藻基因的启动子(双向启动子)和基因的终止子实现外源基因的表达[9]。以质粒pGEX-4T-1-Cath-1a为模板,用引物和进行PCR扩增得887 bp的GST+Cath-1a片段,接入pPha-NoVCP载体的I和酶切位点之间, 得到质粒pPha-VCP-GST+Cath-1a。不带标签的Cath- 1a表达载体pPha-VCP-Cath-1a的构建方法相同,基因的扩增引物为和,大小为216 bp。
根据三角褐指藻密码子的偏好性将基因进行密码子优化,并在两端加上His标签的编码序列,由天一辉远生物科技有限公司合成,连到pPhaT1载体的I和dIII酶切位点之间,命名为pPha-His+Cath-1a。
将pPha-VCP-GST+Cath-1a和pPha-VCP-Cath- 1a质粒分别用I和I线性化后转入海洋微拟球藻和湖泊微拟球藻中,将pPha-His+Cath-1a质粒经I线性化后转入三角褐指藻Pt1中,参照前人[6–7,9]的方法进行遗传转化。
采用CTAB法提取基因组DNA,以野生型受体为阴性对照,相应的质粒为阳性对照,表达带GST标签抗菌肽转化子以和(在终止子上设计)为引物,表达不带标签抗菌肽的转化子以和为引物,表达带His标签抗菌肽的转化子以(在基因上游的pPhaT1载体骨架上设计)和(在终止子上设计)为引物,采用PCR方法检测目的基因是否插入微藻基因组中。载体构建和转化子PCR检测的引物见表1。
1.4 表达抗菌肽的转基因藻株的Western blot筛选
随机选择PCR阳性的转化子培养至对数期, 4℃2800×离心10 min收集藻体,用预冷的1×PBS洗涤藻细胞1次后,加入适量的RIPA裂解液(碧云天),裂解液在使用前数分钟内加入蛋白酶抑制剂PMSF至终浓度为1 mmol/L。冰上超声后离心提取藻株的总蛋白质,用BCA蛋白浓度测定试剂盒(碧云天)测定蛋白质浓度,用1×PBS调整样品浓度一致,以确保每个蛋白质样品的上样量一致,蛋白质样品-20℃保存。变性后的蛋白质经12%分离胶浓度的SDS-PAGE电泳分离后转移至PVDF膜上,内参抗体选用南京金斯瑞生物科技有限公司的抗-actin单克隆抗体,抗菌肽的免疫印迹检测使用本研究制备的抗Cath-1a的多克隆抗体,用Millipore公司的ECL发光液对结果进行显影。
1.5 体外抑菌效果评估
菌种于28℃液体培养基中摇床(200 r/min)培养过夜,使用无菌水稀释菌液,将爱德华氏菌稀释至1×106CFU,无乳链球菌稀释至1×109CFU,将200L稀释后的菌液均匀涂布于固体培养基平板上, 贴上6 mm灭菌后的滤纸片,纸片上滴加10L待检藻蛋白质提取液(1×PBS超声提取),以原核表达蛋白质提取液和1×PBS为对照,平板晾干后37℃培养箱过夜。
下划线表示酶切位点。
Underline indicates the restriction site.
1.6 藻粉成分测定
分别称取50 mg干藻粉进行总蛋白质、总糖和总脂肪的测定。蛋白质提取使用RIPA细胞裂解液超声法裂解细胞,蛋白质浓度测定使用BCA蛋白质浓度测定试剂盒;参照总糖含量试剂盒说明书, 使用水解法提取总糖,硝基水杨酸法测定藻粉总糖含量;使用氯仿-异丙醇法提取藻粉内油脂成分,以重铬酸钾氧化法测定脂肪含量。
采用氯仿-甲醇法提取藻粉总油脂,将提取的总油脂甲酯化后用正己烷萃取,制备气相色谱样品, 送至中国农业科学院油料作物研究所用气相色谱测定脂肪酸组成[17]。
参照Jeffrey等[18]的方法提取藻粉中的色素,用分光光度计分别测定OD630、OD480、OD664和OD750值,计算叶绿素a (Chl a)、叶绿素c (Chl c)和类胡萝卜素(Car)的含量。Chl a=11.47×OD664–0.4×OD630;Chl c=24.36×OD630–3.73×OD664;Car=10×(OD480–3× OD750)。
参照Yuan等[19]的方法,称取50 mg冻干藻粉提取藻粉中色素,使用高效液相色谱法测定岩藻黄素含量。
1.7 斑马鱼饲料制备和喂养
将白鱼粉、维生素预混物、矿物盐预混物、微晶纤维素、冻干藻粉分别用粉碎机打磨成粉后过筛,充分混合后膨化并烘烤干燥,粉碎过筛,筛出颗粒直径为180~250和250~380m的饲料备用。
选择体型大小相近的120条斑马鱼分缸后称取质量, 分成4组,对照组投喂未添加藻粉的饲料,3个试验组投喂的饲料分别添加1.5%的Pt1、Pt6、PtC (表达抗菌肽的Pt1转化子)藻粉。每组喂养15条鱼, 设置2个生物学重复,称量每组初始体重(湿重)后养殖于10 L容积塑料水缸,喂养24 d。受试斑马鱼第一周喂食180~250m直径的饲料,每日喂食量为鱼初始体重的5%~6%,第二周起喂食250~380m直径的饲料,每日喂食量为鱼初始体重的10%~12%。
1.8 斑马鱼组织取样和基因表达分析
对喂养23 d的斑马鱼进行饥饿处理24 h并称重,然后放入加冰的1×PBS溶液中麻醉,快速取出肝脏组织放置在无RNA酶的EP管中,液氮速冻保存于−80℃。用Trizol试剂法提取斑马鱼的肝脏总RNA,反转录成cDNA,以基因做内参,分析抗氧化和免疫相关的基因相对mRNA水平,采用2−△△CT法进行相对定量计算。
1.9 斑马鱼肝脏丙二醛(MDA )含量的测定
斑马鱼肝脏样品加入250L PBS溶液和适量石英砂,高通量研磨仪匀浆后取上清,使用BCA蛋白质浓度测定试剂盒测定样品蛋白质浓度,使用MDA测定试剂盒以硫代巴比妥酸法(TBA)测定样品MDA含量,最终结果以mmol/mg protein表示。
2 结果和分析
2.1 阳性转化藻株的筛选
藻株进行遗传转化后,随机挑选24个转化子置于含有博来霉素的48孔板中培养10 d,微拟球藻随机挑取6株转化子、三角褐指藻随机挑取17株转化子提取基因组DNA,用相应引物进行PCR鉴定,扩增基因和转基因质粒骨架上的部分序列。野生型基因组为模板均未扩增出条带,全部微拟球藻转化子(GC1-12和C1-C12) DNA和大部分三角褐指藻转化子(除P15之外) DNA都扩增得到与质粒对照模板(PL1-3)相当的条带(图1: A),初步表明外源基因已整合进入3种微藻的基因组中。
2.2 抗菌肽的表达
将含pGEX-4T-1-Cath-1a和pGEX-4T-1质粒的表达宿主菌经1.0 mmol/L IPTG于20 ℃诱导6 h后,同时以未诱导的pGEX-4T-1-Cath-1a菌株作参照, 进行SDS-PAGE电泳(图1: B)。结果表明,转化GEX- 4T-1-Cath-1a的宿主菌在33 kD附近有明显的诱导带,而转化空载pGEX-4T-1质粒的菌体主蛋白条带在26 kD附近(GST标签约26 kD),说明带有GST标签的Cath-1a在宿主菌中得到了表达。纯化原核表达的抗菌肽,免疫兔子并对抗血清进行亲和纯化和去GST纯化,得到抗Cath-1a的多克隆抗体(福因德公司制备)。取诱导表达抗菌肽的菌体裂解液上清,制样后梯度上样,用12% SDS-PAGE分离总蛋白质,以纯化的抗Cath-1a的多克隆抗体为一抗, 显影可见33 kD位置有明显条带,且随上样量的减少,目标条带也相应减弱,说明所制备的一抗有效(图1: C)。

图1 转基因藻株筛选和Cath-1a蛋白质的表达。A: 转基因藻株Cath-1a基因的PCR检测, M: Marker DL 2000; B: Cath-1a的原核表达, M: 分子量标记, 1: 经IPTG诱导的pGEX-4T-1菌株总蛋白质; 2: 未诱导的pGEX-4T-1-Cath-1a菌株总蛋白质; 3: 经IPTG诱导的pGEX-4T-1-Cath-1a菌株总蛋白质; C: 免疫印迹评估抗Cath-1a的多克隆抗体,1~4为梯度稀释的表达Cath-1a的菌体裂解液上清;D: 免疫印迹检测藻株中Cath-1a蛋白质的表达, Cath-1a: 抗Cath-1a的多克隆抗体; β-actin: 抗β-actin的内参单克隆抗体。NOH: 野生型海洋微拟球藻; KR98: 野生型湖泊微拟球藻; Pt1: 野生型三角褐指藻; PL1~ PL3: 质粒; GC1~GC6, C1~C6: 海洋微拟球藻转化子; GC7~GC12, C7~C12: 湖泊微拟球藻转化子; P1~P17: 三角褐指藻转化子。
为检测抗菌肽在微藻转化子中的表达情况,我们首先从转入了带有GST标签的Cath-1a转化子中随机挑选2个藻株进行蛋白质印记试验。野生型海洋微拟球藻(NOH)和湖泊微拟球藻(KR98)样品中均未检测到目标条带,在海洋微拟球藻转化子(GC1和GC2)和湖泊微拟球藻转化子(GC7和GC8)中均检测到抗菌肽Cath-1a融合GST标签蛋白质的表达(图1: D)。
GST标签蛋白的大小为26 kD,远大于预测的Cath-1a蛋白大小(7.25 kD),用GST融合蛋白质表达便于免疫印迹检测,但可能会对抗菌肽的活性有影响,因此我们进一步分析了不带标签或带His标签(2个6×His)的转化子中Cath-1a蛋白的表达情况,筛选表达抗菌肽的藻株用于下一步试验。3个野生型藻株(NOH、KR98和Pt1)中都没有检测到Cath-1a蛋白的表达,而所有转化藻株中均检测到抗菌肽Cath-1a的表达(图1: D)。海洋微拟球藻转化株C3、C5,湖泊微拟球藻转化株C7、C12和三角褐指藻转化株P1-3的抗菌肽表达量较高,将这些转化子用于下一步的抑菌效果评估。
2.3 抑菌效果检测
采用纸片抑菌圈法对3种野生型微藻和表达抗菌肽的转化子进行抑菌效果评估,受试菌为水生动物常见致病菌——革兰氏阳性细菌无乳链球菌和革兰氏阴性细菌爱德华氏菌。结果表明,在无乳链球菌抑菌试验中,所有藻株的蛋白质提取液均无抑菌圈出现(图2: A~C),表明它们对无乳链球菌均无抑菌效果。在爱德华氏菌抑菌试验中,微拟球藻及其转化子的蛋白质提取液也没有明显的抑菌圈(图2: D, E),但滴加了野生型三角褐指藻(WT)和3株表达抗菌肽Cath-1a的三角褐指藻转化子(P1~ P3)的蛋白质提取液的纸片边缘都出现了清晰抑菌圈(图2: F),而对照组未出现抑菌圈,各藻株抑菌圈大小无明显差异,表明三角褐指藻及转化子对爱德华氏菌均有抑菌效果,但表达抗菌肽似乎并未增强抑菌效果。

图2 蛋白质提取液的抑菌圈试验。A, B, C: 涂布无乳链球菌的平板; D, E, F: 涂布爱德华氏菌的平板; N: 野生型海洋微拟球藻; C3, C5: 海洋微拟球藻转化子; K: 野生型湖泊微拟球藻; C7, C12: 湖泊微拟球藻转化子; +: 滴加原核表达Cath-1a蛋白质提取液的对照; −: 1×PBS溶液对照; WT: 野生型三角褐指藻; P1~P3: 三角褐指藻转化子。
2.4 藻粉成分测定
我们的前期研究表明不同地域的野生型三角褐指藻Pt6比Pt1有更高的岩藻黄素含量,本研究选择2株野生型三角褐指藻(Pt1和Pt6)和表达抗菌肽的Pt1转化子(图1中的P2,为表述方便以下命名为PtC)进行扩大培养,首先测定3种藻粉的蛋白质、碳水化合物和脂肪含量(表2)。转化子PtC的蛋白质和脂肪含量略高于2种野生型,碳水化合物含量略低于2种野生型,Pt6的碳水化合物略高于Pt1,蛋白质和脂肪含量无差异。

表2 藻粉营养成分含量(% DW)
同行数据后不同字母表示差异显著(<0.05)。
Data followed different letters at the same line indicate significant differences at 0.05 level by One-Way ANOVA.
从图3: A, B可见,虽然3种藻粉的脂肪酸含量占总脂的比例略有不同,但组成上均以肉豆蔻酸(C14:0)、棕榈酸(C16:0)、棕榈油酸(C16:1)和二十碳五烯酸(EPA, C20:5)为主,占总脂肪酸的90%以上。Pt6藻粉中EPA占总脂的摩尔百分比虽然低于Pt1和PtC,但由于其脂肪酸总量远高于Pt1和PtC (分别高56.5%和55.8%),所以EPA含量也显著高于Pt1和PtC,说明Pt6更具营养效益。
3种藻粉的色素组成均以Chl a为主,占总色素含量的50%以上(图3: C)。Pt6的总色素含量显著高于Pt1和PtC,其中Chl a含量比Pt1和PtC分别高47%和38%,类胡萝卜素含量比Pt1和PtC分别高83%和38%,Chl c含量在3种藻粉中无显著差异。此外,Pt6的岩藻黄素含量也显著高于Pt1和PtC (图3: D)。
2.5 饲料中添加藻粉对斑马鱼的影响
分别称量斑马鱼养殖前后的体重,计算体重增长率(表3), 经单因素ANOVA分析,表明4种饲料喂养的斑马鱼体重增长无显著差异。
RT-qPCR分析斑马鱼肝脏中与抗氧化和免疫相关基因(引物见表1)的表达情况,结果表明(图4: A),与空白饲料组相比,添加藻粉影响了斑马鱼抗氧化和免疫相关基因的表达水平,其中,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、免疫球蛋白D (IgD)、M (IgM)和溶菌酶(Lyz)的编码基因表达水平相对增加,toll样受体1、2、4和22 (TLR1、TLR2、TLR4和TLR22)、髓样分化因子88 (MyD88)、肿瘤坏死因子(TNF)、白细胞介素1、6和8 (IL1β、IL6、IL8)的编码基因表达水平相对减少。添加藻粉组的MDA含量均低于空白饲料组,Pt6和PtC的MDA含量低于Pt1,Pt6和PtC间无显著差异(图4: B)。

表3 饲料中添加藻粉对斑马鱼生长的影响
3 结论和讨论
3.1 饵料微藻中表达抗菌肽
三角褐指藻和微拟球藻具有较高的光合作用效率和生物量,并富含多不饱和脂肪酸,特别是EPA,可作为生物反应器工业化生产各行业所需要的高附加值原料,也能作为鱼类幼体和轮虫的饵料,甚至可能成为人类的食品[20–22]。有报道在单细胞真核藻类中表达抗菌肽多使用莱茵衣藻[16],然而衣藻不是水产饵料微藻,藻种本身的营养价值不如金藻、硅藻、微拟球藻等饵料藻类。为提高外源蛋白质的表达量,可以通过优化外源基因的密码子,以符合宿主的密码子偏好。由于湖泊微拟球藻的基因组序列尚未测定,对海洋微拟球藻密码子偏好性分析表明,虹鳟来源的基因并不存在特殊偏好,因此本研究只对三角褐指藻抗菌肽表达质粒的抗菌肽基因序列进行了密码子优化。使用融合表达载体表达抗菌肽Cath-1a,有利于降低抗菌肽对宿主细胞的毒性,提高表达量,简化纯化过程[23]。本研究分别将带有GST标签、His标签和未带任何标签的抗菌肽基因经过电转化方法导入藻细胞,在DNA和蛋白质水平均检测到的成功插入与表达。
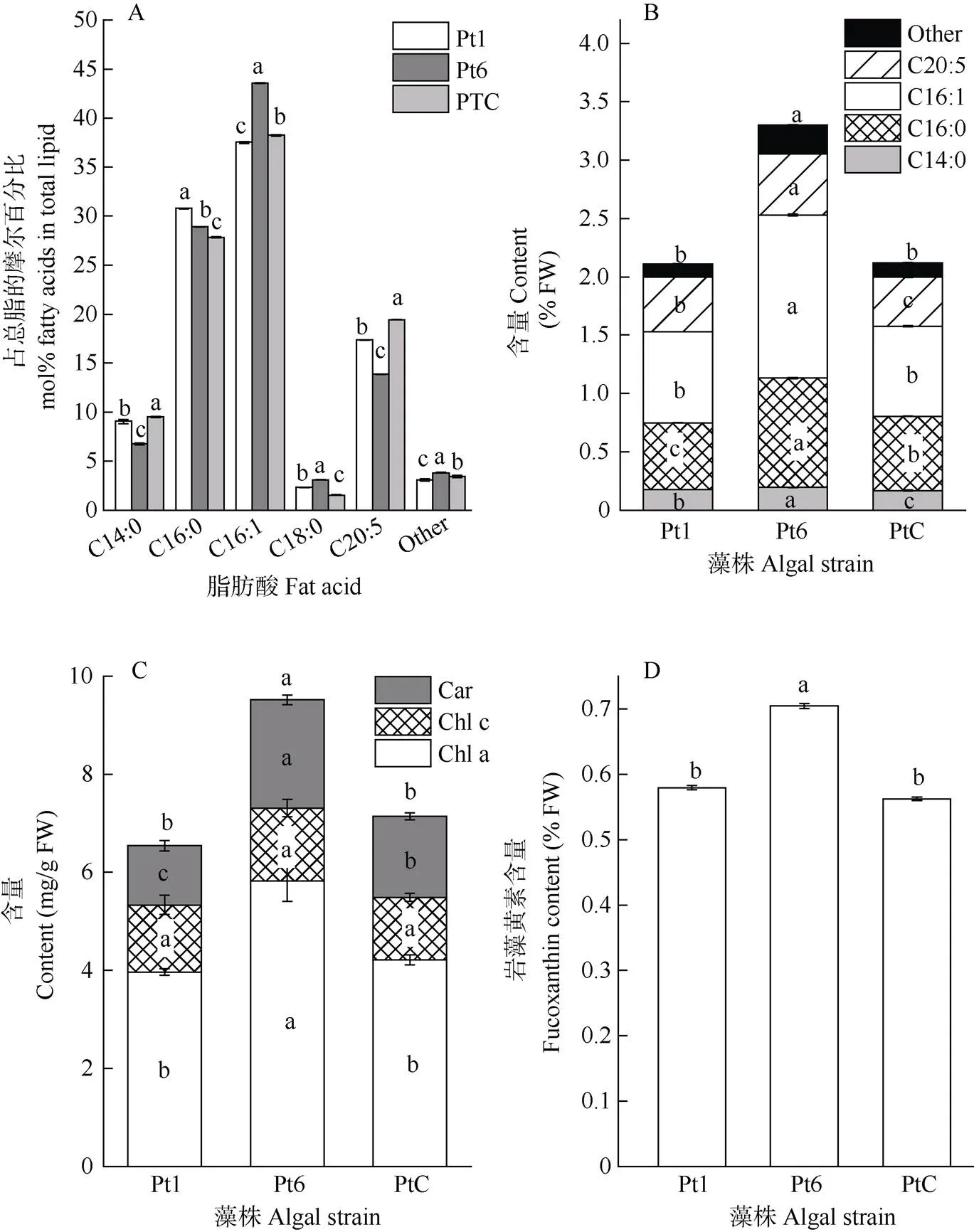
图3 藻粉的脂肪酸组成和色素含量。A: 脂肪酸组成; B: 脂肪酸含量; C: 色素含量; D: 岩藻黄素含量。柱上不同字母表示差异显著(P<0.05)。下同

图4 斑马鱼免疫相关基因的表达(A)和肝脏的MDA含量(B)
3.2 饵料微藻中表达抗菌肽的体外抑菌效果
对微藻表达的抗菌肽进行抑菌效果评价,已往研究是提取藻株总蛋白质后亲和纯化或超滤浓缩纯化,再使用抑菌圈法或比浊法验证[16,24]。本研究探讨使用藻株饲喂水产动物的应用价值,不考虑提取纯化抗菌肽,直接使用转化藻株蛋白质提取液进行抑菌效果评价。
抗菌肽具有广谱抗菌性,不仅对细菌有效,对真菌和寄生虫均有抑制或杀死作用。天蚕素对多种革兰氏阳性和阴性菌具有抑制作用,且能抑制艾滋病病毒基因表达,从而减少艾滋病病毒的增殖[25]。防御素和导管素可以在体外杀死细菌、真菌和具膜结构的病毒[26];部分抗菌肽可以杀死草履虫和变形虫等原生动物[27];某种牛的抗菌肽可以激活细胞凋亡,清除炎症部位的有害细胞,达到抗肿瘤的目的[28]。动物体内的抗菌肽还可在体内引发体液和细胞免疫反应,调节动物机体的免疫力[13]。本研究在3种微藻中表达的抗菌肽都没有显著的体外抑菌效果,可能是因为Cath-1a体外的抗菌性能不显著,也可能是Cath-1a有更广谱的抑菌和增强动物免疫力的功效,需要在动物机体内的才会显现出作用,还可能与微藻中抗菌肽的表达量不高有关,后续的研究可以尝试将抗菌肽在藻细胞叶绿体中进行表达,进一步提高其表达量。
3.3 饲料中添加藻粉对斑马鱼抗氧化能力和免疫力的影响
三角褐指藻是水产动物的天然饵料,其富含的岩藻黄素具有抗氧化、抗炎等多种效用,本研究在鱼饲料中添加了野生型三角褐指藻Pt1和Pt6 (岩藻黄素含量较高)、表达抗菌肽的PtC藻粉,结果表明饲料中添加藻粉对斑马鱼的体质量无影响。相似的,Sørensen等[2]报道,成年斑马鱼在喂养添加三角褐指藻藻粉的饲料21 d后,体重也无变化。这可能与实验鱼的年龄、喂养时间、藻粉的添加量有关。
SOD是抗氧化防御系统的第一道防线,催化超氧阴离子发生歧化反应生成过氧化氢,随后过氧化氢在CAT的催化下生成水和氧分子。所以SOD和CAT具有清除细胞内活性氧,保护鱼体免受氧化损伤的作用[29]。此外,MDA含量也常用于反映机体的抗氧化能力,用以评价生物体内脂质的过氧化水平[30]。本研究中,相比于空白饲料组,3个添加藻粉组的和/或表达水平有增加趋势,并且添加藻粉组的MDA含量均低于空白饲料组,说明添加藻粉组斑马鱼受到的氧化损伤低于空白饲料组,具有较强的抗氧化能力,添加不同藻粉组的MDA含量无明显差异。由此推测,三角褐指藻藻粉可能改变抗氧化酶的基因表达,减少氧自由基对机体的破坏。
通常而言,硬骨鱼类依赖非特异性免疫执行免疫应答,对抗病原体感染[31]。免疫球蛋白和溶菌酶是鱼类体液免疫(非特异性免疫的第二道防线)的重要组成部分[32]。IgD和IgM均由B淋巴细胞分泌,IgD可以通过与多种病原体结合,阻止病原体进入器官从而发挥免疫作用,IgM可通过调节炎症细胞因子的产生来抵抗细菌感染[33–34]。溶菌酶在鱼体内发挥的溶菌作用,可以保护鱼类,抵抗病原微生物的入侵[35]。因此,这三者的表达水平可以反映鱼体的免疫水平。本研究中,添加藻粉组的、和的表达水平比对照组均有所增加,可能说明添加食用藻粉的饲料提高了斑马鱼的免疫力。
免疫细胞介导的非特异免疫是通过细胞表面或细胞质内的模式识别受体识别病原相关的分子模式,然后激活一系列抗微生物信号通路来实现的。toll样受体(TLRs)主要存在于脊椎动物的免疫细胞中,通过识别微生物产物从而诱导激活免疫反应[36]。TLRs均可通过髓MyD88依赖型信号通路转导信号,传递活化信号至下游,诱导促炎基因的表达[37]。有研究表明,某些活性成分可以降低大鼠肠道中的和表达,影响MyD88信号通路,减少促炎性因子的释放,进而推断这些成分具有治疗效果[38–39]。TNF是一种促进肿瘤细胞坏死的蛋白质,可以调节炎症反应和免疫应答,协助机体抵抗细菌和病毒感染[40]。IL1是一种促炎因子,能诱导趋化因子、粘附分子等的合成,IL6和IL8既是一种细胞趋化因子,也是促炎因子,能诱导IL1和TNF生成,均可作为炎症监测指标预测鱼体炎症性疾病[41]。本研究中,添加藻粉组的、、、、、、、和表达量比对照组均降低,总体上Pt6组的基因表达水平比Pt1和PtC组低,PtC组的基因表达水平比Pt1组略微下降。据此推测,本研究的3种藻粉可能具有提高斑马鱼机体免疫的功能和增强斑马鱼抗病能力的效果,且Pt6和PtC藻粉的效果比Pt1藻粉好,表明三角褐指藻中表达抗菌肽能进一步提高斑马鱼的免疫力。EPA和岩藻黄素在抗炎和免疫调节方面有重要作用[42–43],野生型三角褐指藻株Pt6中有更高的EPA和岩藻黄素含量,结合基因表达情况分析,推测EPA和岩藻黄素在增强斑马鱼的抗病力方面也有重要作用。
综上所述,本研究利用湖泊微拟球藻、海洋微拟球藻和三角褐指藻3种饵料微藻为宿主,均可成功表达外源抗菌肽,并且三角褐指藻蛋白提取液表现出一定的体外抑菌性,初步揭示了饵料微藻三角褐指藻能增强斑马鱼的抗氧化和抗炎症能力,三角褐指藻中表达抗菌肽能进一步提高斑马鱼机体免疫力。本研究为饵料微藻高效表达抗菌肽提供了有力支撑,也为饵料微藻表达抗菌肽在水产养殖中的应用奠定了基础。
[1] Hu Q, Sommerfeld M, Jarvis E, et al. Microalgal triacylgly- cerols as feedstocks for biofuel production: perspectives and advances [J]. Plant J, 2008, 54(4): 621–639. doi: 10.1111/j.1365-313X.2008.034 92.x.
[2] Sørensen M, Berge G M, Reitan K I, et al. Microalgain feed for Atlantic salmon () effect on nutrient digestibility, growth and utilization of feed [J]. Aquaculture, 2016, 460: 116–123. doi: 10.1016/j.aquaculture.2016.04.010.
[3] Freire I, Cortina-Burgueño A, Grille P, et al.: A freshwater microalga for marine aquaculture [J]. Aquaculture, 2016, 459: 124–130. doi: 10.1016/j.aquaculture.2016.03. 015.
[4] Bowler C, Allen A E, Badger J H, et al. Thegenome reveals the evolutionary history of diatom genomes [J]. Nature, 2008, 456(7219): 239–244. doi: 10.1038/nature07410.
[5] Vieler A, Wu G X, Tsai C H, et al. Genome, functional gene anno- tation, and nuclear transformation of the heterokont oleaginous algaCCMP1779 [J]. PLoS Genet, 2012, 8(11): e1003064. doi: 10.1371/journal.pgen.1003064.
[6] Li F J, Gao D W, Hu H H. High-efficiency nuclear transformation of the oleaginous marinespecies using PCR product [J]. Biosci Biotechnol Biochem, 2014, 78(5): 812–817. doi: 10.1080/0916 8451.2014.905184.
[7] Zhang C Y, Hu H H. High-efficiency nuclear transformation of the diatomby electroporation [J]. Mar Genom, 2014, 16: 63–66. doi: 10.1016/j.margen.2013.10.003.
[8] Karas B J, Diner R E, Lefebvre S C, et al. Designer diatom episomes delivered by bacterial conjugation [J]. Nat Commun, 2015, 6: 6925. doi: 10.1038/ncomms7925.
[9] Chen Y W, Hu H H. High efficiency transformation by electro- poration of the freshwater alga[J]. World J Microbiol Biotechnol, 2019, 35(8): 119. doi: 10.1007/s11274-019- 2695-9.
[10]HU Y Y, YAO B. Advance in research of fish antimicrobial peptides [J]. J Wuhan Inst Technol, 2020, 42(1): 8–17. [胡媛媛, 姚波. 鱼类抗菌肽的研究进展[J]. 武汉工程大学学报, 2020, 42(1): 8–17. doi: 10. 19843/j.cnki.CN42-1779/TQ.201908002.]
[11] Gordon Y J, Romanowski E G, Mcdermott A M. A review of antimicrobial peptides and their therapeutic potential as anti-infec tive drugs [J]. Curr Eye Res, 2005, 30(7): 505–515. doi: 10.1080/0271 3680590968637.
[12] Hancock R E W, Diamond G. The role of cationic antimicrobial peptides in innate host defences [J]. Trends Microbiol, 2000, 8(9): 402– 410. doi: 10.1016/S0966-842X(00)01823-0.
[13] Yang D, Biragyn A, Hoover D M, et al. Multiple roles of antimicrobial defensins, cathelicidins, and eosinophil-derived neuro- toxin in host defense [J]. Annu Rev Immunol, 2004, 22: 181–215. doi: 10.1146/annurev.immunol.22.012703.104603.
[14] WU T T, YANG J. Progress in investigation of natural antimicrobial peptides and application prospect [J]. Biotechnol Bull, 2009(1): 27–30. [吴甜甜, 杨洁. 天然抗菌肽的研究进展及应用前景[J]. 生物技术通报, 2009(1): 27–30. doi: 10.13560/j.cnki.biotech.bull.1985.2009.01. 002.]
[15] Li Y F, Chen Z X. RAPD: A database of recombinantly-produced antimicrobial peptides [J]. Fems Microbiol Lett, 2008, 289(2): 126–129. doi: 10.1111/j.1574-6968.2008.01357.x.
[16] ZHAO Y P, LI X Y, PENG T T, et al. Expression of exogenous antimicrobial peptides in[J]. J Hydroecol, 2021, 42(3): 106–113. [赵艳苹, 李小燕, 彭婷婷, 等. 以莱茵衣藻为载体表达外源抗菌肽的研究 [J]. 水生态学杂志, 2021, 42(3): 106– 113. doi: 10.15928/j.1674-3075.202003300080.]
[17] HU H H, GAO K S. Optimization of growth and fatty acid composition of a unicellular marine picoplankton,sp., with enriched carbon sources [J]. Biotechnol Lett, 2003, 25(5): 421–425. doi: 10.1023/a:1022489108980.
[18] Jeffrey S W, Humphrey G F. New spectrophotometric equations for determining chlorophylls a, b, c1and c2in higher plants, algae and natural phytoplankton [J]. Biochem Physiol Pflanzen, 1975, 167(2): 191–194. doi: 10.1016/S0015-3796(17)30778-3.
[19] Yuan J P, Chen F, Liu X, et al. Carotenoid composition in the green microalga[J]. Food Chem, 2002, 76(3): 319–325. doi: 10.1016/S0308-8146(01)00279-5.
[20] Lubzens E, Gibson O, Zmora O, et al. Potential advantages of frozen algae (sp.) for rotifer () culture [J]. Aquaculture, 1995, 133(3/4): 295–309. doi: 10.1016/0044- 8486(95)00010-Y.
[21] Yarnold J, Karan H, Oey M, et al. Microalgal aquafeeds as part of a circular bioeconomy [J]. Trends Plant Sci, 2019, 24(10): 959–970. doi: 10.1016/j.tplants.2019.06.005.
[22] Butler T, Kapoore R V, Vaidyanathan S.: A diatom cell factory [J]. Trends Biotechnol, 2020, 38(6): 606–622. doi: 10.1016/j.tibtech.2019.12.023.
[23] Barrell P J, Liew O W, Conner A J. Expressing an antibacterial protein in bacteria for raising antibodies [J]. Protein Expr Purif, 2004, 33(1): 153–159. doi: 10.1016/j.pep.2003.08.026.
[24] Mu F Y, Li H, Hu Z L. Expression of tandem repeat Cecropin B inand its antibacterial effect [J]. Prog Biochem Biophys, 2012, 39(4): 344–351. doi: 10.3724/SP.J.1206.2010. 00671.
[25] DU S H, LIU X M, WAN Q, et al. Cecropins as antimicrobial peptides [J]. Chin J Anim Nutr, 2012, 24(1): 41–47. [杜淑环, 刘秀明, 万秋, 等. 天蚕素抗菌肽的研究进展 [J]. 动物营养学报, 2012, 24(1): 41– 47. doi: 10.3969/j.issn.1006-267x.2012.01.007.]
[26] Yang D, Chertov O, Oppenheim J J. Participation of mamma- lian defensins and cathelicidins in anti-microbial immunity: Receptors and activities of human defensins and cathelicidin (LL-37) [J]. J Leukoc Biol, 2001, 69(5): 691–697.
[27] LI W C, LI S B. Application prospects of antibacterial peptides in animal husbandry industry [J]. Feed Ind, 2005, 26(16): 14–16. [李文春,李松柏. 抗菌肽在畜牧业上的应用前景 [J]. 饲料工业, 2005, 26 (16): 14–16. doi: 10.3969/j.issn.1001-991X.2005.16.003.]
[28] Zanetti M. Cathelicidins, multifunctional peptides of the innate immunity [J]. J Leukoc Biol, 2004, 75(1): 39–48. doi: 10.1189/jlb.040 3147.
[29] LIANG X M, ZENG F, ZHANG Q F, et al. Effects of combined exposure to mercury and cadmium on histology and the expression of antioxidative enzyme genes in gonads of zebrafish [J]. J Chongqing Norm Univ (Nat Sci), 2018, 35(3): 59–64. [梁晓敏, 曾凤, 张群芳, 等. 汞镉联合暴露对斑马鱼性腺组织学和抗氧化酶基因表达的影响 [J]. 重庆师范大学学报(自然科学版), 2018, 35(3): 59–64. doi: 10. 11721/cqnuj20180314.]
[30] Jin Y X, Zhang X X, Shu L J, et al. Oxidative stress response and gene expression with atrazine exposure in adult female zebrafish () [J]. Chemosphere, 2010, 78(7): 846–852. doi: 10.1016/j. chemosphere.2009.11.044.
[31] Rodríguez I, Novoa B, Figueras A. Immune response of zebrafish () against a newly isolated bacterial pathogen[J]. Fish Shellfish Immunol, 2008, 25(3): 239– 249. doi: 10.1016/j.fsi.2008.05.002.
[32] Forsatkar M N, Safari O, Boiti C. Effects of social isolation on growth, stress response, and immunity of zebrafish [J]. Acta Ethol, 2017, 20(3): 255–261. doi: 10.1007/s10211-017-0270-7.
[33] Salonen E M, Hovi T, Meurman O, et al. Kinetics of specific IgA, IgD, IgE, IgG, and IgM antibody responses in rubella [J]. J Med Virol, 1985, 16(1): 1–9. doi: 10.1002/jmv.1890160102.
[34] Boes M, Prodeus A P, Schmidt T, et al. A critical role of natural immunoglobulin M in immediate defense against systemic bacterial infection [J]. J Exp Med, 1998, 188(12): 2381–2386. doi: 10.1084/jem. 188.12.2381.
[35] WEI S N, QIN Q W. Advance on lysozyme and cathepsin of fish [J]. Guangxi Sci, 2018, 25(1): 32–35. [魏世娜, 秦启伟. 鱼类溶菌酶和组织蛋白酶研究进展 [J]. 广西科学, 2018, 25(1): 32–35. doi: 10.13656/j. cnki.gxkx.20180206.002.]
[36] Majewska M, Szczepanik M. The role of Toll-like receptors (TLR) in innate and adaptive immune responses and their function in immune response regulation [J]. Postępy Hig Med Dośw, 2006, 60: 52– 63.
[37] SHAN J L, CHENG H Y, WEN L, et al. Advances in research of TLR/MyD88/NF-κB signaling pathway in different diseases [J]. Chin Pharmacol Bull, 2019, 35(4): 451–455. [单佳铃, 程虹毓, 文乐, 等. TLR/MyD88/NF-κB信号通路参与不同疾病作用机制研究进展 [J]. 中国药理学通报, 2019, 35(4): 451–455. doi: 10.3969/j.issn.1001- 1978.2019.04.002.]
[38] ZHANG L, ZHOU Y P, LIU G W. Therapeutic effects of astragalus saponin on rats with atrophic gastritis and MyD88, TLR4 receptor [J]. Chin J Exp Trad Med Form, 2013, 19(2): 226–229. [张莲, 周语平, 刘光炜. 黄芪皂苷对大鼠萎缩性胃炎的治疗作用及对MyD88, TLR4受体的影响 [J]. 中国实验方剂学杂志, 2013, 19(2): 226–229. doi: 10.13422/j.cnki.syfjx.2013.02.067.]
[39] LI C, YU Y, FAN Y F, et al. Effect of Shaohuang Anchang decoction on TLR4/Myd88/NF-κB signaling pathway in ulcerative colitis rats [J]. Chin J Exp Trad Med Form, 2014, 20(7): 151–155. [李晨, 俞媛, 范尧夫, 等. 芍黄安肠汤对溃疡结肠炎大鼠TLR4/MyD88/NF-κB信号通路的影响 [J]. 中国实验方剂学杂志, 2014, 20(7): 151–155. doi: 10. 13422/j.cnki.syfix.2014070151.]
[40] QIU L H, ZHANG H H, WU J F. TNFα and receptors in fish-A review [J]. J Fishery Sci China, 2004, 11(5): 482–487. [邱丽华, 张汉华, 吴进锋. 鱼类肿瘤坏死因子基因和受体的研究进展 [J]. 中国水产科学, 2004, 11(5): 482–487. doi: 10.3321/j.issn:1005-8737.2004.05.017.]
[41] LIU Z J, ZHAO J, BU Y X, et al. Expression patterns of IL-8 protein during bacterial LPS-induced inflammatory response in grass carp () [J]. J Fisheries China, 2017, 41(7): 1028– 1035. [柳昭君, 赵杰, 卜云璇, 等. IL-8在LPS诱导的草鱼炎症过程中的表达特征 [J]. 水产学报, 2017, 41(7): 1028–1035. doi: 10.11964/ jfc.20160210278.]
[42] Heo S J, Yoon W J, Kim K N, et al. Evaluation of anti-inflammatory effect of fucoxanthin isolated from brown algae in lipopolysaccha- ride-stimulated RAW 264.7 macrophages [J]. Food Chem Toxicol, 2010, 48(8/9): 2045–2051. doi: 10.1016/j.fct.2010.05.003.
[43] LIU Z S, JIANG Y, CHEN F. Roles of arachidonic acid, docosa- hexaenoic acid and eicosapentaenoic acid in inflammation [J]. J Food Saf Qual, 2016, 7(10): 3890–3899. [柳泽深, 姜悦, 陈峰. 花生四烯酸、二十二碳六烯酸和二十碳五烯酸在炎症中的作用概述 [J]. 食品安全质量检测学报, 2016, 7(10): 3890–3899. doi: 10.19812/j.cnki. jfsq11-5956/ts.2016.10.008.]
Expression of Antimicrobial Pepetides in Microalgae for Aquaculture and Its Preliminary Application
PAN Yufang, YANG Huan, CHEN Yiwen, HAN Dong*, HU Hanhua*
(Institute of Hydrobiology, Chinese Academy of Sciences,Wuhan 430072, China)
To understand the roles of antimicrobial peptides expressed in microalgae for aquaculture, expression vectors containing(from rainbow trout) gene were constructed and introduced to,and, respectively.Randomly selected transformants were confirmed by PCR and Western Blot. Positive clones were used for thebacteriostatic experiments, and some lines were used as additives to feed zebrafish in order to test the effect of different nutrients on the immune system of fish. The results showed that all the three algal strains had successfully expressed exogenous antimicrobial peptides. Onlyshowed a bacteriostatic effect on, a common pathogenic bacterium in aquaculture, and there was no significant difference in the bacteriostatic effect between the wild-type and transformants of the three species of microalgae. The growth of zebrafish fed with algae as additives had no significant difference compared with the control (without additives). The expression levels of antioxidant and immune related genes together with the content of malondialdehyde (MDA) in the liver of zebrafish indicated that zebrafish fed with additives showed stronger antioxidant and anti-inflammatory ability than the control, and expression of antimicrobial peptides (PtC, a wild-typestrain Pt1 transformant expressinggene) could further enhance the immunity of zebrafish. In addition, the anti-inflammatory capacity of the group with Pt6 (a wild-typestrain with high fucoxanthin content) additives is more significant than that of the group with PtC additives, which indicated that fucoxanthin and eicosapentaenoic acid (EPA) inmight enhance disease resistance of zebrafish.
Microalgae for aquaculture; Antimicrobial peptide; Immunity; Antioxidation; Fish meal
10.11926/jtsb.4634
2022-03-07
2022-05-10
中国科学院水生生物研究所特色研究所服务项目(Y85Z061601);中国科学院国际伙伴计划项目(152342KYSB20200031);国家重点研发计划项目(2018YFD0901500)资助
This work was supported by the Featured Institute Service Projects of Institute of Hydrobiology, Chinese Academy of Sciences (Grant No. Y85Z061601), the International Partnership Program of Chinese Academy of Sciences (Grant No. 152342KYSB20200031), and the National Key Research & Development Program of China (Grant No. 2018YFD0901500).
潘玉芳(1987年生),女,博士,实验师,主要从事藻类分子生物学研究。E-mail: panyufang@ihb.ac.cn
. E-mail: hand21cn@ihb.ac.cn; hanhuahu@ihb.ac.cn
