卤水中耐酸耐盐产细菌素乳酸菌的筛选
2023-10-17唐海峰崔子杭盘赛昆侯晓月
孙 昊, 唐海峰, 刘 欢, 崔子杭, 盘赛昆, 侯晓月, 杨 杰
(江苏海洋大学海洋食品与生物工程学院,江苏连云港 222005)
乳酸菌具有良好发酵特性。 乳酸菌(LAB)是能够发酵糖类物质转化为大量乳酸的一类物质,呈球状或杆状、 不产芽孢的革兰氏阳性细菌的统称 (Bao 等,2012)。 能产多种具有抑菌活性的物质,例如:乳酸、乙酸、过氧化氢、细菌素等(Pradhan 等,2021), 可通过竞争性排斥来抑制病原体(Ayala 等,2019)。 乳酸菌主要包括乳球菌属、乳杆菌属、链球菌属及肠球菌属等。
植物乳杆菌属于乳杆菌属,因多数从植物中分离而得名(赵小茜等,2017;胡爱华等,2015;李利等,2015),主要来源有天然原料奶、水果、肉、蔬菜和地方特色发酵食品等 (Reuben 等,2020;Handa等,2016),此外,也存在人体的胃肠、口腔(Thompson 等,2020)。 植物乳杆菌 (Lactobacillus plantarum)作为人体和禽畜肠道内的优势菌之一,研究表明,其具有维持肠道健康、提高免疫力、调节肠道微生物菌群平衡、拮抗致病菌感染、抗氧化性等多种功效(La Fata 等,2018;Rinaldi 等,2018), 在食品、医疗保健、饲料等领域被广泛应用,国内外学者对其益生功能和临床研究越来越深入。
细菌素是由乳酸菌核糖体合成的一类抗菌肽,属于胞外产物,具有抑菌效率高、不易残留、耐高温、无毒害、不产生抗性(Perez 等,2014)等优点。细菌素主要由多肽或者抗菌蛋白组成,是天然的防腐剂(郑文雄等,2021;曹硕等,2019)。 细菌素因其安全性、稳定性等作为生物防腐剂替代化学防腐剂是必然趋势(Seyed 等,2018),具有广阔应用前景。
抗生素作为最常用的药物之一, 能杀灭或抑制微生物(王润玲等,2014)。抗生素饲料喂养畜禽短时间可以促进动物生长、 预防或者治疗动物感染等,但是长期使用会导致畜禽肠道菌群紊乱,生物富集层层积累到人体内, 甚至促进超级耐药细菌的产生和扩散(王何中等,2019),导致产生生物安全、食品安全和环境污染等问题。 因此,自2020年7 月,我国饲料全面“禁抗”。 乳酸菌饲料制剂以其维持肠道菌群平衡、促进动物健康生长、提高饲料转化率等优点逐渐成为抗生素的替代品(刘震坤等,2022)。本试验从农家生产发酵的卤水中分离筛选出一株植物乳杆菌,对其生长曲线、产酸能力、耐酸能力、耐盐能力和所产抑菌物质进行了研究和分析,为开发优良的乳酸菌饲料制剂提供参考。
1 材料和方法
1.1 试验材料
1.1.1 样品 试验采用的乳酸菌筛自贵州省黔东南苗族侗族自治州农家生产卤水。
1.1.2 指示菌 金黄色葡萄球菌、蜡样芽孢杆菌、大肠杆菌、蜡样芽孢杆菌。
1.1.3 培养基和试剂 MRS 肉汤、MRS 培养基、LB 培养基、盐酸、氢氧化钠、过氧化氢酶、胃蛋白酶3000 U/g、胰蛋白酶250 U/mg、蛋白酶K 30 U/mg,革兰氏染色试剂盒,杭州百思生物科技有限公司;乳酸菌生化鉴定试剂盒,海博生物技术有限公司。
1.1.4 仪器与设备 YXQ-LS-50SI 立式压力蒸汽灭菌器, 上海讯博实业有限公司医疗设备厂;DK-S24 型电热恒温水浴锅, 上海精宏实验设备有限公司;DHG-9240A 电热恒温鼓风干燥箱,上海一恒科技有限公司;DNP-9126 型电热恒温培养箱, 上海精宏实验设备有限公司;PHS-3CW Microprocessor pH/mV Merer, 上海理大智能电子有限公司; D-37520 高速冷冻离心机美国赛默飞世尔科技有限公司;3730XL 测序仪,美国ABI;SH2-D(Ⅲ)循环水式真空泵,上海越众仪器设备有限公司;RE52-AA 旋转蒸发仪, 上海亚荣生化仪器厂; BCD-537WLDPC 冰箱海尔智家股份有限公司。
1.2 试验方法
1.2.1 乳酸菌的分离纯化 取适量样品梯度稀释10-4~10-7后, 用涂布法接种到固体MRS 培养基中,每个梯度稀释液涂布三块平板于37 ℃倒置培养48 h。 根据形态特征挑选典型菌落,反复划线获得纯菌株后进行甘油保存备用, 进行革兰氏染色镜检。
1.2.2 生长曲线的测定 将活化的菌株, 按1%的接种量接种到MRS 肉汤培养基中,37 ℃厌氧培养48 h,每隔2 h 取样,在600 nm 波长处测定样品的光密度(OD)值,绘制不同菌株的生长曲线图。
1.2.3 产酸能力的测定 将活化的菌株, 按1%的接种量接种到MRS 肉汤培养基中,37 ℃厌氧培养48 h,每隔2 h 取样,测pH,绘制不同菌株的pH 曲线图。
1.2.4 耐酸性试验 将活化的菌株, 按1%的接种量接种到pH 分别为6.0、5.0、4.0、3.0、2.0 的MRS肉汤培养基中,37 ℃厌氧培养48 h, 每隔2 h 取样,在600 nm 波长处测定样品的OD 值,每个菌株至少做3 个平行, 对菌株在不同pH 下的生长情况进行研究。
1.2.5 耐盐性试验 将活化的菌株, 按1%接种量接种到含NaCl 浓度分别为0、4%、8%、12%、16%的MRS 肉汤培养基中,37 ℃厌氧培养48 h,在4、8、12、24、36、48 h 无菌环境下取样,在600 nm波长处测定其OD 值。
1.3 乳酸菌发酵上清液的制备 取在甘油管中保藏的MMB-09 菌株, 以1%的接种量接到MRS肉汤培养基中,37 ℃静置培养12 h 后, 再按1%接种量接种到2 L 新鲜MRS 肉汤培养基中,37 ℃静置培养48 h。发酵结束后4 ℃、8000 g 离心20 min,弃沉淀取发酵上清液,将其在45 ℃条件下旋蒸至原始体积的1/10,放置于4 ℃的冰箱保存备用。
1.4 指示菌菌悬液的制备 指示细菌培养于营养琼脂培养基,将大肠杆菌(Escherichia coli)、金黄色葡萄球菌 (Staphylococcus aureus)CICC 23656、蜡样芽孢杆菌(Bacillus cereus.Frankland),按照1%的接种量分别接种于50 mL 琼脂培养基中,采用37 ℃培养12 h。
1.5 抑菌活性的测定 以大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)CICC 23656、蜡样芽孢杆菌(Bacillus cereus.Frankland)和腐败希瓦氏菌(Shewanella putrefaciens)为指示菌,LB 作为培养基,采用打孔法,每个孔中加入80 μL 的乳酸菌上清液,37 ℃培养12 h, 通过十字交叉法测量抑菌圈直径的大小, 测定乳酸菌的抑菌活性。
1.6 乳酸菌的鉴定
1.6.1 乳酸菌的形态特征 将分离菌株接种到MRS 固体培养基平板上,37 ℃培养48 h,观察单菌落的形态特征。 然后挑取单菌落接种于50 mL 的MRS 液体培养基中,37 ℃培养48 h,取适量发酵液进行革兰氏染色,镜检观察菌落形态与显微形态。
1.6.2 生理生化鉴定 根据《伯杰氏细菌鉴定手册》 和乳酸细菌分类鉴定及试验方法对具有透明抑菌圈的菌株进行形态观察和生理生化试验。 使用乳酸菌鉴定条、 明胶生化管和其他糖类试剂盒进行乳酸菌检验。
1.6.3 16S rDNA 鉴定及系统发育树 将筛选的得到的菌株按照1% 的接种量接种于液体MRS培养基中,37 ℃培养12 h 后,按照细菌基因组快速提取试剂盒的要求提取目标菌株的基因组。PCR 扩增引物选择细菌通用引物:27F 和1492R。PCR 反应的总体积为50 μL:ddH2O 17 μL, 通用引物各2 μL,Mg2+3 μL,DNA 模板1 μL,PCR Mix 25 μL。 反应程序:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,35 个循环;72 ℃终延伸5 min。 经过PCR 扩增得到的目的基因片段送至上海生工生物公司测序。 所得到的序列提交GenBank 比对, 用MEGA 7.0 软件构建系统发育树。
1.7 乳酸菌产抑菌物质的确定
1.7.1 排酸试验 使用1 mol/L HCl 和1 mol/L NaOH 溶液调整发酵上清液的pH 至4.5、5.0、5.5、6.0、6.5、7.0,37 ℃孵育30 min,然后将pH 调节回原pH=4,;选择同时配制的MRS 培养基,并使用乳酸溶液调MRS 培养基至相同的pH 作为空白对照,其余操作相同。以蜡样芽孢杆菌和大肠杆菌作为指示菌做抑菌试验验证相同pH 下的抑菌活性。 筛选出发酵过程中可产除了乳酸之外的抑菌物质的菌株。
1.7.2 过氧化氢酶试验 调整浓缩后的上清液pH 至过氧化氢酶的最适pH 7.0,加入4000 U/mL的过氧化氢酶, 振荡混匀后,37 ℃水浴保温2 h。对照选择同样加酶处理的MRS 培养基。结束后以蜡样芽孢杆菌和大肠杆菌作指示菌做抑菌试验验证发酵上清液的抑菌活性, 判定抑菌物质是否为过氧化氢。
1.7.3 蛋白酶敏感试验 调整浓缩后的上清液pH 至胃蛋白酶最适pH 1.7, 添加胃蛋白酶量为4000 U/mL; 调整上清液pH 至胰蛋白酶最适pH 8.1,添加胰蛋白酶量为2500 U/mL;充分振荡混匀后,37 ℃水浴保温4 h; 调整上清液pH 至蛋白酶K 最适pH 8.0,添加蛋白酶K 量为2500 U/mL;充分振荡混匀后,37 ℃水浴保温4 h。对照选择同样处理的MRS 培养基。抑菌试验验证发酵上清液的抑菌活性,判定抑菌物质是否为细菌素。
1.8 数据处理 所有试验均以相同的方法重复三次,所有样品均进行三次平行分析。试验所得数据利用Excel 软件计算得出各组数据的标准偏差;采用SPSS 统计学20(IBM 公司,NY,USA)进行显著性分析,并以P <0.05 值评估显著性分析。绘图采用Origin 2021,所有数据结果均以“平均值±标准差”表示。
2 结果与分析
2.1 产抑菌物质乳酸菌的筛选 采用琼脂孔扩散法,以蜡样芽孢杆菌、大肠杆菌、金黄色葡萄球菌和腐败希瓦氏菌为指标菌, 根据抑菌圈直径的大小, 初筛出的155 株菌中, 选取C8、L13、L14、X5、LS4、G16、S32、MMB-09 作为复筛的研究对象,结果如表1 所示。

表1 不同菌株的抑菌圈直径
2.2 乳酸菌的生长及代谢特性研究
2.2.1 乳酸菌菌株的生长曲线 由图1 可知,8 株菌株中的大部分在4 ~8 h 处于对数生长期,此时,8 株菌生长速率快, 符合工业化菌株的基本要求,菌株L13、L14、C8、MMB-09 在8 h 时OD600达到2.0 以上;12 ~36 h 进入稳定期,活菌数变化不大,此时L13、L14、MMB-09 的生物量多于其他菌株;菌株MMB-09 在36 h 后进入衰亡期。

图1 8 株乳酸菌的生长曲线
2.2.2 乳酸菌菌株的产酸能力测定结果 乳酸菌的活力良好的特征之一便是产酸能力, 由图2 可知,L13、LS4 和MMB-09 在较短时间内产生大量有机酸, 使其pH 在8 h 后迅速降到4.2 左右,除了X5、G16 和S32 这三株菌, 其余菌株均在12 h时发酵产酸使pH 降低至4 左右, 而这三株菌也在20 h 左右pH 达到4 附近, 这与杜贺超等(2021) 的菌株PC4-5 产酸情况类似。 C8、L13、L14、LS4、MMB-09、X5、G16 以及S32 均展示了较好的产酸能力。

图2 8 株乳酸菌的产酸能力
2.2.3 耐酸性试验结果 乳酸菌在到达肠道定植发挥其益生作用前会经过胃部环境消化2 ~3 h,人和动物的胃液环境pH 一般保持在3.0 左右,因此筛选作乳酸菌制剂的菌株需要良好的耐酸能力(JunLi 等,2021)。 图3 中,当pH 为2.0 时,8 个菌株的生长均受到严重抑制;当pH 为3.0 时,菌株L13、LS4 和MMB-09 有所生长,其中LS4 生长最好,OD600值最高达到0.5, 其余菌株C8、L14、X5、G16 以及S32 的生长仍然受到严重抑制; 当pH为4.0 时,8 株菌的生长曲线均呈上升趋势,OD600最高能达到2.1,大部分集中在1.5 ~2.0。 这与赵鑫等 (2022) 在传统发酵泡菜中筛选出的Z5 在pH=4.0 时OD600的值相似。 综上所述,L13、LS4 和MMB-09 表现出较强的耐酸能力。
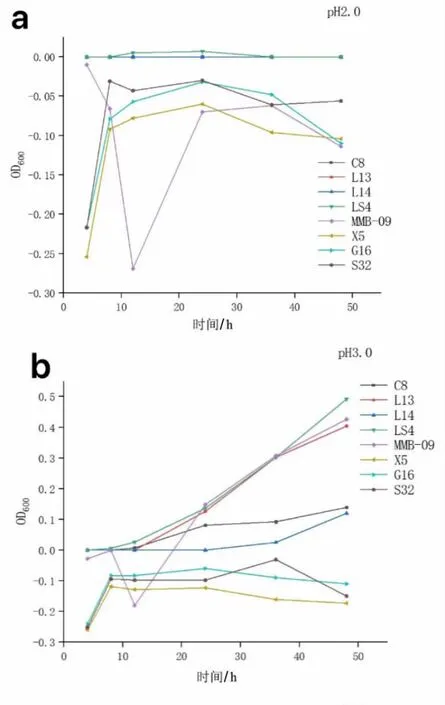
图3 乳酸菌菌株耐酸能力的测定结果
2.2.4 耐盐性试验结果 由图4 可知, 在不同盐浓度下均有一定的生长,OD600的值随着NaCl 含量的增加而降低, 且在各个浓度均呈现先上升后稳定的趋势。 在NaCl 含量增加到80 g/L 时,与其余浓度相比,菌株前期的生长较为缓慢,但仍能生长。 这与Hiroshi 等(2003)的菌株在0% ~15%浓度下可以生长的研究一致。 综上所述,C8、L13、L14、LS4、MMB-09、X5、G16 以及S32 均呈现出较好的耐盐能力。


图4 乳酸菌菌株耐盐能力的测定结果
结合抑菌能力、生长曲线、产酸能力、耐酸能力和耐盐能力, 最终决定选取MMB-09 做进一步试验。
2.2.5 乳酸菌形态特征的鉴定 菌株MMB-09在MRS 固体培养基上生长良好, 培养24 h 后形成乳白色小菌落。 菌落凸起,表面光滑圆润,边缘整齐,属典型的乳酸菌菌落特征。 在MRS 液体培养基中30 ℃静置培养24 h,菌液浑浊,生长状态良好。 革兰氏染色后(图5),镜检为蓝紫色,显示为革兰氏阳性短杆菌,无芽孢。

图5 菌株MMB-09 的形态特征
2.2.6 生理生化 菌株MMB-09 发酵葡萄糖不产生气体;明胶液化呈阴性;精氨酸水解呈阴性;能够发酵利用海藻糖、阿拉伯糖、木糖、果糖、甘露糖、蜜二糖、水杨苷(表2)。 参考《伯杰氏细菌鉴定手册》,表明该菌株为植物乳杆菌。

表2 菌株MMB-09 的生理生化鉴定结果
2.2.7 16S rDNA 基因序列分析 使用试剂盒提取MMB-09 的DNA 为模板进行PCR 扩增,扩增产物送去上海生工生物公司测序, 测序结果经过同源性比较发现, 其与植物乳杆菌的相似度达95%,结合形态学观察、生理生化鉴定和16S rDNA 分子生物学鉴定, 以及细菌系统发育分类学的分析,初步鉴定该菌株为植物乳杆菌,命名为植物乳杆菌MMB-09。 利用MEGA 7 软件构建系统发育树(图6)。在系统发育树中,菌株MMB-09 与植物乳杆菌在同一分支。

图6 菌株MMB-0916S rDNA 序列系统进化树
2.3 所产抑菌物质的鉴定
2.3.1 排酸结果 有研究表明, 乳酸菌的代谢产物中具有多种抑菌物质,包括有机酸、过氧化氢等(陆春波,2019)。使用NaOH 溶液调节发酵上清液pH 至7.0 后,发酵液抑菌性逐渐减弱(P <0.05),但仍有明显的抑菌效果, 由此推测在发酵上清液中,有机酸不是MMB-09 发酵上清液的主要抑菌物质,还存在其他具有抑菌作用的物质(表3),这与吕蕾等(2022)对于ZW2、ZW9 以及ZW14 的排酸试验结果一致。

表3 菌株MMB-09 的排酸结果
2.3.2 过氧化氢的排除 经过氧化氢酶处理后,发酵上清液的抑菌性变小(P <0.05),但是还保留78.41% ~86.03%的抑菌效果,说明发酵上清液中的抑菌作用仅有小部分是由过氧化氢引起的(表4),这与涂小丽等(2018)对于过氧化氢酶处理后的乳酸菌上清液仍有较强抑菌作用一致。 表明发酵上清液中还存在其他抑菌物质。

表4 过氧化氢的排除以及蛋白酶稳定性抑菌圈直径 mm
2.3.3 蛋白酶敏感试验 试验结果表明, 发酵上清液经胰蛋白酶、 蛋白酶K 和胃蛋白酶处理后,与原发酵液相比, 抑菌活性分别降低了13.97%、14.29%、21.59%(P <0.05)。 进一步证明抑菌物质的成分中有蛋白质类物质,这与辛婷等(2022)对菌株A2、A7 以及A13 的蛋白酶敏感的研究结果类似,证明该菌株可产细菌素。
3 结论
我国“禁抗”以来,用作饲料添加剂的乳酸菌菌株主要从动物和人类的消化道、肠道、粪便以及发酵食物中分离。 本研究从贵州省黔东南苗族侗族自治州农家生产卤水中分离纯化获得一株耐盐耐酸产细菌素能力较好的菌株MMB-09, 经形态学观察、分子生物学鉴定其为植物乳杆菌。植物乳杆菌MMB-09 进入对数期较快,说明该菌株能够大量增殖,符合筛选要求。 动物的胃液环境pH 一般保持在3.0 左右,食物在胃里消化的时间为2 ~3 h,因此筛选作乳酸菌制剂的菌株需要良好的耐酸能力, 菌株MMB-09 在pH 为3.0 时仍保持良好的生长状态,说明具有一定的耐酸性能,对于动物的胃部环境有一定的耐受力, 加入饲料中的乳酸菌能通过胃部环境定植动物肠道发挥其益生作用。 乳酸菌菌株MMB-09 在生长过程中通过快速产酸降低肠道pH,能有效抑制部分有害微生物生长(Nagpal 等,2012)。 该菌株经过排酸试验证实其所产抑菌物质在pH 为7.0 时还保留35%的抑菌效果,说明其所产抑菌物质不是酸类物质,且被过氧化氢酶和各类蛋白酶处理过后一部分抑菌活性消失,说明其所产抑菌物质存在蛋白质类,证明其代谢产物有细菌素等抗菌物质。这些结果表明,植物乳杆菌MMB-09 适合作为乳酸菌饲料制剂的优良菌株, 为后续开发乳酸菌饲料制剂提供资料和参考。
