1-十四烷基-3-甲基咪唑溴与BSA 相互作用研究
2023-10-16耿斐
耿斐
(山东建筑大学学报编辑部,山东 济南 250101)
0 引言
蛋白质是一类两性物质,可以与包括表面活性剂[1-2]、药物[3-4]、染料[5-6]以及金属离子[7]等在内的许多种类的小分子结合。 蛋白质的功能是由特定的三维空间结构决定的,与小分子的相互作用会引起分子中各级结构的变化,导致化学性质变化和生物活性丧失,最严重的还会引起变性。 牛血清白蛋白(Bovine Serum Albumin,BSA)来源丰富,性质稳定,在众多领域都得到了广泛的应用,是人类最早研究的蛋白质之一[1]。 GHOSH 等[8]研究发现表面活性剂极性头基的疏水性在稳定蛋白质方面发挥着重要作用,极性头基的疏水性越强,与蛋白质结合效率越高。 胡晓熙等[9]通过荧光光谱法,从作用机理、结合常数及位点数、作用力类型等方面,研究了全氟烷基甜菜碱与BSA 的相互作用,补充了全氟表面活性剂与蛋白质相互作用的研究数据。
现有报道多关注传统阴、阳离子表面活性剂与BSA 的相互作用,而结构可调、功能化的表面活性剂与蛋白质相互作用的研究虽有报道,但稍显欠缺。阳离子表面活性剂1-十四烷基-3-甲基咪唑溴(1-tetradecyl-3-methylimidazolium bromide, C14mimBr)具有更高的表面活性[10],研究其与BSA 的相互作用,有助于发掘长链咪唑类表面活性剂的特别之处,开拓咪唑类表面活性剂的应用领域。 文章通过测量C14mimBr/BSA 体系的表面张力值、电导率值、静态荧光、内源荧光、圆二色及相互作用焓,考察了C14mimBr与BSA 相互作用过程中的热力学参数、作用方式、作用参数以及BSA 结构的变化。
1 实验材料、仪器与方法
1.1 实验材料
C14mimBr 根据文献[11]的方法合成,过程为:控制温度在75 ~80 ℃范围,在氮气保护的条件下,甲基咪唑、过量的溴代十四烷和乙腈搅拌回流反应48 h,之后旋转蒸发以除去过量的溴代烷烃和乙腈,减压蒸馏以除去水,即得到最终产物。 C14mimBr 结构式如图1 所示。 BSA 购自美国Amresco 公司;十四烷基三甲基溴化铵( Tetradecyl Trimethyl Ammonium Bromide, TTAB),分析纯,购自美国Sigma-Aldrich 公司;碘化钾KI,分析纯,购自上海国药集团。

图1 1-十四烷基-3-甲基咪唑溴结构示意图
1.2 实验仪器与方法
在JYW-200B 型表面张力仪上使用吊环法通过单测得到表面张力数值,至少测量2 次,直到测得的误差<0.2 mN/m。 使用DDS-307 型电导率仪测量体系的电导率。 以上实验的温度分别为25、35、45 ℃
使用LS-55 荧光光谱仪测量荧光:内源荧光测定固定激发波长为280 nm,于295 ~440 nm 范围内扫描C14mimBr/BSA 体系;同步荧光测定固定激发和发射的波长差Δλ=60 nm,于200 ~400 nm 范围内扫描C14mimBr/BSA 体系。 使用J-810 远紫外圆二色光谱仪,测量时带宽为2 nm,通过仪器自带的Secondary Structure 软件计算得到BSA 二级结构。使用Thermal Activity Monitor 2277 等温滴定微量热仪进行实验:注射器每次注入12 μL 表面活性剂进入装着0.50 mL BSA 的样品池,共注入24 次,注入后的平衡时间均为45 min。 待基线在30 r/min 的搅拌下稳定后再启动实验。 搅拌热已由程序自动扣除。 以上实验的温度均为25 ℃。
2 结果与讨论
2.1 C14mimBr/BSA 体系表面张力
测定了25、35、45 ℃ 时C14mimBr/BSA 体系(BSA 质量浓度ρ为0.68 g/L)的表面张力,如图2所示。 曲线有两个明显的拐点,根据蛋白质与表面活性剂相互作用的规律可知,第一个拐点表明BSA开始与C14mimBr结合,此时对应的C14mimBr 浓度称为临界聚集浓度(Critical Aggregation Concentration,CAC)。 由于BSA 的存在,增加的C14mimBr分子大都与之结合,吸附在溶液表面的C14mimBr 没有明显增加,所以表面张力数值的变化很小,出现了第一个平台。 CAC 的出现说明C14mimBr 和BSA 的相互作用优先于胶束的形成。 第二个拐点表明C14mimBr 与BSA 的结合已经达到饱和,C14mimBr 开始形成胶束,达到了临界胶束浓度(Critical Micelle Concentration,CMC)。

图2 不同温度下C14mimBr/BSA 体系(ρBSA =0.68 g·L-1)表面张力图
BSA 中共有3 个亚结构,每个亚结构是由双胱氨酸键连接两个次级区域形成的,而每个次级区域由3 段螺旋结构组成,其相互平行,形成一个槽形区域。 绝大部分疏水残基都分布在螺旋和槽内,所以次级区域有疏水内核;在次级区域的顶端开口部分分布着一些非极性残基,所以次级区域有极性外表。C14mimBr 疏水尾部可以进入BSA 非极性的内部,而其亲水头基则以静电作用与BSA 极性的残基结合。由图2 可知,温度改变对CAC 没有影响。 已知静电相互作用受温度的影响很小,所以在CAC 时,C14mimBr主要以咪唑头基通过静电作用与BSA 中的极性残基相互作用。
测量了不同温度下C14mimBr/BSA 体系(BSA质量浓度变化)的表面张力,如图3 所示。 CAC 不随BSA 质量浓度的增大而变化,而CMC 随着BSA质量浓度的增大而升高。不同温度下体系的CMC数值见表1。

表1 不同温度下C14mimBr/BSA 体系(BSA 质量浓度变化)CMC 值表
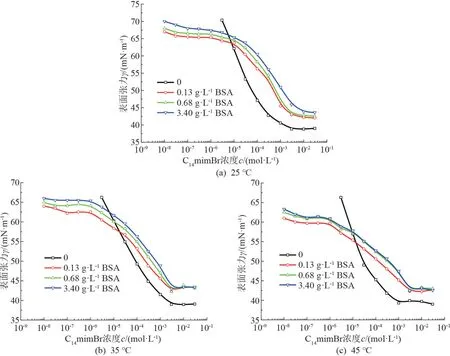
图3 不同温度下C1 4mimBr/BSA 体系(BSA 质量浓度变化)表面张力图
CMCwithBSA-CMCwithoutBSA即为结合到BSA 上的C14mimBr 的量。 以其对BSA 质量浓度作图,如图4所示。 曲线随BSA 质量浓度的增加线性增长,求得直线斜率,即为BSA 结合C14mimBr 的量。 得到每克BSA 结合C14mimBr 的量分别为1.66×10-4mol(25 ℃)、1.99×10-4mol(35 ℃)及1.80×10-4mol(45 ℃)。

图4 CMCwith BSA-CMCwithout BSA对BSA 质量浓度作图
2.2 C14mimBr/BSA 体系热力学参数
测定了25、35、45 ℃ 时,C14mimBr/BSA 体系(ρBSA=0.68 g/L)的电导率,如图5 所示。 所得曲线双折线的折点对应着胶束的形成。 反离子解离度α=胶束形成后的直线斜率/胶束形成前的直线斜率;反离子结合度β=1-α。 根据图5,经过计算可知,25、35、45 ℃时,C14mimBr/BSA 体系的反离子结合度β分别为0.72、0.72 和0.67。
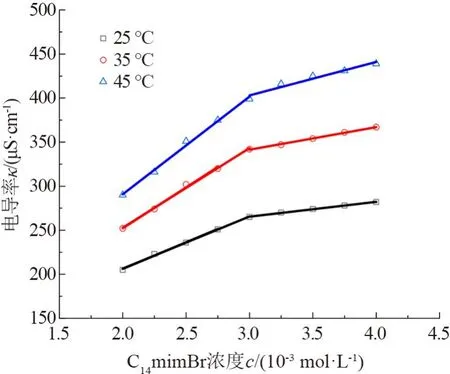
图5 C14mimBr/BSA 体系(ρBSA =0.68 g·L-1)在不同温度下的电导率图
根据质量作用模型,热力学参数可以由式(1)~(3)表示为
式中ΔGmic和ΔHmic分别为胶束形成的吉布斯自由能和焓,kJ/mol;ΔSmic为胶束形成的熵,kJ/(mol·K);T为温度,K;R为常数,取值为8.314。
不同温度下,C14mimBr/BSA 体系的热力学参数计算结果见表2。 ΔGmic值均为负,说明胶束的形成是自发的。ΔHmic和-TΔSmic均为负值,说明胶束的形成是熵焓共驱过程。

表2 不同温度下C14mimBr/BSA 体系(ρBSA =0.68 g·L-1)热力学参数表
2.3 C14mimBr/BSA 体系远紫外圆二色光谱
C14mimBr 与BSA 的相互作用会导致BSA 的结构发生一些变化,可以通过圆二色光谱检测BSA 二级结构的改变。 在圆二色光谱上,α-螺旋结构的特征峰表现为208 及222 nm 附近的两个负槽,β-折叠结构的特征峰表现为215 nm 附近的负槽。
C14mimBr/BSA 体系(ρBSA=0. 68 g/L) 随C14mimBr浓度变化的远紫外圆二色光谱如图6 所示。 可以看出:当C14mimBr 的浓度较低(1×10-8~1×10-4mol/L)时,BSA 的二级构象几乎没有改变,可能是因为C14mimBr 分子与BSA 的高能位点结合,稳定了其二级结构,导致其构象更加紧密;当C14mimBr 的浓度达到1 × 10-3mol/L 时,215 和222 nm处的负槽消失,说明BSA 的二级构象被破坏。

图6 C14mimBr/BSA 体系(ρBSA =0.68 g·L-1)远紫外圆二色光谱图
C14mimBr/BSA 体系中,BSA 二级构象质量分数见表3。 低浓度(<1×10-4mol/L)的C14mimBr 增加了BSA 中α-螺旋及β-折叠的量,稳定了BSA 的二级结构;高浓度(>1×10-4mol/L)的C14mimBr 使BSA 中α-螺旋及β-折叠的量显著降低,破坏了BSA 的二级结构。
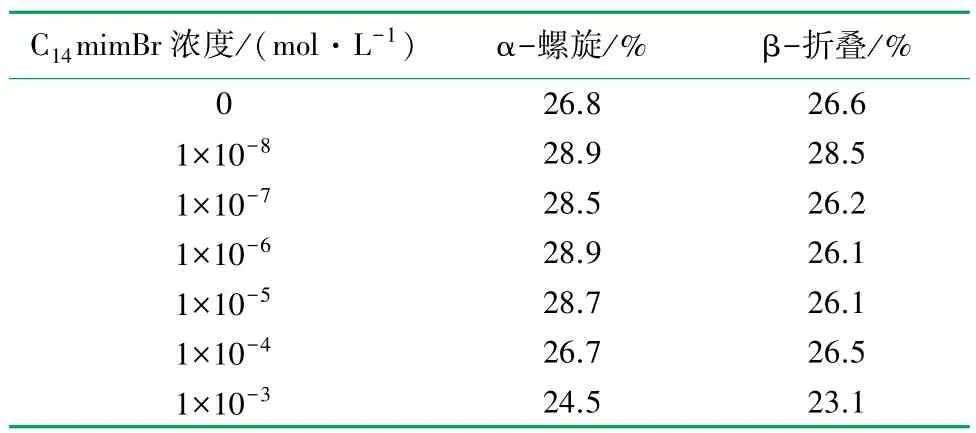
表3 C14mimBr/BSA 体系(ρBSA =0.68 g·L-1)中BSA二级构象质量分数表
2.4 C14mimBr/BSA 体系荧光光谱
2.4.1 C14mimBr/BSA 体系内源荧光光谱
图7 显示了 C14mimBr/BSA 体系(ρBSA=0.68 g/L)中BSA 的内源荧光随C14mimBr 浓度的变化。 色氨酸残基的荧光光谱对微环境的变化很敏感,其峰位一般在波长为325 ~350 nm 之间变动。由图7 可知,体系的荧光发射峰是BSA 中色氨酸残基的特征荧光光谱。 C14mimBr 的加入(0~1×10-3mol/L)导致最大荧光发射峰峰值的降低,色氨酸残基的最大峰峰值从509 下降到258,同时伴随着峰位的蓝移,最大峰位置从350 nm 移到332 nm,说明色氨酸残基暴露于更加疏水的环境中。此时,C14mimBr 还没有形成胶束,这种现象只能归因于C14mimBr 与BSA 形成了复合物。 随着C14mimBr的浓度进一步加大,大于0.01 mol/L 时,最大荧光发射峰峰值与峰位置几乎不再发生变化,此时造成了BSA 的变性。
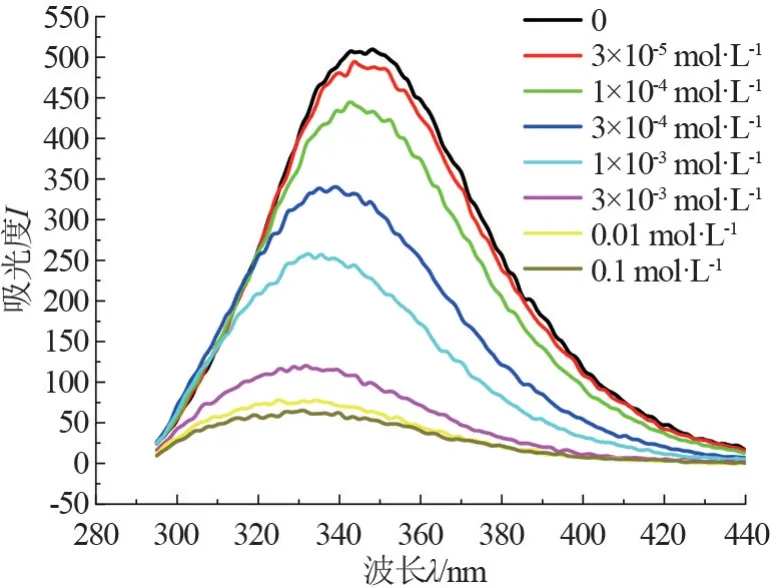
图7 C14mimBr/BSA 体系(ρBSA =0.68 g·L-1)内源荧光光谱图
2.4.2 C14mimBr/BSA 体系结合参数
荧光淬灭可以揭示淬灭剂对荧光物质的淬灭位置。 一般来讲,表面活性剂对色氨酸残基的淬灭是因为静态淬灭形成了不能发射荧光的激基缔合物[12]。 为了验证C14mimBr 与BSA 的淬灭是否是静态淬灭,应用Stern-Volmer 方程计算结合淬灭过程的反应速度Kq,方程由式(4)表示为
式中I、I0分别为不含、含有淬灭剂时的最大荧光发射峰峰值;τ为不含淬灭剂时荧光物质的寿命,对BSA 而言,τ=6 nm[13];cQ为淬灭剂的浓度,mol/L。
图8 为I0/I对C14mimBr 浓度曲线,Kqτ是曲线线性部分的斜率,计算可得Kq为2.81×1011L/mol·s。对于动态淬灭反应,反应速度Kq最大为1.00×1011L/mol·s[14],这就说明C14mimBr 对BSA 的淬灭过程是静态淬灭。
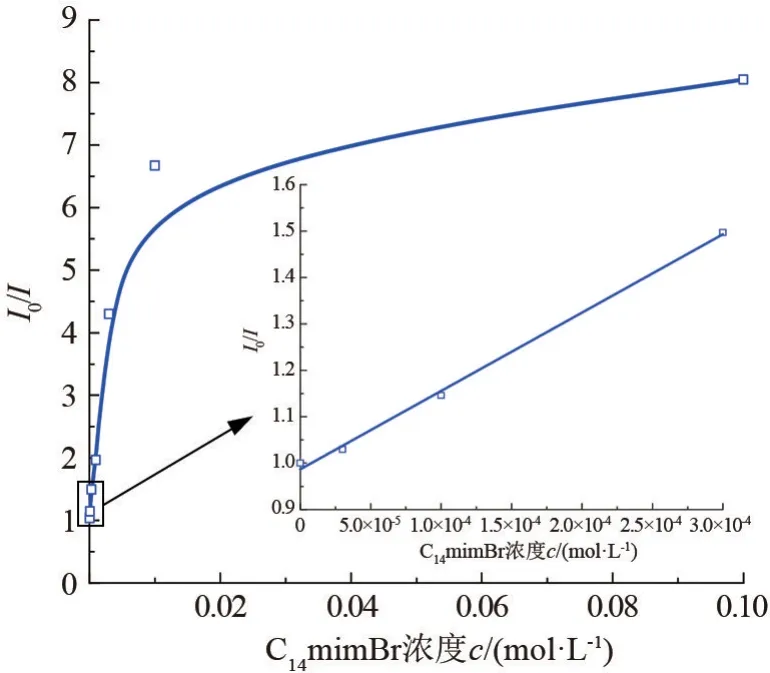
图8 C14mimBr/BSA 体系(ρBSA =0.68 g·L-1)相对荧光强度对C14mimBr 浓度作图
在静态淬灭过程中,假设淬灭剂与荧光物质的n个独立且相同的结合位作用,已经结合的部位之间无相互作用,结合反应可由式(5)表示为
式中Q 与P 分别为淬灭剂与荧光物质;QnP 为激基缔合物。
平衡常数K可由式(6)表示为
式中c为浓度,mol/L。
对式(6)两侧取对数,并将荧光物质与激基缔合物都用其相应的最大荧光发射峰峰值表示,式(6)可变形成式(7)
将C14mimBr/BSA 体系的对lgc作图,如图9 所示。 通过曲线的斜率与截距,可以计算得到结合位点n与平衡常数K。 可得C14mimBr/BSA体系的n=0.97、K=1 000 L/mol。 推测在考察的浓度范围内(C14mimBr 为3×10-5~1×10-3mol/L),C14mimBr与BSA 之间为疏水相互作用。 根据2.1 部分中表面张力曲线,已知在CAC 附近时,C14mimBr与BSA 以静电相互作用为主,可知:当C14mimBr 浓度较小时,其极性头基先以静电相互作用与BSA 特定的结合位点作用;当C14mimBr 浓度较大时,其疏水尾链再以疏水作用与BSA 的非极性残基部分结合。
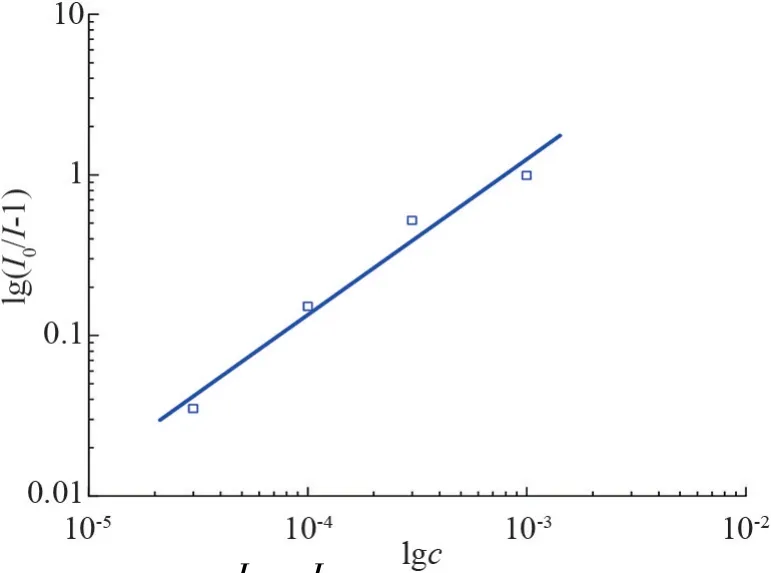
图9 对C14mimBr 浓度作图
BSA 分子中含有两个色氨酸残基,一个位于BSA 的疏水空腔内,另一个位于外层。 C14mimBr 与BSA 相互作用的结合位点n为0.97,说明一个C14mimBr只与一个色氨酸残基作用。 为了验证推测,即在考察的浓度范围内(C14mimBr 浓度为3×10-5~1×10-3mol/L),C14mimBr 与BSA 之间为疏水相互作用,在C14mimBr/BSA 体系中加入I-。 I-作为淬灭剂仅能与BSA 表面的色氨酸残基反应,而不能进入BSA 内部淬灭色氨酸残基[15]。 I-对色氨酸残基的淬灭是动态淬灭,可由式(8)表示为
式中f为可以被淬灭的残基占总残基的比例。
含有与不含有C14mimBr 时,I-对BSA 荧光强度的影响如图10 所示。 通过对图10 中曲线的截距计算可知:不含有C14mimBr 时,f为58.74%;含有C14mimBr时,f为90.09%。 可见随着C14mimBr 的加入,BSA 表面的色氨酸残基所占比例增大。 表面色氨酸残基的数量不会增加,所以f增大只能是由于C14mimBr的加入,使BSA 内部的色氨酸残基的数量降低,由此可知C14mimBr 只能通过疏水作用与BSA内部的色氨酸残基作用。
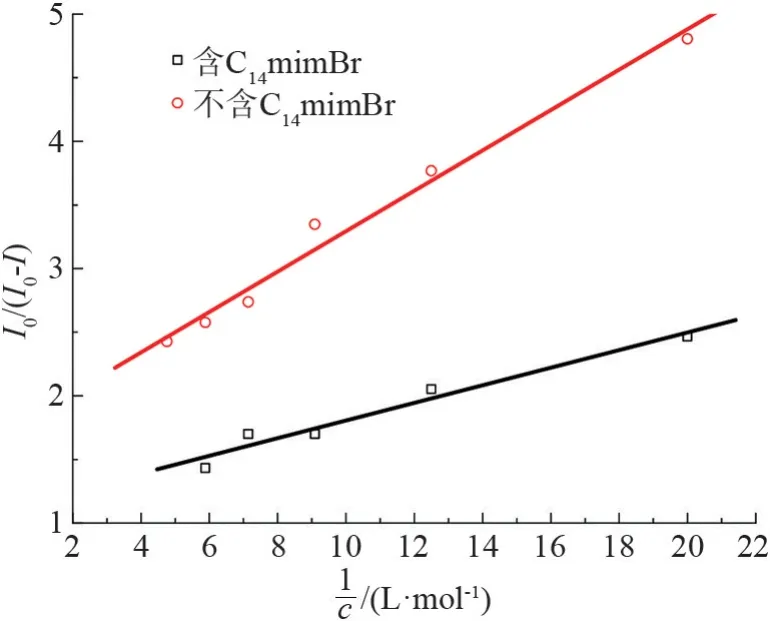
图10 I-浓度对BSA 荧光强度的影响图
2.4.3 C14mimBr/BSA 体系同步荧光光谱
C14mimBr/BSA 体系(BSA 为0.68 g/L)的同步荧光光谱如图11 所示。 Δλ=60 nm 时的同步荧光是色氨酸残基的。 随着C14mimBr 的加入,色氨酸残基的最大发射峰峰值降低,但是最大峰位置未发生变化,表明C14mimBr 与BSA 的相互作用没有影响色氨酸残基的微环境。 当C14mimBr 的浓度>0.01 mol/L时,BSA 荧光光谱不再发生变化,此时BSA 发生变性,这与远紫外圆二色光谱及内源荧光光谱的结果相吻合。

图11 C14mimBr/BSA 体系(ρBSA =0.68 g·L-1)同步荧光光谱图
2.5 C14mimBr/BSA 体系等温滴定微量热
蛋白质与表面活性剂作用的等温滴定微量热控制实验包括胶束及蛋白质的稀释热,已有实验证明蛋白质的稀释热可以忽略[16]。 扣除控制实验之后,C14mimBr/BSA及TTAB/BSA 体系(BSA 均为0.68 g/L)的等温滴定微量热曲线如图12 所示。 两体系曲线的变化趋势类似,可以按反应进程将曲线划分为3 部分。第一进程(c<c1),BSA 的高能位点与表面活性剂分子结合, BSA 的热稳定性增强。 此阶段作用焓随着表面活性剂浓度的增大逐渐减小,说明随着相互作用,BSA 上特定的高能位点逐渐减少。根据2.1及2.4部分分析,此时表面活性剂的极性头基先通过静电作用与BSA 带负电荷的氨基酸残基作用,尾链再通过疏水作用与BSA 的疏水氨基酸残基作用。 第二进程(c1<c<c2),BSA 的二级结构遭到破坏,分子逐步展开,最终发生变性。 此阶段作用焓随着表面活性剂浓度的增大逐渐变大,c2所对应的作用焓最大值是BSA 发生变性时产生的热量[16]。 此阶段C14mimBr/BSA体系的热量变化比TTAB/BSA 体系的明显, 说明在破坏BSA 的二级结构方面,C14mimBr要强于TTAB。 这主要由于C14mimBr 分子的咪唑头基之间有氢键,当与BSA 作用时,要先克服氢键作用。 第三进程(c>c2),表面活性剂开始形成胶束,热量急剧减小至零。

图12 C14mimBr/BSA 及TTAB/BSA 体系热流曲线图
3 结论
通过上述研究,得到以下结论:
(1) 咪唑型表面活性剂C14mimBr 与BSA 的相互作用与其浓度有着密切的关系。 当C14mimBr 浓度较低时,作用方式为静电相互作用,C14mimBr 的加入稳定了BSA 的二级结构;当C14mimBr 浓度较大时,作用方式为疏水相互作用,C14mimBr 的加入破坏了BSA 的二级结构并最终导致其变性。
(2) C14mimBr 与BSA 内部空腔里的色氨酸残基的作用方式为疏水相互作用,对色氨酸残基的淬灭是导致BSA 内源荧光改变的原因。
(3) 通过计算可知,每克BSA 可以结合的C14mimBr的量约为2×10-4mol,不同温度下的结合量略有差别。
(4) 对比C14mimBr/BSA、TTAB/BSA 体系作用焓可知,在破坏BSA 的二级结构方面,C14mimBr 要强于传统的阳离子表面活性剂TTAB。
