替莫唑胺治疗多形性胶质母细胞瘤及间变性星形细胞瘤的快速卫生技术评估Δ
2023-10-16朱云珊赵紫楠张闪闪张亚同金鹏飞北京医院药学部国家老年医学中心中国医学科学院老年医学研究院北京市药物临床风险与个体化应用评价重点实验室北京医院北京100730
朱云珊,赵紫楠,朱 翊,张闪闪,张亚同,金鹏飞(北京医院药学部,国家老年医学中心,中国医学科学院老年医学研究院,北京市药物临床风险与个体化应用评价重点实验室(北京医院),北京 100730)
间变性星形细胞瘤(anaplastic astrocytoma,AA)和胶质母细胞瘤均属于中枢神经系统肿瘤[1]。AA的恶性程度高,生物学行为与多形性胶质母细胞瘤(glioblastoma multiforme,GBM)相似,可以很快转为GBM。GBM是临床上较常见的颅脑胶质瘤。据报道,GBM约占原发性脑肿瘤的40%[2];由星形细胞瘤恶化演变而来,在星形细胞瘤中恶性程度最高[3]。全球每年每10万人中约有2.5例GBM患者发病,且该病发生概率经流行病学证实在逐渐升高,目前诊断为GBM的患者中位年龄约为64岁,并随着年龄增长,发病率会持续升高[4]。目前,中枢神经系统肿瘤的标准治疗方法是对肿瘤病灶和边缘组织进行最大安全的外科手术切除和常规分割法局部放疗,但细胞瘤多以浸润性方式生长,具有很高的转移性和复发性,因此,手术及放疗难以根治病灶组织,需要替莫唑胺(temozolomide,TMZ)贝伐珠单抗、伊立替康、洛莫司汀+丙卡巴肼+长春新碱(PCV方案)、亚硝基脲、铂类化疗药等进行辅助化疗[5]。但对于GBM患者尤其是老年患者,目前一线用药仍是TMZ。TMZ为口服烷化剂类抗肿瘤药,在体循环生理pH状态下,迅速转化为活性产物3-甲基-(三嗪-1-)咪唑-4-甲酰胺(MTIC)。MTIC的细胞毒作用主要表现为DNA分子上鸟嘌呤第6位氧原子的烷基化以及第7位氮原子的烷基化,通过甲基化加成物的错配修复,发挥细胞毒作用。TMZ口服后吸收迅速,最快在服药后20 min可达血药峰浓度(平均时间为0.5~1.5 h),生物利用度接近100%,且易透过血脑屏障进入脑脊液[6]。尽管GBM及AA已有多种治疗方法,但全球范围内该类患者预后效果仍很差,预期中位生存期为15个月,2年生存率为27%,5年生存率勉强达到10%[7-8]。因此,需要更多关注并探讨治疗GBM及AA的方法。
卫生技术评估(health technology assessment,HTA)指对某种卫生技术的技术特性、临床安全性、有效性、经济学特性和社会适应性进行的全面评估活动。本研究利用循证医学和卫生经济学的方法,以研究实践为目的简化HTA时长,对TMZ治疗GBM及AA的技术特性、有效性、安全性和经济性进行系统评价,以最佳证据论证方案的可行性,为医疗决策者提供快速的决策价值信息。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究对象:临床诊断为GBM或AA的患者,包括新诊断和复发者。
1.1.2 干预措施:干预组患者使用TMZ单药作为化疗药治疗,剂量和疗程不限。
1.1.3 对照措施:安慰剂、放疗、其他阳性对照药物单药或其他阳性对照药物联合治疗,剂量和疗程不限。
1.1.4 结局指标:总生存期(OS);生存率;中位生存期;无进展生存期(PFS);无进展生存率;中位PFS;总有效率;临床缓解率;肿瘤进展时间(TTP);生活质量。
1.1.5 研究类型:HTA报告、Meta分析/系统评价和药物经济学研究;同一作者或其研究团队发表的相近文献仅纳入最近发表的一篇;发表语言为中文或英文。
1.1.6 排除标准:普通综述;干预措施/对照措施不符合标准;文献内容与本研究无关;无法获得全文及重复发表的文献;会议摘要;学位论文。
1.2 检索策略
以“替莫唑胺”“Temozolomide”“8-Carbamoyl-3-methyli-midazo(5,1-d)-1,2,3,5-tetrazin-4(3H)-one”和“Metha-zolastone”等中英文主题、自由关键词,加以手工辅助检索PubMed、Embase、the Cochrane Library、中国知网(CNKI)、万方数据库(Wanfang Data)、国际卫生技术评估协会(HTAi)、国际卫生技术评估机构网络(INAHTA)和国际卫生保健技术评估协会(ISTAHC)等中英文数据库及国内外HTA相关机构的官方网站。为了获取更全面的相关研究,检索时间均为建库至2021年7月20日。
1.3 文献筛选、数据提取
由2名研究者独立根据纳入标准和排除标准交叉核对筛选相关文献,并使用预先设计的数据提取表对纳入的研究进行数据提取。其中有效性与安全性的基本特征和研究结果包括纳入的研究(第一作者及发表年份)、纳入研究数、研究方法、患者数、患者种类、干预措施、对照措施、结局指标、有效性结论及安全性结论;经济性研究基本特征和研究结果包括纳入的研究(第一作者及发表年份)、国家、研究角度、分析方法、患者种类、病例数、研究年限、干预措施、对照措施。如遇分歧,与第3名研究者协商解决。
1.4 质量评价
采用“A Measurement Tool to Assess Systematic Reviews 2”(AMSTAR 2)量表进行Meta分析或系统评价的质量评价;采用“Consolidated Health Economic Evaluation Reporting Standards”(CHEERS)量表进行经济学研究的质量评价;采用INAHTA制定的“HTA checklist”评价HTA报告质量。
1.5 证据合成与分析
根据研究类型,采用描述性分析方式汇总纳入文献中的研究结论。
2 结果
2.1 文献检索与筛选结果
根据检索策略,初步检索到文献687篇,剔重后剩余476篇,阅读摘要和题目后得到90篇,进一步阅读全文后最终纳入0篇HTA报告、17篇Meta分析/系统评价[9-25]和6篇药物经济学研究[26-31],见图1。
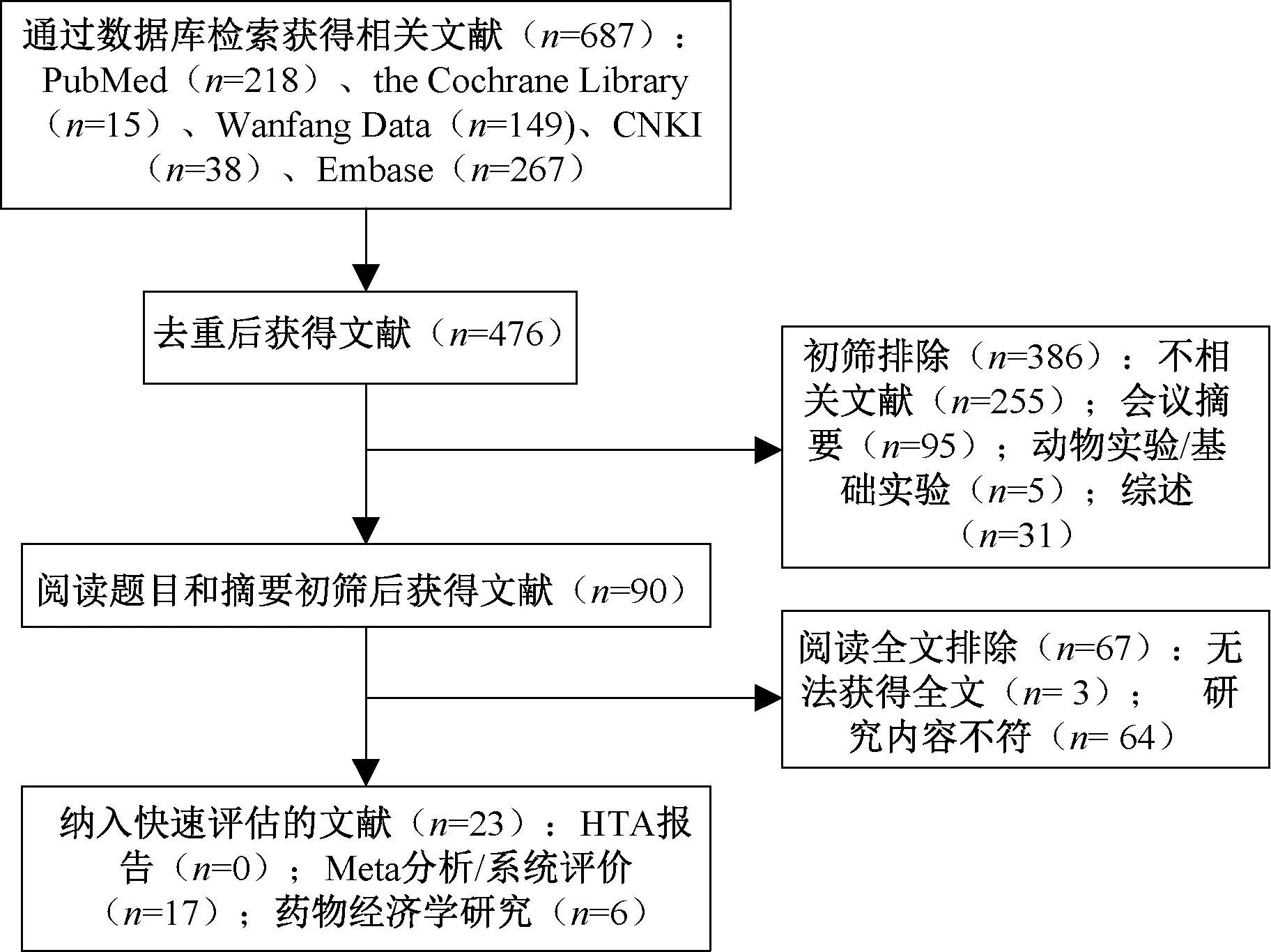
图1 文献检索与筛选流程Fig 1 Literature retrieval and screening process
2.2 纳入文献的基本特征与质量评价
纳入文献的基本特征与质量评价见表l—2。17篇Meta分析/系统评价文献中,除5篇网状Meta分析[10-11,18-19,21]外,对其余文献进行质量评价,1篇文献[15]的AMSTAR 2量表评分为中等,11篇文献[9,12-14,16-17,20,22-25]的AMSTAR 2量表评分极低;6篇经济学研究[26-31]的CHEERS量表评分为11.0~17.5分。
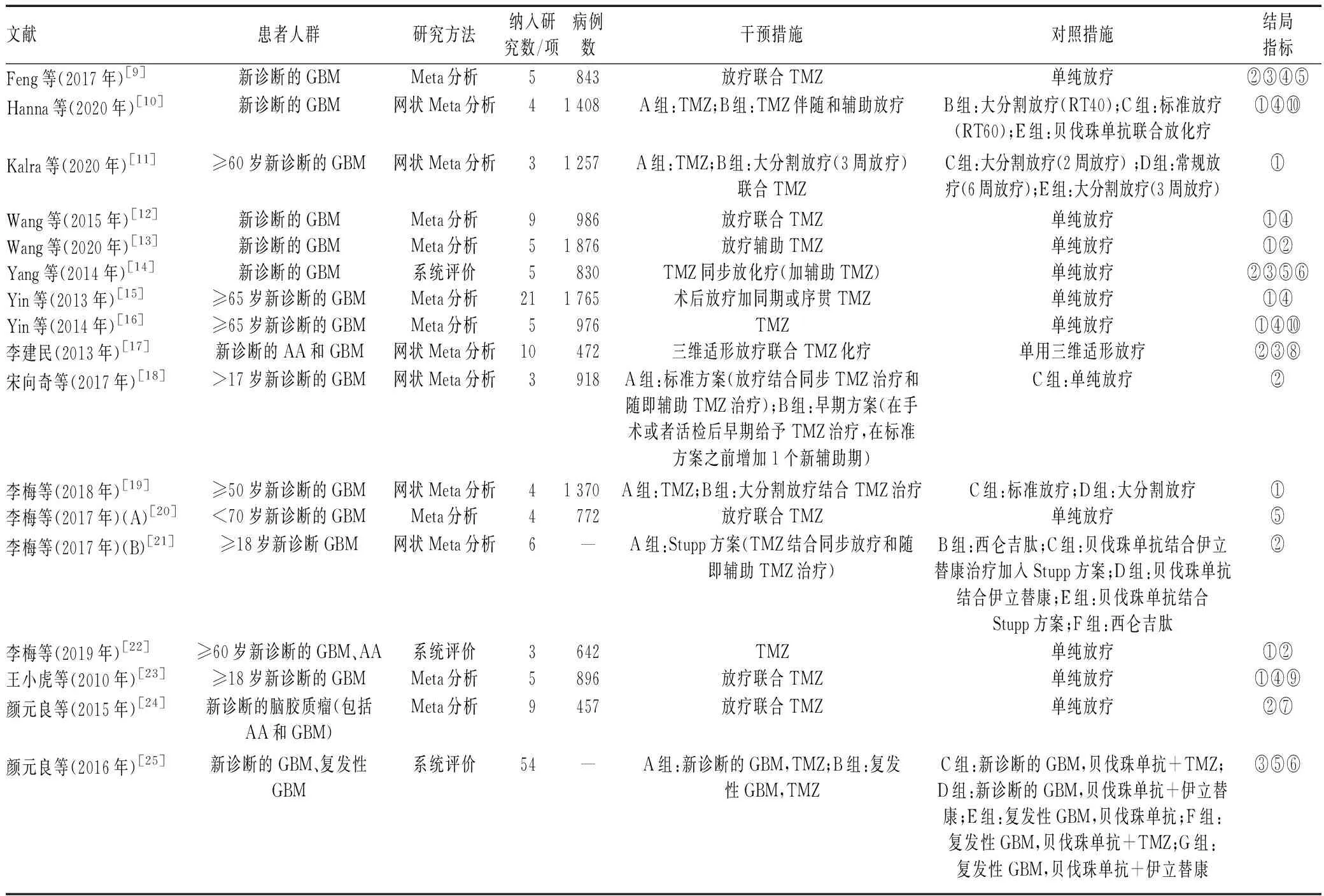
表1 纳入的Meta分析/系统评价的基本特征及结论Tab 1 Basic characteristics and conclusions of included Meta-analysis/systematic review
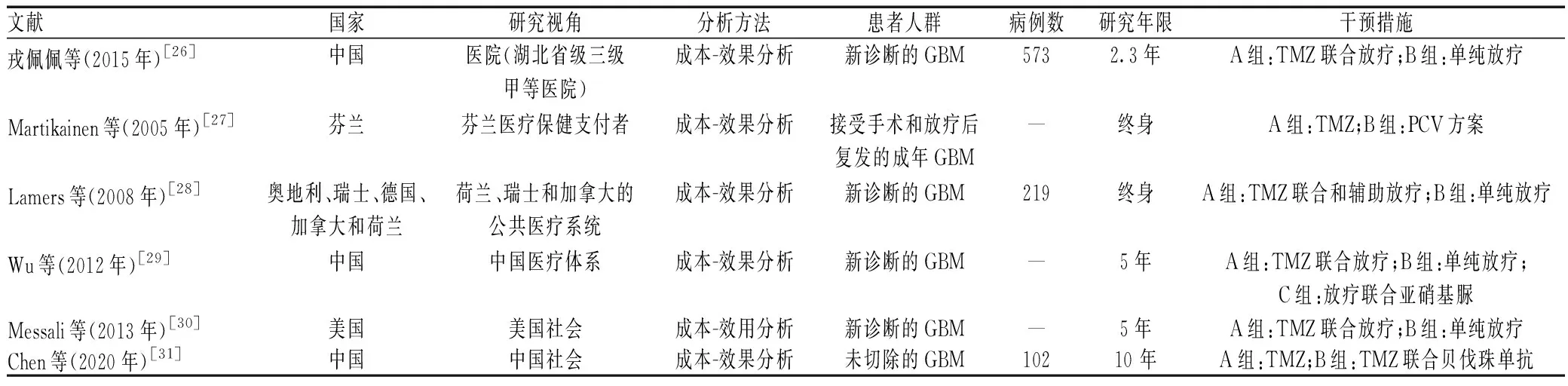
表2 纳入的药物经济学研究的基本特征Tab 2 Basic characteristics of included pharmacoeconomic studies
2.3 临床有效性评价
纳入的17篇Meta分析/系统评价均分析了TMZ的临床有效性及相关结局指标。
2.3.1 TMZ对新诊断GBM的有效性评价:13项研究[9-16,18-21,23]对TMZ治疗新诊断GBM的有效性进行了评价,其中11项研究[9-15,18-20,23]结果显示,放疗结合TMZ治疗方案较单纯放疗方案更有生存优势;1项研究[16]结果显示,TMZ单药治疗方案较单纯放疗方案更有生存优势;1项研究[21]结果显示,西仑吉肽方案、贝伐珠单抗结合伊立替康方案结合或不结合TMZ联合放疗方案较TMZ联合放疗方案更有生存优势。
(1)OS。①2项研究[10-11]均根据直接和间接比较证据合并进行网状Meta分析。1项研究[10]通过对OS的有效性进行排序,证明TMZ伴随和辅助放疗的排序高于TMZ、放疗。另1项研究[11]中,在OS方面,中度大分割放疗(3周)联合TMZ和辅助TMZ分别以81.0%和99.1%的概率成为最佳和次佳辅助治疗选择。②4项研究[12-13,15,23]对比了TMZ联合放疗与单纯放疗的OS,综合4项研究结果,与单纯放疗相比,放疗联合TMZ治疗新诊断的GBM患者有明显的生存优势,可显著延长OS,差异有统计学意义(RR=2.93,95%CI=2.29~3.75,P<0.000 01[12];HR=0.63,95%CI=0.52~0.76,P<0.000 01[13];HR=0.59,95%CI=0.48~0.72,P<0.000 01[15];18个月OS:RR=2.46,95%CI=1.11~5.46,P=0.03[23];24个月OS:RR=2.88,95%CI=1.95~4.25,P<0.000 01[23])。③1项研究[19]根据直接和间接比较证据合并进行网状Meta分析,有效性排序从高至低分别为大分割放疗结合TMZ治疗、大分割放疗、单独TMZ治疗、标准放疗,其中最优治疗方案为大分割放疗结合TMZ治疗方案。④1项研究[16]中,与单纯放疗相比,TMZ单药治疗可延长OS,差异有统计学意义(HR=0.86,95%CI=0.74~1.00,P=0.05),提示TMZ单药治疗在改善OS方面比单纯放疗优越。但另1项研究[19]中的传统Meta分析结果显示,标准放疗与大分割放疗、单独TMZ治疗方案在OS方面的差异无统计学意义(P>0.05);大分割放疗与单独TMZ治疗、短期放疗方案在OS方面的差异也无统计学意义(P>0.05)。因此,TMZ单药治疗对比单纯放疗在改善OS方面的结论并不统一,有待进一步论证。
(2)生存率。①1项研究[9]中,放疗联合TMZ与单纯放疗的6个月生存率比较,差异无统计学意义(OR=0.690,95%CI=0.471~1.011,P=0.057);放疗联合TMZ的1年生存率高于单纯放疗,差异有统计学意义(OR=0.469,95%CI=0.237~0.928,P=0.030)。②1项研究[13]结果显示,与单纯放疗相比,放疗辅助TMZ可显著提高2年生存率,差异有统计学意义(RR=3.25,95%CI=2.13~4.94,P<0.000 01)。③1项研究[14]中,放疗联合TMZ治疗的0.5年和1年生存率分别为80.2%~95.0%和20.0%~61.1%,单纯放疗分别为8.3%~84.2%和5.0%~50.6%,提示与单纯放疗相比,放疗联合TMZ治疗有更高的生存率。④1项研究[18]根据直接和间接证据合并进行网状Meta分析,24个月总生存率有效性排序从高至低分别为早期方案、标准方案、单独放疗。⑤1项研究[20]中,TMZ与单独放疗在12个月总生存率(RR=1.22,95%CI=1.01~1.47,P=0.04)、24个月总生存率(RR=2.65,95%CI=1.86~3.78,P<0.01)方面的差异均有统计学意义,提示与单纯放疗相比,放疗结合同步和随后辅助TMZ治疗提高了GBM患者的12、24个月总生存率。⑥1项研究[21]的网状Meta分析结果显示,不同血管抑制剂结合/不结合Stupp方案的干预效果均优于Stupp方案。24个月总生存率有效性排序从高至低分别为西仑吉肽方案(1次2 000 mg,1周5次)、贝伐珠单抗结合伊立替康治疗加入Stupp方案、贝伐珠单抗结合伊立替康方案、贝伐珠单抗结合Stupp方案、西仑吉肽方案(1次2 000 mg,1周2次)、Stupp方案。
(3)中位生存期。2项研究[9,14]对比了TMZ联合放疗与单纯放疗的中位生存期。1项研究[9]中,联合治疗组患者的中位生存期为13.4~19.0个月,而单纯放疗组为7.7~17.1个月。1项研究[14]中,联合治疗组患者的中位生存期为9.4~19.0个月,而单纯放疗组为7.3~17.1个月。综合上述2项研究结果,与单纯放疗相比,TMZ联合放疗能够延长中位生存期。
(4)PFS。①1项研究[9]结果显示,TMZ联合放疗组患者的PFS为6.3~13.0个月,而单纯放疗组为5.0~7.6个月。1项研究[10]中,高确定性证据表明,与RT40相比,CRT延长了疾病进展时间,差异有统计学意义(HR=0.50,95%CI=0.41~0.61,P<0.000 1)。1项研究[12]中,与单纯放疗相比,TMZ联合放疗延长了PFS,差异有统计学意义(RR=3.52,95%CI=2.53~4.89,P<0.000 01)。1项研究[15]中,与单纯放疗相比,TMZ联合放疗延长了PFS,差异有统计学意义(HR=0.58,95%CI=0.41~0.84,P=0.003)。1项研究[23]中,与单纯放疗相比,TMZ联合放疗延长了6个月PFS(RR=1.48,95%CI=1.22~1.78,P<0.000 1)、12个月PFS(RR=3.07,95%CI=2.17~4.34,P<0.000 01)、18个月PFS(RR=4.71,95%CI=2.51~8.84,P<0.000 01)和24个月PFS(RR=7.47,95%CI=2.67~20.94,P=0.000 1),差异均有统计学意义。综合上述5项研究结果,与单纯放疗相比,联合TMZ治疗可显著改善PFS。②1项研究[16]的分析结果显示,TMZ单药治疗与单纯放疗在PFS方面的差异无统计学意义(HR=0.98,95%CI=0.64~1.51,P=0.92),非劣效性测试证实了TMZ相较于放疗对老年GBM患者的非劣效性,由于数据有限,对此应谨慎解读。
(5)无进展生存率。1项研究[9]中,放疗联合TMZ与单纯放疗在6个月无进展生存率方面的差异无统计学意义(OR=0.429,P=0.052);放疗联合TMZ的1年无进展生存率高于单纯放疗,差异有统计学意义(OR=0.245,P<0.001)。1项研究[14]结果显示,放疗联合TMZ组患者的0.5年无进展生存率为53.9%~78.0%,而单纯放疗组为5.0%~36.4%。1项研究[20]结果显示,放疗联合TMZ组患者的12个月无进展生存率(RR=2.59,95%CI=1.53~4.40,P=0.000 4)、24个月无进展生存率(RR=6.77,95%CI=2.82~16.26,P<0.01)高于单纯放疗组,差异均有统计学意义。综合上述3项研究结果,放疗联合TMZ治疗较单纯放疗提高了GBM患者的无进展生存率。
(6)中位PFS。1项研究[14]中,放疗联合TMZ组患者的中位PFS为5.5~13.0个月,而单纯放疗组为4.4~7.6个月,提示放疗联合TMZ治疗较单纯放疗延长了患者的中位PFS。
(7)TTP。1项研究[23]中,与单纯放疗相比,放疗联合TMZ治疗的6个月TTP(RR=1.51,95%CI=1.07~2.13,P=0.02)、12个月TTP(RR=3.91,95%CI=1.59~9.61,P=0.003)更短,差异均有统计学意义。提示与单纯放疗相比,放疗联合TMZ治疗可以改善6、12个月TTP。
(8)生活质量。2项研究报告了与生活质量相关的结局指标。1项研究[10]纳入的中度确定性证据显示,TMZ组与放疗组患者的3、6或12个月总体生活质量(QoL)评分比较,差异均无统计学意义(P>0.05);在沟通缺陷引起的不适方面,两组患者的差异有统计学意义(P<0.05),尤其发生于6~12个月死亡的接受放疗的患者中。1项研究[16]结果显示,在认知、角色、身体和情绪功能方面,TMZ组患者与健康相关的QoL评分总体上优于放疗组,两组患者的整体健康状况相似,但因为在较长时间点完成的问卷很少,应谨慎解释结果。
2.3.2 TMZ对新诊断GBM和AA的有效性评价:3项研究[17,22,24]对TMZ治疗新诊断GBM和AA的有效性均进行了评价,结果显示,放疗结合TMZ治疗方案较单纯放疗方案更有生存优势;TMZ单药治疗与单纯放疗有相似的结果,在OS和12个月总生存率方面的差异均无统计学意义(P>0.05)。(1)OS。1项研究[22]结果显示,在新诊断的GBM和AA患者中,TMZ单药治疗与单纯放疗的OS比较,差异无统计学意义(HR=0.84,95%CI=0.62~1.15,P=0.29)。(2)生存率。①2项研究[17,24]结果显示,与单纯放疗相比,TMZ联合放疗可提高新诊断GBM和AA患者的1、2、3年生存率,1项研究[17]中,合并OR分别为3.34(95%CI=2.15~5.18,P<0.000 01)、2.56(95%CI=1.58~4.14,P=0.000 1)、2.81(95%CI=1.61~4.90,P=0.000 3);1项研究[24]中,合并OR分别为2.39(95%CI=1.50~3.81,P=0.72)、2.20(95%CI=1.11~4.38,P=0.72)、2.00(95%CI=0.81~4.94,P=0.94)。②1项研究[22]中,TMZ单药治疗与单纯放疗的12个月总生存率比较,差异无统计学意义(RR=1.11,95%CI=0.76~1.62,P=0.60)。(3)中位生存期。1项研究[17]结果显示,与单纯放疗相比,放疗联合TMZ治疗能够延长患者的中位生存期,差异有统计学意义(OR=8.42,95%CI=7.54~9.29,P<0.000 01)。(4)总有效率。1项研究[24]结果显示,与单纯放疗相比,TMZ联合放疗可提高总有效率,差异无统计学意义(OR=3.63,95%CI=2.34~5.62,P=0.55)。(5)临床缓解率。1项研究[17]结果显示,与单纯三维适形放疗相比,放化疗联合方案能够提高临床缓解率,差异有统计学意义(OR=4.20,95%CI=2.72~6.50,P<0.000 01)。
2.3.3 TMZ对新诊断、复发性GBM的有效性评价:1项研究[25]对TMZ治疗新诊断、复发性GBM的有效性均进行了评价。(1)中位生存期。复发性GBM患者使用TMZ单药、贝伐珠单抗联合伊立替康和贝伐珠单抗化疗的中位生存期均短于新诊断的GBM患者;各对照组内的中位生存期相近。(2)中位PFS。在新诊断的GBM患者中,贝伐珠单抗化疗组、贝伐珠单抗联合TMZ组和贝伐珠单抗联合伊立替康治疗组的中位PFS长于TMZ单药治疗组;在复发性GBM患者中,各组患者中位PFS的差异无统计学意义(P>0.05);新诊断GBM与复发性GBM患者中位PFS的差异无统计学意义(P>0.05)。(3)6个月无进展生存率。在新诊断的GBM患者中,提高6个月无进展生存率的有效性由高至低排序分别为贝伐珠单抗联合伊立替康、贝伐珠单抗联合TMZ、TMZ单药治疗;在复发性GBM患者中也有类似的结果,TMZ单药治疗的6个月无进展生存率最低,贝伐珠单抗联合伊立替康方案优于贝伐珠单抗联合TMZ、贝伐珠单抗单药治疗,贝伐珠单抗单药治疗方案优于TMZ单药治疗方案。
2.4 临床安全性评价
共11项研究对TMZ的安全性进行了分析。(1)10项研究[10,12,14-18,20,23-24]报告了血液系统相关不良反应,主要为嗜中性粒细胞减少、白细胞减少、淋巴细胞减少、血小板减少和贫血等。多数研究[10,12,14-18,20,24]结果显示,TMZ能增加患者血液系统不良反应的发生风险,但大多数不良反应可以通过延迟下一个治疗周期或减少给药剂量来控制,经对症治疗后可好转,大多数患者仍然耐受TMZ治疗。(2)8项研究血液系统不良事件也极少发生。(3)1项研究[13]报告了血液系统并发症,比单纯放疗比较,辅助TMZ治疗增加了[12,14-18,20,24]报告了非血液系统相关不良反应,如疲劳、无力、头痛、恶心和感染等,结果显示,TMZ不会增加非血液系统不良反应的发生风险,严重的非血液系统并发症的发生风险,但其血液风险并发症通常是可以耐受的。由此可见,TMZ对新诊断的GBM和AA患者具有可接受的安全性特征。
2.5 经济性评价
1项药物经济学评价[26]从我国医疗卫生角度分析,利用成本-效果分析方法,结果显示,尽管TMZ的应用使得晚期GBM患者OS显著延长,但相较于单纯放疗方案,TMZ联合放疗方案中每例患者的OS延长1个月,需多花费人民币58 959.7元。根据世界贸易组织推荐的成本-效果阈值分析增量成本-效果比(ICER)>3倍人均国内生产总值(人均GDP,以2013年湖北省人均GDP每月3 557.2元计算),说明与单纯放疗比较,TMZ联合放疗用于GBM不具有成本-效果优势。
1篇药物经济学评价[27]从芬兰医疗保健支付者的角度分析,利用成本-效果分析方法,采用马尔科夫模型方式,比较了TMZ与PCV方案治疗术后复发的GBM的经济性。结果显示,基于芬兰的分析,在术后复发的GBM患者中,TMZ与PCV方案治疗的ICER为32 471欧元/质量调整生命年(QALY);在愿意为每质量调整生命月(QALM)支付5 000、10 000、20 000欧元的情况下,TMZ比PCV方案分别有约60%、75%、85%的概率更具有成本-效果优势。
1篇药物经济学评价[28]从公共卫生保健角度,比较了TMZ联合和辅助放疗与单纯初始放疗治疗新诊断GBM的成本-效果。结果显示,与单纯初始放疗相比,TMZ联合和辅助放疗提高了生存率,增加了治疗成本,以荷兰单位成本计算,TMZ组患者的ICER为37 361欧元/生命年、34 870欧元/无进展生命年。根据概率敏感性分析显示,假设40 000欧元为该分析的阈值时,在每生命年TMZ更具经济性的可能性为55%、在无进展生命年TMZ更具经济性的可能性为64%。
1篇药物经济学评价[29]采用马尔科夫模型方式从我国医疗体系角度分析,比较了TMZ联合放疗、放疗、放疗联合亚硝基脲治疗新诊断GBM的成本-效果。相对于单纯放疗方案、放疗联合亚硝基脲方案,放疗联合TMZ方案每增加1个QALY的ICER分别为87 940.6、94 968.3美元。根据世界卫生组织的建议,中国支付意愿阈值为11 034美元/QALY,概率敏感性分析结果显示,放疗联合TMZ方案不具有经济性。
1篇药物经济学评价[30]从美国社会视角分析,利用成本-效用分析方法,采用马尔科夫模型方式,对标准放疗方案联合原研药TMZ和仿制药TMZ与单独放疗方案进行比较,每个QALY的ICER分别为102 364和8 875美元。在每个QALY的支付意愿阈值为15万美元的情况下,TMZ治疗新诊断的GBM具有经济性。
1篇药物经济学评价[31]从我国社会角度分析,利用成本-效果分析方法,采用马尔科夫模型方式,对TMZ治疗方案与TMZ和贝伐珠单抗联合治疗方案进行比较。结果显示,在TMZ疗法中加入贝伐珠单抗使总成本增加了30 894.99美元,QALY增加了0.18年,ICER为171 638.83美元/QALY。单向敏感性和概率敏感性分析证实,在支付意愿阈值为26 508.00美元/QALY的情况下,TMZ和贝伐珠单抗联合治疗不具有经济性。
3 讨论
TMZ于1999年1月27日在欧洲获批治疗GBM,于1999年8月11日通过美国食品药品监督管理局批准在美国上市,2000年以后国内逐步有其临床应用的报道。2005年,欧洲肿瘤研究治疗组织和加拿大国立癌症研究院的大规模Ⅲ期临床研究得出的Stupp方案是目前高级别胶质瘤的标准治疗方案,通过放射治疗加同步TMZ每日给药共给药6周,然后辅助TMZ治疗6个月[7,32]。TMZ最常发生的不良反应包括恶心、厌食、乏力、中度至重度的血小板减少,见于10%~20%的患者[33]。通过适当的延迟给药和减少剂量,大多数患者能够完成预期的TMZ辅助治疗周期。同步治疗期间,需要每周监测1次全血细胞计数。由于血小板计数和中性粒细胞绝对计数可急剧降低,如果血小板计数<0.1×109/L或中性粒细胞绝对计数<0.001 5×109/L,应停用TMZ[34]。
本研究通过快速HTA的方法,探索了TMZ治疗GBM和AA患者的有效性、安全性和经济性。(1)有效性方面,放疗联合TMZ优于单纯放疗;单纯TMZ治疗与单纯放疗的有效性结果不统一,有待进一步论证。贝伐珠单抗与TMZ或伊立替康联合应用优于单纯TMZ治疗。西仑吉肽方案、贝伐珠单抗结合伊立替康方案结合/不结合TMZ联合放疗方案均优于TMZ联合放疗方案。(2)安全性方面,TMZ会增加患者血液系统不良反应的发生风险,如嗜中性粒细胞减少、白细胞减少、血小板减少和贫血等,但3—4级严重毒性极少发生,大多数不良反应可以通过延迟下一个治疗周期或减少剂量等方法控制,经对症治疗后可好转,因此,大多数患者仍然耐受TMZ治疗。(3)经济性方面,共有6项研究[26-31]对TMZ治疗GBM进行了经济性评价。其中2项来自我国的经济性研究[26,29],以我国医疗体系为研究视角,结果显示,在成本-效果方面,与单独放疗比较,TMZ联合放疗不具有经济性。1项来自多个国家的经济性研究[28]以荷兰、瑞士和加拿大的公共医疗系统为视角,结果显示,在成本-效果方面,TMZ联合放疗比单独放疗更有经济性。1项来自美国的经济性研究[30]以美国社会为视角,结果显示,在成本-效用方面,TMZ联合放疗比单独放疗更有经济性。1项来自我国的经济性研究[31]以我国社会为视角,结果显示,在成本-效果方面,与TMZ治疗比较,TMZ和贝伐珠单抗联合治疗不具有经济性。1项来自芬兰的经济性研究[27]以芬兰医疗保健支付者为视角,结果显示,在成本-效果方面,TMZ比PCV方案更具成本-效果优势。TMZ联合放疗与单纯放疗相比,经济性结论不统一,分析差异性可能存在以下原因:(1)从不同的医疗保健系统角度来看,不同研究中的ICER差异很大;(2)不同国家的支付意愿阈值不同。因此,国内有必要对TMZ治疗GBM和AA的经济性进行更多高质量的研究及评价。
本研究具有一定的局限性:(1)本研究为快速HTA,对纳入的研究仅进行定性分析。(2)纳入的文献均为中文或英文文献,数量较少,且纳入的Meta分析/系统评价的文献质量较低。(3)纳入的17篇Meta分析/系统评价中,有4篇均为同一个第一作者。(4)在当前的分析中,干预措施与对照措施的具体治疗方案及给药剂量并不完全相同,术后开始治疗的时间也存在一定的差异,在患者特征方面缺乏一致性,这些差异对患者预后的影响尚未可知。因此,未来需要根据患者年龄、不同放疗方案、不同TMZ给药剂量等进行大量的高质量研究,进一步证实TMZ在GBM和AA患者中的有效性、安全性及最佳的治疗方案。
综上所述,根据本研究的评估,在GBM和AA患者中,TMZ联合放疗较单纯放疗具有良好的有效性,TMZ单药方案与单纯放疗方案的有效性结论不统一,未来有必要对此对照方案进行更多高质量研究;TMZ具有可接受的安全性;经济性结论不统一,有必要在国内对TMZ的经济性进行更多高质量的研究及评价。
