基于指纹图谱、抗氧化谱效相关性及多成分含量的诃子炮制方法优选Δ
2023-10-16杨武杰鞠成国安悦言辽宁中医药大学药学院辽宁大连6600国家中医药管理局中药炮制技术传承基地辽宁大连6600
杨武杰,郝 季,鞠成国,2,张 强,安悦言,王 巍#(.辽宁中医药大学药学院,辽宁 大连 6600;2.国家中医药管理局中药炮制技术传承基地,辽宁 大连 6600)
诃子为使君子科植物诃子Terminalia chebulaRetz.或绒毛诃子T. chebulaRetz. var.tomentellaKurt.的干燥成熟果实,收载于2020 年版《中国药典》(一部)。其味苦、酸、涩,性平,归肺、大肠经[1]。诃子中含有酚酸类、鞣质类、三萜类等多种化学成分,具有抗氧化、抗癌、抗炎等多种药理活性[2]。
诃子在临床上存在生熟异用现象。清代张璐的《本经逢原》记载“诃子苦涩降敛,生用清金止嗽,煨熟固肠止泻”[3]。关于诃子的炮制方法首载于汉代张仲景的《金匮要略》:“治气痢,以诃黎勒十枚,面裹煻灰火中煨之,令面黄熟,去核,细研为末”[4]。后世医家多沿用“面裹煻灰火煨”或“湿纸裹煨”之法,直至南北朝雷敩在《雷公炮炙论》中载酒蒸之法——“凡修事,先于酒内浸,然后蒸一伏时,其诃黎勒以刀削路,细锉,焙干用之”[5]。目前,在各省炮制规范中所载的诃子炮制方法多为单炒法、麸煨法、砂烫法、炒炭法,而少见煻灰火煨法及酒蒸法。
本研究以诃子生品(SP)、单炒品(DC)、麸煨品(FW)、砂烫品(ST)、煻灰火煨品(THH)、炒炭品(CT)、酒蒸品(JZ)为研究对象,分别建立其高效液相色谱(high performance liquid chromatography,HPLC)指纹图谱,同时结合聚类分析(cluster analysis,CA)、主成分分析(principal component analysis,PCA)、正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)3 种化学计量学分析方法研究其经不同方法炮制后指纹图谱的差异,旨在探索诃子经不同方法炮制后指纹图谱信息的异同。
另外,研究发现,诃子所含的酚酸类、鞣质类成分均有明确的抗氧化活性[6]。本课题组前期研究发现,诃子经炮制后化学成分会发生转化[7],笔者推测其抗氧化活性也会随之发生改变。同时,中医药古籍所载的诃子经典炮制方法如煻灰火煨法在炮制过程中需要面皮包裹,操作繁琐,且该法在现代工业生产车间难以实现,因此寻找合适的现代炮制方法尤为重要。故本研究采用1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除法测定诃子SP 及不同炮制品的体外抗氧化活性,并结合灰色关联度分析(grey relation analysis,GRA)及偏最小二乘回归分析(partial least squares regression,PLSR)研究诃子SP及不同炮制品抗氧化活性的谱效关系,探讨诃子现代炮制方法与古法的异同,为寻找与经典古法相近的现代炮制方法提供科学依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有1100 型HPLC 仪、G1314A型可变波长检测器(美国Agilent公司),FA1004B型万分之一分析天平(上海精密科学仪器有限公司),METTLER AE240 型十万分之一分析天平(瑞士Mettler Toledo公司),U3010型紫外-可见分光光度仪(日本Hitachi公司)。
1.2 主要药品与试剂
10 批诃子药材(编号S1~S10)的来源信息见表1,所有药材均经辽宁中医药大学药学院宋慧鹏副教授鉴定为使君子科植物诃子T. chebulaRetz.的干燥成熟果实;诃子次酸、没食子酸、鞣花酸对照品(批号分别为MUST-22112801、MUST-13040103、MUST-14031010)均购自成都曼思特生物科技有限公司,安石榴苷对照品(批号J0201AS,其为安石榴苷A 与安石榴苷B 的混合物,安石榴苷A 与安石榴苷B 互为异构体)购自大连美仑生物技术有限公司,柯里拉京、诃黎勒酸、1,2,3,4,6-O-五没食子酰葡萄糖、诃子酸对照品(批号分别为PRF9101742、PRF8112302、PRF9091704、PRF8071201)均购自成都普瑞法科技开发有限公司,所有对照品的纯度均大于98%;DPPH(纯度>97%)购自上海梯希爱化成工业发展有限公司;乙腈、甲醇、甲酸均为色谱纯,水为超纯水。

表1 10批诃子药材的来源信息
2 方法与结果
2.1 诃子SP及不同炮制品的制备
(1)SP:取净诃子,砸去果核,留取果肉,即得[1]。
(2)THH:取净诃子,用面皮裹后置于煻灰火(木材燃烧后所得灰烬,翻动可见火星而无明火)中,烧至面皮焦黄色(大概烧15 min),取出,放凉,砸去面皮及果核,留取果肉,即得[4]。
(3)DC:取净诃子置锅内,文火加热,炒至深黄色(大概炒5 min),取出,放凉,砸去果核,留取果肉,即得[8]。
(4)FW:取净诃子与麸皮同置锅中[药材-麦麸(100∶30,m/m)],文火加热,缓慢翻动,以(140±10) ℃煨至黄褐色(大概煨20 min),取出,筛去麸皮,放凉,砸去果核,留取果肉,即得[9]。
(5)ST:取净河砂置锅内炒烫,倒入净诃子,以(160±10) ℃翻炒6 min,取出,筛去河砂,放凉,砸去果核,留取果肉,即得[7]。
(6)CT:取净诃子置锅内,武火加热,炒至亮黑色(大概炒6 min),取出,放凉,砸去果核,留取果肉,即得[10]。
(7)JZ:取净诃子加入黄酒浸润30 min,置于蒸锅中,蒸24 h,70 ℃烘干,砸去果核,留取果肉,即得[5]。
2.2 溶液的制备
2.2.1 对照品溶液
分别精密称取诃子次酸、没食子酸、安石榴苷、柯里拉京、诃黎勒酸、鞣花酸、1,2,3,4,6-O-五没食子酰葡萄糖、诃子酸对照品各适量,分别置于10 mL容量瓶中,加入50%乙腈定容制得相应对照品溶液。吸取上述各对照品溶液适量,混合,制得每1 mL含12.25 µg诃子次酸、20.00 µg 没食子酸、32.10 µg 安石榴苷、17.60 µg 柯里拉京、23.64 µg诃黎勒酸、52.80 µg鞣花酸、18.00 µg 1,2,3,4,6-O-五没食子酰葡萄糖、60.72 µg 诃子酸的混合对照品溶液。
2.2.2 供试品溶液
取诃子SP及不同炮制品,粉碎,过65目筛。精密称取0.1 g各样品粉末,加入50%乙腈25 mL,称定质量,超声(功率250 W,频率40 kHz)提取30 min,放冷,以提取溶剂补足减失的质量,摇匀,滤过,取续滤液2 mL 用提取溶剂定容至10 mL 容量瓶中,再经0.45 µm 微孔滤膜滤过,取续滤液,即得指纹图谱用供试品溶液;将该指纹图谱用供试品溶液以50%乙腈依次稀释,得质量浓度分别为8.0、4.0、2.0、1.0、0.50、0.25 µg/mL的系列溶液,作为测定诃子SP及不同炮制品抗氧化活性用供试品溶液。
2.3 色谱条件
采用Dikma Platisil ODS色谱柱(250 mm×4.6 mm,5 µm),以乙腈为流动相A、0.1%甲酸-5%甲醇溶液为流动相B进行梯度洗脱(0~5 min,2%A→4%A;5~10 min,4%A;10~12 min,4%A→6%A;12~25 min,6%A→13%A;25~38 min,13%A;38~40 min,13%A→14%A;40~52 min,14%A;52~55 min,14%A→16%A;55~82 min,16%A);进样量为5 µL;流速为1 mL/min;柱温为25 ℃;检测波长为270 nm。
2.4 诃子SP及不同炮制品的指纹图谱研究
2.4.1 精密度试验
取诃子SP(编号S1)按“2.2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件连续进样6次,记录色谱图。以诃黎勒酸色谱峰(峰15)为参照,计算得各共有峰相对保留时间的RSD 为0.68%~1.22%(n=6),相对峰面积的RSD为0.71%~1.16%(n=6),表明方法精密度良好。
2.4.2 稳定性试验
取诃子SP(编号S1)按“2.2.2”项下方法制备供试品溶液,分别在制备后0、2、4、8、12、24 h 按“2.3”项下色谱条件进样,记录色谱图。以诃黎勒酸色谱峰(峰15)为参照,计算得各共有峰相对保留时间的RSD 为0.84%~1.06%(n=6),相对峰面积的RSD为0.69%~1.34%(n=6),表明供试品溶液在24 h内稳定性良好。
2.4.3 重复性试验
取诃子SP(编号S1)按“2.2.2”项下方法平行制备6份供试品溶液,按“2.3”项下色谱条件进样,记录色谱图。以诃黎勒酸色谱峰(峰15)为参照,计算得各共有峰相对保留时间的RSD 为0.83%~1.47%(n=6),相对峰面积的RSD为0.94%~1.21%(n=6),表明方法重复性良好。
2.4.4 指纹图谱建立及相似度评价
取10 批诃子药材,按“2.1”项下方法分别制备10 批SP及不同炮制品,按“2.2.2”项下方法分别制备各样品的供试品溶液,再按“2.3”项下色谱条件进样分析,记录色谱图。将各样品的色谱数据分别导入《中药色谱指纹图谱相似度评价系统(2012 版)》,各样品的分析条件均相同:设定药材编号S1的SP样品图谱为参照图谱,设置时间窗宽度为0.1 min,采用多点校正和Mark 峰匹配生成指纹图谱(图略),并采用中位数法生成各样品的对照指纹图谱。经识别得到各样品的20 个共有峰,见图1A。各批次诃子SP、DC、FW、ST、THH、CT、JZ的相似度分别为0.959~0.996、0.923~0.990、0.952~0.983、0.935~0.993、0.915~0.997、0.924~0.999、0.980~0.997。
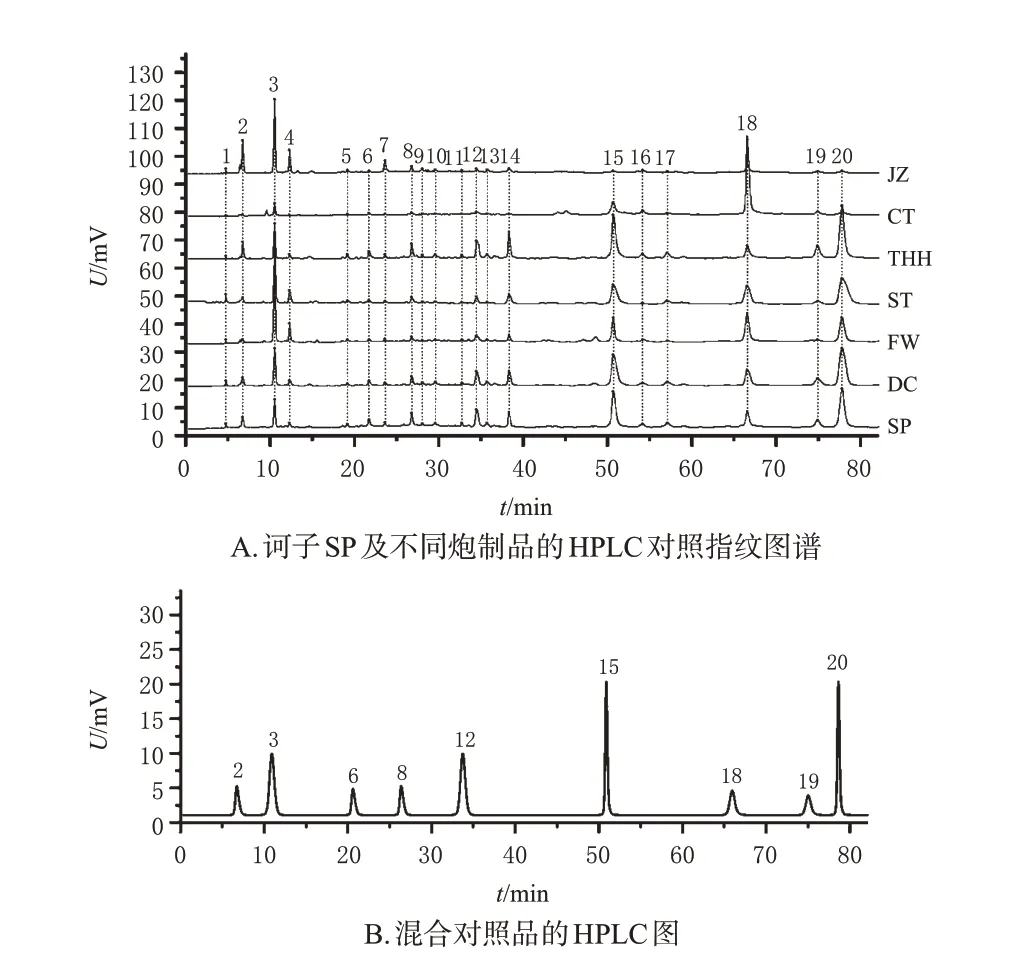
图1 诃子SP 及不同炮制品的HPLC 对照指纹图谱和混合对照品的HPLC图
2.4.5 共有峰指认
取“2.2.1”项下混合对照品溶液,按“2.3”项下色谱条件进样分析,记录色谱图(图1B),通过与对照指纹图谱中各共有峰的保留时间进行对比,共指认出9个共有峰,分别为色谱峰2(诃子次酸)、3(没食子酸)、6(安石榴苷A)、8(安石榴苷B)、12(柯里拉京)、15(诃黎勒酸)、18(鞣花酸)、19(1,2,3,4,6-O-五没食子酰葡萄糖)、20(诃子酸)。
2.5 诃子SP及不同炮制品中8种成分的含量测定
2.5.1 线性关系及检测限、定量限考察
取“2.2.1”项下各对照品溶液,用50%乙腈稀释成系列质量浓度的线性工作液,分别按“2.3”项下色谱条件进样分析,以进样质量浓度为横坐标(x)、峰面积为纵坐标(y)绘制标准曲线。取“2.2.1”项下各对照品溶液,用50%乙腈稀释成系列质量浓度的溶液,按“2.3”项下色谱条件进样分析,分别以信噪比3∶1和10∶1对应的质量浓度作为检测限和定量限(其中安石榴苷峰面积为安石榴苷A 与安石榴苷B 峰面积之和)。线性关系及检测限、定量限考察结果见表2。
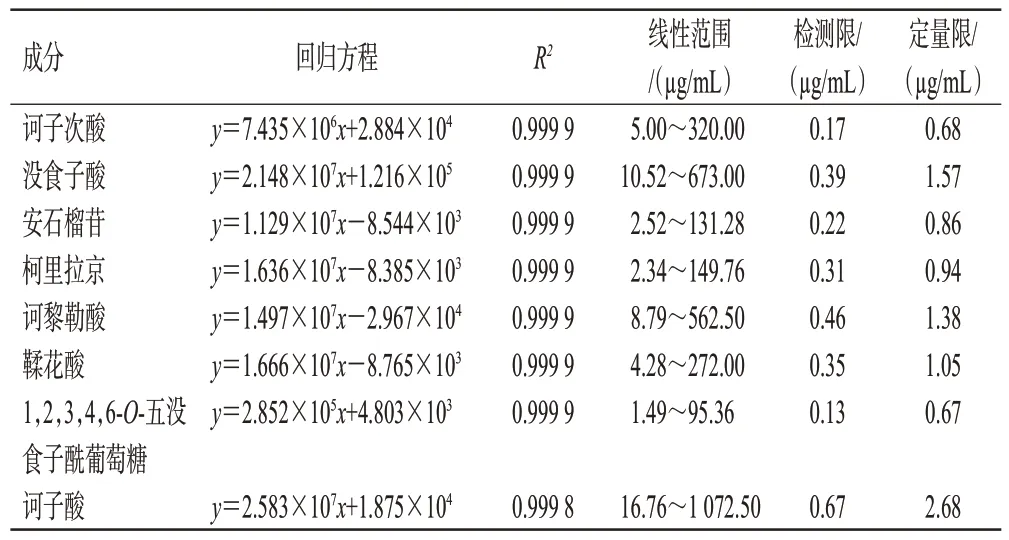
表2 线性关系及检测限、定量限考察结果
2.5.2 精密度试验
取诃子SP(编号S1)按“2.2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件连续进样6次,记录色谱图。结果显示,8 种待测成分色谱峰峰面积的RSD 为0.36%~1.07%(n=6),表明方法精密度良好。
2.5.3 稳定性试验
取诃子SP(编号S1)按“2.2.2”项下方法制备供试品溶液,分别在制备后0、2、4、8、12、24 h 按“2.3”项下色谱条件进样,记录色谱图。结果显示,8种待测成分色谱峰峰面积的RSD 为0.28%~1.12%(n=6),表明供试品溶液在制备后24 h内稳定性良好。
2.5.4 重复性试验
取诃子SP(编号S1)按“2.2.2”项下方法平行制备6份供试品溶液,按“2.3”项下色谱条件进样,记录色谱图,按外标一点法计算8种待测成分的含量。结果显示,各成分含量的RSD 为0.23%~1.35%(n=6),表明方法重复性良好。
2.5.5 加样回收率试验
取6份已知成分含量的诃子SP(编号S1)适量,按质量比1∶1 加入各对照品,按“2.2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件进样检测,记录色谱图,计算加样回收率。结果显示,诃子次酸、没食子酸、安石榴苷、柯里拉京、诃黎勒酸、鞣花酸、1,2,3,4,6-O-五没食子酰葡萄糖、诃子酸的加样回收率分别为100.3%~101.7%、98.60%~102.3%、99.76%~102.6%、100.4%~102.5%、98.43%~101.8%、99.6%~102.5%、98.24%~102.4%、98.39%~101.3%,RSD 分别为0.35%、1.14%、0.83%、0.75%、0.53%、0.86%、1.12%、0.94%(n=6),表明该方法准确度良好。
2.5.6 含量测定
取“2.2.2”项下诃子SP及不同炮制品的供试品溶液(各10批),分别按“2.3”项下色谱条件进样测定,采用外标一点法计算样品中8种成分的含量,并计算平均含量,结果见表3。结果显示,诃子经过不同炮制方法炮制后,8 种待测成分的含量均发生了改变,其中CT、JZ 由于经过高温及长时间蒸制,其8种待测成分的含量变化较其他炮制品更为明显。
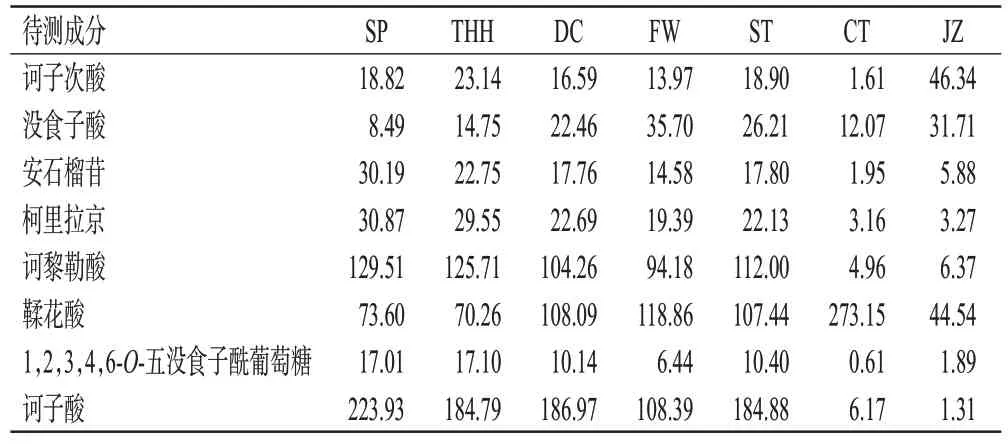
表3 诃子SP及不同炮制品中8种成分的含量测定结果(mg/g,n=10)
2.6 诃子SP及不同炮制品的抗氧化能力测定
采用DPPH 自由基清除法进行抗氧化能力测定[11—12]。精密量取“2.2.2”项下诃子SP 及不同炮制品抗氧化活性用供试品溶液各3 mL,分别置于具塞试管中,精密加入DPPH自由基溶液(0.25 mmol/L)1 mL,混合摇匀,密塞,室温避光放置30 min。采用紫外-可见分光光度计测定517 nm 波长处各样品的吸光度(A1)。以等体积50%乙腈代替DPPH 自由基溶液,同法操作,测定其吸光度(A2);以等体积50%乙腈代替样品溶液,同法操作,测定其吸光度(A0)。各样品均测定3 次,取平均值,计算DPPH 自由基清除率:DPPH 自由基清除率(%)=[1—(A1—A2)/A0]×100%。借助SPSS 22.0 软件中Probit分析功能,通过Logit法计算诃子SP 及不同炮制品的自由基半数清除浓度(IC50)。结果显示,诃子SP、DC、FW、ST、THH、CT、JZ 对DPPH 自由基的IC50分别为2.209、1.945、3.009、2.960、4.385、7.391、7.736 µg/mL,各样品的IC50差异明显,提示不同炮制工艺对诃子抗氧化活性具有不同影响,其中以DC(单炒品)抗氧化活性最强。
2.7 化学计量学分析
2.7.1 CA
采用SPSS 22.0进行数据处理。将收集的70批次诃子样品(SP及不同炮制品各10批)的共有峰峰面积作为原始数据导入该软件,用组间连接法计算,采用平方欧氏距离为测度进行CA,结果见图2。结果显示,当聚类距离为20 时,JZ 和CT 各自聚为一类,而SP、FW、DC、THH、ST 聚为另一类,表明SP、FW、DC、THH、ST 具有一定相似性,其指纹图谱信息存在部分重叠。
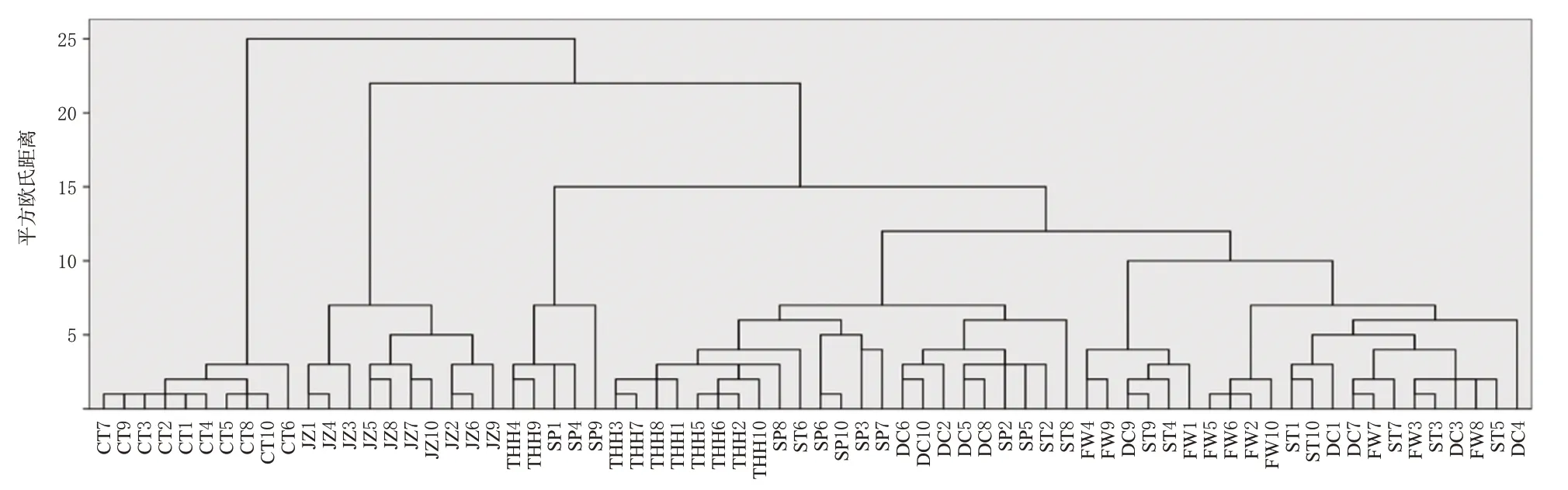
图2 诃子SP及不同炮制品的指纹图谱聚类分析树状图
2.7.2 PCA
将诃子SP及不同炮制品的共有峰峰面积作为原始数据,经标准化处理后,采用SPSS 22.0 软件进行PCA。结果显示,KMO 值>0.6,巴特利特球形检验显著性<0.05,表明各变量之间具有较强关联性,提示进行PCA具有可行性。
筛选得到特征值>1 的4 种主成分,其累计方差贡献率为86.633%,说明这4 种主成分涵盖了诃子SP 及不同炮制品指纹图谱86.633%的信息。由主成分因子载荷矩阵可知,色谱峰19(1,2,3,4,6-O-五没食子酰葡萄)、15(诃黎勒酸)、11、16、13、12(柯里拉京)、8(安石榴苷B)、5、6(安石榴苷A)对主成分1的贡献较大;色谱峰7、2(诃子次酸)、4对主成分2的贡献较大;而主成分3、4中未见贡献较大的色谱峰。PCA 得分图(图3)显示,诃子JZ、CT 均与SP 及其他炮制品具有显著区别,而诃子SP及其他炮制品之间区分不明显,与CA结果一致。

图3 诃子SP及不同炮制品的PCA得分图
2.7.3 OPLS-DA
将诃子SP及不同炮制品共有峰峰面积作为原始数据,采用SIMCA 14.1 软件进行OPLS-DA,结果见图4。从图4 可知,诃子JZ 和CT 能各自聚在一起,而SP 和其他炮制品聚在一起,结果与CA、OPLS-DA 结果保持一致,且OPLS-DA 分离效果较PCA 更好,更适用于诃子SP及不同炮制品的指纹图谱数据分析。OPLS-DA模型的R2X为0.944、R2Y为0.512,均大于0.5,表明该模型对X矩阵和Y矩阵均有较好的解释能力;Q2为0.456>0.4,表明该模型对样品变量有良好的预测能力。
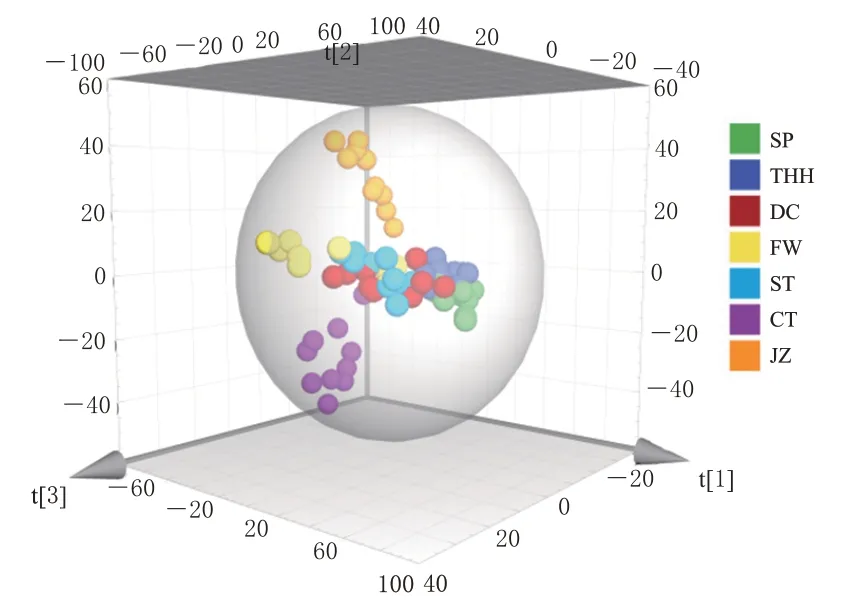
图4 诃子SP及不同炮制品的OPLS-DA得分图
结合重要变量投影结果,以变量投影重要性(variable importance in projection,VIP)值>1为筛选标准,筛选诃子SP 及不同炮制品之间的差异性色谱峰。结果显示,VIP值从大到小依次为色谱峰20(诃子酸,VIP=2.149)、15(诃黎勒酸,VIP=1.824)、3(没食子酸,VIP=1.787)、18(鞣花酸,VIP=1.748)。
2.8 谱效关系分析
2.8.1 GRA
将诃子SP 及不同炮制品的IC50及共有峰峰面积导入SPSSPRO 在线分析平台(https://www.spsspro.com),对数据进行均值化处理,并将共有峰峰面积作为自变量,IC50作为因变量进行GRA,结果见表4。结果显示,色谱峰7、2(诃子次酸)、9、18(鞣花酸)、3(没食子酸)、4、1 与IC50的关联度均大于0.6,说明上述色谱峰所对应的成分与抗氧化活性联系较为紧密。
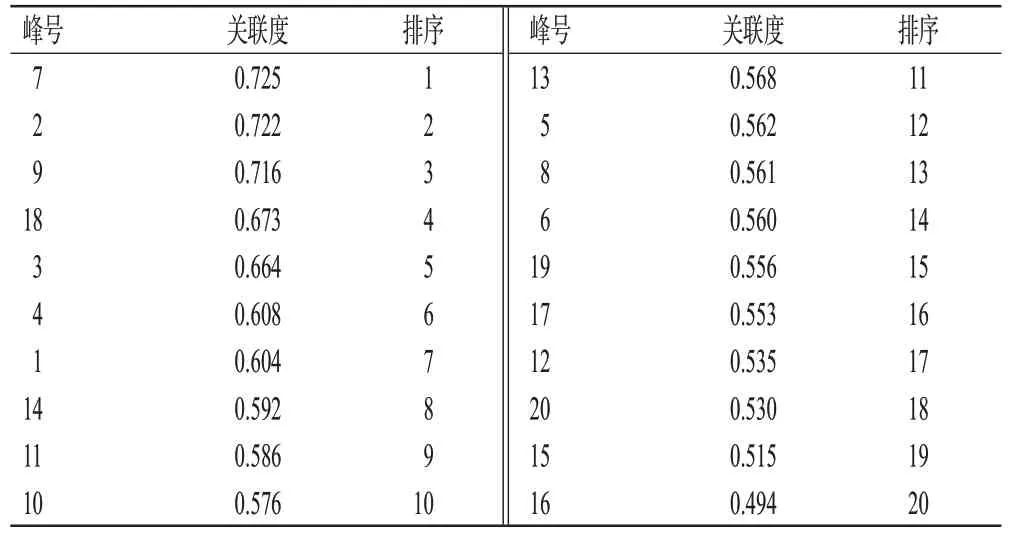
表4 诃子SP及不同炮制品各共有峰和IC50的关联度
2.8.2 PLSR
将诃子SP 及不同炮制品的IC50(因变量)和共有峰峰面积(自变量)导入SIMCA 14.1软件进行PLSR,该模型的诊断参数如下:R2X=0.992,R2Y=0.980,Q2=0.867,数值均大于0.5。这说明该模型有很好的解释能力和预测能力。模型自动拟合出偏最小二乘回归系数,系数为正时说明该色谱峰对应的化合物与抗氧化活性呈正相关,系数为负时则为负相关。结果显示,色谱峰1、3(没食子酸)、4、6(安石榴苷A)、8(安石榴苷B)、10、11、12(柯里拉京)、13、15(诃黎勒酸)、20(诃子酸)所对应的成分与诃子SP 及不同炮制品的抗氧化活性呈正相关,其余色谱峰对应的成分与诃子SP及不同炮制品的抗氧化活性呈负相关。
结合重要变量投影结果,以VIP值>1为筛选标准,筛选诃子SP 及不同炮制品的抗氧化活性主要药效峰,分别是色谱峰20(诃子酸,VIP=2.483)、15(诃黎勒酸,VIP=2.283)、18(鞣花酸,VIP=1.130)、12(柯里拉京,VIP=1.084)、3(没食子酸,VIP=1.041)。
3 讨论
笔者在前期实验中发现,诃子中部分鞣质类成分在高浓度甲醇中存在不稳定现象,但在乙腈-水不同配比下,部分色谱峰选择性较差,经在洗脱体系中加入少量甲醇调节后分离效果得以改善,同时加入少量甲酸可以改善峰形,因此本研究最终选择乙腈(A)、0.1%甲酸-5%甲醇溶液(B)组成流动相体系。另外,在测定前对诃子提取液进行200~400 nm 波长范围的吸收光谱扫描,发现其在270 nm波长处有最大吸收,因此本研究选择检测波长为270 nm。
诃子SP 及不同炮制品共标定出20 个共有峰,指认出其中9 个色谱峰。通过CA、PCA、OPLS-DA 3 种化学计量学方法分析,结果均显示CT和JZ能各自区分为一类,而SP、DC、ST、FW、THH区分不明显。对比3种分析方法,有监督模式的OPLS-DA区分效果更明显,更适用于多种炮制品指纹图谱的分析。由OPLS-DA 结果可知,诃子酸、诃黎勒酸、没食子酸、鞣花酸4种成分对诃子SP及不同炮制品指纹图谱信息影响较大;结合含量测定结果可以看出,诃子炮制前后其诃子酸、诃黎勒酸、没食子酸、鞣花酸的含量变化较明显,这可能是因为炮制使诃子的化学成分发生了转化。此外还可以看出,炮制时间和温度不同,诃子的化学成分会发生不同程度的转化,其中CT 经过高温炒至炭化,JZ 经过24 h 长时间蒸制,导致大部分成分被破坏、分解,使得二者指纹图谱信息与其他炮制品相比区别明显。
《本经逢原》首次提出诃子生熟异用的观点,认为炮制可使诃子固肠止泻的作用增强,更适用于“肠澼”的治疗。“肠澼”与现代临床溃疡性结肠炎(ulcerative colitis,UC)相对应。本课题组前期对诃子SP 及不同炮制品治疗UC的药效学进行了比较,证实了诃子在炮制后对UC的治疗作用确有增强[7],该作用与其对氧化应激指标的调控有关。同时文献研究表明,诃子拥有强抗氧化活性,其清除自由基的能力为临床常用药依达拉奉的数倍[13],通过抗氧化途径能够起到心脏保护、神经保护、抗肿瘤、抗炎等作用[14—15]。本研究采用DPPH 自由基清除法测定了诃子SP 及不同炮制品的抗氧化活性,GRA 结果显示,色谱峰7、2(诃子次酸)、9、18(鞣花酸)、3(没食子酸)、4、1 所对应的成分与抗氧化活性联系较为紧密;结合PLSR,可初步判断诃子酸、诃黎勒酸、柯里拉京、没食子酸是诃子抗氧化活性的重要药效成分。文献亦报道这4种成分均具有明确的抗氧化作用[16—19]。结合诃子SP 及不同炮制品含量测定与抗氧化实验中IC50结果可知,诃子CT和JZ中上述4种成分总含量均较SP明显降低(4种成分总含量均在3%左右),所表现出的抗氧化活性也较低;而诃子SP及其他炮制品中上述4种成分的总含量高达20%以上,所表现出的抗氧化活性也明显升高。虽然诃子的抗氧化活性是多种成分共同作用的结果,单从4个已知成分含量变化来评价其抗氧化活性不够全面,但本研究结果足以证明不同炮制方法对诃子化学成分产生了不同的影响,进而影响到其抗氧化活性。根据本研究结果可推测,化学成分的变化将导致诃子其他生物活性亦随之变化,从而影响其临床疗效的发挥。
本研究发现,现代常用炮制方法制备的诃子DC、FW、ST 与古法炮制的THH 的HPLC 指纹图谱信息较为相似,均表现出较强的抗氧化活性,通过抗氧化谱效相关性分析所得的4种主要药效成分(诃子酸、诃黎勒酸、柯里拉京、没食子酸)总含量均较高,其中以DC的抗氧化活性最强;而诃子JZ与CT的4种抗氧化活性主要药效成分总含量均较低,其抗氧化活性与其他炮制品相比大大减弱。
综上所述,诃子DC具有与THH相似的化学成分及更优的抗氧化活性,且单炒法操作简单,适用于工业化生产,因此可初步判断单炒法是与诃子炮制经典古法煻灰火煨法相近且更为优良的现代炮制方法。
