尼妥珠单抗联合放化疗治疗局部晚期宫颈癌的疗效及对相关肿瘤因子水平和免疫功能的影响
2023-10-16朱海艺周丽妃张玉兰
朱海艺,周丽妃,张玉兰
(海南医学院第二附属医院肿瘤内科,海南 海口 570311)
宫颈癌是女性最为常见的一种恶性肿瘤,局部晚期患者预后不佳[1]。对于局部晚期宫颈癌(locally advanced cervical cancer,LACC),同步放化疗仍是标准治疗方案,但由于放化疗抵抗等因素,临床疗效受限,需积极探索新的有效治疗手段。约85%的宫颈癌患者存在与其预后密切相关的表皮生长因子受体(epidermal growth factor receptor,EGFR)表达[2],基于EGFR的靶向治疗为宫颈癌治疗带来新思路。尼妥珠单抗作为一种针对EGFR的人源化单克隆抗体,能够阻断EGFR介导的信号传导通路,进而发挥抗肿瘤作用[3]。尼妥珠单抗在局部晚期非小细胞肺癌、头颈部鳞状细胞癌、食管癌等多种恶性肿瘤的治疗中有着确切疗效[4-6],但目前关于其在LACC治疗中的应用尚缺乏足够的临床数据。为此,本研究拟探讨尼妥珠单抗联合放化疗治疗LACC的疗效。
1 资料与方法
1.1 一般资料
选取2020年1月至2021年12月海南医学院第二附属医院收治的90例LACC患者作为研究对象。纳入标准:(1)经病理活检证实为宫颈癌,FIGO分期属于II B-Ⅲ期;(2)无远处转移;(3)美国东部肿瘤协作组(east-ern cooperative oncology group,ECOG)评分为0~2分;(4)预计生存期不少于3个月;(5)年龄≥18岁。排除标准:(1)合并重要脏器(如心肺肾)功能不全者;(2)合并其他恶性肿瘤者;(3)合并严重血液系统疾病者;(4)对放化疗无法耐受者;(5)处于妊娠或哺乳期;(6)合并免疫系统疾病者。按照治疗方式不同将患者分为对照组(n=45)与观察组(n=45)。本研究获伦理委员会审批通过,患者均签署知情同意书。两组患者一般资料比较,差异均无统计学意义。见表1。

表1 两组患者一般资料比较
1.2 治疗方法
对照组予以同期放化疗治疗。放疗采用体外照射+内照射。外照射总剂量48~60 Gy,照射22~25次,5次/周;内照射5次,每次10~15 Gy。化疗采用TP方案:顺铂+紫杉醇,前者第1~3天,50 mg/m2,后者135 mg/m2,治疗28 d。观察组联合尼妥珠单抗,放化疗前,尼妥珠单抗400 mg溶于250 mL 0.9%氯化钠溶液后,静脉滴注时间>1 h,1次/周,共6周。
1.3 观察指标
(1)临床疗效:治疗后两个月,进行疗效评价,使用实体瘤疗效标准[7],包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD),计算客观缓解率(ORR)和肿瘤控制率(DCR),其中ORR=(CR例数+PR例数)/总例数×100%,DCR=(CR+PR+SD)/每组总例数×100%。(2)生活质量:于治疗前和治疗后两个月,采用癌症患者生命质量测定量表体系之宫颈癌量表(QLICP-CEV2.0)[8]评定患者生存质量,分值越高表明生存质量越好。(3)肿瘤标志物:于治疗前和治疗后两个月,采集患者空腹静脉血5 mL,经3 500 r/min离心取生层血清待检。采用酶联免疫吸附法测定血清鳞状细胞癌抗原(squamous cell carcinoma antigen,SCC)、糖链抗原125(carbohydrate antigen 125,CA125)水平,肿瘤特异性生长因子(tumor specific growth factor,TSGF)经电化学发光法获得。(4)免疫功能:于治疗前和治疗后(放化疗后两个月),采集外周血标本,采用流式细胞仪(美国BD公司)进行T淋巴细胞亚群(CD4+T细胞、CD8+T细胞)的检测。(5)安全性:参照美国肿瘤放射治疗协作组织常见不良反应事件评价标准[9]进行不良反应评价与记录,分为I-Ⅳ级。
1.4 统计学分析
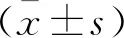
2 结果
2.1 两组患者临床疗效比较
观察组ORR高于对照组(86.67%vs.66.67%,P<0.05)。两组DCR比较,差异无统计学意义(P>0.05)。见表2。

表2 两组临床疗效比较 [n(%)]
2.2 两组生存质量评分比较
治疗后,两组QLICP-CEV2.0评分均增高(P<0.05),且观察组高于对照组(P<0.05)。见表3。

表3 两组QLICP-CEV2.0评分比较分)
2.3 两组肿瘤标志物比较
治疗后,两组SCC、CA125、TSGF均降低(P<0.05),且观察组低于对照组(P<0.05)。见表4。

表4 两组肿瘤标志物比较
2.4 两组免疫功能指标比较
治疗后,两组CD4+T细胞均降低(P<0.05),但观察组高于对照组(P<0.05);两组CD8+T细胞水平比较,差异无统计学意义(P>0.05)。见表5。

表5 两组免疫功能指标比较
2.5 两组不良反应比较
两组不良反应均属于I-II级,未见Ⅲ-Ⅳ级不良反应,差异无统计学意义(P>0.05)。见表6。

表6 两组不良反应比较[n(%)]
3 讨论
同步放化疗是LACC的标准治疗方法,但仍存在部分患者由于对放化疗敏感性差,加上化疗耐药的问题,可能会导致治疗效果差。血管内皮细胞生长因子可作为宫颈癌靶向治疗的理想靶标[10]。但目前关于宫颈癌的靶向治疗研究,多针对复发、转移性宫颈癌[11],LACC的靶向治疗仍缺乏足够的临床数据。
EGFR高表达与肿瘤进展和不良预后密切相关,在宫颈癌中的高表达率约85%[12],是宫颈癌治疗的理想靶标。尼妥珠单抗是全球第一个以EGFR为靶点的单抗药物,也是我国第一个批准上市的功能性单抗药物,其能与EGFR细胞外特定区域结合,导致EGFR构象发生变化,进而影响其与表皮细胞生长因子及转化生长因子α结合,阻断EGFR介导的信号向细胞内传导,发挥抗肿瘤效应。此外,尼妥珠单抗具有放化疗增敏作用,增强放化疗效果[13]。同时,尼妥珠单抗的亲和力适度,不良反应少[14]。在体外实验和很多实体瘤治疗中,尼妥珠单抗已表现出能够增强抗肿瘤免疫力,发挥着强大的抗肿瘤活性和理想的组织特异性,获得了良好治疗疗效,且耐受性良好[4-6]。
Cao等[15]研究显示,对LACC患者实施尼妥珠单抗+放化疗治疗,患者ORR显著提升(88.4%vs.67.4%);Chen等[16]发现,尼妥珠单抗联合放化疗治疗LACC能够明显提高ORR(87.0%vs.73.3%)。本研究显示,观察组ORR为86.67,高于对照组的66.67%,表明尼妥珠单抗联合放化疗治疗LACC能够提高近期疗效,与既往报道[15-16]一致。本研究中,治疗后,观察组QLICP-CEV2.0评分高于对照组,表明尼妥珠单抗的应用有助于改善患者生存质量。
SCC、CA125及TSGF是由肿瘤细胞合成、分泌,反映肿瘤存在及生长的物质,其与肿瘤生长、发展、复发及转移等密切相关[17-18]。SCC是鳞状细胞癌患者组织分泌的糖蛋白;CA125作为常见的肿瘤标志物,对宫颈癌的诊断、预后判断有重要价值;TSGF是能够反映肿瘤早期增殖、浸润和转移的肿瘤标志物,与宫颈癌的发生发展、预后紧密关联[19-20]。本研究结果显示,尼妥珠单抗联合放化疗能够明显降低血清SCC、CA125、TSGF水平,这从分子水平进一步验证了尼妥珠单抗的治疗价值。
肿瘤细胞的增殖可导致患者免疫力低下,而机体免疫差可使得患者感染风险增高,进而影响化疗效果,甚至导致部分患者不得不终止治疗[21]。T淋巴细胞亚群在细胞免疫过程中有着重要作用,其中CD4+T细胞为辅助性T细胞表面分子,能够通过辅助或调控其他类型淋巴细胞来产生免疫调节作用,发挥抗肿瘤作用;CD8+T细胞主要是细胞毒性T细胞表面分子,其在外周血的表达水平与肿瘤的预后相关。本研究中,治疗后,两组CD4+T细胞下调,但观察组比对照组高,这提示尼妥珠单抗能够改善LACC放化疗患者免疫功能,这可能与尼妥珠单抗增强抗肿瘤免疫力的作用有关[22]。机体抗肿瘤免疫主要依靠CD8+CTL介导的细胞免疫为主,本研究中,观察组治疗后CD8+T细胞水平低于对照组,可能是因为CD8+T细胞参加抗肿瘤消耗更多所致。本研究还表明,尼妥珠单抗安全性较高,未加重不良反应。
综上,尼妥珠单抗联合放化疗治疗LACC,不仅使临床疗效提高,还可改善血清肿瘤因子水平及免疫功能,且不增加不良反应。
