镁基储氢材料的性能及研究进展
2023-10-14史柯柯刘木子赵强李晋平刘光
史柯柯,刘木子,赵强,李晋平,刘光
(太原理工大学化学工程与技术学院,气体能源高效清洁利用山西省重点实验室,山西 太原 030024)
氢是所有已知元素中最轻的元素,具有热值高(142MJ/kg)、零碳排放、来源丰富等优点,因其特有的性质而被认为是传统化石燃料中最有潜力的替代能源之一[1]。氢是宇宙中含量最丰富的元素,并且可以通过许多方法制取氢气,如电化学和生物方法[2]。氢的燃烧产物为水,是世界上最干净的能源,对环境没有危害。因此可以称为最理想的清洁能源,是未来可再生能源的主要候选者。此外,氢的利用形式多,可以转换成不同形式的能量,例如可以通过燃烧产生热能,通过氢燃料电池将氢能转化为电能等[3]。氢经济系统包含氢的绿色制取、存储和利用三个方面。其中,氢气存储是实现氢能广泛应用的主要技术瓶颈,研发出安全高效的高性能储氢材料是实现大规模氢能应用所需解决的重要问题[4]。
氢气的储存方式主要有高压气态储氢、低温液态储氢和固体材料储氢[5]。高压气态储氢和低温液态储氢给车载应用带来了安全和成本问题,目前,基于金属氢化物的固态存储系统已经显示出相当安全且能够可逆地存储大量氢气的潜力,成为储氢材料越来越有吸引力的选择。许多储氢材料研究致力于满足美国能源部(US DOE)[6]设定的氢储存目标。美国能源部最严格的标准是达到6.5%的质量储氢密度和0.05kg H2/L 的体积容量[7]。除了需要高的质量和体积容量外,理想的体系还应在近环境温度下表现出快速的吸附动力学、高可逆性(运行周期寿命)、高稳定性和高成本效益[8]。在众多固态储氢材料中,氢化镁具有高的质量储氢密度(7.6%)和体积储氢密度(110kg/m3),储量丰富(地球中镁的含量约为2.5%)以及成本低廉,因此被认为是最有发展前景的一类固体储氢材料[9]。
镁基储氢材料的储氢原理是:氢原子以化学键的形式与储氢材料Mg形成稳定的氢化物MgH2来实现氢气存储。1960 年,Stampfer 等[10]研究了金属镁与氢气在不同温度下的吸氢反应的P-C-I曲线,得出Mg 的吸氢反应的焓变为-74.4kJ/mol H2,熵变为-135.4kJ/mol H2。Bohmhammel 等[11]又报道了MgH2的放氢反应的焓变为74.7kJ/mol H2,而熵变为130kJ/mol H2。在氢化镁放氢反应中,Mg—H 之间形成的离子键有很强的作用力,且MgH2热力学稳定性高,导致其吸放氢温度高。因此,想要有彻底的吸氢/脱氢反应,需要在300℃以上的条件进行,这很大程度上阻碍了镁基储氢材料的广泛应用[12]。通过研究动力学性能,发现具体的吸氢反应过程为:氢分子的表面解离,氢原子吸附、扩散,氢化物成核长大。放氢反应是吸氢反应的逆过程[13]。其中,H2在Mg 表面的解离能垒高为218kJ/mol H2[14],且氢在MgH2中的扩散速率较慢是影响Mg 吸氢反应动力学的关键因素。在这个过程中Mg 极易氧化,在表面形成氧化层阻碍H2分子解离,进而也影响H 原子扩散,导致吸放氢速率减慢[15]。综上,由于Mg/MgH2储氢体系过高的放氢温度、较差的动力学性能以及在相对较高的温度下Mg 颗粒容易发生团聚,影响体系吸放氢循环稳定性,限制了其在实际中的应用。MgH2作为储氢介质在实际应用中需要克服热力学和动力学方面的巨大障碍[16]。
因此,近年来针对镁基储氢材料性能的改善已经取得了许多研究成果。研究发现,Mg 与过渡金属等元素可以形成热力学性能较不稳定的合金相,改变反应路径,从而改善其吸放氢性能。Mg/MgH2储氢材料纳米化能降低形核能垒,促进动力学性能;同时,颗粒尺寸减小有利于Mg—H 键的不稳定及影响吸放氢反应的焓变,从而改善热力学性能。添加催化剂可在Mg/MgH2吸放氢过程中促进H吸附、解离并为H2分子的扩散提供活性位点,改善其吸放氢动力学性能。然而仅仅依靠上述任何一种方法来提高MgH2的储氢性能远远不够,综合运用添加催化剂和纳米化改性双重机制优化储氢性能,在改善热力学和动力学性能的同时保持高储氢能力是非常关键的。本文针对国内外镁基储氢材料的研究进展,对通过合金化、纳米化和添加催化剂来改善Mg/MgH2储氢体系的性能进行总结评述。最后,对该领域的研究成果和发展前景进行总结和展望。
1 合金化
合金化能有效改善镁基储氢材料的热力学性能,但是与过渡金属合金化后材料的储氢量会有明显降低。通过将Mg 与过渡金属复合能够制备出含有单相或多相的镁基储氢合金,合金的存在可以促进氢的解离和吸附,添加的金属元素与Mg 和H 结合生成次稳定的氢化物而降低MgH2的稳定性,多相边界也可以为吸/放氢反应提供大量的活性位点,从而改善Mg/MgH2储氢体系的储氢性能。
最具代表性的是Mg-Ni 系储氢合金,Reilly等[17]首先通过熔炼法制备出Mg2Ni合金,Mg2Ni合金能在2MPa氢压、470~500K的温度范围内与氢直接反应生成稳定性较低的Mg2NiH4,该氢化反应的焓变约65kJ/mol H2,明显低于MgH2的反应焓变75kJ/mol H2[18],可见其热力学性能好。另外,通过对Mg2Ni 储氢性能和机理的具体研究发现:①Mg2Ni合金的压力-组成-温度(PCI)曲线较为平缓,滞后较小,如图1 所示;②Ni 的存在也对MgH2的吸放氢产生了催化作用[19]。之后,Morinaga 等[20]研究发现,在Mg2NiH4中,氢原子和镍原子之间的反应明显强于氢原子和镁原子,形成的Ni—H间的相互作用力弱于Mg—H键,因此Mg2NiH4的生成焓会低于MgH2。放氢动力学也明显改善,其放氢温度为200~300℃,储氢量为3.6%(质量分数)。
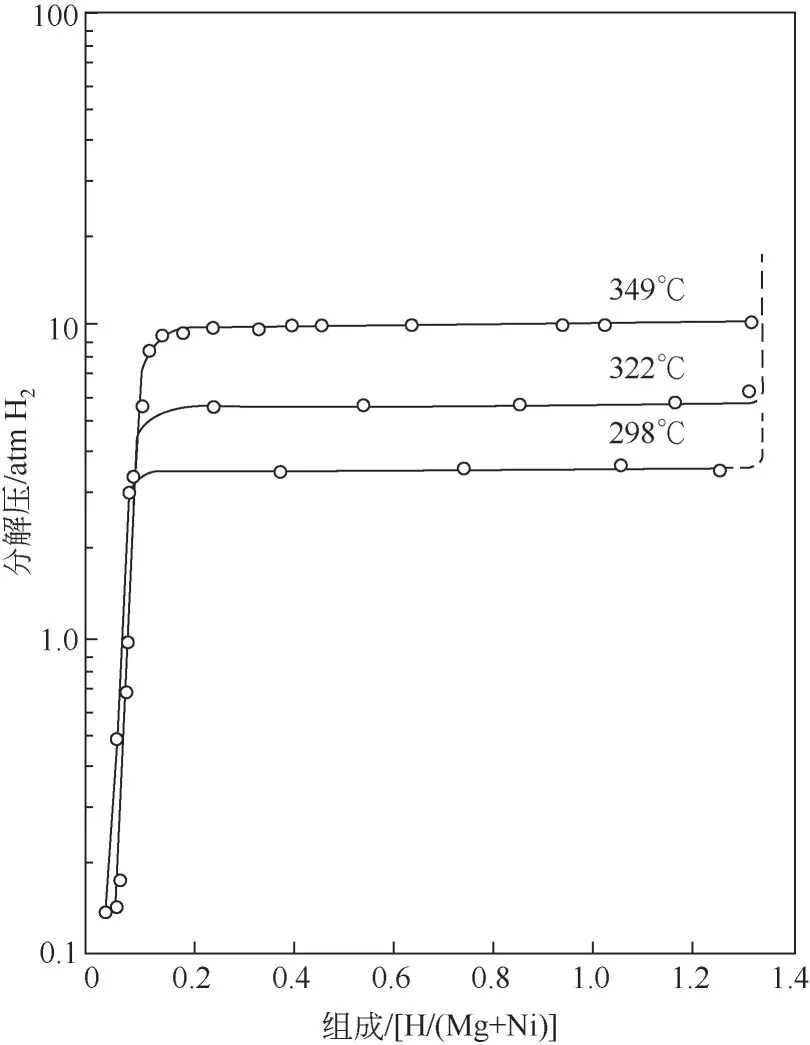
图1 Mg2Ni-H体系的PCI曲线[19](1atm=101.325kPa)
Mg2FeH6因其较高的质量储氢密度(5.5%)和体积储氢密度(150kg/m3)成为另一种常见的镁基储氢合金,Fe 价格低廉,但是Mg2FeH6的生成焓为-77.4kJ/mol,略高于MgH2[21],其热力学稳定性较高,也很难实现可逆吸放氢循环。Gennari 等[22]在室温氢气气氛下,采用反应机械合金化单一工艺合成了Mg2FeH6氢化物。Fe 的存在对MgH2的吸放氢产生催化作用,使分解温度降低约100℃,且活化能降低至(110±10)kJ/mol H2。
与Mg-Fe体系相似,在氢气气氛下机械混合单质Mg和Co就能形成Mg2CoH5(储氢量4.5%)。Chen等[23]将2MgH2+Co的化学计量混合物在氢气气氛下球磨,合成了纳米晶金属氢化物Mg2CoH5。氢化物生成和分解焓分别为-69.5kJ/mol H2和83.2kJ/mol H2。研究得到的最大含氢量(4.4%)与配方单元Mg2CoH5(4.5%)几乎相同,在280℃下连续20次循环后,氢化能力损失仅为2%。Mg2NiH4、Mg2CoH5、Mg2FeH6等遵循18电子规则的三元金属化合物具有较高的储氢量,分别对应3.6%(质量分数,下同)、4.5%、5.4%,它们也因具有有趣的结构和储氢特性而备受关 注。 此 外, Mg2Si[24]、 Mg2Cu[25]、 Mg17Al12[26]、Mg3Cd[27]等也是镁基储氢合金的研究热点。在表1中对它们的焓变和氢含量进行了比较。
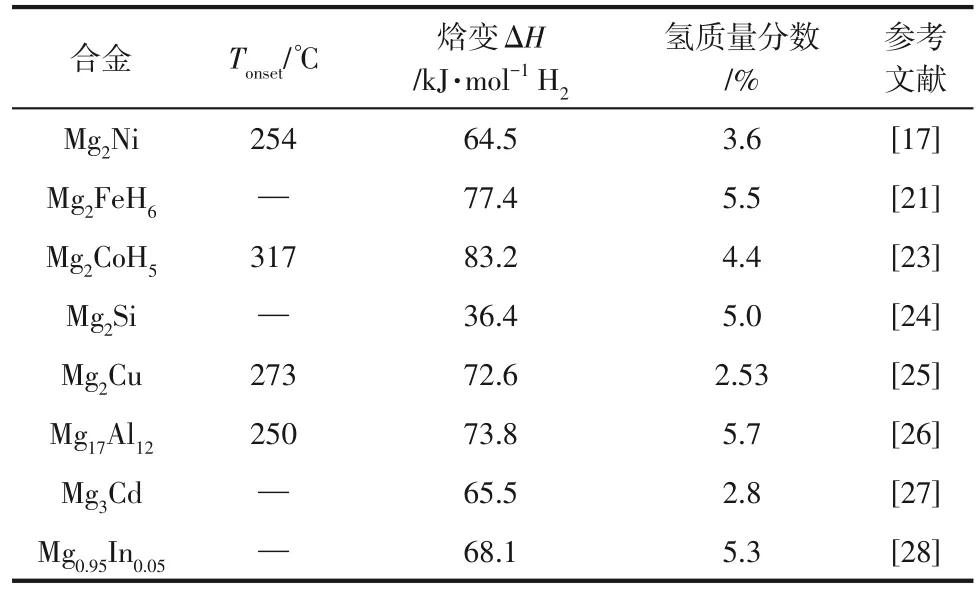
表1 镁基储氢材料合金化部分储氢性能总结
另一种失稳策略是形成镁基固溶体,Mg(In)固溶体的可逆生成在适度的容量损失下对镁的结构和组成进行轻微调整,能够改善热力学性质。Zhong等[28]采用机械合金化法制备Mg(In)固溶体,可以通过氢化产物(MgH2、MgIn和Mg2In)脱氢可逆生成。Mg0.95In0.05固溶体的吸氢焓为(68.1±0.2)kJ/mol H2。研究结果为储氢镁合金的开发提供了一条新的途径。综上所述,镁基储氢体系合金化改性能够明显改善吸放氢的动力学性能,也是一种可行的热力学改性方法,能够一定程度上降低其焓变。但是在合金化过程中由于引入重金属,氢容量急剧下降。在加氢过程中由于Mg 与其他元素之间的键断裂,其可逆性较差,体系的循环稳定性也会下降。
2 纳米化
自20 世纪末开始,纳米化作为镁基储氢材料的改性策略受到了广泛的关注,且可以明显改善Mg/MgH2储氢体系的动力学和热力学性能。在吸放氢的过程中,纳米化的Mg 颗粒比表面积增大,明显地增加了活性位点,可加快氢分子的解离速度,同时颗粒尺寸减小到纳米尺寸,氢原子的扩散路径缩短,更有利于吸附和扩散。更重要的是,粒子的尺寸足够小,大部分原子暴露在表面,这有利于Mg—H键的不稳定。事实上,理论研究表明当Mg/MgH2粒子下降到2nm 时,通过Mg/MgH2颗粒的尺寸效应,Mg/MgH2体系的热力学性能能够被显著地改善[29-30]。由图2可以看出MgH2的总能量随粒子尺寸的变化以及Mg 纳米颗粒与H2分子结合的变化,与相应的分解相(即含剩余H2气体的Mg 纳米颗粒)相比,MgH2的纳米颗粒在1nm 以下的是能量不稳定的[31]。纳米颗粒总能量的正变化表明,与块体材料相比,纳米相的热力学性质将发生改变。已报道的制备纳米镁基材料的纳米技术包括高能球磨法、化学还原法、气相沉积法和氢化法等。镁基储氢材料纳米化部分储氢性能总结见表2。
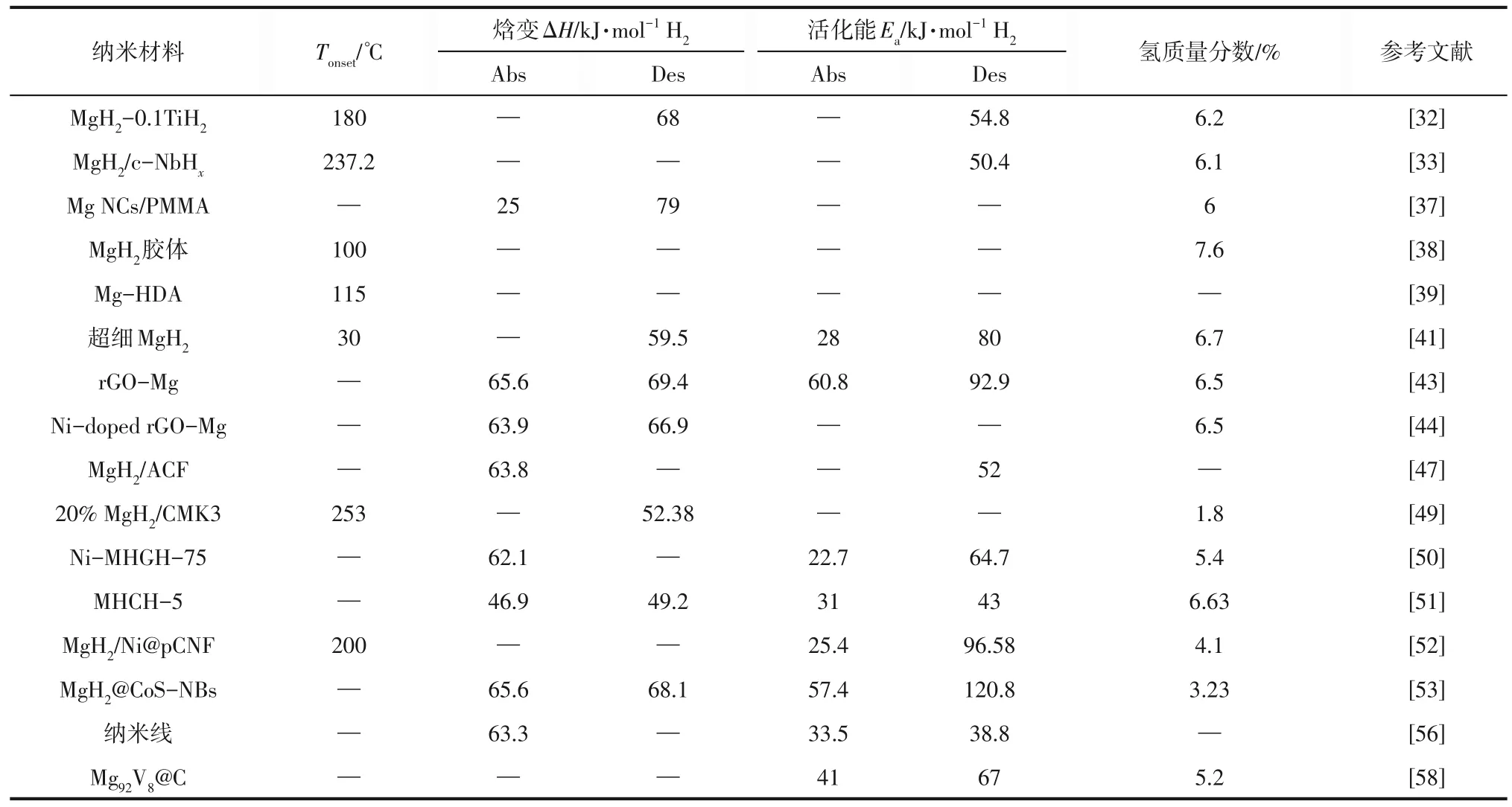
表2 镁基储氢材料纳米化部分储氢性能总结
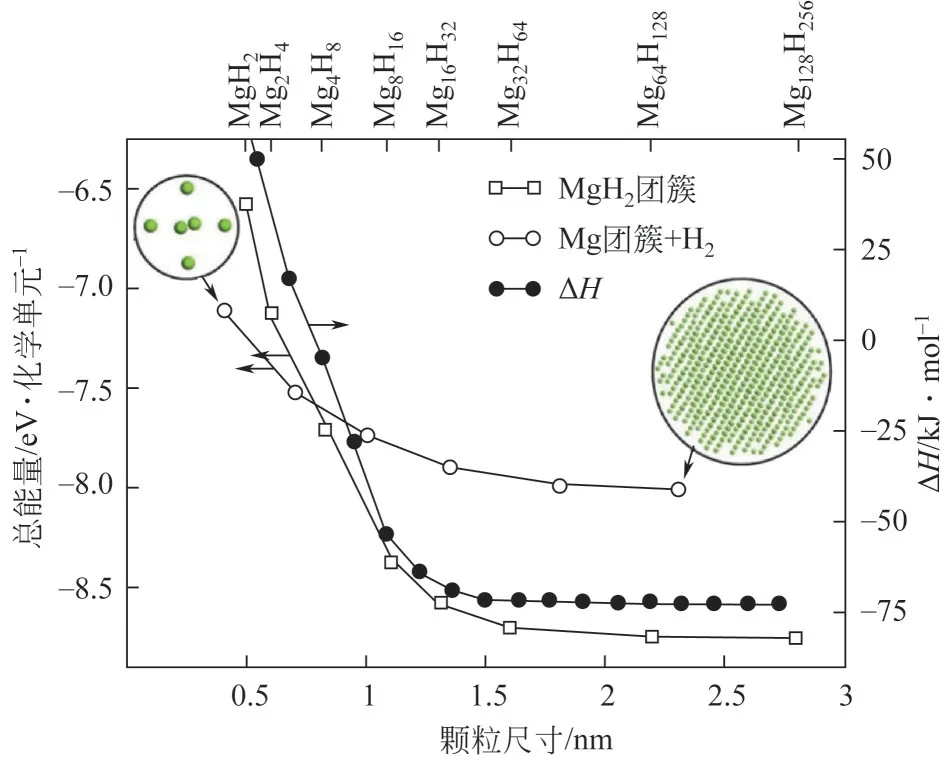
图2 MgH2纳米团簇的总能量与颗粒尺寸的关系[31]
2.1 高能球磨
高能球磨是制备镁纳米颗粒最广泛的方法之一,通常用于改善储氢性能。Lu等[32]通过超高能高压球磨制备了纳米MgH2-0.1TiH2。MgH2-0.1TiH2粉末晶体的纳米尺寸为5~10nm,TiH2均匀分布在MgH2颗粒之间。循环储氢容量为6%,在290℃时,氢化和脱氢动力学快速,且有高的循环稳定性,超过80 次循环后没有容量损失。MgH2-0.1TiH2脱氢的ΔH值低于MgH2,为68kJ/mol H2。Zhang等[33]通过湿化学法制备了三种NbHx纳米颗粒,并通过球磨法将其引入MgH2中催化提高其储氢性能。结果表明,NbHx纳米颗粒能显著提高MgH2的氢化-脱氢动力学,NbHx的结构越无序、粒径越小,对MgH2的催化储氢性能越好,MgH2/c-NbHx的表观活化能为(50.4±0.6)kJ/mol H2。带状的NbHx在球磨过程中分离MgH2,且多价Nb能够促进Mg—H键的断裂,提高了其储氢性能。然而,高能球磨法制备的时间较长且不能精准控制材料粒度分布到所需的狭窄范围内,也易引入杂质,引起材料的团聚和长大[34]。
2.2 化学还原法
化学还原法是一种自下而上合成镁纳米颗粒的方法,在电子载体存在的情况下,用碱金属(Li、Na、K、Ca等)作为还原剂在有机溶液(四氢呋喃或二氧喹啉)中还原镁盐,得到镁纳米颗粒[34-36]。2011年,Jeon等[37]报道了在含有锂、萘和聚甲基丙烯酸甲酯(PMMA)的四氢呋喃溶液中还原二茂镁(MgCp2)的方法,获得了能隔绝水氧的聚合物基纳米Mg 复合材料(Mg NCs/PMMA),Mg NCs 粒径约为5nm。在200℃时30min 内可以实现Mg 的快速吸氢,且该复合材料的吸氢量为4%。PMMA 也可以有效防止Mg/MgH2的团聚和长大,循环稳定性好,但热力学性质尚未确定。Aguey-zinsou 等[38]采用液相还原金属盐的方法以溴化四丁胺(TBA)为模板在四氢呋喃中电化学还原制备了粒径为5nm的Mg 纳米胶体,在室温附近可逆地储存约7.6%的H2,85℃时,胶体MgH2可以完全脱附氢。随后,Kalidindi 等[39]采用室温消化成熟法,利用十六烷基胺(HDA)为模板剂制备了2~3nm 的单分散胶体镁。制备的Mg-HDA 在115℃开始解吸,但是由于镁纳米颗粒在高温下烧结(特别是Mg/HDA较低的情况下)使得大部分解吸温度范围在350℃以上。Norberg 等[40]采用化学还原法制备了不同尺寸的纳米Mg 颗粒(25nm、32nm、38nm),研究表明不同尺寸的纳米Mg 颗粒表现出不同的吸放氢性能,25nm的Mg颗粒表现出最优异的储氢性能,但是其热力学性质并没有改变。
Zhang 等[41]利用金属氢化物和氯化物在四氢呋喃(THF)中溶解度的巨大差异,提出了一种超声驱动的液固相复分解新工艺。在无负载的情况下,成功地获得了主要大小在4~5nm 的超细MgH2纳米颗粒。在30℃时,可逆性储氢容量为6.7%,脱氢焓变为59.5kJ/mol H2,焓值下降了约22%。吸氢活化能和解吸活化能约为28kJ/mol 和80kJ/mol,分别降低了69%和50%。在150℃条件下,裸纳米颗粒在50 次循环中表现出稳定和快速的氢循环行为。减少颗粒尺寸可以同时改善动力学和热力学性能。当材料为纳米尺寸时,活性表面积增加,有利于H2分子解离;但同时材料更可能发生表面氧化或其他副反应。用还原氧化石墨烯包覆Mg 纳米复合材料[42],在Mg 纳米颗粒与石墨烯包覆层的界面处存在一层原子薄的氧化层。Mg 的最外层原子层被轻微氧化,形成单层的蜂窝状MgO,有利于氢化动力学。这种蜂窝状MgO 单层增强了石墨烯和Mg纳米颗粒之间的结合,有助于提高纳米复合材料的机械稳定性。更重要的是,计算揭示了MgO 单层不会阻碍H2的解离。事实上,裂解氢分子的激活势垒与原始Mg 金属[0001]表面的激活势垒非常相似。这改变了人们对传统钝化层的理解并提供了一种极有前景的研究方法。
Cho 等[43]用化学还原法制备了包裹在原子薄且气体选择性还原氧化石墨烯片中的镁纳米晶体材料。具有非常高的储氢容量(6.5%),与球磨法制备的金属氢化物相比,Mg 纳米晶为细的单分散纳米晶,且Mg 纳米晶的直径为3.26nm(±0.87nm),吸氢和解吸的活化能为60.8kJ/mol H2和92.9kJ/mol H2。还原氧化石墨烯层表现出理想的选择性,使MgH2不受氧气和水分的影响,并提高了其动力学性能。之后一年Cho等[44]在原来的基础上制备了由原子薄的分子筛分还原氧化石墨烯层包裹的掺杂镍的Mg 纳米晶体材料。采用外部(rGO 应变)和内部(Ni 掺杂)机制,有效促进Mg 纳米晶的氢化和脱氢过程,实现了高储氢能力和优异的动力学,同时保持坚固性。纳米结构的rGO-Mg复合材料的吸氢和放氢焓变分别为-63.9kJ/mol H2和66.9kJ/mol H2(图3)。该复合材料也显示出优异的循环稳定性,在模拟真实工况下连续30次循环后,氢吸收/解吸动力学没有变化,并且容量仅降低了0.1%。最近,Cho 等[45]研究了杂原子掺杂石墨烯作为镁基储氢主动相互作用的二维封装介质。研究发现,石墨烯衍生物上掺杂元素也是改善储氢动力学的另一个可控关键因素,杂原子掺杂石墨烯的复合材料在整个吸氢过程中表现出较低的活化能。
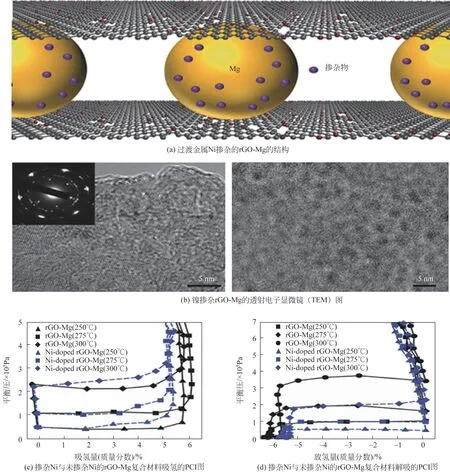
图3 过渡金属Ni掺杂rGO-Mg催化剂的微观结构及吸放氢性能图[44]
2.3 氢化法
氢化法是在高压氢气(>3.5MPa) 和高温(>150℃)条件下直接将镁盐氢化合成MgH2的方法,且氢化法通常是将储氢材料限制于多孔材料的纳米孔道内,即纳米限域。纳米限域可以从两个方面来描述:一是将颗粒的尺寸降低到几十纳米以下,可以明显改善动力学和热力学性能;二是将这些非常小的颗粒嵌入多孔支架来进行空间稳定和处理,既能获得纳米尺寸的纳米颗粒,还能有效抑制纳米颗粒在循环过程中的长大与团聚。目前,纳米限域所使用的载体主要为碳基材料,如碳气凝胶、CMK-3、石墨烯、MOFs 材料等。在各种类型的多孔材料中,高孔隙率、高比表面积和良好的骨架稳定性的碳材料被认为是纳米限域的优良支架。通过湿浸渍和熔体渗透等最基本的技术,将较小尺寸的镁纳米颗粒加入到碳基支架中。Nielsen等[46]用过量的二丁基镁(MgBu2)在庚烷溶液中浸润间苯二酚甲醛碳气凝胶,研究发现,纳米限域MgH2的脱氢动力学受到支架材料孔径分布的显著影响,发现孔隙越小,脱氢速度越快,这可能是由于限域氢化物的尺寸减小所致。Zhao-karger 等[47]第一次将小于3nm 的MgH2颗粒限制在碳支架中,并通过定量动力学和热力学数据进行研究。发现可以通过Bu2Mg直接加氢的方法在碳支架的孔隙内形成MgH2纳米颗粒,与块体材料相比,脱氢的活化能降低了52kJ/mol H2。同样,纳米限域体系的反应焓降低为(63.8±0.5)kJ/mol H2,熵降低为(117.2±0.8)kJ/mol H2。可见,纳米Mg 颗粒是降低活化能和热力学稳定性的关键因素。
另一方面,Jia 等[48]采用HAADF-STEM(高角环形暗场-扫描透射电子显微镜)分析了纳米多孔碳中MgH2颗粒的纳米限域。从报道的结果来看,纳米多孔碳的孔径为4nm,表面的Mg 颗粒粒径为5~6nm,在纳米孔网络之外。此外,超细的1~2nm大小的MgH2颗粒被限制在纳米孔碳支架内。MgH2纳米多孔支架的吸氢ΔH值为55.4kJ/mol H2[48]。对受限MgH2的研究表明,由于碳支架与MgH2的超细颗粒表面及界面相互作用,MgH2体系的解吸温度降低,解吸动力学改善,热力学焓变值降低。
Konarova等[49]以CMK-3为介孔材料,采用湿法浸渍法制备MgH2颗粒。MgH2/CMK-3 化合物的程序升温脱附(TPD)结果表明,MgH2负载量对其起始脱氢温度和最大脱氢温度有显著影响。20%负载的MgH2/CMK-3 化合物在253℃下释放出氢气。相应的分解焓为(52.38±2.16)kJ/mol H2。此外,该样品的透射电子显微镜(TEM)图显示,粒径为4nm的MgH2纳米晶在CMK-3 模板孔内分散良好。Xia等[50]通过氢化法对MgH2/GNs 体系进行了改性,在石墨烯表面负载金属Ni 纳米颗粒,利用纳米限域与催化协同改性MgH2吸放氢性能。将MgH2的负载量提高至75%,在Ni的催化作用下,Ni-MgH2/GNs的吸放氢动力学明显提高,在250℃下30min 内可放氢5.4%,并能在低温50℃下60min 内吸氢2.3%。计算得到该体系的吸放氢活化能分别为22.7kJ/mol H2和64.7kJ/mol H2,远低于块状MgH2(99.0kJ/mol H2和158.5kJ/mol H2)。其热力学性能也明显改善,金属Ni 的引入使MgH2/GNs 的反应热从64.8kJ/mol H2降低至62.1kJ/mol H2。
Shinde 等[51]使用活性炭代替石墨烯合成了镍修饰的三维活性炭和限制性MgH2(MHCH-5)。单分散的MgH2纳米颗粒粒径约为5.5nm,Ni 元素均匀地固定在3D碳基结构上。该复合材料中MgH2纳米颗粒的负载率可达60%。由于Ni 的尺寸效应和催化效应,复合材料表现出了显著的储氢性能,在180℃下小于5min的快速动力学负载,具有优异可逆性和长期循环稳定性,脱氢和氢化反应焓变分别为49.1kJ/mol H2和46.9kJ/mol H2。
Ren等[52]通过纳米限域制备的MgH2/Ni@pCNF复合材料有较低的起始脱氢温度(200℃),快速的吸收/解吸动力学(Eab=25.4kJ/mol H2,Ede=96.58kJ/mol H2),较高的储氢容量(4.1%)和良好的循环稳定性(图4)。其纳米限制效应、N原子的供电子能力及生成的Mg2Ni/Mg2NiH4作为MgH2的“氢泵”的协同作用提高了材料的性能。Ma 等[53]通过氢化法浸渍在CoS-nano boxes(NB)框架中的MgBu2,成功地制备了负载3nm MgH2颗粒的MgH2@CoS-NBs 复合材料,其热力学性能明显增强,放氢焓降低为68.1kJ/mol H2,原位生成MgS 的催化效应能够增强氢吸收的动力学性能,吸氢和解吸动力学能垒降低为(57.4kJ/mol H2和120.8kJ/mol H2)。与纯MgH2相比,纳米限域Mg/MgH2晶体的“纳米尺寸效应”、MgS的催化效应以及CoS-NBs支架的多功能作用可能是MgH2@CoS-NBs复合材料具有优异吸氢性能的协同因素。氢化法以具有纳米孔的材料为框架,将Mg/MgH2控制在纳米尺度内,实现了有效限域,使粒子减小到纳米级,明显改善了其热力学和动力学性能,但通常框架会占整个体系的50%以上,严重的理论容量损失是不可避免的。
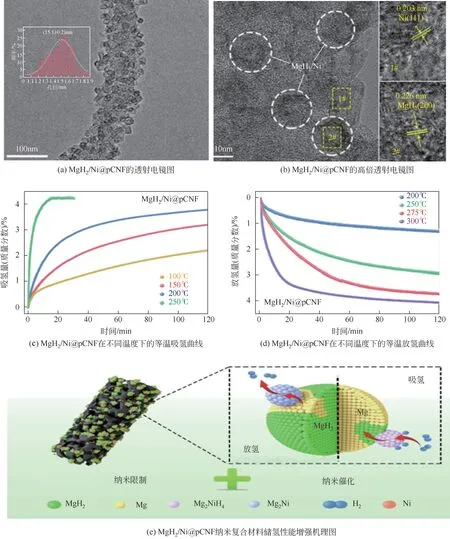
图4 MgH2/Ni@pCNF纳米复合材料微观结构、吸放氢性能及机理图[52]
2.4 气相沉积法
气相沉积法是基于电弧产生高温使金属瞬间蒸发,在氢气等气体作用下使金属原子经历蒸发、形核、长大、凝聚等一系列过程,以获得纳米尺寸Mg[54]。 Matsumoto 等[55]采 用 化 学 气 相 沉 积(CVD)技术研究了温度和压力对产物形状的影响。CVD 是以Mg 蒸气和H2为原料合成MgH2的过程,发现CVD 产物的形状依赖于产物合成的温度和压力。
Li 等[56]通过气相沉积法获得了不同直径的纳米线,发现直径30~50nm 的纳米线吸氢反应焓降低 到-63.3kJ/mol H2, 吸/放 氢 活 化 能 分 别 为33.5kJ/mol H2和38.8kJ/mol H2,且活化能随着纳米线直径的减少而降低。结果表明,当纳米线的直径小于30nm 时,其动力学和热力学发生了变化。Wu 等[57]采用第一性原理计算方法,系统地研究了不同直径的Mg 和MgH2纳米线的储氢性能和电子结构。随着MgH2纳米线尺寸的减小,MgH2纳米线的脱氢能和脱氢温度逐渐降低。较低的氢气解吸能和温度表明,MgH2纳米线是一种良好的储氢材料。Chen 等[58]采用气相沉积法制备了V 修饰的Mg 纳米粒子并将其限制在1nm 的碳壳中。Mg92V8@C 纳米复合材料的平均粒径为32nm,储氢容量为6.6%。由于超薄的碳壳结构,Mg-V@C纳米复合材料的负载量达到94%以上。在200℃/300℃的条件下,可实现可逆加氢/脱氢循环,储氢容量超过5.2%,加氢和脱氢的表观活化能分别降低到41kJ/mol H2和67kJ/mol H2。
3 添加催化剂
添加催化剂改性来改善Mg/MgH2体系的储氢性能是研究最多,也是最简单、最高效地实现实用性改性的方法。添加催化剂能为Mg/MgH2吸放氢过程中的H吸附、解离和H2分子的扩散提供活性位点,改善其动力学性能。目前常用于改善Mg/MgH2体系性能的催化剂主要是过渡金属单质、金属氧化物、其他过渡金属化合物和碳基材料等。镁基储氢材料添加催化剂部分储氢性能总结见表3。
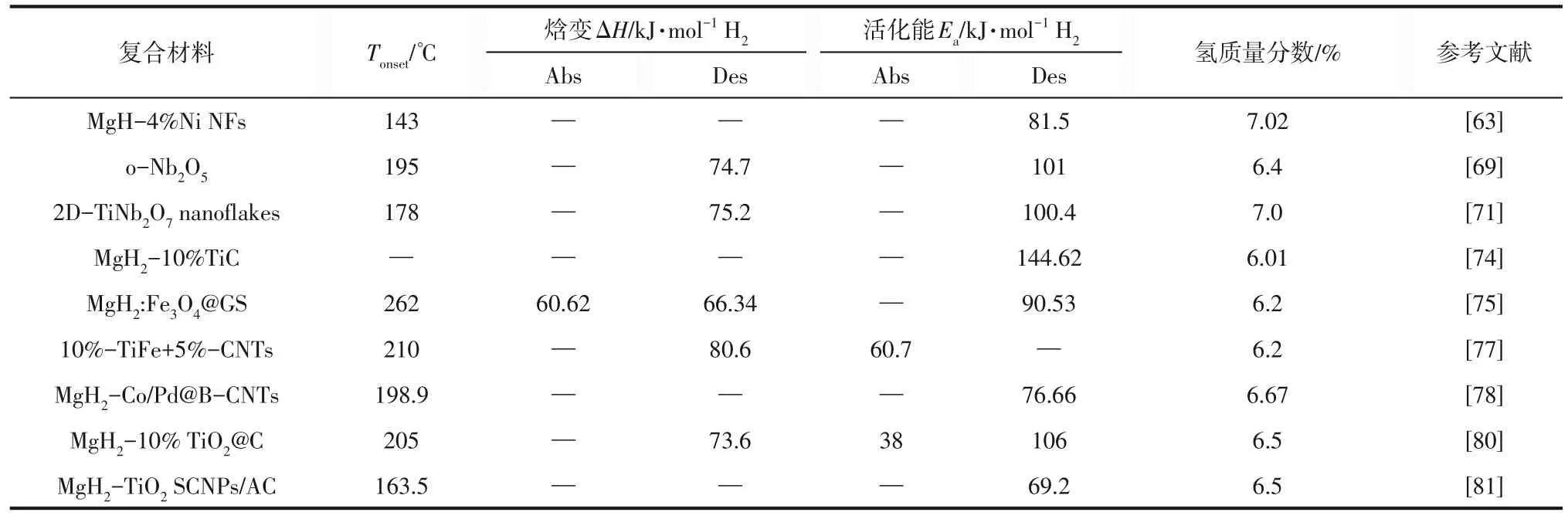
表3 镁基储氢材料添加催化剂部分储氢性能总结
3.1 过渡金属催化剂
已有研究表明,过渡金属对氢原子有很强的亲和力,d空电子轨道未完全填充,容易与H原子的反键相互作用,从而减弱了MgH2中Mg—H 的结合力[59]。一些过渡金属原子掺杂到MgH2晶格中,取代了Mg 离子形成新的相,从而提高了脱氢动力学或降低了脱附温度[60]。早在1999 年,Liang 等[61]比较了不同过渡金属(Ti、V、Mn、Fe、Ni)的催化效果,发现Ti 在加速H2解吸动力学方面表现出最高的催化活性。Cui 等[62]证实了这一点,他们使用湿化学法合成了一系列核壳结构的Mg-TM(TM=Ti、Nb、V、Co、Mo、Ni 等)纳米复合物。催化脱氢性能为Mg-Ti>Mg-Nb>Mg-Ni>Mg-V>Mg-Co>Mg-Mo,这可能是因为从Ti 到Mo 的电负性几乎都是递增的,且研究发现,过渡金属的电负性越小,脱氢性能越好。Ni 除外,尽管Ni 有高的电负性,但是催化脱氢性能好。这可能与Mg2Ni化合物的形成有关,促进了Mg-Ni体系的氢化/脱氢作用。
Chen等[63]采用静电纺丝技术制备多孔镍纳米纤维。合成的Ni NFs 对MgH2的脱氢性能有增强的催化作用,在325℃下11min 内可快速释放7.02%的氢。特别是4%(质量分数)Ni NF 催化的MgH2(MgH2-4%Ni NFs)在143℃时就开始释放氢,活化能显著降低至81.5kJ/mol H2。该方法的新颖之处在于以Ni 纳米晶组成的NFs 为前体,可实现Ni NPs在氢化物表面的均匀分散,为显著提高MgH2的储氢性能提供了有效的催化位点。
3.2 过渡金属氧化物
与过渡金属单质相比,过渡金属氧化物具有更高的脆性,价格低廉,通过球磨技术可以更容易地在MgH2基体中均匀分散[64]。1991 年,Terzieva 等[65]报道了Fe2O3和MnO2能够提升MgH2吸放氢动力学性能。研究发现,金属氧化物部分还原为金属颗粒,这些金属可加快氢分子的分解,从而促进了体系的动力学性能。随后,2001 年Oelerich 等[66]研究了各种过渡金属氧化物(Sc2O3、TiO2、V2O5、Cr2O3、Mn2O3、Fe3O4、CuO、Al2O3和SiO2)对Mg基储氢材料性能的影响。在这些氧化物中,CuO添加的MgH2复合材料可吸氢5.5%(质量分数);而在300℃真空条件下放氢,10min之内均可完成放氢过程。V2O5和Fe3O4添加的氢化镁在5min 之内就可完成放氢。高价态Nb2O5和ZrO2对MgH2体系的吸放氢性能有显著提升。Friedrichs等[67]将2%(摩尔分数)Nb2O5掺入MgH2中并对其进行研究。X 射线衍射(XRD)图显示,Nb2O5还原为金属Nb,可能形成MgNb2O3.67相,与纯MgH2样品相比,MgO 的生成增加。添加剂形成的反应物层对MgH2相的生长有抑制作用,从而提高了储氢性能。Pukazhselvan 等[68]研究了ZrO2添加剂与MgH2相互作用改善其储氢性能的机理。当在强粉碎条件下制备粉末时,可以清楚地发现ZrO2和MgH2相互作用形成ZrHx和MgO,该粉末的催化活性比纯净的ZrO2更强。MgH2和ZrO2发生化学反应后,产物粉末中的颗粒尺寸非常小(约20nm),而且高度分散。此外,Zr的化学状态是Zr4+、Zr2+和ZrO的混合状态,这似乎比Zr单独存在于Zr4+状态更有利。本研究进一步证实了功能性金属氧化物添加剂与MgH2发生化学作用,可在MgH2体系中生成活性的原位催化剂。
最近,Zhang 等[69]利用水热和煅烧法制备了壁厚约50nm、表面呈苔藓状的Nb2O5空心球(o-Nb2O5),该空心球在MgH2的储氢反应中表现出很高的催化活性。当o-Nb2O5的质量分数为7%时,MgH2的脱氢起始温度降至195℃。在300℃条件下,5min 内可以解吸5.5%(质量分数,下同)以上的H2。氢的再吸收在25℃时开始,在200℃时5min内达到5.6%。10次循环的氢吸收/释放后,实际氢容量稳定在5.8%。在初始脱氢过程中,o-Nb2O5被MgH2原位还原为低价Nb,发挥了活性催化剂的作用,使脱氢动力学增强。
另外,两种过渡金属共掺杂的MgH2体系相对于简单掺杂的Mg—H 键能更低,这是由于Mg—H杂化峰的减小以及掺杂剂与Mg 和H 原子的杂化效应导致[70]。Xian 等[71]通过球磨法制备了二维双金属Ti-Nb 氧化物纳米片TiNb2O7(图5),该氧化物具有高比表面积。与质量分数低至3%的TiNb2O7纳米片结合,MgH2的起始脱氢温度为178℃,与原始的相比降低了100℃。并显示出优越的循环稳定性,在脱氢至300℃和氢化至250℃的循环状态、5MPa的压力下进行30次循环,30min后容量保持率达到96%。2D-TiNb2O7纳米片被粉碎成超细薄片,并充分分散在MgH2基质中,作为氢的主要催化剂。这种高比表面积的二维双金属Ti-Nb 氧化物改善了MgH2体系的性能。
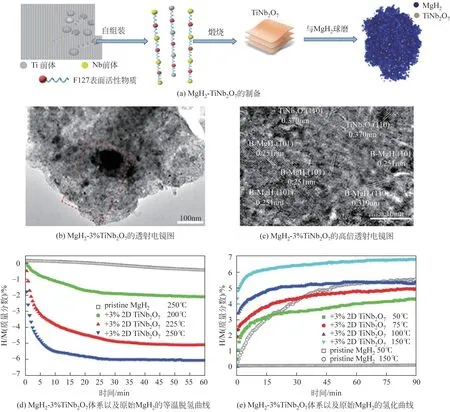
图5 MgH2-3%(质量分数)TiNb2O7的制备、微观结构及吸放氢性能图[71]
3.3 其他过渡金属化合物
其他过渡金属化合物(氯化物、氟化物和碳化物等)对镁基储氢材料的储氢性能也有很好的催化作用。Jin 等[72]研究了各种过渡金属氟化物对MgH2脱氢和加氢反应的影响。其中,NbF5和TiF3对MgH2加氢动力学的促进作用最为显著。MgH2与这些过渡金属氟化物在加氢过程中形成的氢化物相是提高MgH2加氢动力学的关键因素。Malka等[73]研究了不同金属卤化物添加剂(ZrF4、TaF5、NbF5和TiCl3)掺杂MgH2对材料吸放氢性能的影响。通过计算发现,所研究的金属卤化物只起到催化剂的作用,提高了MgH2的动力学性能,而不改变体系的热力学性质(焓变和熵变)。Fan等[74]利用球磨方式在MgH2中掺杂TiC,在300℃时,复合材料脱氢6.3%(质量分数,下同),而MgH2在相同条件下仅脱氢4.9%。脱氢活化能从191.27kJ/mol H2降低到144.62kJ/mol H2,MgH2-10%TiC 复合材料在300℃、3000s、1MPa H2条件下吸氢6.01%。且具有良好的循环稳定性,经10 次脱氢循环后,其氢容量仅比第一次运行时下降3.3%。通过研究分析,Ti 原子和氢分子结合形成TiH2相,与TiC 自催化协同作用,为氢原子提供了快速扩散的通道,进而提高了MgH2的动力学性能。
3.4 金属和碳基材料
过渡金属单质、过渡金属氧化物以及其他化合物的分子量较大,添加量大会降低储氢材料的储氢量。碳基材料是一种良好的催化剂载体,且有较小的质量密度和较低的价格,有利于储氢材料质量储氢密度的提升。更重要的是碳材料可以有效抑制MgH2颗粒的团聚和长大。常用的碳基材料有石墨烯、石墨、碳纳米管、活性炭和金属有机框架衍生多碳等。
Bhatnagar等[75]研究了合成的石墨烯薄片模板化Fe3O4纳 米 颗 粒(Fe3O4@GS) 的 催 化 效 果。Fe3O4@GS 催化MgH2的起始解吸温度为262℃。MgH2:Fe3O4@GS的动力学势垒和热力学势垒分别为90.53kJ/mol 和60.62kJ/mol H2(生成焓),比原始MgH2低很多。GS作为模板保证了Fe NPs(Fe3O4还原形成)的均匀分布,避免了它们的团聚,增加了有效催化的表面积以及催化剂的耐久性和稳定性。由Mg 与Fe3O4反应形成的Mg1-xFexO 刺穿MgO 层,促进氢扩散。不同价态的Fe 可以作为中间载体,在脱氢/再氢化反应中,增强Mg2+与H-的电子转移。此外,GS 还可作为MgH2/Mg 的晶粒抑制剂。催化活性的提高归因于Fe NPs 与GS 的协同作用。Lotoskyy等[76]研究发现石墨添加剂(5%,质量分数)可提高复合材料的长期循环稳定性,使其达到高度稳定的可逆氢存储容量(约6% H2)。Lu等[77]制备了TiFe,并通过球磨作为较好的催化剂掺杂到MgH2中,改善了MgH2在低温下的脱氢/再氢化性能。此外,额外掺杂的碳纳米管(CNTs)均匀分布在MgH2颗粒的表面,使MgH2+10%-TiFe+5%-CNTs 复合材料具有优异的循环性能。与制备的MgH2相比,添加15%%-TiFe 后,MgH2的起始解吸温度可降低到175℃。加入TiFe和CNTs后,MgH2的氢化活化能由(72.5±2.7)kJ/mol H2降至(60.7±8.0)kJ/mol H2。Liu等[78]使用竹节状碳纳米管负载双金属催化剂(Co/Pd)来改善MgH2的储氢性能。MgH2-Co/Pd@B-CNTs 复合材料在250℃下10s内迅速吸收了6.68%的H2,并在10周循环后,脱氢动力学和储氢量均保持稳定,循环稳定性好。
最近,含过渡金属的金属有机框架(MOFs)被用来合成碳包覆的过渡金属催化剂也被提出,MOFs 是一种多孔、结晶性的材料,可以通过一步焙烧过程轻松地转化为所需的产物。Jia 等[79]通过机械化学力驱动一步制备Ni NPs(2~3nm),Ni-MOF-74 作为Ni 前体的分子结构[图6(a)、(b)]显示了镍位与多孔骨架结构的独特优势,由于其较大的表面积,有助于机械力化学球磨过程中Ni NPs 的原位还原。理论计算和实验研究表明,由于尺寸效应,超细Ni NPs 在Mg 中催化加氢/脱氢的效率更高。这些发现可能有助于利用不同的MOFs作为催化剂前体制备其他催化的储氢材料。
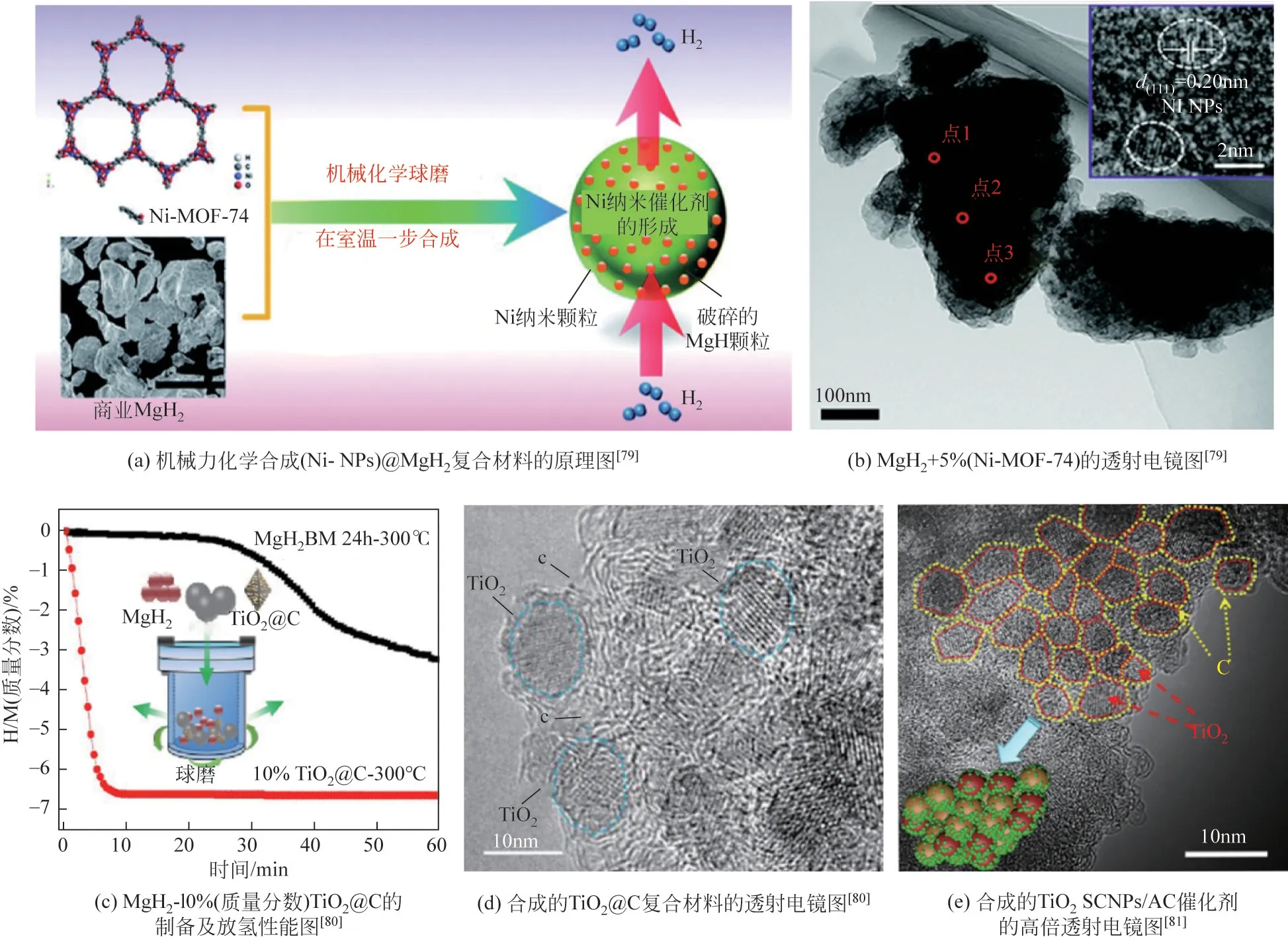
图6 改善Mg/MgH2体系储氢性能的部分金属和碳基材料催化剂
Zhang 等[80]合成了一种新型锐钛矿/金红石混合TiO2负载在多孔碳上的复合材料(TiO2@C)[图6(c)],TiO2@C催化剂是由10nm的TiO2纳米颗粒在多孔碳基体中精细分散而成。加入少量碳负载的纳米TiO2显著降低了脱氢操作温度,MgH2-10%TiO2@C样品在205℃时开始释放H2,比原始MgH2低95℃。在300℃下,10% TiO2@C 样品在7min 内快速释放6.5%的氢。更重要的是,脱氢的10%TiO2@C 样品即使在室温和50bar(1bar=105Pa)的氢压力下也能吸收氢。动力学测量表明,当添加10%TiO2@C时,MgH2脱氢和加氢的表观活化能分别降低30%和50%。离散傅里叶变换(DFT)计算表明,当MgH2吸附在TiO2团簇上时,Mg—H 键的键长延长,键能降低,导致体系的脱氢/氢化温度降低。后来,Zhang 等[81]提出了一种制备高效过渡金属氧化物纳米催化剂TiO2纳米颗粒的策略,该催化剂采用单分散的单晶状TiO2纳米颗粒包裹无定形碳制备而成[图6(d)、(e)]。原位合成的SCNPs/AC 催化剂对MgH2的脱氢性能有明显的改善。5%TiO2SCNPs/AC催化MgH2的起始氢气解吸温度(163.5℃)和活化能(69.2kJ/mol H2)均显著降低,在200℃下5min内可实现6.5%的可逆再氢化,在275℃下10min 内可实现完全脱氢。非晶态碳和多价态钛在纳米催化剂中起协同催化作用。根据X 射线光电子能谱(XPS)结果,Ti4+、Ti3+、Ti2+和Ti—H 等多价Ti 成分共存,这可能会促进Mg2+和H-生成,提高了其吸氢性能。此外,DFT计算发现催化剂中无定形炭的存在不仅可以阻止催化剂纳米颗粒的聚集和生长,而且可以大幅度降低H2在MgH2中的解吸能值。
4 结语与展望
镁基储氢材料具有储氢容量高、价格低廉、在自然界中镁资源丰富等优点,是最具有发展前景的一类储氢材料。但镁基储氢材料吸放氢热力学稳定、动力学缓慢,限制了其在储氢方面的应用。近年来,通过合金化、纳米化和添加催化剂来改善Mg/MgH2储氢体系的性能已经取得明显的进展。
(1)合金化是通过改变反应路径来降低生成焓的传统而有效的方法,但缺点是以牺牲氢的容量为代价。且在加氢过程中Mg 与其他元素之间的键会发生断裂,导致镁合金的可逆性较低,循环稳定性降低。因此,虽然合金化改性已经取得很大的突破,但仍需进一步研究来解决其遗留的储氢密度较低的问题。
(2)通过研究知道纳米Mg 颗粒是降低活化能和热力学稳定性的关键因素。具有高孔隙率、高比表面积和良好的骨架稳定性,是能够纳米限域的支架材料,可控制颗粒的大小至几纳米,调节MgH2的热力学性质。但目前大部分的纳米限域复合材料对于体积储氢密度的研究很少,纳米晶体的合成和氧化稳定也仍然是一个挑战。因此,寻找高效的负载体提升材料的性能,并有良好的质量、体积储氢密度是非常重要的。另外,在没有任何支架的情况下获得悬空纳米颗粒来显著改善材料的储氢性能,也是制备纳米镁基材料的有效方法。未来的研究包括纳米镁的不断细化和在合成过程中加入高效纳米催化剂,以进一步提高实际应用的吸附/解吸动力学和热力学性质。
(3)添加催化剂可以显著提高加氢/脱氢动力学。对于MgH2体系来说,动力学的改进已经不是难以克服的问题,但是热力学性质[焓变(ΔH)和熵变(ΔS)]几乎没有改变。添加催化剂对于MgH2体系的催化作用机制仍需从理论计算和实验上进行更深入的研究,从而为更优异的添加催化剂MgH2体系的设计及实用提供理论基础和技术依据。
综上,在合金化、纳米化和添加催化剂方面已经取得了很大的成就,通过研究可知,在改善动力学性能方面,合金化、纳米化和添加催化剂三种改性方法均可实现,然而催化剂添加对热力学稳定性影响不大。仅仅依靠上述任何一种方法来提高MgH2的储氢性能远远不够。需进一步优化储氢性能,改变Mg/MgH2颗粒表面结构、降低颗粒尺寸、增大氢原子扩散路径及界面催化反应效率、减少催化剂的用量,保证其可逆储氢量,提高低温放氢动力学性能。总之,未来需综合运用催化剂添加和纳米化改性双重机制对MgH2体系性能进行调控,加强对MgH2体系的催化机制分析,以促进其实际应用。
