固体高分子脱硝剂选择性非催化还原NOx特性
2023-10-14朱传强茹晋波孙亭亭谢兴旺李长明高士秋
朱传强,茹晋波,孙亭亭,谢兴旺,李长明,高士秋
(1 光大环境科技(中国)有限公司,焚烧技术研究所,江苏 南京 211100;2 中国科学院过程工程研究所,多相复杂系统国家重点实验室,北京 100190;3 北京工商大学生态环境学院,北京 100048)
针对环保部门日益严格的NOx排放指标,尤其NOx所规定的排放限值小于100mg/m3时,一般需要采用选择性非催化还原(SNCR)+选择性催化还原(SCR)工艺才能满足排放要求[1-2]。然而传统SNCR工艺面临脱硝效率低(<60%)和氨逃逸高等难题,SCR工艺面临技术系统复杂、投资和运行成本高昂和废弃催化剂作为危废处置等问题[3-4]。因此,烟气净化领域技术人员逐步寻求新的脱硝技术突破。
高分子非催化还原(PNCR)工艺,作为一种近些年发展的新型炉内脱硝技术,采用改性固体脱硝剂直接喷入炉膛脱硝,具有工艺简单、效率高、温度窗口宽、投资和运行成本低等优势,特别适用于垃圾焚烧等中小型锅炉烟气净化,在光大环境、康恒环境和粤丰环保等公司获得广泛应用,并能够满足NOx<100mg/m3的排放标准[5-7]。目前针对PNCR的工程应用报道较多[8-10],刘焕联等[8]通过垃圾焚烧炉运行实例比较了SNCR+PNCR 和SNCR+SCR的经济适用性,SNCR+SCR脱硝工艺由于投资和运行成本都高,不适用于垃圾补贴费低的项目;SNCR+PNCR脱硝技术以投资、运行成本低及占地面积小的特点,适用于垃圾焚烧领域。通过分析比较生活垃圾焚烧项目不同脱硝技术运行状况,发现PNCR脱硝技术投资及运行成本最低[10-11]。尽管PNCR 工艺在垃圾焚烧电厂已经推广应用至上百条线,但是目前PNCR研究仅限于燃烧工况、运行成本等工程案例分析,对PNCR反应规律和机理等基础研究较少,限制了PNCR 技术深入发展[8-9,12-13]。本文以光大环境正在应用的脱硝剂为实验原料,在小试实验平台上探索其脱硝性能,揭示其不同条件下反应规律和机理,为PNCR技术工程调试和运行调整提供理论支撑和技术参考。
1 实验部分
1.1 实验装置
实验装置如图1 所示,实验系统包括微型进料、配气、反应器、电炉、水蒸气发生器、气体净化分析等子系统及部件。脱硝反应器由2520 型不锈钢材料制成,内径68mm、高760mm,距反应器底部250mm 处设置孔径为1.0mm 的多孔分布板。反应器内部空腔的中间安装高度约为300mm 的竖直挡板(12),把烟气出口和进料口分开。在分布板上部加入3mm 的氧化铝小球,充分分布和预热模拟烟气,反应器内部设有两个K型热电偶(T1和T2)。配气系统主要由N2(1A)和NO 标气(1B)钢瓶构成,所需气体流量由质量流量计控制,N2和NO 标气在混合罐4 混合后送入反应器,经分布板后均匀进入反应器。另一路N2(1C)则通入脱硝剂供给通道作为平衡气,保证正常进料。水蒸气发生器温度控制在300℃,水蒸气加入量由平流泵控制。经预热的模拟烟气与水蒸气混合后,由加热带保温送入反应器底部。加热炉有4根硅碳棒提供电加热,炉温可在0~1200℃内调整。
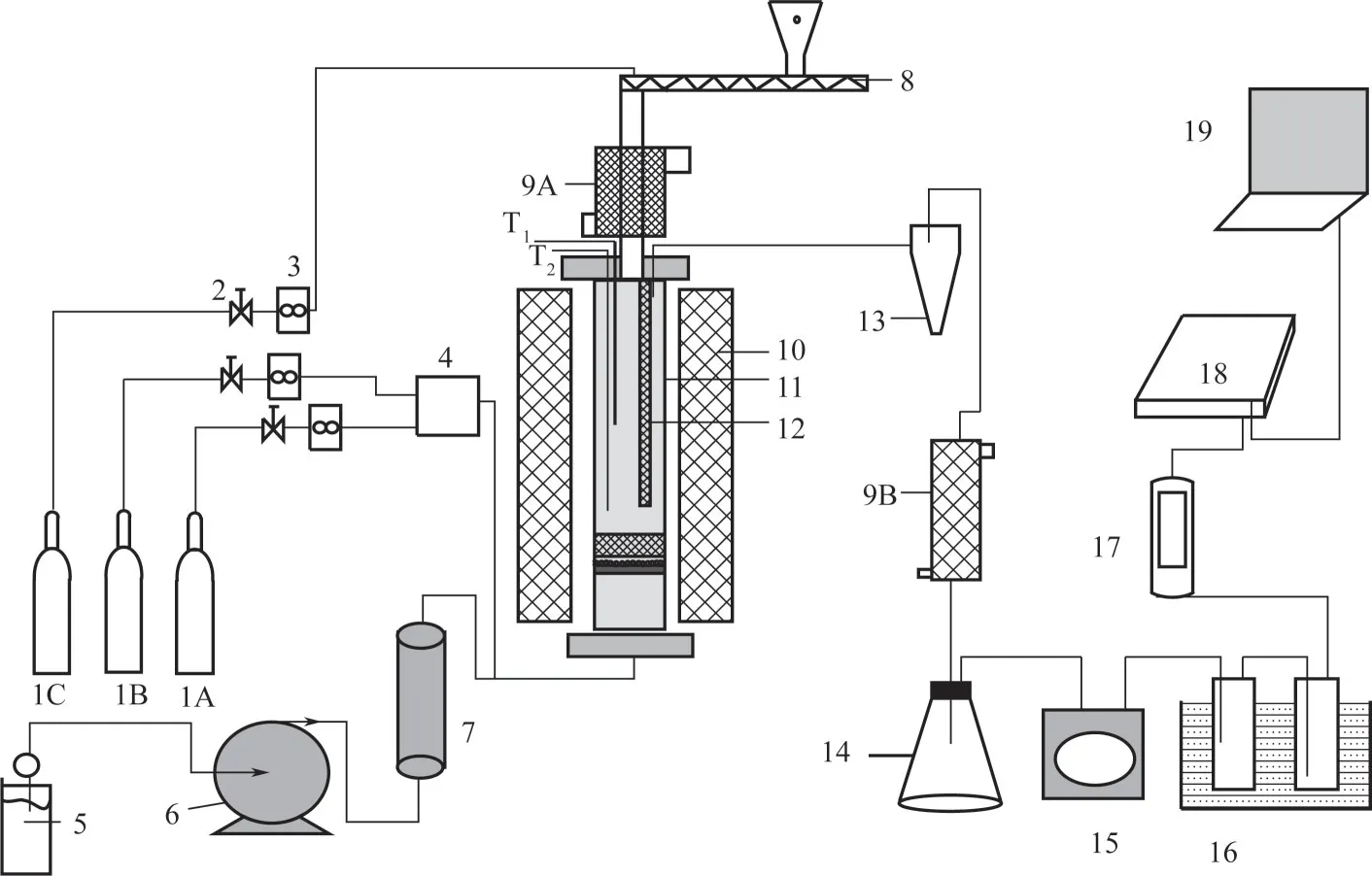
图1 脱硝剂效果评价实验装置流程
实验过程中,当反应器达到指定温度,模拟烟气通入反应器流速约为1m/s,NO 经过N2稀释后浓度稳定在400mg/m3左右,稳定10min以后开始供给脱硝剂,进料速率由电机变频调速器调控在0.3~1g/min,控制模拟烟气中脱硝剂的质量浓度为0.65g/m3。模拟烟气经过旋风分离器和冷凝器之后,进一步通过洗气瓶洗涤、干燥器脱湿后直接进入在线烟气分析仪(Testo350-XL,Germany)。该仪器可同时测量NO、NO2、SO2、CO2、CO 和O26 种成分的浓度。实验过程一般在烟气指标稳定1h 后停止。由于每次实验NOx初始浓度会有波动,最后统一转化为脱硝效率进行比较。
1.2 实验原料
实验采用的脱硝剂与工程研究所用原料相同[5],主要为尿素等含氨基的固体材料,用万能破碎机研磨后筛分为0.3mm左右粉末,连同钠盐、镁盐及其他无机类助剂按照一定比例称取后,加入V型高效混合器中,设置搅拌线速度为5m/s,混合3min 后,再将一定的高分子材料(聚丙烯类)加入混合器中,以同样的线速度混合反应5min,冷却卸料,得到脱硝剂粉体材料。
1.3 数据处理
在实验正式开始前调整N2和NO的浓度,出口NOx浓度稳定在400mg/m3左右10min 后,记录为NOx的初始浓度,在实验进入稳定状态后,以实际测量出口NOx浓度1h数据的平均值作为出口NOx的浓度。实验中在线监测的NOx浓度是波动的,为了便于分析比较,采用算术平均值表示NOx浓度,如式(1)。
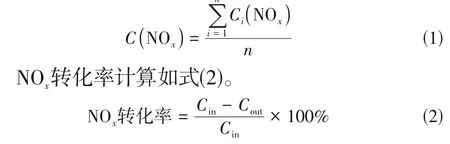
式中,Cin和Cout分别为脱硝前和脱硝后气体中的NOx浓度,mg/m3。
脱硝剂在模拟烟气中的质量浓度计算如式(3)。
式中,m1和m2分别为脱硝前和脱硝后料仓中脱硝剂的质量,g;t为脱硝实验运行时间,min;Q为模拟烟气的气体流量,m3/min。
2 结果与讨论
2.1 温度对脱硝效果影响
选择合适的温度窗口对于脱硝剂与NOx非催化还原至关重要[14-15]。如图2所示,温度从850℃升高到950℃,脱硝效率有所提高,而超过950℃后,脱硝效率逐渐降低。说明从850℃到950℃升温过程,能促进脱硝剂进一步快速分解,进入反应器与NOx的反应速率增加,从而使脱硝效率增加。随着温度进一步升高,脱硝剂进入反应器分解析出气体速率更快,同时原有的NOx和N2等混合气体随着温度升高在反应器内流速加快,停留时间变短,促使脱硝剂与NOx在有效温度范围内充分混合反应时间变短,最终导致脱硝效率降低,这一现象随着温度升高到1150℃更为明显。该结果与工程试验报道存在一定偏差,主要在工程试验中还同时受到O2、水蒸气及其他因素的共同影响。

图2 反应温度对脱硝剂脱硝效率的影响
此外,脱硝剂中含有氧元素,高温热解过程中会形成含氧自由基,在温度超过950℃后,也会和脱硝剂中含氮中间体结合,形成新的NOx,进而导致脱硝效率下降,这一点与SNCR脱硝反应类似[16]。因此,脱硝剂脱硝效率随着温度升高呈现先升高后降低的趋势。
2.2 氧气浓度对脱硝剂脱硝效果影响
在SNCR 反应过程中,NOx的还原反应需要氧气参与。有研究结果表明在缺氧的条件下,SNCR反应不会进行,O2体积分数在0.5%~2.2%之间时,NO浓度变化不大[14,17]。李辉等[18]的研究也表明氧气是保证高温非催化还原反应的一个重要因素。而本章上节实验研究表明,采用的脱硝剂直接和NOx发生反应完全可行,甚至脱硝效率能达95%以上。因此本节实验在温度850℃、保证总流量一致情况下,将钢瓶1A 改为空气,通过调节钢瓶1A 和1C来改变混合气体中氧气的浓度,考察其对脱硝剂的脱硝效率,结果如图3所示。在氧气浓度为0条件下,脱硝效率最高,随着氧气浓度的增加,脱硝效率逐渐降低。如上节所述,由于脱硝剂高温分解时产生大量的含N自由基,其脱硝反应不需要外加氧也能顺利进行。而传统的以氨水为还原剂的SNCR脱硝反应,需要O2引发还原反应,由O2产生的自由基维持反应持续进行。此外,脱硝剂本身含有氧元素,在高温分解过程中也主要以CO2等气体形式逸出。若反应气氛中增大氧气浓度,脱硝剂中含氮中间体与氧和OH发生式(4)~式(6)氧化反应。
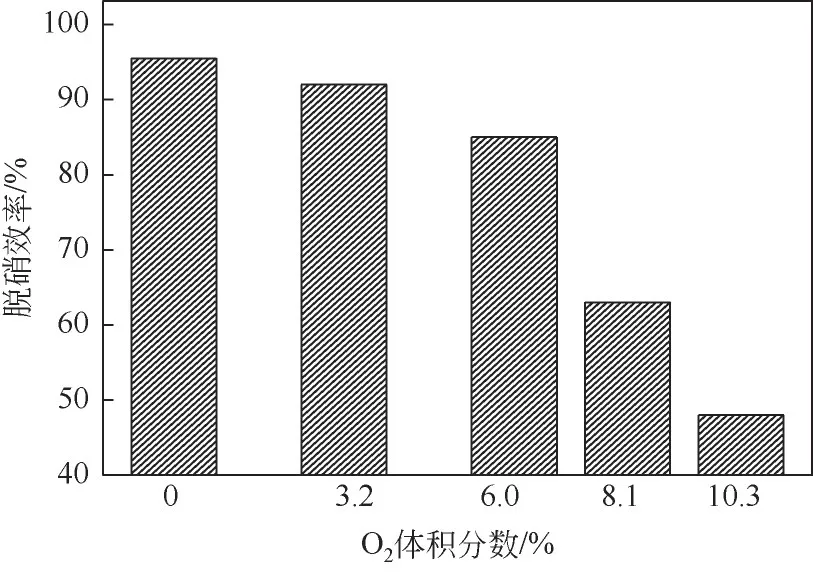
图3 氧气体积分数对脱硝剂脱硝效率的影响
研究表明一般在温度超过950℃后,还原剂的氧化反应才会明显,而O2体积分数的增加,促进高温下含氮物质的氧化反应向低温方向移动[19]。因此,如图3 所示,在850℃下随着氧气体积分数增加,尤其在超过6%以后,脱硝效率急剧下降,在氧气体积分数达到10.3%时,脱硝效率不到50%,充分说明随着氧气体积分数进一步加大,含氮物质的氧化反应促进作用更加明显。
2.3 水蒸气体积分数对脱硝剂脱硝效果的影响
在炉内进行脱硝过程中,烟气中存在大量的水蒸气,这些水蒸气势必会对炉内脱硝过程产生影响[20-22]。本节考察不同水蒸气含量对脱硝剂脱硝效率的影响,结果如图4所示。
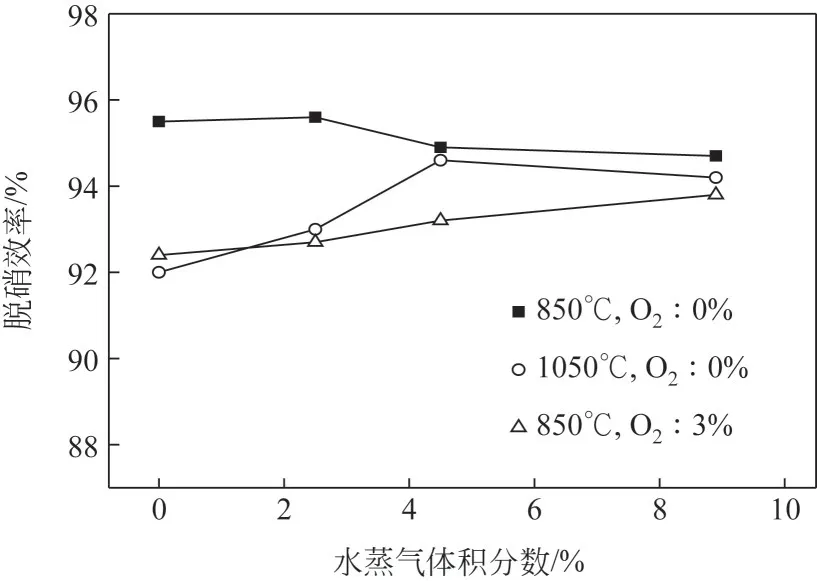
图4 水蒸气浓度对脱硝剂脱硝效率的影响
在850℃条件下,随着水蒸气体积分数增加,脱硝效率逐渐下降,可以看出水蒸气的加入降低了脱硝效率。主要是因为水蒸气加入,将NO浓度和脱硝剂有效气体成分稀释,降低了脱硝剂中的含氮中间体与NOx反应概率,促使脱硝效率随着水蒸气体积分数增加逐渐降低。同时水蒸气加入,生成大量OH,引起脱硝剂中有效成分与其发生式(4)反应生成HNO,一定程度上促进了NOx生成。在停留时间足够的条件下,其影响程度有限。最终在此条件下,脱硝效率出现了缓慢下降的趋势。
温度为1050℃时,随着水蒸气加入,脱硝效率开始逐步增加,说明水蒸气加入能抑制脱硝剂中含氮中间体向生成NOx的反应方向移动,尤其是抑制含氮中间体(NH、NH2和HNCO)等向HNO 的转化过程,HNO是生成NOx的主要途径[23],因温度升高有部分脱硝剂成分被氧化而导致脱硝效率下降程度减缓,因此在该温度下水蒸气加入一定程度上提高了脱硝效率。随着水蒸气的含量进一步加大,在水蒸气含量超过5%后,在其稀释脱硝剂中的含氮物质和NOx,降低反应转化率的程度较大时,导致脱硝效率又开始下降,水蒸气的加入延迟了脱硝剂氧化反应的发生,减缓了高温对脱硝剂氧化影响。这一现象与水蒸气对高氮燃料燃烧生成NOx的影响类似[24]。
在850℃,同时通入水蒸气和3%氧气,发现随着水蒸气的加入,脱硝效率在逐步增加,相比无氧气条件下,氧气的氧化作用随着水蒸气的加入在逐步减缓。说明水蒸气加入后大大稀释了反应气氛中向NOx转化的自由基,如HNO和O等浓度,抑制脱硝剂中含氮中间体发生氧化作用。在实际工况中,氧气和水蒸气交叉关联,是影响脱硝效率的重要因素,需要引起关注。
2.4 脱硝剂的热分解特性
通过热重分析研究了脱硝剂起始分解温度、分解速率、完全分解温度等脱硝剂热分解特性,结果如图5 所示。根据TG 曲线变化特性可把热分解分为4个阶段:低温分解、中温分解、中温再分解和完全分解。以尿素为主要成分的脱硝剂在尿素熔点之前(150℃)失重占比较小,在10%以内,这与Schaber 等[25]的研究基本一致。在150~320℃温度区间内失重约20%,代表脱硝剂热分解第一阶段,也是尿素等含氮物质低温熔化、蒸发和分解阶段;在350~420℃温度区间内失重约为35%,表明中温分解阶段,主要为有机含氮物质分解;在600~750℃之间失重率约占10%,为含氮有机化合物再分解及含钠和镁等盐类的分解阶段。固体脱硝剂聚合物基本上在800℃前分解,最后的完全分解阶段的失重率不足5%。剩余20%左右物质主要为无机盐类,熔点较高,难以分解。在TG 曲线中,最大的失重速率代表了最快的变化速率,其对应的DTG 峰的持续时间越短或峰越窄,表明反应(热分解)越容易发生[26]。从DTG曲线上可以看出,燃料失重速率有4 个峰值对应4 个特征温度值(200℃、375℃、410℃和720℃),其中375~410℃阶段峰形尖锐,失重速率最大,这一阶段失重速率为0.45%/℃,失重占比35%,说明脱硝剂成分主要在该阶段发生分解和析出。
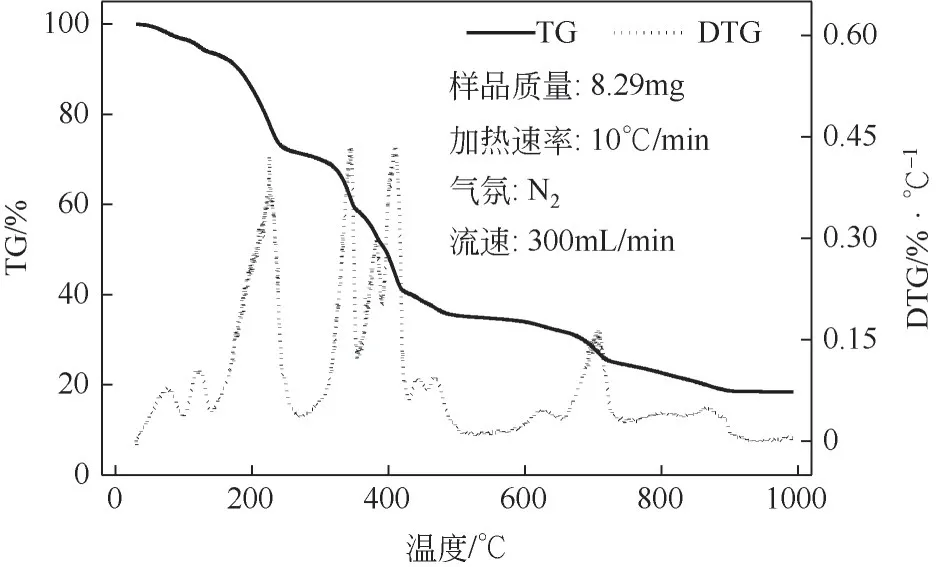
图5 脱硝剂热分解的TG、DTG曲线
进一步采用TG-IR 分析了脱硝剂热分解过程产物释放特征,其红外的三维和二维曲线如图6所示。根据DTG曲线上4个特征温度值,第1个特征温度(200℃)对应析出物质的红外峰值较小,红外谱图官能团信号变化不明显,代表脱硝剂含氮物质低温熔化、蒸发和初步分解阶段,但此温度下析出的物质较少。第2、第3 个特征温度(375℃、410℃)的峰值较高,持续时间较长,连续出峰,这也说明在该温度区间为脱硝剂分解的主要阶段,含氮低熔点物质完全分解的同时,这中间也会发生复杂的反应,产生众多含氮中间体[26]。对应于红外谱图中410℃的CO2、CO 和CN 等官能团的出现,说明脱硝剂中有大量的含氮中间体或化合物析出。这一温度区间也包括脱硝剂中其他物质部分熔化、分解过程。
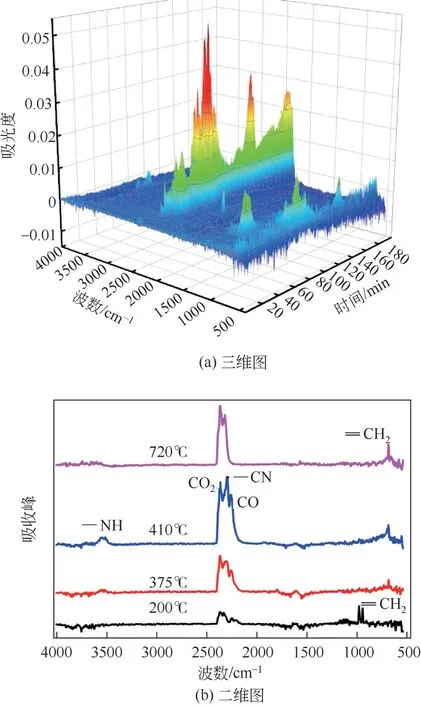
图6 脱硝剂热分解的热重-红外联用三维和二维图
此外,由红外谱图分析可知,= = CH2官能团随着温度的升高,峰值逐渐明显,说明高分子聚合物随着温度的升高逐步分解,375~720℃一直存在。红外谱图分析NH 官能团在410℃出现。随着温度的升高,CO2官能团出峰的峰形逐渐尖锐,表明CO2浓度不断升高,同时中低温分解过程中有CO官能团出现。在特征温度720℃时,CO2官能团出峰最大,说明脱硝剂高温分解过程能将脱硝剂中C和O元素主要以CO2析出。同时在该温度下可能由含氮中间体的相互作用生成HNCO等。综合TG-IR分析,脱硝剂在350~420℃区间发生热分解反应,析出大量的高反应活性的含氮中间体和自由基,无需高温和氧气即可引发自由基链式反应,较好地揭示了PNCR 比传统SNCR 脱硝温度窗口宽、氧气依耐性低且脱硝效率高的原因[5]。
2.5 高分子脱硝机理
依据Miller 等[23]含氮物质在燃烧过程中反应动力学模型,结合高分子脱硝剂的分解反应历程和热重气体的红外分析,高分子脱硝剂在炉内发生反应的路径如图7所示。
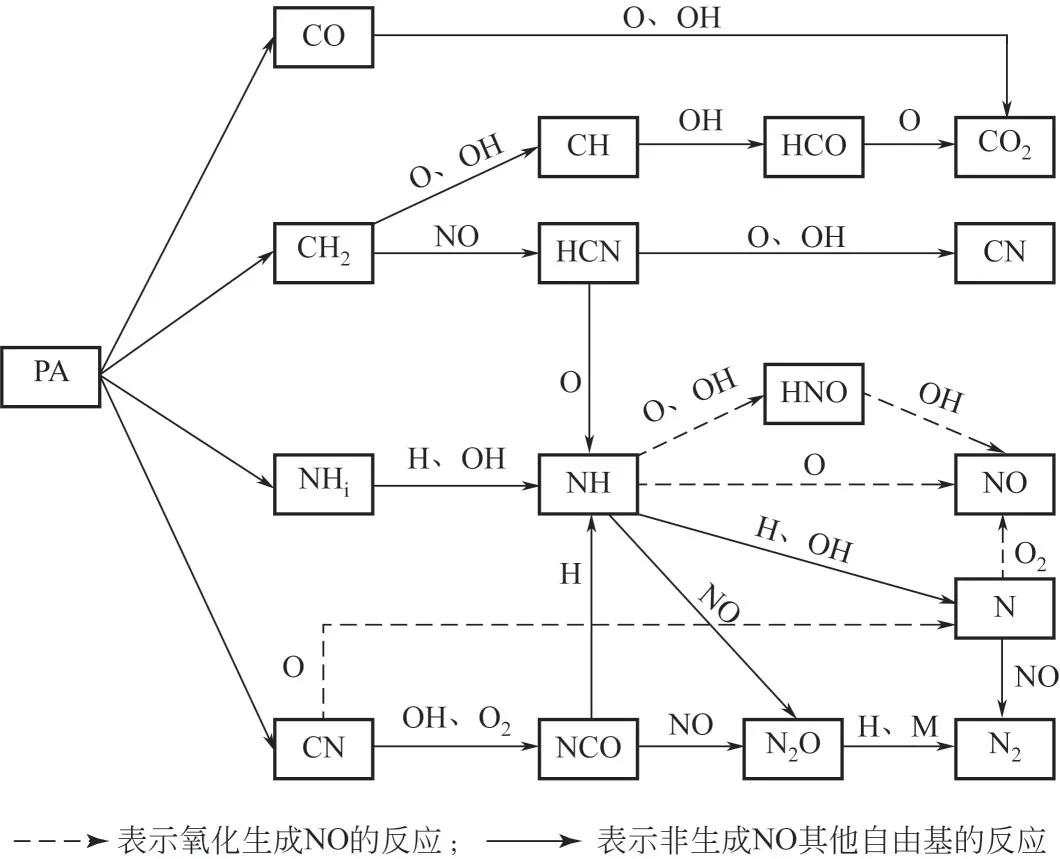
图7 高分子脱硝剂炉内反应路径
如2.1节所述,高分子脱硝剂主要是由聚丙烯高分子和氨基活性物质合成,在炉内高温(>800℃)的条件下,化学键断开,瞬间分解为CH2、CO、NHi和CN等物质(结合热解气体红外谱图分析)。CH2、CO 和CN 会首先与O 和OH 反应,高分子材料主要提供CH2和CH等自由基,发生式(7)~式(11)反应。
将可能与NH 反应生成NO 的O 和OH 大量消耗,产生还原气氛的自由基H,为NO 的还原创造条件。此外,CH2还能直接与NO发生式(12)反应。
HCN 可以进一步消耗O 和OH,发生式(13)~式(15)反应。
生成CN和分解产生的CN(红外检测)进一步消耗O,为来自热分解和新生成的NH 提供还原气氛,促进NO 还原,抑制NH 和N 的氧化过程。而CN主要发生式(16)~式(18)反应。
生成的NCO可进一步发生式(19)、式(20)反应。
NH2通过式(21)、式(22)反应生成NH。
NH 在还原气氛下,发生式(23)~式(25)反应,生成N2。
或直接与NO 反应[式(26)、式(27)],生成N2O,进而生成N2。
而N2O 也可在脱硝剂中氧化物(CaO、MgO 和Fe2O3等)催化下[27]生成N2,如式(28)、式(29)。
在整个脱硝剂发生反应过程中,会发生式(30)氧化作用(图7中虚线反应路径),生成NO。
式(4)与式(30)反应生成的HNO,再发生式(6)反应生成NO;或NH 和N 也可直接氧化生成NO,如式(31)、式(32)。
在高分子脱硝剂进入炉内后,将发生热裂解反应,首先高分子化学键断裂生成的CH2和CN 自由基将O2、O 和OH 反应基本消耗,形成了局部还原性气氛。其中CH2一部分生成CO2,另一部分生成CN和NH,CN可以进一步生成N和NCO,并有H、CO 等产物进一步作为反应物,与脱硝剂中NH 和NCO等一起参与还原NO的反应。而整个过程氧化反应受到了抑制,发生概率极小,在氧气浓度足够大的情况才会发生上述氧化反应,导致脱硝效率下降。这也是整个小试实验无O2条件下,脱硝效率较高的原因。
3 结论
针对目前正在推广应用的PNCR脱硝剂,在小试实验平台研究了影响其脱硝性能的关键因素并进行了反应机理的分析,为工程调试和工业应用提供技术参考,获得主要结论如下。
(1)在850~1150℃范围内,随着温度升高,脱硝剂脱硝效率先升高后降低,在950℃达到最佳脱硝效率,在97%左右,反应过程不需要氧气的参与,并能够稳定运行。
(2)脱硝剂本身含有的氧元素在热分解中主要以CO2形式逸出。随着氧气浓度的增加,脱硝效率逐渐降低,水蒸气的加入延迟了脱硝剂在高温条件下氧化反应的发生。而在有O2条件下,氧气的氧化作用随着水蒸气的加入逐步被稀释和弱化。
(3)依据固体脱硝剂的热重-红外热解特性,结合高分子脱硝剂反应路径,固体脱硝剂热解过程中高分子化学键断裂首先生成NH、CH2和CN等自由基,所生成的自由基(特别是高脱硝活性NH)能够快速与NO 反应生成N2而实现高效脱硝,CH2和CN则通过与O2、O和OH反应形成了局部还原性气氛,抑制了NH 等自由基通过氧化形成NO 的副反应,提高了固体脱硝剂的脱硝效率。
