硫铁矿介导的自养反硝化研究进展
2023-10-14许中硕周盼盼王宇晖黄威宋新山
许中硕,周盼盼,王宇晖,黄威,宋新山
(东华大学环境科学与工程学院,上海 201600)
水资源短缺、水环境破坏以及水生态破坏是制约我国高质量发展的突出瓶颈和生态文明建设的突出短板,污水资源化利用是破解上述问题的有效措施和多赢途径。目前,我国城市各类污(废)水年排放总量近700 亿吨,是城市水环境的主要污染源,同时也是一种来源稳定、具有潜在利用价值的可再生资源[1]。但是城市排水中具有高浓度的氮磷等营养物质,危害生态系统和人类健康,制约了其资源化再生梯级分质利用。如何有效控制城市排水中氮磷污染物以保障再生水的安全合理利用,是城市污水资源化过程中亟需解决的问题。
城市排水中氮磷营养物质的深度控制目前已引起广泛关注。随着我国生态文明建设的推进,许多污水处理厂在常规水处理工艺后添加反硝化深度处理单元,以保证氮磷营养物质的高效去除,从而利于再生水回用于景观生态补水、工业利用和市政杂用等,推进污水处理厂从“治污单功能”向“治污供水双功能”转变[2]。针对城镇排水中氮磷浓度高而碳源含量少的特征,工程实践表明高效脱氮除磷尚需外加碳源和除磷药剂,从而使城镇排水深度脱氮除磷的成本提高,成为城镇排水深度处理领域可持续发展的制约性因素之一。相较于传统异养反硝化,硫铁矿自养反硝化是一种经济、高效和绿色的脱氮处理技术,具有节省外加有机碳源、同步脱氮除磷、减少污泥产量和CO2排放量等优势[3],是近年来深度处理领域研究的前沿和焦点。
1 硫铁矿自养反硝化技术概述
1.1 硫铁矿介导自养反硝化的发现
作为自然界普遍存在且储量丰富的天然矿,硫铁矿主要包括硫化亚铁(FeS)、磁黄铁矿(Fe1-xS)、胶黄铁矿(Fe3S4)以及黄铁矿(FeS2)等[4]。20 世纪,研究者已证实在缺氧和中性pH 条件下微生物可以驱动硫铁矿介导的自养反硝化,是地下含水层、海洋和湖泊沉积物等自然水生环境中硝态氮还原的重要过程[5-7]。Golterman[8]于1991年发现在淡水系统中硫铁矿物的氧化过程需要借助硝酸盐的消耗。Garcia-Gil 等[5]于1992 年发现了海洋沉积物中FeS介导的脱氮作用。Jϕorgensen等[9]证明砂质含水层沉积物中黄铁矿可以作为反硝化细菌的电子供体;Torrentó 等[10]也发现黄铁矿的添加可以增强受硝酸盐污染的地下水和沉积物中的反硝化作用,并提高反硝化细菌的丰度。Vaclavkova 等[11]也发现FeSx的添加可以提升缺氧含水层沉积物反应器中硝酸盐的去除,而未添加硫铁矿物的反应器中几乎未观察到硝酸盐的减少。由上可知,自然生境中存在微生物驱动的硫铁矿氧化与硝酸盐还原的耦合现象。
尽管上述研究表明硫铁矿可以作为硝态氮还原的有效电子供体,然而部分研究者认为这可能是由于硫铁矿中残存的还原态硫单质造成的,主要成分FeSx是否可以作为有效电子供体依然存在争议[12]。Zhang 等[13]利 用 多 同 位 素(15N-NO-3、18N-NO-3、34S-SO2-4、18O-SO2-4以及34Spyrite)发现黄铁矿氧化约占脱氮区硫酸盐的70%,证实黄铁矿是砂质含水层中脱氮的主要电子供体;其中,16S rRNA 基因测序显示存在与硝酸盐还原相结合的硫化物氧化细菌。Jakus 等[14]利用56Fe、57Fe 以及32S 等铁硫同位素证实了黄铁矿介导的自养反硝化中FeS2和残存硫单质对硝氮去除率的贡献率分别为26%和73%,直接证实了微生物可以驱动黄铁矿的氧化。综上所述,除了硫铁矿中残留的单质硫外,硫铁矿(FeSx)本身亦可以作为反硝化过程的电子供体。
1.2 基于硫铁矿的生物处理技术
基于自然生境中微生物驱动硫铁矿氧化与硝态氮还原的耦合作用,研究者开始利用硫铁矿(黄铁矿、磁黄铁矿等)同时作为电子供体和生物膜基质,开发相应的生物技术用以处理各类污水。目前基于硫铁矿开发的生物处理技术主要包括生物滤池[15-17]、人工湿地[18-20]以及生物滞留池[21]等。Capua等[22]构建循环式黄铁矿生物滤池,当水力停留时间大于8h 时,硝氮和磷的去除率分别超过了90%和70%。Liang等[23]发现相较于人工湿地空白组,添加了磁黄铁矿的人工湿地系统处理效能大幅度提升,草甘膦、总磷以及总氮的平均去除率分别高达90.3%±6.1%、 88.2%±5.1% 以 及 60.4%±5.60%。Kong 等[24]开发了生物炭-黄铁矿双层生物滞留池,相较于传统砂基或秸秆基生物滞留池,其对雨水径流中碳氮磷组分的去除具有更好的稳定性和高效性。同时大量研究也发现,硫铁矿介导微生物反硝化过程中磷污染物也得到了有效地去除[25-27],这是由于硫铁矿的生物和化学氧化过程中无定形Fe(OH)3和γFeOOH 等产物具有高比表面积和正表面电荷,可吸附沉淀去除负电性的磷污染物[22,26]。由此可见,基于硫铁矿的生物技术可通过“生物驱动反硝化-非生物化学除磷”双重途径协同作用实现氮磷的同步去除。
2 硫铁矿自养反硝化技术的影响因素
硫铁矿自养反硝化技术主要是由硫铁矿与微生物的相互作用主导,可归结于固相电子供体与反硝化细菌间的界面反应。该界面反应的影响因素主要包括硫铁矿特性、添加量、运行pH以及温度等。
2.1 硫铁矿特性
目前广泛研究的代表性硫铁矿物主要包括硫化亚铁、磁黄铁矿以及黄铁矿等。大量研究表明硫化亚铁[5,28-29]、磁黄铁矿[23,30-31]以及黄铁矿[32-34]均可以作为电子供体以增强系统的反硝化性能;然而,他们结构上的差异会影响其作为电子供体的性能。其中,硫化亚铁是铁硫化物之间反应形成的第一种硫化铁相,呈四方层状结构,是黄铁矿或磁黄铁矿的前体物质[35]。磁黄铁矿非化学计量组成显示为Fe1-xS(0≤x≤0.125),其结构随着不同的缺铁量而呈现不同的形式[36]。黄铁矿非化学计量组成显示为FeS2,其呈NaCl 型结构,坚固的S—S 键和对称的立方晶体结构使得其具有更高的稳定性[37]。研究发现黄铁矿的反硝化能力可能弱于其前体物(如FeS),在相同培养实验条件下FeS和FeS2组的硝态氮去除率分别为61.5%和54.1%[38]。Trouve等[39]也发现了脱氮硫杆菌对FeS的亲和力大于FeS2,说明不同硫铁矿在生物利用性上的差异可能是影响其作为电子供体时脱氮性能的主要因素。整体而言,典型硫铁矿的结构特性差异会影响其作为电子供体的生物利用性。
研究发现硫铁矿的晶面结构直接决定了其是否可以被反硝化细菌利用。Haaijer等[29]发现当高度结晶的黄铁矿作为电子供体时,微生物无法驱动其生物氧化以实现硝态氮的还原。Yan 等[40]也证实了纯结晶的黄铁矿不能为反硝化菌提供有效电子供体,而合成的低结晶度的FeS2则可以实现以硝态氮为电子受体的生物氧化。最新研究也表明,相较于多晶面结构黄铁矿,单晶面结构的黄铁矿具有更高的表面能,稳定性更高,从而不利于反硝化细菌的利用,甚至无法作为电子供体[41]。李雅倩等[42]发现相较于六方磁铁矿,低结晶度的单斜磁铁矿表现出更优异的脱氮除磷活性。基于硫铁矿晶面结构对其生物利用性的影响作用,研究者尝试通过预处理手段改变硫铁矿的物理结构特性以增强其生物利用性。Aquilina等[43]发现普通的矿物表面呈现低反应活性,而粉碎可通过诱发矿物表面缺失使其产生新的潜在的高反应活性表面,从而有利于含水层中基于黄铁矿的自养反硝化。Yang等[27]利用无氧焙烧研制了纳米晶粒组成的黄铁矿,其具有蜂巢状结构,可大大降低生物滤池出水氮和磷的浓度。综上所述,硫铁矿的物理化学特性是影响硫铁矿自养反硝化是否发生及效率的重要因素。
2.2 硫铁矿的添加量
硫铁矿的添加量会影响系统的电子供给能力和铁产物生成量,从而影响系统的脱氮除磷效能。一般而言,硫铁矿的添加量与系统脱氮除磷能力存在正相关关系。Tong等[44]利用BBD模型和响应面法对黄铁矿反硝化性能进行了研究和优化,当黄铁矿剂量从50g/L 提高到125g/L 时,批次系统的反硝化速率显著提高。Si等[26]发现在低温条件下当人工湿地系统中黄铁矿/火山岩的质量比从1∶10 提高到2∶1 时,NO-3-N 的去 除率从47.6% 增加到61.1%,PO3-4-P 去除率从25%升至74.7%。Chu 等[45]构建了黄铁矿和石英不同体积比(0∶100%、25%∶75%、50%∶50%、75%∶25%、100%∶0)的垂直流人工湿地,发现随着黄铁矿含量的增加,TN和TP去除率呈现递增趋势。由此可知,随着黄铁矿添加量的增加,系统的脱氮和除磷能力均呈现明显的上升趋势。然而,微生物和氧气驱动硫铁矿的氧化作用均会导致SO2-4副产物的生成。Li等[46]研究表明在磁黄铁矿自养生物滤池中,当水力停留时间为72h 时,出水SO2-4平均浓度高达(196.69±12.12)mg/L[进水SO2-4平均浓度仅为(34.6±1.3)mg/L]。基于污水排入城市下水道水质标准(SO42-<600mg/L)和饮用水标准(<250mg/L),该体系出水中硫酸根离子浓度的同步增加是后续研究中值得注意的问题。
2.3 pH
pH是影响硫铁矿自养反硝化的重要因素之一,主要体现在其可以影响反硝化细菌活性以及硫铁矿的溶解,从而影响其对该体系脱氮效能的调控[47]。一般而言,反硝化细菌的最适pH为6.5~8.0,过高或过低的pH都会抑制反硝化细菌的正常生命活动,从而对反硝化过程产生不利影响[39];然而,硫铁矿介导的自养反硝化对pH 范围的响应有所不同。Vaclavkova 等[11]发现在初始pH 为5.5(整个过程中4.5<pH<6)的条件下,砂质含水层中缺氧NO-3-N还原耦合FeSx氧化作用依然可以发生,并导致NO-3-N浓度逐渐降低。同时,研究发现从富含黄铁矿的石灰岩含水层中分离的硝酸盐还原依赖铁氧化菌群,可以在pH为6.0~6.5条件下实现硝酸盐的还原[48]。Torrentó 等[33]证实了酸性pH(<6.5)不会导致脱氮硫杆菌驱动的硫铁矿自养反硝化速率的降低。此外,Li 等[16]发现在FeS 自养反硝化系统中,当初始pH 从7 下降到5 或者从7 升高至8 时,反硝化速率均呈现加快趋势,但pH 大于8 时反硝化速率显著下降。由此可知,硫铁矿自养反硝化可以在较宽的pH 范围内(5~8)发生,特别是在酸性pH条件下(5~6)。这可能是由于:①驱动硫铁矿生物氧化的反硝化菌株可能具有低pH 的适应值[49];②较低的pH 可以促进硫铁矿的溶解,从而提升其反硝化速率[16];③硫铁矿可以作为一种有效的缓冲剂维持系统的pH稳定。
2.4 温度
温度是微生物新陈代谢的重要因素,它可以通过影响微生物增殖速率、氮还原酶活性等来控制反硝化过程[50]。一般而言,反硝化是一个温度依赖的过程,其在低温条件下易受到抑制。其中,自养反硝化菌的适宜温度为20~40℃,而最佳生长温度约为30℃;因此微生物驱动的硫铁矿自养反硝化通常在室温条件下发生。蒲骄阳[51]发现当运行温度从30℃下降为20℃时,硫铁矿反硝化系统的硝酸盐去除率从99%下降至50%,且亚硝酸盐含量明显上升。Li 等[16]发现FeS 介导的反硝化作用可以在10~35℃范围内发生,然而系统在5℃时几乎不发生任何反硝化作用。Xu 等[52]发现黄铁矿自养反硝化系统的NO-3-N 去除速率随着温度的降低而逐渐下降;其中,当温度从20℃下降到10℃时,NO-3-N 去除率从49.2%下降到15.2%。由此可见,过低的温度会抑制硫铁矿介导的自养反硝化效能,如何在低温条件下提升该系统的脱氮除磷效能还值得探究。
3 硫铁矿自养反硝化技术的生物机制
3.1 硫铁矿自养反硝化功能菌
研究表明硫氧化反硝化菌和亚铁氧化反硝化菌是驱动硫铁矿介导的自养反硝化过程的关键功能微生物[9,20,32]。目前典型的硫氧化反硝化菌主要包括脱氮硫杆菌(Thiobacillus denitrificans,T.denitrificans)、脱氮硫单胞菌(Sulfurimonas denitrificans,S.denitrificans)等[53];常见的铁氧化反硝化菌主要包括微杆菌属(Microbacteriumsp)[54]、氧化亚铁硫杆菌(Thiobacillus ferrooxidans)[55]、氧化亚铁假单胞菌(Pseudogulbenkiania ferrooxidans)[56]、肠杆菌(Enterobactersp.CC76)[57]、食酸菌(Acidovorax sp)[58]等。
目前硫铁矿自养反硝化技术中优势自养反硝化菌种多鉴定为硫氧化菌,其中以T.denitrificans为主。2006 年Haaijer 等[59]在富含硫铁矿的天然生态系统中分离出β变形杆菌群Thiobacilli,并发现其可以在缺氧环境中氧化FeSx并耦合硝酸盐还原。Torrentó 等[60]和Bosch 等[61]分别证实了T.denitrificans可以硝酸盐为电子受体驱动纳米级黄铁矿或纯黄铁矿的生物氧化。周翔等[62]发现T.denitrificans可以FeS 为电子供体进行反硝化。朱良等[63]证实水热法合成的FeS2粉末也可以作为硫自养厌氧反硝化污泥系统的电子供体,其中优势菌属为T.denitrificans。此外,S.denitrificans也是硫铁矿介导的自养反硝化体系的优势菌属,其可在中性条件下利用无机硫化物和硫代硫酸盐作为电子供体[64]。刘斌等[65]发现黄铁矿生物滤池主要功能微生物除T.denitrificans(相对丰度27.6%)外,S.denitrificans(相对丰度11.8%)也占主要优势。Li 等[46]发现磁黄铁矿自养反硝化生物滤池处理缺碳废水时,系统中最优势菌种为S.denitrificans,其相对丰度高达68.05%。综上所述,T.denitrificans和S.denitrificans等硫氧化反硝化菌属在该体系中发挥重要作用。
除了硫氧化反硝化菌,亚铁氧化反硝化菌被证实也可以利用硫铁矿进行反硝化。研究者发现硝酸盐还原依赖亚铁氧化菌大多数不是专性自养生物,需要额外的有机碳作为能源进行持续生长[55-66],并多属于嘉利翁氏菌科(Gallionellaceae)、嗜酸菌属(Acidovoraxsp)、花生根瘤菌属(Bradyrhizobiumsp)以及诺卡氏菌属(Nocardioidessp)[67]等。同时,假单胞菌属(Pseudogulbenkianiasp)、氧化亚铁副球菌(Paracoccus ferrooxidans) 和弗氏柠檬酸杆菌(Citrobacter freundii)已被证明兼具亚铁氧化和硝酸盐还原的能力[68]。目前上述典型的硝酸盐还原依赖亚铁氧化细菌并未在硫铁矿介导的反硝化体系中得到鉴定;同时,受限于微生物学的发展,尚有部分硝酸盐还原依赖的亚铁氧化菌处于富集混合培养而未分离或未鉴定完整种属阶段。然而,Senko等[69]分离出了硝酸盐还原依赖亚铁氧化细菌(命名为FW33AN),并证实其可以驱动FeS 氧化协同硝酸盐还原。Jakus 等[48]从富含黄铁矿的石灰含水层中富集培养了自养型硝酸盐还原依赖的亚铁氧化菌群,16S rRNA 基因测序表明其归属Gallionellaceae科;同时证实其可以同时驱动硝态氮的还原和Fe(Ⅱ)的氧化,NO-3-N/Fe(Ⅱ)的化学计量系数约为0.2。上述研究进一步说明了硝酸盐还原依赖亚铁氧化细菌可以驱动硫铁矿的生物氧化,有助于推动对硫铁矿自养反硝化体系微生物群落结构的全面认识。
3.2 硫铁矿介导自养反硝化的原理
由上述研究可知,硫铁矿介导的自养反硝化是通过“生物驱动反硝化-非生物化学除磷”双重途径协同作用实现氮磷的同步去除。以黄铁矿为例,当其作为电子供体时,总反硝化反应方程式如式(1)所示。总体而言,该过程可能还涉及残存硫单质自养反硝化[式(2)]、铁化学除磷[式(3)和式(4)]等[4,70-71]。
尽管黄铁矿自养反硝化是一个热力学自发过程(ΔGo'=-2439kJ/mol),但是该反应只能在微生物催化作用下发生,且动力学比较缓慢[72]。目前研究虽然证实了微生物可以驱动硫铁矿介导的反硝化作用,但其微观机制仍不清楚,比如不溶性硫铁矿与微生物的初始反应是如何发生的。目前部分研究认为硫铁矿受到酸性溶解或氧化攻击后,Fe和S之间的键被裂解,释放出Fe2+和S2-2,之后Fe2+被迅速氧化成Fe3+并在中性pH 下生成铁(氢)氧化物,S2-2被氧化生成各种无机硫中间体(如S2O2-3等)最终被氧化成SO2-4[73]。其中,对于黄铁矿而言,其表面的S—S 键比Fe—S 键弱,S—S 更先断裂,故而硫元素先被氧化生成SO2-3、S2O2-3等并最终转化为SO2-4;铁则主要以氧化物或者氢氧化物形式稳定存在[74]。部分研究认为微生物与矿物的相互作用可由胞外聚合物中酶(如铁氧化酶MtoA和细胞色素c等)驱动[75];Pang等[32]研究发现在黄铁矿自养反硝化过程中,参与电子穿梭体生物合成的menC/E/G等基因得到显著富集,认为微生物衍生的电子穿梭体是黄铁矿氧化的第一步。同时,Fe3+、铁(氢)氧化物等中间产物通过沉淀吸附作用则可以同步去除PO3-4-P[76-77];此外,部分含铁沉淀物有可能通过胞外聚合物中的金属结合位点沉淀至生物膜。综上所述,硫铁矿介导的自养反硝化同步脱氮除磷潜在原理见图1。
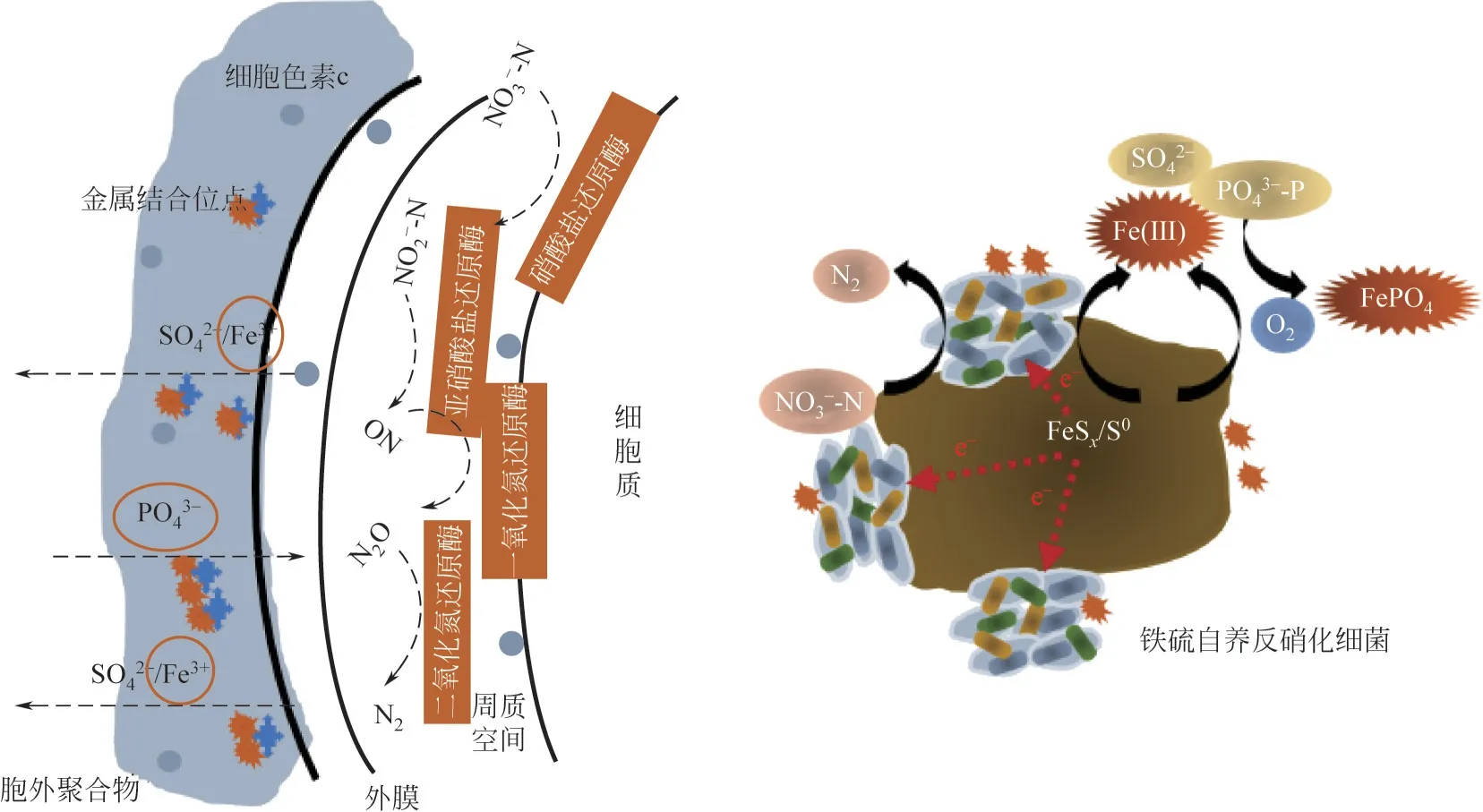
图1 硫铁矿自养反硝化同步脱氮除磷的潜在机制
4 技术的关键难点
4.1 硫铁矿的生物利用性
由于微生物无法将硫铁矿固体颗粒直接摄入到细胞中,硫铁矿界面的电子直接转移和溶解是被生物利用的潜在途径[3]。在生物浸出过程中,根据硫铁矿物的电子结构,存在酸性溶解和氧化溶解两种溶解途径。其中,价带来源于铁和硫化物原子轨道的硫铁矿物(如FeS、Fe3S4、Fe1-xS、Fe7S8等)通常是酸溶性的,即容易受到质子攻击而产生溶解生成Fe2+和H2S[78],这也与较低pH 下产生的高反硝化速率一致。然而,与单硫化物有所不同,黄铁矿具有高度结晶性,其价带完全来源于其金属轨道,导致晶体对酸性或质子促溶作用呈现惰性,这与黄铁矿的生物利用性低于FeS 存在关联[79]。由此可知,相较于其他硫铁矿,黄铁矿的生物利用性则主要取决于直接电子转移或氧化剂溶解。在黄铁矿自养反硝化过程中,200mV 左右是黄铁矿转化为生物可利用有效形态的电化学阈值。从热力学角度来看,中性条件下微生物中细胞色素a、c和d是可以氧化黄铁矿的,即为微生物-矿物的直接电子转移;但是这种直接作用是建立在微生物和矿物的接触基础上,意味着与矿物界面可用性有很大关系。同时,研究证实Fe3+作为强氧化剂,可与硫铁矿发生化学反应加速其溶解;Moses等[80]发现相较于O2,Fe3+对黄铁矿的溶解速率高出两个数量级。Liu 等[81]也证实了有机配体EDTA 的添加通过形成Fe3+-EDTA 配合物,可以显著加速黄铁矿氧化并提升其反硝化性能。综上所述,硫铁矿的结晶度、反应pH、界面可用性、氧化剂(如Fe3+等)以及非还原有机配体都是影响硫铁矿生物利用性的重要因素。
4.2 铁沉积物的抑制作用
亚微米级高价态铁产物在基质及微生物界面沉积聚集形成铁钝化膜,导致硫铁电子转移和氮磷物质传输受阻,进而可能诱发微生物活性恶化。一方面,通过化学氧化途径生成的铁氧化物和磷酸铁等高价态铁产物会沉积在黄铁矿表面,限制甚至阻止反硝化菌和黄铁矿的直接接触,从而阻止硫铁电子从矿物转移到细胞外膜蛋白Cytc2 或铁氧化酶MtoA[75]。另一方面,通过亚铁胞外生物氧化(主要途径)和亚铁胞内化学氧化途径形成的高价态铁矿物微粒,会在胞外和周质空间等氧化位点聚集形成结壳现象[14,82-83],阻碍物质的传输和代谢,导致微生物活性降低而诱发系统恶化。化学纳米成像显示微生物分泌的黏液基质-胞外聚合物(EPS)在控制细胞高价态铁矿物微粒的赋存形态起主导作用[84],且EPS中多糖为高价态铁矿物微粒的潜在成核沉淀位点[85]。相关研究进一步证实EPS 中腐殖质、羧基、巯基、胺基以及膦基等金属吸附位点会与高价态铁矿物微粒紧密结合形成复合物[86]。因此,如何调控界面高价态铁沉积物钝化问题是实现硫铁矿同步脱氮除磷长效运行面临的难点。研究发现有机配体络合法可以去除细胞铁结壳物[84,87],进而恢复微生物新陈代谢,说明细胞铁结壳现象属于可逆的抑制作用。有机配体与黄铁矿氧化产生的Fe3+相互作用形成较强的络合物,不仅可以干扰(氢)氧化铁的晶体结构、表面电荷和电势等以阻止铁(氢)氧化物的沉淀,而且降低了Fe(Ⅱ)/Fe(Ⅲ)循环的氧化还原电位。Liang等[88]发现天然有机物(络合物)可以稳定地下水中Fe(Ⅱ)浓度并增加Fe(Ⅲ)浓度,说明有机配体通过增溶Fe3+进而阻止铁(氢)氧化物形成上有一定的积极作用。其次,研究表明利用微超声波可以促进厌氧氨氧化菌和硝酸盐还原依赖的亚铁氧化细菌等微生物细胞附着的金属物质解吸,实现微生物与金属物质的分离[86,89],从而解除金属物质包裹的抑制作用而恢复微生物的活性。此外,具有铁还原能力的菌种能够以Fe(Ⅲ)矿物为电子受体将高价态铁沉淀物溶解为Fe(Ⅱ),从而减缓或消除铁钝化膜的生成。近期研究也发现Fe(Ⅱ)/Fe(Ⅲ)循环可通过由NO-2-N 诱导的Fe(Ⅱ)氧化和NH+4-N 诱导的Fe(Ⅲ)还原,推动总氮的去除[90]。由此推断,如果向该系统提供外部电子受体(如氨),Fe(Ⅱ)/Fe(Ⅲ)循环将得到极大的促进,这不仅可以减轻铁沉积物钝化问题,还可以提高总氮的去除率。综上所述,硫铁矿自养反硝化中铁沉积物钝化问题仍需要进一步深度探究。
5 结语与展望
硫铁矿介导自养反硝化具有节省外加有机碳源、同步脱氮除磷、且减少污泥产量和CO2排放量等优势,是一种经济、高效和绿色的脱氮技术。目前基于硫铁矿的各类生物处理技术已证实可以高效处理城镇废水、地下水以及雨水等,在低碳废水处理领域具有优势的应用前景。然而,目前研究多聚焦于该技术的脱氮除磷性能、运行参数以及微生物群落结构等;而对硫铁矿介导自养反硝化的微观生物机制研究较少,硫铁矿生物氧化与反硝化耦合过程中的电子传递机制仍不清楚。同时,结合该技术的发展难点,该技术未来的研究方向与发展重点应包括:①继续深入探究硫铁矿介导反硝化的微生物机制,尤其是微生物胞外聚合物中细胞色素c等电子穿梭体;②如何增强硫铁矿的生物可利用性;③如何解除硫铁矿基质和生物膜界面铁沉积物的抑制作用。
