具有pH响应性的自愈合蓝光水凝胶
2023-10-14王少凡周颖郝康安黄安荣张如菊吴翀左晓玲
王少凡,周颖,郝康安,黄安荣,张如菊,吴翀,左晓玲
(1 贵州民族大学材料科学与工程学院,贵州 贵阳550025;2 贵州民族大学机械与电子工程学院,贵州 贵阳 550025;3 国家复合改性聚合物材料工程技术研究中心,贵州 贵阳 550014;4 贵州中医药大学药学院,贵州 贵阳550025)
近年来,随着对水凝胶的深入探索,研究者们发现了其通常具有可调节的力学性能、低毒性以及良好的生物相容性[1-2],在生物医学领域,例如伤口敷料、组织工程和细胞培养等方面得到了广泛的应用[3-6]。然而水凝胶作为一种软湿材料,其力学性能易受到外力的影响,进一步破坏水凝胶网络结构的完整性,会导致水凝胶出现不可逆的破损[7]。在自然界中,不论是不小心被割伤后的皮肤自主再生,还是肠胃受损后的自主愈合,生物体的自愈现象都激发了人们对于自愈合性质的无限想象。受此启发,研究人员将这一类性质引入水凝胶,使该材料在受损后可以快速愈合自身损伤,既维持了水凝胶的原有功能性,又实现了材料的循环利用。
水凝胶的自愈合现象一般是通过在交联网络结构中引入动态共价键(二硫键、硼酸酯键及Diels-Alder反应等[8-11])或动态非共价键(氢键、分子间作用力及静电相互作用等[12-14])来实现。这些动态价键通过在水凝胶网络中建立重组与解离的动态平衡,从而赋予水凝胶自愈能力。但是大多数价键需要依赖外界条件的改变才能实现自动重组,即非自主型自愈合[15-16],例如,基于硼酸酯键动态重组的水凝胶需要在酸性环境(pH=4.2)条件才能触发自愈合性能[15];基于二硫键构建的水凝胶,其自愈合性能则需要在碱性环境(pH=9)条件下得以实现[16];而基于可逆Diels-Alder反应所制备的水凝胶除了需要合成特定的共轭双烯和亲双烯体,更是需要升温才能实现动态自修复[9]。此外,这些自愈合水凝胶的构建方式不仅需要烦琐的合成步骤,而且自愈合性能的实现条件较为严苛,从而限制了自愈合水凝胶在更多领域中的应用[17]。因此,以高效便捷的方式开发自主型自愈合水凝胶显得尤为重要。
壳聚糖作为自然界中唯一的碱性多糖,具有良好的生物降解性和抗菌性,同时其结构中含有羟基和氨基等高活性基团,使壳聚糖水凝胶在多领域展示出潜在的应用价值[18-19]。然而分子链中大量氢键的存在,使得壳聚糖几乎不溶于水和碱性溶液,这极大地限制了壳聚糖的应用[20-22]。因此对其羟基进行改性,可以开发具备较好溶解性的壳聚糖衍生物,以进一步扩宽壳聚糖的应用范围。例如,Chen 等[23]将壳聚糖衍生物引入聚(N-异丙基丙烯酰胺),设计了一种具有核-壳结构的水凝胶,该水凝胶具有温度敏感性和良好的生物相容性,能够很好地实现组织再生。海藻酸钠同样是一种可降解再生的天然高分子,其结构中含有大量的羟基和羧基,因此在水溶液中具有良好的溶解性、稳定性以及黏性[24-26]。此外,海藻酸钠因其低毒性而常被用于制备医学材料。特别是其分子间的顺式二醇结构,很容易被氧化剂氧化,以降低分子量并进一步提高流动性,从而具有更高的应用价值[27]。Pei等[28]在海藻酸钠结构单元上引入了多个功能性醛基,并将其与功能化聚乙二醇反应,所制备的水凝胶能够很好地包覆抗癌药物阿霉素。在近几年的研究中,基于天然高分子材料构建的自主型自愈合水凝胶已经被成功设计并应用于多个领域,例如基于Diels-Alder反应制备的果胶-壳聚糖水凝胶表现出良好的自愈性、pH 响应性以及热响应性,并被作为药物载体应用于生物医药领域[6]。但是这一类材料不能对生物体进行实时和非侵入性的监测,从而限制了水凝胶为研究者们提供复杂生物结构的重要信息。经研究发现,将发光基团引入水凝胶使其产生荧光现象可以很好地赋予水凝胶生物追踪和特异性识别能力,从而进一步推进自愈合水凝胶在更多领域的潜在应用[29]。
基于此,本文利用氯乙酸取代壳聚糖形成羧甲基结构,并利用高碘酸钠氧化海藻酸钠形成二醛结构,通过席夫碱交联制备了新型荧光自愈合水凝胶(CSA水凝胶)。通过傅里叶红外光谱仪对水凝胶进行结构表征,利用旋转流变仪表征水凝胶的自愈合性能,同时利用荧光光谱仪表征水凝胶的荧光性能,旨在通过一种低成本且快速易得的方式制备出具有多功能集成特性的新型高分子水凝胶材料。这种水凝胶材料受外力破坏后能够通过自主型共价键的快速重组在短时间内复原,同时在365nm紫外灯照射下,能够发射出明亮的蓝色荧光,并表现出荧光激发波长依赖特性。此外,通过调节pH 能够实现水凝胶的溶胶-凝胶相转变,进而实现水凝胶的动态重组。这种同时具备pH 响应性、自愈合特性以及荧光性能的新型水凝胶材料,有望在生物影像和信息防伪等领域展现出无比巨大的应用潜力。
1 实验部分
1.1 试剂与仪器
氯乙酸,东京化成工业株式会社;高碘酸钠、无水乙醇、异丙醇、乙二醇、氢氧化钠,北京伊诺凯科技有限公司;PBS缓冲液、KI淀粉指示剂,上海阿拉丁生化科技股份有限公司;海藻酸钠、壳聚糖,上海麦克林生化科技有限公司。所用试剂均为分析纯,未经纯化直接使用。
R-300 型旋转蒸发仪,瑞士BUCHI 公司;Tensor Ⅱ傅里叶变换红外光谱分析仪,德国Bruker公司;Fluoromax-4 分子荧光光谱仪,日本HORIBA 公司;DHR-1 型旋转流变仪,美国TA 公司;松下LX10相机,日本松下电器产业株式会社。
1.2 单体与水凝胶制备过程
1.2.1 氧化海藻酸钠(OSA)的合成
根据已有文献[30]报道,将10.0g 海藻酸钠(SA)溶于500mL 去离子水和175mL 无水乙醇中,得到悬浮液。待其分散均匀后,称取8g 高碘酸钠加入悬浮液中,避光条件下反应10h。加入2.33g乙二醇反应30min中和未反应的高碘酸钠,旋蒸后用丙酮多次过滤洗涤产物以完全去除残留反应物,烘干得到白色粉末状OSA。
1.2.2O-(钠盐)羧甲基壳聚糖(Na-CMCs)的合成
根据已有文献[31]报道,将13.5g氢氧化钠溶于20mL 去离子水中,分别称取80mL 异丙醇和10.0g壳聚糖加入到氢氧化钠水溶液,50℃下加热搅拌1h。将15.0g 氯乙酸溶于20mL 异丙醇中,滴加(30min内滴完)到反应中,继续加热搅拌10h,得到乳白色固体。使用70%乙醇溶液多次过滤洗涤产物以完全去除残留反应物,真空干燥24h后得到Na-CMCs。
1.2.3O-羧甲基壳聚糖-氧化海藻酸钠水凝胶(CSA水凝胶)的合成
反复实验探索得到OSA 和Na-CMCs 在水中的最大溶解度,分别为0.225g/mL和0.067g/mL。称取1.0g Na-CMCs 溶于20mL 去离子水,待其完全溶解后加入1.125g OSA,充分搅拌后即可得到CSA水凝胶。在模具中充分交联以后的CSA 水凝胶所具有的形状即为最终水凝胶的永久形状。此时单体的质量分数约为10%,分别配制质量分数为1%~10%的水凝胶,编号CSA 1~CSA 10(表1)。

表1 不同固含量下水凝胶的成形状态
1.3 测试与表征
1.3.1 海藻酸钠的氧化程度测试
根据不同n(SA)∶n(IO-4)制备OSA,待其反应完全后,分别取出0.5mL 溶液加入KI 淀粉指示剂,搅拌均匀后呈黄褐色;以空白溶液为参比,于480nm波长处测量吸光度,通过标准曲线确定剩余高碘酸钠的量[32],利用差减法计算海藻酸钠的氧化度。
1.3.2 红外光谱测试(FTIR)
取适量水凝胶冷冻干燥后,进行红外分析。测试模式为ATR 模式,扫描范围为500~4000cm-1,分辨率4cm-1,测定红外光谱。
1.3.3 凝胶化时间测试
使用烧杯侧倾法[16](侧倾时液体无流动则证明形成了凝胶)进行凝胶时间测试。
1.3.4 溶胀性能测试
在室温下,分别将不同组别的CSA 干凝胶浸泡在去离子水中,每隔一段时间取出,将表面擦干后称重,计算溶胀率。
1.3.5 流变学测试
将CSA 水凝胶制备成厚度为1mm 左右的圆柱体,放置在旋转流变仪中。25℃下,设定应变1%,在频率1~100r/s 范围内进行扫描,记录储能模量(G')和损耗模量(G″)的变化。
1.3.6 荧光性能测试
将水凝胶放置在365nm紫外灯的照射下会有强烈的蓝色荧光。随即,分别配制不同组别的CSA水凝胶,然后放置在荧光光谱仪的测量模具中对其进行荧光性能表征,设置扫描间隔为5nm,激发波长为365nm,测试不同组别水凝胶的发射光谱;在得到最大荧光发射峰后,测试其激发光谱,记录其荧光性能。
1.3.7 自愈合性能测试
将水凝胶样品平均切成两半,其中一半样品使用曙红-Y 进行染色,另一半使用亚甲基蓝进行染色处理。在室温下将分割为两半的水凝胶由断面贴合到一起,在无外力作用下进行自愈合性能测试。
2 结果与讨论
2.1 CSA水凝胶的成胶时间与结构表征
CSA 水凝胶的合成机理如图1(a)所示,本文利用Na-CMCs 提供的氨基与OSA 提供的醛基进行动态席夫碱交联形成水凝胶。调节单体的固含量,CSA水凝胶的交联程度有所不同,其物理和化学性质也会随之改变。由表1可以看出,成胶时间最短的是CSA-10组,成胶时间最长的是CSA-4组,而CSA-1~CSA-3 组不能形成水凝胶。当单体的固含量质量分数小于4%时,整个体系中的单体含量较低,Na-CMCs 与OSA 分子链不能很好地缠结在一起,使得交联网络非常稀疏,因此体系呈微凝胶态甚至是液态。而单体固含量质量分数介于4%~10%之间时,混合溶液中的Na-CMCs 含量多,体系黏稠度较大且流动性较小,Na-CMCs 与OSA 能够快速交联形成致密的网状结构。此时,CSA水凝胶在常温下能够稳定存在。图1(b)是SA 的氧化度随高碘酸钠加入量的变化曲线,由图可以看出,随着高碘酸钠用量的增加,海藻酸钠的氧化度呈直线上升趋势(R=0.98824),这与文献[32]报道是一致的。图1(c)为OSA的核磁氢谱图,在OSA的核磁共振氢谱图中,化学位移δ在4.65 处是溶剂重水的吸收峰,在5.05和5.15处出现两个峰[27],这对应由醛和邻近羟基形成的半乙酰质子,也证明OSA 被成功制备。

图1 CSA水凝胶的合成机理图以及OSA的结构表征
图2(b)是海藻酸钠(SA)、壳聚糖(CS)、OSA、Na-CMCs、CSA 水凝胶的FTIR 谱图。图中位于3300~3400cm-1处的宽吸收峰为CS羟基的伸缩振动峰,位于1652cm-1和1575cm-1的峰分别是CS酰胺带和氨基的弯曲振动峰[33]。与CS相比,Na-CMCs在1586cm-1处出现羰基的伸缩振动峰,而氨基的弯曲振动峰则移动到1409cm-1。这表明羧甲基很好地接枝在了壳聚糖分子链上,并且Na-CMCs 依然保留有氨基。位于1588cm-1和1403cm-1处的吸收峰则是SA 中羧基的反对称伸缩振动峰和对称伸缩振动峰[27],而在1630cm-1处出现了新的特征峰,为醛基的伸缩振动特征峰,进一步证明SA 被成功氧化为OSA。此外,随着OSA 的加入,Na-CMCs 分子链上的亲水性氨基进行席夫碱交联反应,逐渐转变为活性亚胺网络。1630cm-1处的OSA的醛基特征峰消失,在1690cm-1处出现亚胺键的特征峰。以上结果表明Na-CMCs 分子链上的氨基与OSA 分子链上的醛基发生了席夫碱交联生成了CSA水凝胶。图2(a)则是不同组别的CSA 水凝胶的溶胀曲线,由图中可见,所有组别水凝胶的溶胀率随着时间的延长而逐渐增大并最终趋于平缓,这表明CSA 水凝胶具有优异的吸水性能。随着CSA 水凝胶中的Na-CMCs 和OSA含量的增加,水凝胶的最终溶胀率有所降低,CSA-4 水凝胶的溶胀率可达到8000%以上,而CSA-10 的溶胀率约为5000%。这是因为随着水凝胶体系中交联密度的增大,水凝胶的分子链缠结紧密,因此导致水凝胶的孔径变小而孔隙变密,从而使水凝胶的吸水能力下降[10],图2(c)中不同水凝胶的SEM图像也能证明这一点。
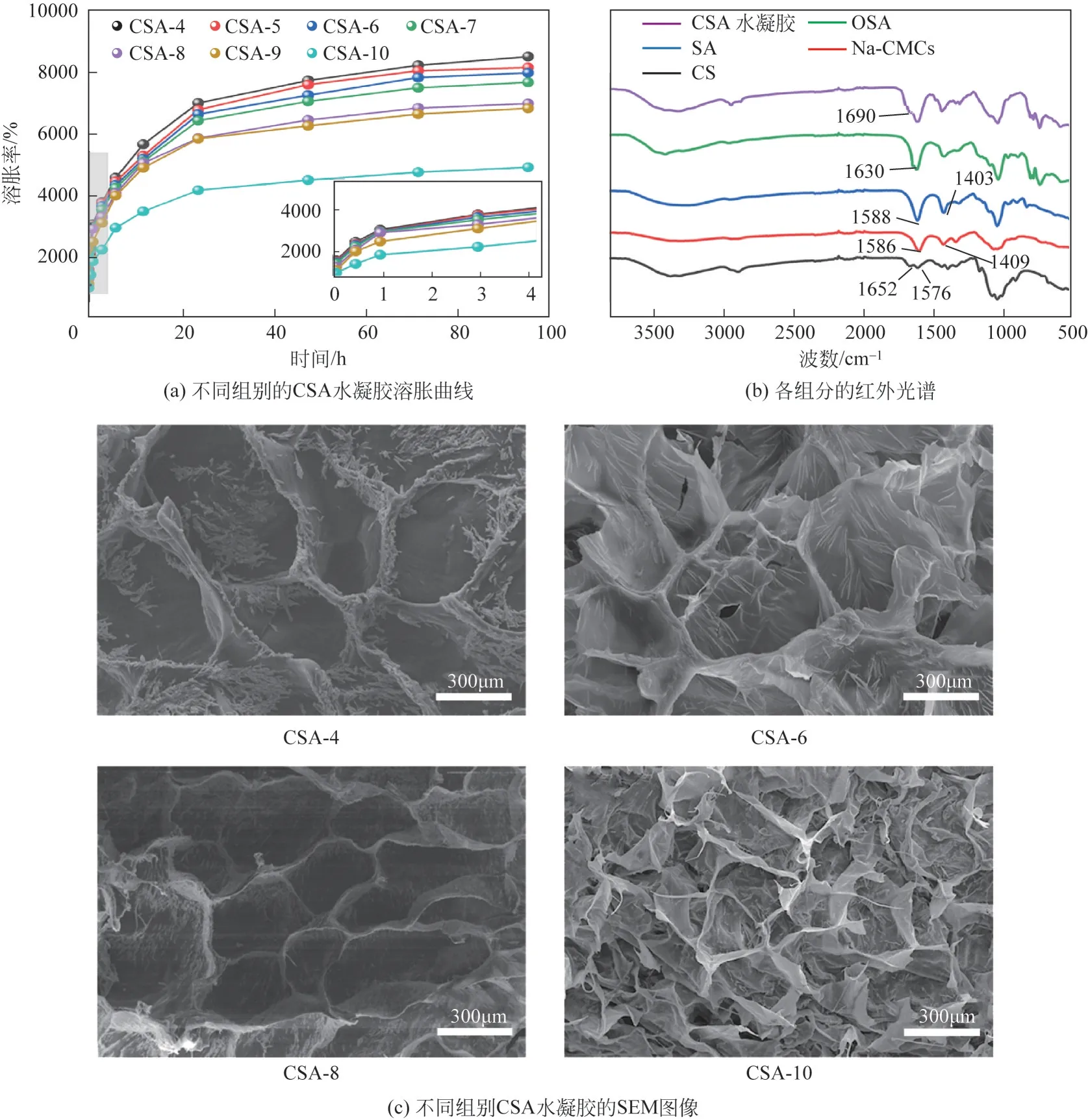
图2 CSA水凝胶的结构表征
2.2 CSA水凝胶的自愈合性能
通过宏观自愈合实验证明了CSA 水凝胶的自愈合性能。如图3所示,首先将完整的CSA-4组水凝胶分割成两半,分别用曙红-Y 和亚甲基蓝染料对其进行染色处理,然后拼接到一起观察自愈合现象。刚拼接时,水凝胶切面处能够看到明显的裂缝,而放置0.5h后,水凝胶的拼接处边界开始变得模糊,这是由于水凝胶在切面处接触后开始愈合,染料分子会相互流动交换,因此切面两侧呈两种染料颜色的叠加。在放置2h 后,水凝胶的切面处基本愈合完全。用镊子可以夹起水凝胶而不会再次断裂,这表明水凝胶的切面处进行了动态重组,而不是简单的粘连。这是因为水凝胶内部存在大量的动态亚胺键和部分游离氨基,在无需任何外界刺激条件下,破损的水凝胶在切面处会重新键合组成亚胺网络,最终修复损伤[32,34-35]。
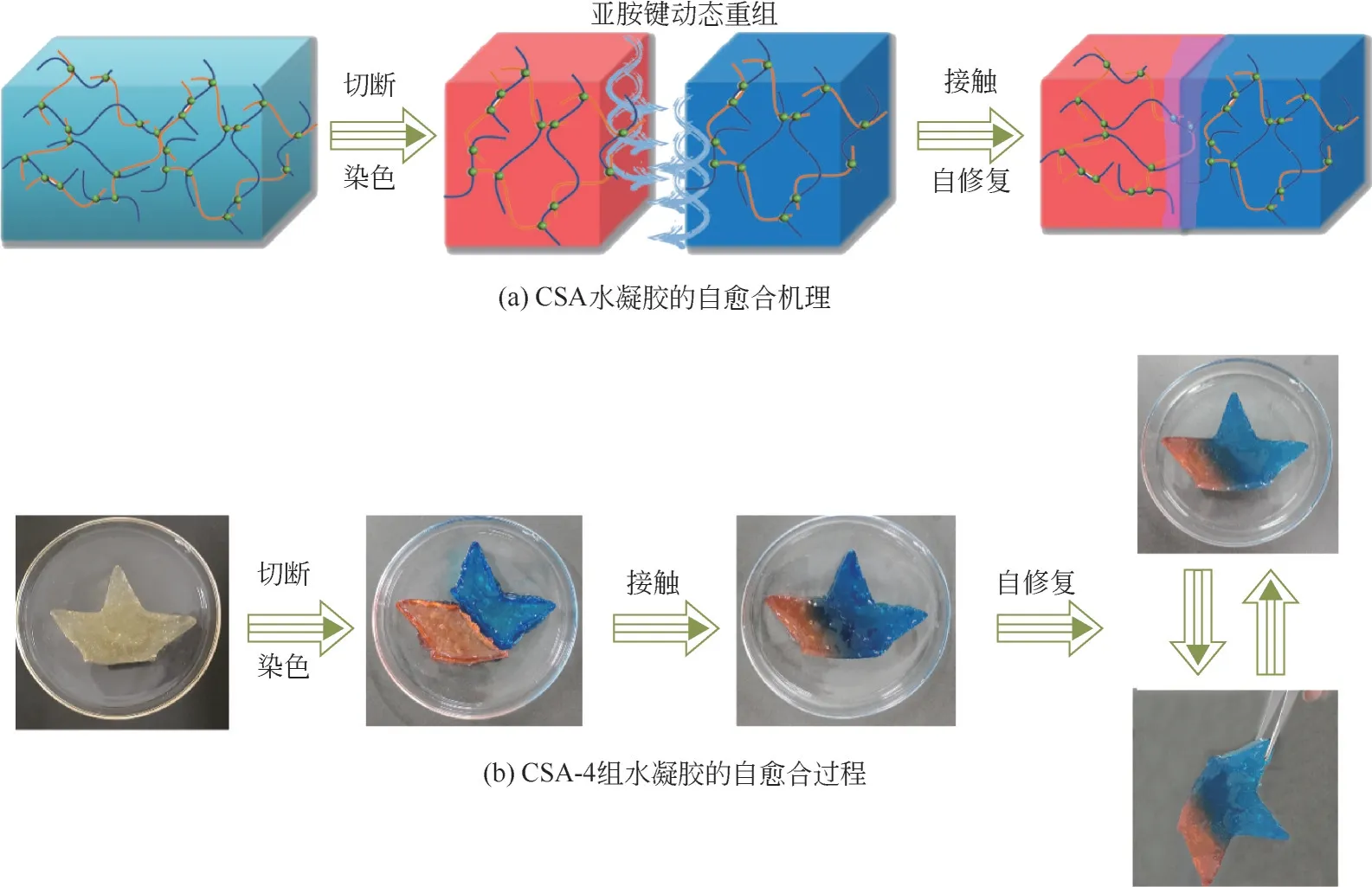
图3 CSA水凝胶的自愈合性能
CSA 水凝胶在固定应变(γ) 为1%、频率(ω)为1~100r/s 条件下的流变性能如图4 所示。通常来说,化学交联水凝胶的力学性能十分稳定,一般在频率范围内,体系形变较小时储存模量G'远大于损耗模量G″[11]。从图中可以看出自愈合前后CSA-4、CSA-6、CSA-8 样品的储能模量G'基本上呈现出一直增大的趋势,这是由于水凝胶体系中微量未交联的Na-CMCS 存在着运动阻力[4]。而CSA-10 样品增加幅度不大,表明水凝胶交联最为致密。而CSA-4、CSA-6、CSA-8三组水凝胶在频率达到100r/s 以后,储能模量G'上升幅度减小,这主要是由于水凝胶交联度高,非交联的反应性单体少,分子链再次发生缠结的概率也随之变低。在自愈合前后,所有水凝胶样品的储能模量G'基本上相差不大,这进一步证明CSA 水凝胶具有优异的自愈合性能,且自愈合后的CSA 水凝胶依然保持着较高的交联程度和弹性形变,以及具有优异的形状保真度。同时,水凝胶样品的损耗模量G''变化幅度不大,这也表明未自愈合前水凝胶就已经形成比较完好的三维网络结构,且自愈合后水凝胶的网络结构依然完好。而所有组中,随着水凝胶样品交联度的增大,储能模量G'的值在不断增大,这说明CSA水凝胶的抗变形能力良好。
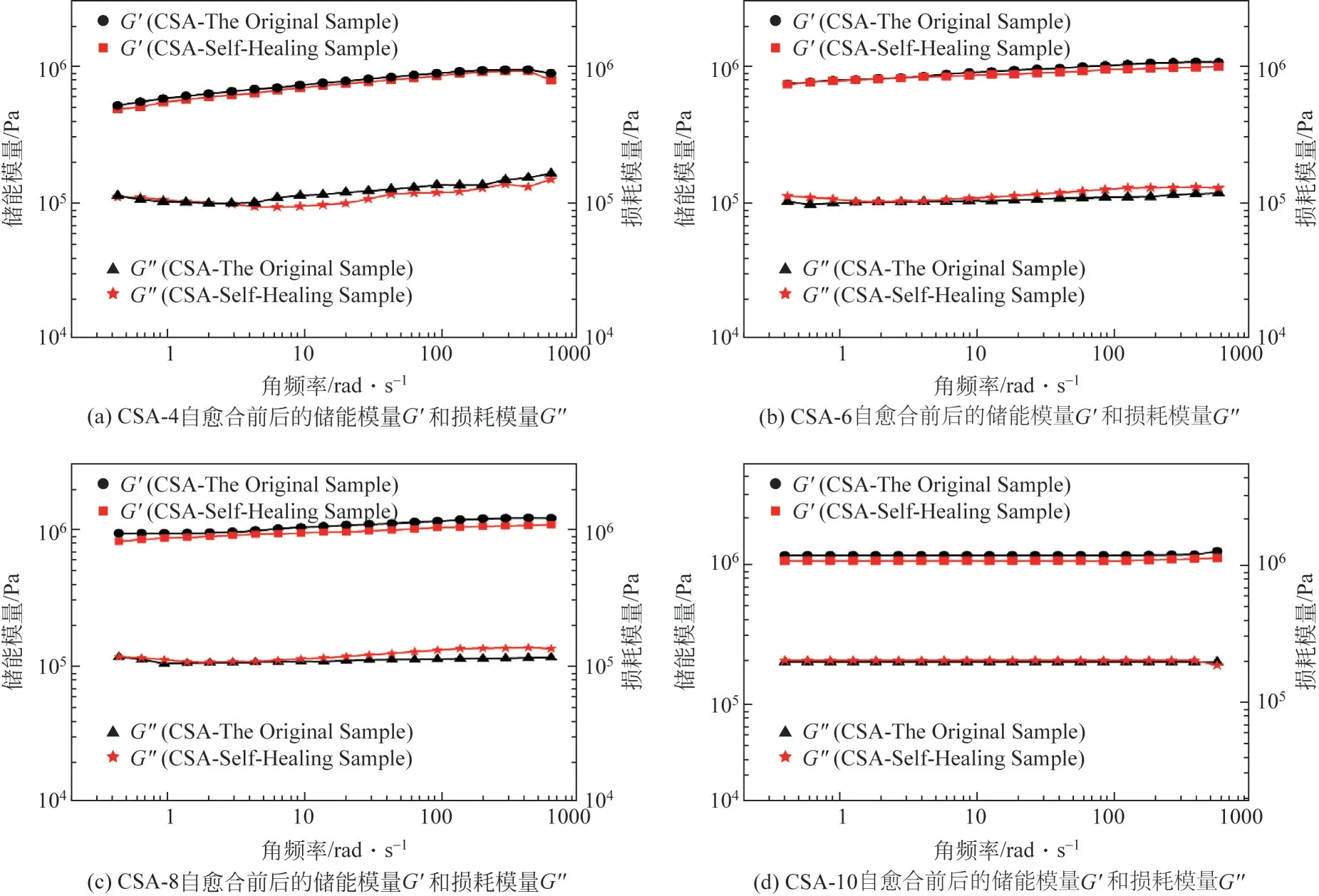
图4 CSA水凝胶流变性能
2.3 CSA水凝胶的荧光性能
图5(a)为不同模具制备的CSA-4组水凝胶,样品为黄色透明的固体,在室温下均具有良好的稳定性。在黑暗处使用波长为365nm 的紫外光照射时,水凝胶会发出明亮的蓝色荧光,这是因为席夫碱亚胺荧光基团(C= = N)赋予了水凝胶优异的光致发光性能[36]。图5(b)为不同组别的水凝胶的荧光发射光谱及CIE色度坐标,由图中可以看出7组水凝胶的荧光光谱在417nm和437nm处能够观察到很强的荧光特征发射峰,对应的CIE 色度坐标(0.1595,0.1499)也主要集中在蓝色光区。这是由于波长较短的紫外光能够穿透席夫碱荧光基团,从而导致C= = N键发生n-π*电子跃迁,但该基团的发光原理不同于共轭聚合物型荧光基团,因为这种基团的荧光能力来自于大π共轭主链和离域电子结构[37]。随着CSA 水凝胶中OSA 与Na-CMCs 的固含量逐渐增加,席夫碱荧光基团的数量也在逐渐增多,导致水凝胶中的刚性结构抑制线性分子链结构和亚胺键的分子内旋转,因此水凝胶的荧光强度随单体固含量的增加显著提高。图5(c)则是不同组别的CSA水凝胶的荧光激发光谱,在发射峰为437nm时,水凝胶的激发波长表现出红移特性。CSA-4组需要在波长为320nm的紫外光激发下才能发射出437nm的蓝光特征峰,而CSA-10 组仅需用339nm 的紫外光激发即可实现同样的蓝光发射峰。这表明,席夫碱荧光基团在浓度较大的时候能够用能量较低的紫外光激发。如图5(d)所示,测试了CSA-4组水凝胶在不同激发光波长下的荧光发射强度。随着激发光波长从310nm 逐渐增加到370nm,CSA-4 组水凝胶的荧光最大发射强度先增大后减小,在波长为320nm的激发光下荧光强度达到最大,说明CSA 水凝胶具有荧光激发波长依赖特性。这是由于CSA 水凝胶表面具有丰富的活性官能团,这些官能团被能量较大的光源照射时,会在C= = C和C—O、C= = N的π-π*和n-π*之间会产生一系列电子跃迁[33]。荧光实验证明了CSA 水凝胶拥有优异的蓝光响应性能,且蓝光强度可由激发光来调节,这为CSA 水凝胶应用在荧光标记领域提供了可能性。
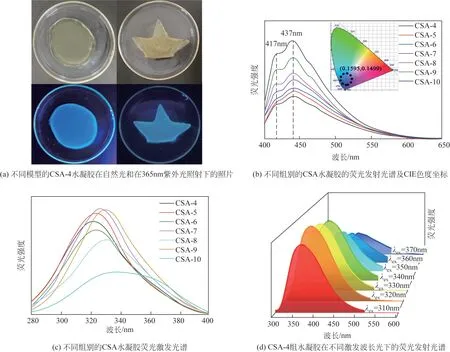
图5 CSA水凝胶的荧光性能
2.4 CSA水凝胶的pH响应性能
如图6 所示,首先向CSA-10 组水凝胶中不断滴加pH=2 的HCl 溶液,旋涡振荡以后,水凝胶逐渐由胶态相转变为液态相。在较强酸性下,席夫碱反应生成的亚胺键容易断裂,Na-CMCs 上的氨基被质子化,壳聚糖分子链开始伸展[27],同时海藻酸钠分子中解离出的—COO-与H+结合成—COOH,而羧基阴离子与水的亲和力要大大高于羧基[10],因此凝胶的亲水性降低,CSA 水凝胶的凝胶态被破坏,转变为液态。再向液态中滴加NaOH溶液,调节溶液的pH>6时,亚胺键重新形成,—COOH逐渐发生离解形成羧基阴离子,分子链充分伸展,凝胶网络开始恢复。水凝胶又由液态相逐渐转变为固态相,实现了CSA水凝胶的凝胶-溶胶pH响应性。上述结果表明,室温环境下亚胺键在适当的pH 范围内会发生可逆断裂-重组。
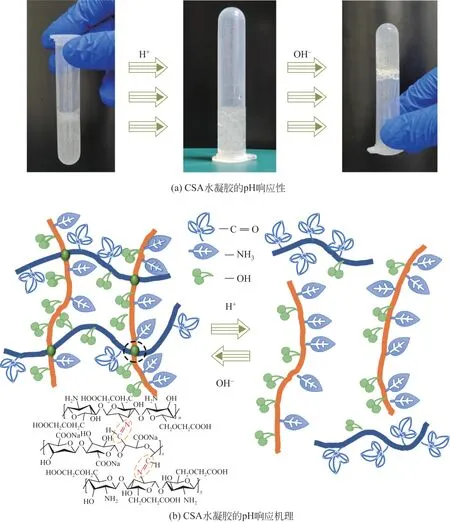
图6 CSA水凝胶的pH响应性能
3 结论
本文通过分子设计,以壳聚糖和海藻酸钠两种天然高分子材料为原料进行结构改性,成功构筑了一种低成本且具有多功能集成特性的蓝光自愈合水凝胶。通过结构表征可知,CSA水凝胶同时拥有亚胺键和氢键交联点,使得水凝胶的网络结构在室温下能够稳定存在。当这种通过动态席夫碱交联制备的水凝胶受到外力破坏时,只需将断口重新接触,醛基与氨基便能够自发地重组生成亚胺键,从而实现CSA水凝胶的自愈合。在波长为365nm的紫外光照射下,CSA水凝胶能够稳定释放出强烈的蓝色荧光。荧光光谱表明,水凝胶在417nm和437nm处拥有两个稳定的蓝光发射峰,同时还发现CSA 水凝胶具有荧光激发波长依赖特性。基于亚胺键和海藻酸钠分子链特有的pH响应性,CSA水凝胶随pH变化呈现出凝胶-溶胶可逆转变。这种具有pH 响应性的自愈合荧光水凝胶在生物影像、信息加密以及荧光标记等领域具有广阔的应用前景。
