苦参碱对食管癌Eca-109细胞自噬的影响及作用机制
2023-10-13侯敏杰林淑璇
侯敏杰,林淑璇,吕 洋
(河北北方学院病理学教研室,河北 张家口 075000)
食管癌是全球第八大最常见的癌症类型,是导致癌症死亡的第六大原因[1]。我国的食管癌在华北地区尤为高发,且食管癌患者的预后仍然较差[2-3]。中药在放化疗治疗食管癌过程中起到了显著的增效减毒作用[4]。苦参碱已被证明具有抗纤维化、抗病毒、抗炎及免疫调节等多种药理作用[5-9]。细胞自噬作为一种细胞死亡过程,已被证实与多种人类疾病相关,其在肿瘤发生发展中具有重要意义[10]。自噬可以调节肿瘤的形成、增殖、转移以及能量代谢等诸多方面[11]。研究发现,苦参碱可以诱导非小细胞肺癌[12]、乳腺癌[13]和髓母细胞瘤[14]等多种肿瘤细胞发生自噬。但目前关于苦参碱对食管癌细胞自噬的作用研究较少。基于此,本研究初步探讨苦参碱对食管癌自噬的作用及可能的作用机制,以期为苦参碱在临床食管癌治疗中的应用提供理论依据。
1 材料与方法
1.1 细胞、药物、试剂及仪器
Eca-109细胞株购自南京凯基生物科技有限公司;苦参碱(纯度≥98%)购自大连美仑生物技术有限公司;RPMI 1640 培养基购自美国Corning公司,胎牛血清购自德国Cegrogen Biotech公司,胰蛋白酶购自以色列Biological Industries (BioInd) 公司,四甲基偶氮唑盐[3-(4,5)-dimethylthahiazo (-z-y1)-3,5-di-phenytetrazolumromide,MTT]购自梯希爱(上海)化成工业发展有限公司,蛋白提取试剂盒购自英文特生物技术(北京)有限公司,聚氰基丙烯酸正丁脂蛋白定量试剂盒购自河北瑞帕特生物科技有限公司,自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)购自上海优宁维生物科技股份有限公司,兔抗人微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)、Beclin1和多聚蛋白62(polyprotein 62,P62)一抗购自日本MBL公司,兔抗人肝激酶B1(liver kinase B1,LKB1)一抗、磷酸化肝激酶B1(phosphorylated liver kinase B1,p-LKB1)一抗、实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)试剂盒购自武汉爱博泰克生物技术有限公司,兔抗人腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)、磷酸化腺苷酸活化蛋白激酶(phosphorylated adenosine monophosphate-actived protein kinase,p-AMPK)一抗购自杭州华安生物技术有限公司,兔抗人哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、磷酸化哺乳动物雷帕霉素靶蛋白(phosphorylated mammalian target of rapamycin,p-mTOR)一抗购自上海帛龙生物科技有限公司,二抗及荧光二抗购自北京博奥森生物技术有限公司,RNA提取试剂盒购自成都福际生物技术有限公司,反转录试剂盒购自北京庄盟国际生物基因科技有限公司,Beclin1基因引物购自上海英潍捷基生物技术有限公司;CO2恒温培养箱购自美国 Thermo 公司,倒置相差荧光显微镜购自日本Nikon公司,AI600超灵敏化学发光成像仪购自美国 GE 公司,Mastercycler nexus gradient 基因扩增仪购自德国 Eppendorf 公司,PikoReal 五通道实时荧光定量 PCR 仪购自美国 Thermo 公司,透射电子显微镜购自日本日立公司。
1.2 实验方法
1.2.1 细胞培养
Eca-109细胞复苏后,置于37 ℃、含体积分数5% CO2的饱和湿度培养箱中培养,待细胞生长至融合度约80%时,去除上清,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤细胞,2.5 g·L-1胰蛋白酶消化细胞后加入含体积分数10%胎牛血清的 RPMI 1640培养基传代培养。
1.2.2 MTT法检测细胞活性
取传代培养Eca-109细胞重悬计数,调整细胞密度为8×107L-1,接种于96孔板中,于细胞生长至融合度约 60%时,吸去上清,将细胞分为对照组、低浓度苦参碱组、中浓度苦参碱组和高浓度苦参碱组。对照组细胞加入100 μL含体积分数10%胎牛血清的RPMI 1640培养基,低浓度苦参碱组细胞加入终质量浓度为1.0 g·L-1苦参碱溶液,中浓度苦参碱组细胞加入终质量浓度为1.5 g·L-1苦参碱溶液,高浓度苦参碱组细胞加入终质量浓度为2.0 g·L-1苦参碱溶液。继续培养24 h后,加入20 μL MTT,避光孵育 4 h 后,吸去上清,每孔加入100 μL二甲基亚砜,温箱孵育10 min,用酶标仪测490 nm处吸光度(absorbance,A)值,计算细胞增殖抑制率。细胞增殖抑制率=[1-(A药物处理组-A空白孔)/(A未处理组-A空白孔)]×100%。实验重复3次,取均值。
1.2.3 免疫荧光细胞化学染色法检测Eca-109细胞中 LC3 蛋白的定位及表达
取传代培养Eca-109细胞,重悬计数,调整细胞密度为1×109L-1,接种于24孔培养板(24孔板中已提前放好无菌小圆片),细胞进行爬片,待细胞生长至融合度约80% 时,吸去上清,分为对照组、低浓度苦参碱组、中浓度苦参碱组和高浓度苦参碱组。对照组细胞加入500 μL含体积分数10%胎牛血清的RPMI 1640培养基,低、中、高浓度苦参碱组细胞的干预措施同“1.2.2”项。各组细胞继续培养24 h后用多聚甲醛固定 2 h,弃甲醛,经破膜、染色阻断后,添加兔抗人 LC3 一抗(滴度为11 000),4 ℃ 过夜,避光加入荧光二抗,抗荧光封片,激光共聚焦观察并保存图像。
1.2.4 Western blot法检测Eca-109细胞中P62和LC3蛋白的表达
1.2.5 RT-qPCR法检测Eca-109细胞中Beclin1 mRNA的表达
1.2.6 透射电子显微镜观察Eca-109细胞的超微结构
1.2.7 Western blot法检测Eca-109细胞中LC3、Beclin1、LKB1、p-LKB1、AMPK、p-AMPK、mTOR和p-mTOR蛋白的相对表达量
1.3 统计学处理
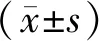
2 结果
2.1 对照组、低浓度苦参碱组、中浓度苦参碱组和高浓度苦参碱组Eca-109细胞增殖抑制率比较
对照组、低浓度苦参碱组、中浓度苦参碱组和高浓度苦参碱组细胞增殖抑制率分别为(2.903±0.788)%、(26.540±1.386)%、(30.220±1.357)%、(39.990±1.167)%。低、中、高浓度苦参碱组细胞增殖抑制率显著高于对照组,差异有统计学意义(P<0.05);中浓度苦参碱组和高浓度苦参碱组细胞增殖抑制率显著高于低浓度苦参碱组,差异有统计学意义(P<0.05);高浓度苦参碱组细胞增殖抑制率显著高于中浓度苦参碱组,差异有统计学意义(P<0.05)。
2.2 对照组、低浓度苦参碱组、中浓度苦参碱组和高浓度苦参碱组Eca-109细胞中LC3蛋白的定位及表达
对照组、低浓度苦参碱组、中浓度苦参碱组和高浓度苦参碱组Eca-109细胞质中均可见到红色荧光标记的LC3蛋白阳性表达。对照组细胞中LC3蛋白呈弥散状态;各浓度苦参碱组细胞中LC3蛋白呈斑点状态,且苦参碱浓度越高,细胞质中呈斑点状LC3蛋白越多。结果见图1。

A:对照组;B:低浓度苦参碱组;C:中浓度苦参碱组;D:高浓度苦参碱组。
2.3 对照组、低浓度苦参碱组、中浓度苦参碱组和高浓度苦参碱组Eca-109细胞中P62和LC3蛋白表达比较
低、中、高浓度苦参碱组Eca-109细胞中P62蛋白的相对表达量均显著低于对照组,差异有统计学意义(P<0.05);中浓度苦参碱组和高浓度苦参碱组Eca-109细胞中P62蛋白的相对表达量显著低于低浓度苦参碱组,差异有统计学意义(P<0.05);中浓度苦参碱组与高浓度苦参碱组Eca-109细胞中P62蛋白的相对表达量比较差异无统计学意义(P>0.05)。低浓度苦参碱组与对照组Eca-109细胞中LC3-Ⅱ/LC3-Ⅰ比较差异无统计学意义(P>0.05);中浓度苦参碱组和高浓度苦参碱组Eca-109细胞中LC3-Ⅱ/LC3-Ⅰ显著高于对照组,差异有统计学意义(P<0.05)。中浓度苦参碱组和高浓度苦参碱组Eca-109细胞中LC3-Ⅱ/LC3-Ⅰ显著高于低浓度苦参碱组,差异有统计学意义(P<0.05);高浓度苦参碱组Eca-109细胞中LC3-Ⅱ/LC3-Ⅰ显著高于中浓度苦参碱组,差异有统计学意义(P<0.05)。结果见图2和表1。

表1 对照组、低浓度苦参碱组、中浓度苦参碱组和高浓度苦参碱组Eca-109细胞中P62蛋白表达量及LC3-Ⅱ/LC3-Ⅰ比较
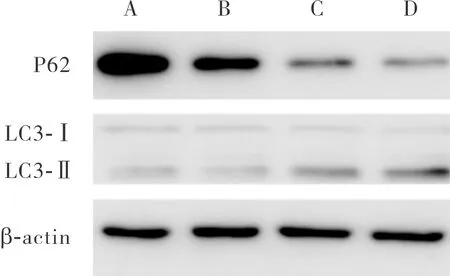
A:对照组;B:低浓度苦参碱组;C:中浓度苦参碱组;
2.4 对照组、低浓度苦参碱组、中浓度苦参碱组和高浓度苦参碱组Eca-109细胞中Beclin1 mRNA表达比较
对照组、低浓度苦参碱组、中浓度苦参碱组和高浓度苦参碱组Eca-109细胞中Beclin1 mRNA的相对表达量分别为1.000±0.000、1.730±0.180、3.230±0.255、8.123±0.890。低、中、高浓度苦参碱组Eca-109细胞中Beclin1 mRNA的相对表达量显著高于对照组,差异有统计学意义(P<0.05)。中浓度苦参碱组和高浓度苦参碱组Eca-109细胞中Beclin1 mRNA相对表达量显著高于低浓度苦参碱组,差异有统计学意义(P<0.05);高浓度苦参碱组Eca-109细胞中Beclin1 mRNA的相对表达量显著高于中浓度苦参碱组,差异有统计学意义(P<0.05)。
2.5 对照组和高浓度苦参碱组 Eca-109细胞的超微结构
对照组细胞中可见正常的细胞质、细胞器和细胞核;高浓度苦参碱组细胞质中可见大量大小不等的自噬泡,并可见包裹有细胞内容物的自噬体,而细胞核未见明显异常;结果见图3。
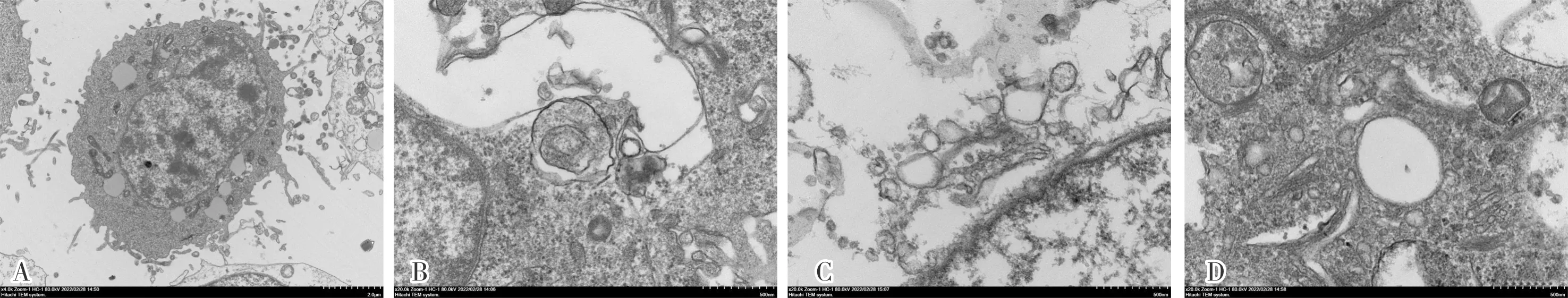
A:对照组(×3 000);B~D:高浓度苦参碱组(×20 000)
2.6 对照组、自噬抑制剂组、苦参碱组和自噬抑制剂+苦参碱组Eca-109细胞中自噬相关蛋白及LKB1/AMPK/mTOR 信号通路蛋白相对表达量比较
自噬抑制剂组与对照组Eca-109细胞中Beclin1蛋白的相对表达量和LC3-Ⅱ/LC3-Ⅰ比较差异无统计学意义(P>0.05);苦参碱组和自噬抑制剂+苦参碱组Eca-109细胞中Beclin1蛋白的相对表达量和LC3-Ⅱ/LC3-Ⅰ 均显著高于对照组,差异有统计学意义(P<0.05)。苦参碱组和自噬抑制剂+苦参碱组Eca-109细胞中Beclin1蛋白的相对表达量和LC3-Ⅱ/LC3-Ⅰ 均显著高于自噬抑制剂组,差异有统计学意义(P<0.05);自噬抑制剂+苦参碱组Eca-109细胞中Beclin1蛋白的相对表达量和LC3-Ⅱ/LC3-Ⅰ 均显著低于苦参碱组,差异有统计学意义(P<0.05)。
自噬抑制剂组Eca-109细胞中p-LKB1/LKB1、p-AMPK/AMPK显著低于对照组,p-mTOR/mTOR显著高于对照组,差异有统计学意义(P<0.05);苦参碱组Eca-109细胞中p-LKB1/LKB1、p-AMPK/AMPK显著高于对照组,p-mTOR/mTOR显著低于对照组,差异有统计学意义(P<0.05);自噬抑制剂+苦参碱组Eca-109细胞中p-LKB1/LKB1、p-AMPK/AMPK显著高于对照组,差异有统计学意义(P<0.05);自噬抑制剂+苦参碱组与对照组Eca-109细胞中p-mTOR/mTOR比较差异无统计学意义(P>0.05)。苦参碱组和自噬抑制剂+苦参碱组Eca-109细胞中p-LKB1/LKB1、p-AMPK/AMPK显著高于自噬抑制剂组,p-mTOR/mTOR显著低于自噬抑制剂组,差异有统计学意义(P<0.05);自噬抑制剂+苦参碱组Eca-109细胞中p-LKB1/LKB1、p-AMPK/AMPK显著低于苦参碱组,p-mTOR/mTOR显著高于苦参碱组,差异有统计学意义(P<0.05)。结果见表2和图4。

表2 对照组、自噬抑制剂组、苦参碱组和自噬抑制剂+苦参碱组Eca-109细胞中自噬相关蛋白及LKB1/AMPK/mTOR 信号通路蛋白相对表达量比较

A:对照组;B:自噬抑制剂组;C:苦参碱组;D:自噬抑制剂+苦参碱组。
3 讨论
食管癌是常见的消化道恶性肿瘤,其早期手术治疗有较好的临床效果,但对于进展期患者,单纯手术治疗难以取得满意的临床效果,且术后复发和转移较为多见,因此常辅助以化学治疗、免疫治疗等综合治疗。长期使用一类药物进行治疗时,除药物本身会对患者身体造成一定的损害外,肿瘤亦容易产生耐药性。因此,需要寻找有效且毒副作用较小的新型抗肿瘤药物,制定个性化方案,以延长患者的远期生存率,提高患者的生存质量。
中医药文化历史悠久,中草药因其治疗疾病安全有效且毒副作用较小等优势,已被广泛用于治疗各种疾病。苦参是一味传统中草药,属豆科槐属植物,其性寒味苦,主要功能是清热燥湿、利尿。苦参碱是来源于苦参的单体成分,目前关于苦参碱对食管癌的治疗效果罕有报道,其作用机制也不清楚。有研究发现,苦参碱具有阻滞细胞周期、诱导肿瘤细胞发生自噬和凋亡等作用,体外实验发现其对肝癌、结肠癌有较好的抑制作用[15-17]。
研究显示,苦参碱对胃癌具有显著的抗肿瘤活性,而且苦参碱诱导胃癌细胞死亡时凋亡和自噬均被激活[18]。细胞自噬与肿瘤有着密切关系,在自噬过程中,哺乳动物雷帕霉素靶蛋白复合物(mammalian target of rapamycin complex,mTORC)处于整个自噬过程的起点。细胞内的信号通路如果可以影响到mTORC的活性,那么就能调控下游自噬的过程。抗肿瘤药物常通过诱导肿瘤细胞凋亡或自噬发挥治疗作用[19]。LIN 等[20]研究发现,苦参碱可抑制肝癌细胞生长、迁移和侵袭,同时促进肝癌细胞凋亡和自噬,进而发挥抗肿瘤作用。本研究发现,不同浓度苦参碱组Eca-109细胞中LC3荧光斑点随浓度升高而增多,提示苦参碱可诱导Eca-109细胞自噬。
AMPK 的激活能磷酸化结节性硬化症复合物,从而促进 mTOR的失活,诱导细胞自噬水平的提高。AMPK 也能直接磷酸化mTOR调节相关蛋白,抑制 mTOR,上调细胞自噬。LKB1是AMPK的上游激酶,其可通过形成p-LKB1进而激活AMPK,从而调节自噬。有研究表明,细胞在缺氧或者缺乏营养的状况下,能激活AMPK并显著增加 AMPK蛋白的表达,抑制mTOR的活性,进而激活自噬相关蛋白的表达[21]。
本研究结果发现 ,Beclin1蛋白表达量及LC3-Ⅱ/LC3-Ⅰ、p-LKB1/LKB1和p-AMPK/AMPK在苦参碱组细胞中最高,当加入自噬抑制剂后,相关蛋白的表达量下降;而p-mTOR/mTOR在苦参碱组最低,当加入自噬抑制剂后,p-mTOR/mTOR却增加。本研究还发现,苦参碱可促进p-LKB1、p-AMPK蛋白的表达,抑制p-mTOR蛋白的表达,进而上调自噬,这表明苦参碱激活了LKB1/AMPK/mTOR信号通路。以上结果提示,苦参碱可能是通过调节LKB1/AMPK/mTOR通路蛋白的表达诱导食管癌Eca-109细胞发生自噬的。
4 结论
苦参碱可以抑制细胞增殖,诱导细胞产生自噬,LKB1/AMPK/mTOR信号通路可能涉及自噬的诱导。本研究为苦参碱治疗食管癌提供一定的理论基础,苦参碱可能成为未来临床辅助治疗食管癌的新措施,但苦参碱诱发自噬的具体机制有待深入探究。
