温光敏两系杂交小麦杂交种纯度的表型和标记检测比较
2023-10-13李宏生李绍祥杨忠慧杨家李刘琨熊世安李富乾郭辉杨木军
李宏生 李绍祥 杨忠慧 杨家李 刘琨熊世安 李富乾 郭辉 杨木军
(1 云南省农业科学院粮食作物研究所,650205,云南昆明;2 云南农业大学农学院,650201,云南昆明;3 镇雄县种子管理站,657200,云南昭通)
杂种优势利用是进一步提高作物单产的有效途径之一[1-5]。小麦温光敏两系法具有无需保持系、恢复源广且制种程序简单的优点,已成为我国小麦杂种优势利用的主要途径[6-9]。两系杂交小麦品种在示范推广中表现出丰产、节水、抗旱和耐瘠等优势,尤其在中低产田,增产可达20%以上[10-12]。对杂交种进行纯度鉴定是杂交种生产和应用中必不可少的环节[13]。常用的纯度鉴定方法是田间种植杂交种,抽穗后对植株表型进行检测,该方法鉴定时间长,且准确性易受环境影响[14-16]。近年来,SSR 标记已成功应用于核心种质基因型分析[17-19]、小麦区域试验品系DUS 测试[20-23]以及构建小麦DNA 指纹图谱[24-26]等。基于荧光标记SSR 的毛细管电泳检测法可得到目标DNA 片段的准确大小,具有稳定、准确和高效等特点,已广泛用于大批量品种的鉴定和指纹图谱检测分析[27-29]。
为探索荧光标记SSR 在温光敏两系杂交小麦杂交种纯度检测中应用的可行性,本研究对2 个温光敏两系组合的杂交种采用田间种植表型鉴定和荧光标记SSR 进行了纯度分析,比较2 种方法的准确性,建立快速鉴定杂交种纯度的方法。
1 材料与方法
1.1 试验材料
试验材料为小麦温光敏核不育系K64S、恢复系20Y4-5、组合K64S/20Y4-5 和K64S/MR1238的杂交种,均由云南省农业科学院粮食作物研究所提供;恢复系MR1238 由绵阳市农业科学研究院选育提供。不育系K64S、恢复系20Y4-5、组合K64S/20Y4-5 和K64S/MR1238 的杂交种均为春性品种,在昆明均可常年种植并正常抽穗;2 个杂交种均来自1334m2(2 亩)的小规模制种试验。K64S、20Y4-5 和MR1238 在昆明常年种植的株高分别为60~65cm、75~80cm 和90~95cm,杂交种的株高介于双亲之间。
1.2 试验方法
1.2.1 材料种植 试验材料于2021 年5 月21 日播种于云南省农业科学院昆明嵩明试验基地,该地海拔1920m,春性小麦材料全年均可种植,并可正常抽穗收获。行长1.2m,采用点播,株行距10cm×25cm,每个杂交种播种1500 粒,每20 行种植1 行父本和1 行母本作为表型鉴定对照。
1.2.2 田间表型鉴定 因不育系与恢复系间株高差异明显,植株抽穗扬花后到成熟期,以株高结合穗部性状判断每个单株表型,与不育系相同记为“1”,与恢复系相同记为“2”,不同于双亲的记为“3”(即为杂交种)。
1.2.3 SSR 标记基因型鉴定 基因组DNA 提取:杂交种及其双亲生长到3 叶期,从2 个组合所有杂交种行区各随机选574 个单株(加上2 个亲本共计576 个单株,96 孔PCR 仪刚好运行6 次)挂牌编号、取叶片,同时取对应不育系、恢复系植株叶片,用植物基因组DNA 提取试剂盒[天根生化科技(北京)有限公司]提取待检测样品基因组DNA;用Nanodrop one 检测DNA 浓度,用超纯水将DNA 稀释为10ng/µL 备用。取样的杂交种植株于抽穗后逐株记录表型纯度鉴定结果。
从行业标准《NY/T 3749-2020 普通小麦品种纯度鉴定SSR 分子标记法》推荐的10 对引物中选取8 对引物,筛选父母本间有多态性的引物,引物信息见表1。
荧光PCR 扩增体系10μL,包括基因组DNA 1μL、上、下游引物0.3μL、2×TaqPCR Master Mix 5μL、超纯水补足至10μL。反应程序为95℃预变性5min;95℃变性30s,62℃~52℃退火30s,72℃延伸30s,运行10 个循环;95℃变性30s,52℃退火30s,72℃延伸30s,运行25 个循环;最后72℃延伸20min。然后上机检测,取3μL 荧光PCR 扩增产物,用2%琼脂糖凝胶电泳检测荧光PCR 扩增条带是否正常,并参照标准DNA Marker 将荧光PCR 产物稀释至相同浓度,分别取每个稀释后的荧光PCR 产物1μL 加入7μL 混有4‰Liz 500 内标的去离子甲酰胺,上ABI 3730XL 测序仪进行毛细管电泳检测。
用峰图分析软件GeneMarker 2.0 读取荧光PCR 扩增片段大小。
1.3 纯度鉴定
通过表型鉴定和基因型鉴定分别计算杂交种纯度。计算公式如下。
田间杂交种纯度(%)=表型为“3”的植株数/播种杂交种总株数×100;
分子标记杂交种纯度(%)=父母本杂合带植株数/检测杂交种总株数×100。
1.4 数据处理
采用SPSS 21.0 对数据进行统计分析。
2 结果与分析
2.1 田间表型纯度鉴定
组合K64S/MR1238 和K64S/20Y4-5 的杂交种分别播种1500 粒,各出苗1467 和1448 株。不育系K64S 平均株高62.3cm,变幅为61.2~63.1cm;恢复系MR1238 平均株高88.6cm,变幅为87.8~90.2cm;恢复系20Y4-5 平均株高75.6cm,变幅为74.3~76.9cm;K64S/MR1238 杂交种平均株高74.7cm,变幅为62.5~88.9cm;K64S/20Y4-5 杂交种平均株高69.3cm,变幅为62.4~74.4cm。2 个杂交种与其双亲间株高均差异明显,以株高差异结合穗部性状对2 个杂交种的纯度进行表型鉴定,结果见表2。
K64S/MR1238 的杂交种中伪杂交种17 株,其中8 株为不育系,9 株为恢复系MR1238,纯度为98.84%。
K64S/20Y4-5 的杂交种中伪杂交种30 株,包括23 株自交不育系和7 株恢复系,纯度为97.93%。
2.2 SSR 标记筛选
8 对引物中,3 对引物在恢复系20Y4-5、MR1238与不育系K64S 间表现出多态性(表3,图1),可用于2 个杂交种的纯度鉴定。其中barc164在3 个亲本间分别扩增出211、199 和208bp 片段;gwm161扩增出192、195 和174bp 片段;gwm610在2 个恢复系20Y4-5和MR1238上均分别扩增出189、189bp片段,在不育系K64S 扩增出193bp 片段,仍可用于纯度鉴定,但如果制种中2 个组合相邻种植,该标记不能区分杂交种中混杂的恢复系来源。因此,3 对引物中barc164和gwm161的检测效果更好。
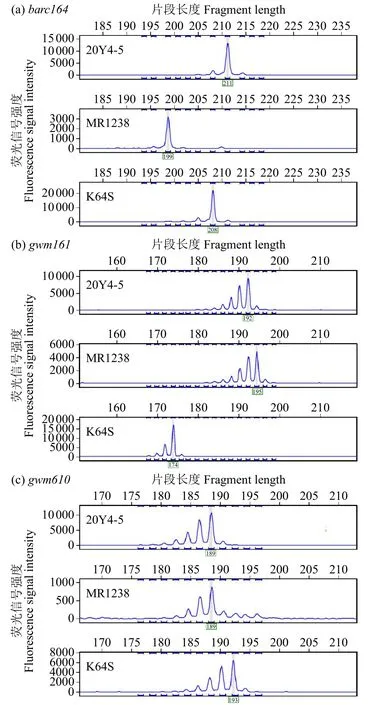
图1 3 个亲本的多态性引物峰图Fig.1 The peak spectrum of polymorphic primers of three parents

表3 亲本间多态性引物筛选Table 3 Polymorphic primer screening between parents
2.3 杂交种单株基因型检测
根据上述SSR 引物筛选结果,选择引物barc164对2 个杂交种进行纯度检测,并与对应表型鉴定结果进行比较(表4)。2 个组合杂交种随机取样的574 株表型鉴定纯度分别为98.43%和97.74%,对应的SSR 标记检测纯度分别为97.73%和97.21%,经卡方检验两种纯度间差异不显著,χ2检测值分别为0.55(P=0.51)和0.62(P=0.49),说明分子标记鉴定与田间表型鉴定都可用于杂交种纯度鉴定,且两者间鉴定结果相近。574 株杂交种田间表型检测纯度分别为98.43%和97.74%,全部1467 株和1448 株杂交种的表型鉴定纯度分别为98.84%和97.93%,经卡方检验两者间纯度差异不显著,χ2检测值分别为0.55(P=0.46)和0.07(P=0.79),说明随机取样的574 株杂交种的表型检测纯度与全部1467 株和1448 株杂交种的表型鉴定纯度相同。
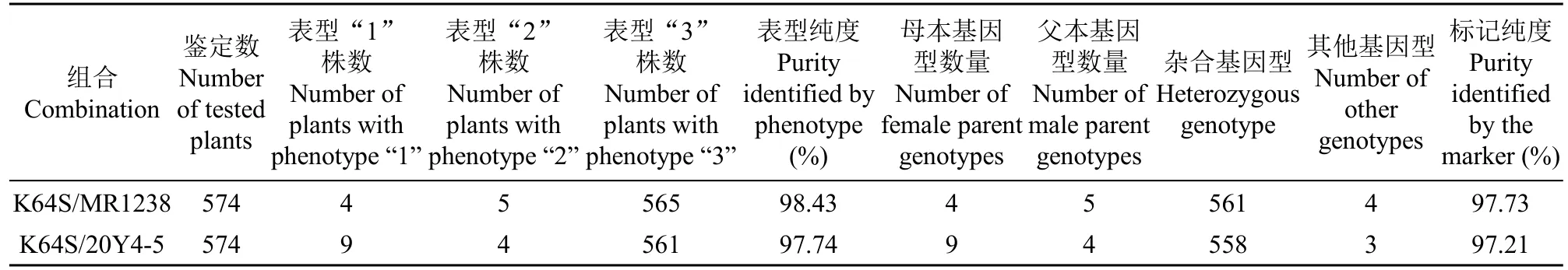
表4 574 株杂交种的表型和标记鉴定纯度比较Table 4 Comparison of the purity of 574 hybrids tested by phenotype and marker identification
标记检测发现,组合K64S/MR1238 的杂交种中有13 株伪杂种,包括4 株不育系、5 株恢复系MR1238 和4 株其他基因型,其杂交种纯度为97.73%(表4)。4 株其他基因型伪杂种,其基因型为224bp/208bp 杂合带型,MR1238 的barc164带型为199bp(表3),4 株伪杂种单株占总鉴定数(574 株)0.70%,可能来自MR1238 中杂株。
组合K64S/20Y4-5 的杂交种中有16 株伪杂种,包括9 株不育系、4 株恢复系20Y4-5 和3 株其他基因型,其杂交种纯度为97.21%。3 株伪杂种基因型为199bp/208bp 杂合带型,20Y4-5 的barc164带型为211bp,MR1238 的barc164带型为199bp,该组合的杂交种出现199bp/208bp 杂合带型的原因可能是制种中与上一组合的父本MR1238 发生“串粉”,因2 个组合试制种时相邻种植,用吹风机辅助授粉时,少量MR1238 花粉越过隔离布与邻田不育系K64S 授粉,导致K64S/20Y4-5 杂交种中出现199bp/208bp 带型的杂交种。
3 讨论
温光敏两系法杂交种的纯度受恢复系纯度、不育系纯度和制种环境温光条件的影响。杂交种纯度直接影响杂种优势的表现,种子纯度每下降1 个百分点可直接导致作物减产约1%[30],而且纯度不达标的杂交种不能进入市场销售。因此,杂交种在种子加工前必须进行纯度检测。
传统的杂交种田间种植表型纯度检测法,需在异地或异季耗时一个生长季节(3~4 个月),如果双亲与杂交种间表型差异较小,还会影响鉴定结果的准确度。SSR 荧光标记毛细管电泳技术能够检测2bp 差异,分辨率较传统银染高[31-34],本研究中也获得相同结果,引物cfa2028 在父本20Y4-5 和母本K64S 间扩增出275bp 和277bp 片段,因此能精准鉴定杂交种在该位点的来源。此外,本研究筛选出3 个标记barc164、gwm161、gwm610可用于优势组合K64S/MR1238 和K64S/20Y4-5 的杂交种纯度检测,其中barc164和gwm161标记较好;不同杂交组合可能有不同的纯度检测分子标记,需另行筛选确定。
分子标记利用种子即可进行基因型鉴定,进行纯度估算。小麦温光敏两系杂交种分子标记检测纯度鲜有研究。为验证分子标记检测的适用性,本研究利用田间苗期取样,表型与基因型相互对应,从而使表型鉴定与标记鉴定为同一材料,降低因材料不同而产生的随机误差。
本研究中2 个组合K64S/MR1238 和K64S/20Y4-5 杂交种的SSR 标记检测纯度(97.73%和97.21%)略低于田间表型鉴定纯度(98.84%和97.93%),与匡猛等[35]和李倩等[36]在棉花和茄子杂交种的纯度检测结果一致,差异原因与2 种方法对伪杂种的区分程度有关。本研究中伪杂种来自小麦温光敏不育系自交结实和父本的机械混杂或生物学混杂,SSR 荧光标记分析发现K64S/20Y4-5 杂交种中有3 株为母本K64S 与邻田父本MR1238 花粉“串粉”产生的杂交种,虽然正季种植时2 个组合的杂交种株高相差约5cm,但在本次夏播田间种植表型鉴定中未能区分出来,加之2 个组合为同一母本,对表型鉴定有干扰,这也显示了分子标记检测纯度的优点。同一品种或组合,在异季、异地种植时其表型与正季种植相比有一定差异,进而影响纯度鉴定结果。
本研究同时用田间种植表型鉴定和SSR 荧光标记2 种方法对2 个温光敏两系杂交小麦杂交种的纯度进行了测定,2 种方法的纯度鉴定结果在2 个组合上都高度一致,无明显差异,证明SSR 荧光标记不仅能准确检测小麦杂交种纯度,还能进一步鉴定伪杂种的来源,为制种中的防杂保纯提供参考依据,因此可以替代田间种植表型鉴定法。同时该检测方法7d 内即可获得纯度结果,为后续种子加工、销售或新组合参加各种试验提供了充足时间。
在利用SSR 荧光标记进行小麦杂交种纯度检测中,检测样本大小无疑对结果的准确性有影响。本研究中用于标记分析的样本数约占田间种植总株数的1/3(574 株),准确鉴定纯度所需最少样本数还需进一步研究确定。
4 结论
通过田间种植表型鉴定和标记基因型鉴定对2 个小麦温光敏两系杂交种纯度进行鉴定,发现分子标记鉴定不仅可区分杂交种中恢复系和不育系混杂,还可以区分其他恢复系花粉“串粉”等造成的伪杂种,且检测周期短,可替代田间种植表型鉴定法。
