桃红四物汤干预后的血小板外泌体对脑缺血再灌注模型大鼠的血管新生作用
2023-10-12戴文涛张亚南侯欣宇彭代银
武 瑞,戴文涛,张亚南,侯欣宇,彭代银,3,韩 岚
(1.安徽中医药大学药学院,安徽 合肥 230012;2.中药复方安徽省重点实验室,安徽 合肥 230012;3.安徽道地中药材品质提升协同创新中心,安徽 合肥 230012)
外泌体(exosomes,Exos)是细胞通向细胞外分泌的直径40~100 nm的囊泡样小体,本质是脂质双分子层[1]。其可由多种细胞分泌产生,如淋巴细胞、树突状细胞、内皮细胞、间充质干细胞和血小板。Exos中包含多种蛋白质、脂类和遗传物质,是细胞间物质传递和信息交流的一种重要方式,在神经再生、血管新生、免疫应答、抗原呈递以及RNA和蛋白质转运等方面具有生物学功能。有研究[2]显示,外泌体还具有穿过血脑屏障的能力。血小板来源的外泌体(platelet-derived exosomes,PLT-Exos)携带多种细胞因子、生长因子、凝血因子和几种类型的RNA,并作为血小板与细胞间相互作用的主要递质而成为研究热点[3-4]。研究表明,PLT-Exos可以通过升高黏附蛋白的表达水平和降低抗黏附因子的水平增强内皮细胞的黏附能力[5-7],且对间充质干细胞的增殖、迁移和分化有积极的影响[8]。PLT-Exos能有效诱导内皮细胞和成纤维细胞的增殖和迁移,从而改善大鼠慢性伤口的血管生成和上皮化[9]。因此,PLT-Exos逐渐成为近年来生物医学领域研究的一大热点,并且在缺血性脑损伤的诊断和治疗方面显示出极大的潜能。
近年来研究[10]发现,脑组织血管密度增高与脑缺血再灌注损伤预后的改善有关[10]。人们开始研究脑缺血再灌注损伤后的血管新生,新生血管使脑缺血后的缺血周围组织脑血流量和脑血流体积增加,从而恢复脑卒中后损伤的神经功能。许多传统中药复方包含多种生物活性成分,可抑制炎症细胞因子释放,抑制血小板和血管内皮细胞中黏附分子的表达,以及抗血栓形成[11-13],具有促进血管新生的作用。桃红四物汤(Taohong Siwu Decoction,THSWD)源自清代吴谦所著的《医宗金鉴》,由桃仁、红花、熟地黄、当归、白芍、川芎6味药组成,是治疗血瘀证的经典方剂。THSWD的临床应用非常广泛,可治疗多种血瘀证疾病。本课题组前期研究[14]表明,THSWD对脑缺血再灌注损伤具有良好的血管生成和神经保护作用,其机制涉及促进脑血管生长,包括调控血小板所释放的另一种膜颗粒——血小板微颗粒(platelet microparticles,PMPs)携带的血管生成相关信号分子和Notch信号通路的激活。本研究旨在观察桃红四物汤调控的血小板源外泌体(THSWD-PLT-Exos)对脑缺血再灌注模型大鼠血管新生的作用。
1 材料
1.1 仪器与试药 CD63抗体、TSG101抗体:江苏Affinity公司;5-溴-2′-脱氧尿嘧啶核苷(5-bromo-2′-deoxyuridine,BrdU)、血管性假血友病因子(von Willebrand factor,vWF)、CD9抗体:北京Bioss公司;4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI):上海Beyotime公司;凝血酶:北京Solarbio公司。
高速冷冻离心机:德国Eppendorf公司;超高速离心机:美国Beckman公司;透射电子显微镜:美国ThermoFisher公司;Nano Sight粒径分析仪:英国Malvern公司;激光多普勒血流仪:瑞典Perimed公司;石蜡包埋机:孝感市亚光医用电子技术有限公司;倒置显微镜:日本Olympus公司。
1.2 动物 SPF级SD大鼠,雄性,体质量170~210 g,购自辽宁长生生物技术股份有限公司[生产许可证号 SCXK(辽)2020-0001],经安徽中医药大学实验动物伦理委员会批准,动物伦理编号: AHUCM-rats-202287,常规饲养。
2 方法
2.1 桃红四物汤的制备 按质量比4∶3∶3∶2∶3∶2称取熟地黄、当归、白芍、川芎、桃仁、红花6味药材,加入药物总质量10倍量的75%乙醇冷凝回流提取2 h,过滤并保留滤液,滤渣加入药物原总质量8倍量的75%乙醇冷凝回流提取2 h后再过滤,将两次滤液合并,旋转蒸发浓缩成1.8 g/mL的浓缩液,-20 ℃保存备用。
2.2 PLT-Exos的制备 取大鼠30只,分成THSWD组和正常对照组,每组15只,THSWD组按18 g/kg灌胃给予THSWD,每日1次,连续7 d;正常对照组大鼠以等量生理盐水灌胃,每日1次,连续7 d。以超高速差速离心法[15]提取EXOS:首先采用腹主动脉取血法分别收集各组大鼠全血样品,以9∶1的比例加入2.5%枸橼酸钠抗凝溶液中;200g离心12 min,上清为富血小板血浆。吸取上清至新离心管;900 g离心12 min,沉淀即为血小板;吸弃上清,2 mL Tyrodes缓冲液37 ℃重悬血小板。使用凝血酶(1 U/mL)体外处理血小板,37 ℃水浴孵育1 h,促进血小板激活和凝集。反应之后,以2 500g离心15 min,上清为血小板分泌的细胞外颗粒。将上清移至超速离心管,加PBS至7~8 mL,其余离心管用水配平。4 ℃、20 000g离心40 min,沉淀为血小板释放的微囊泡,上清为富Exos溶液。将上清移至新超速离心管,配平后在120 000g、4 ℃条件下离心70 min,沉淀为Exos。弃去上清后,用100 μL PBS重悬Exos。
2.3 大鼠脑缺血再灌注模型的制备 参照线栓法[16]制备大鼠脑缺血再灌注损伤模型。假手术组不作插线处理,其余手术步骤同模型组。24 h后进行神经功能学评分,验证动物模型是否复制成功。
2.4 分组与给药 将复制成功的脑缺血再灌注模型大鼠分为假手术组、模型组、THSWD-PLT-Exos组、PLT-Exos组、对照组,每组3只。THSWD-PLT-Exos组通过尾静脉注射0.5 mg/kg的THSWD-PLT-Exos;PLT-Exos组通过尾静脉注射0.5 mg/kg的PLT-Exos;此两组共注射3次,以星期一、星期三、星期五为时间点。模型组与假手术组在同时间点注射等量生理盐水,对照组通过尾静脉注射25 mg/kg的丁苯酞注射液[17]。
2.5 观察指标及方法
2.5.1 透射电子显微镜观察PLT-Exos形态 取15 μL的样本于铜网上静置1 min。使用滤纸将铜网上的Exos样本吸干后,滴加15 μL的2%醋酸双氧铀染色液室温染色1 min。使用滤纸吸干液体,将染色完成的样本置于白炽灯下照射10 min,常温干燥,透射电子显微镜下观察拍照,保存图片。
2.5.2 Western blot法检测PLT-Exos标志蛋白的表达水平 用50 μL蛋白裂解液重悬Exos,冰上涡旋裂解30 min;12 000 r/min、4 ℃离心15 min,将上清液吸取至干净的EP管。按照BCA试剂盒说明书测定蛋白质浓度。配制SDS-PAGE,电泳,转膜,孵育一抗CD9(1∶1 000)、CD63(1∶1 000)、TSG101(1∶1 000)过夜,孵育二抗,显影,成像。以提取的血小板作为对照。
2.5.3 纳米粒径分析仪检测PLT-Exos粒径 使用NanoSight N300检测所提取PLT-Exos的粒径。实验前先以去离子水清洗样本池。再次以PBS清洗样本池,上机检测前使用PBS稀释Exos至合适的浓度,将稀释好的Exos样本注射到样品室中,每个样本检测重复3次。
2.5.4 激光多普勒血流仪检测大鼠脑血流量 采用激光多普勒检测大鼠脑血流量的改变。大鼠麻醉后,采用手术刀于大鼠脑部同侧囟门后中线外5 mm位置切开,清理颅骨表面筋膜,将探头固定到颅骨上,连续检测至基线稳定,截取5 min稳定的基线作为参考数据,单位为灌注单位(perfusion unit,PU)。
2.5.5 苏木精-伊红(hematoxylin-eosin ,HE)染色法观察大鼠脑海马组织的病理变化 将大鼠麻醉后仰卧位固定于操作台上,打开胸腔,使用0.9%生理盐水灌注心脏10 min 后,4%多聚甲醛水溶液灌注心脏15~20 min,取出脑组织,浸泡于4%多聚甲醛水溶液,于4 ℃保存,石蜡包埋切片。
2.5.6 免疫荧光染色法观察大鼠脑BrdU和vWF的表达水平 模型复制后第5天,分别于8:00、10:00、12:00和14:00对大鼠腹膜内注射50 mg/kg Brdll。于模型复制后第7天,将大鼠大脑取出。切片用一级抗体(BrdU,1∶100;vWF,1∶300)孵育,然后用荧光染料标记的二级抗体孵育。最后,在室温下用DAPI染色细胞核5 min,封片拍照。
3 结果
3.1 透射电子显微镜下PLT-Exos的形态 透射电子显微镜下PLT-Exos的形态特征为茶托状或杯状结构,直径在100 nm以内,符合Exos形态要求。见图1。
3.2 Western blot法检测Exos标志蛋白 Western blot法检测Exos标志蛋白CD63、CD9和TSG101,发现CD63、CD9和TSG101在所提取的样本中呈阳性表达,符合Exos表征蛋白的表达,表明本实验所提取的样本为PLT-Exos。见图1。
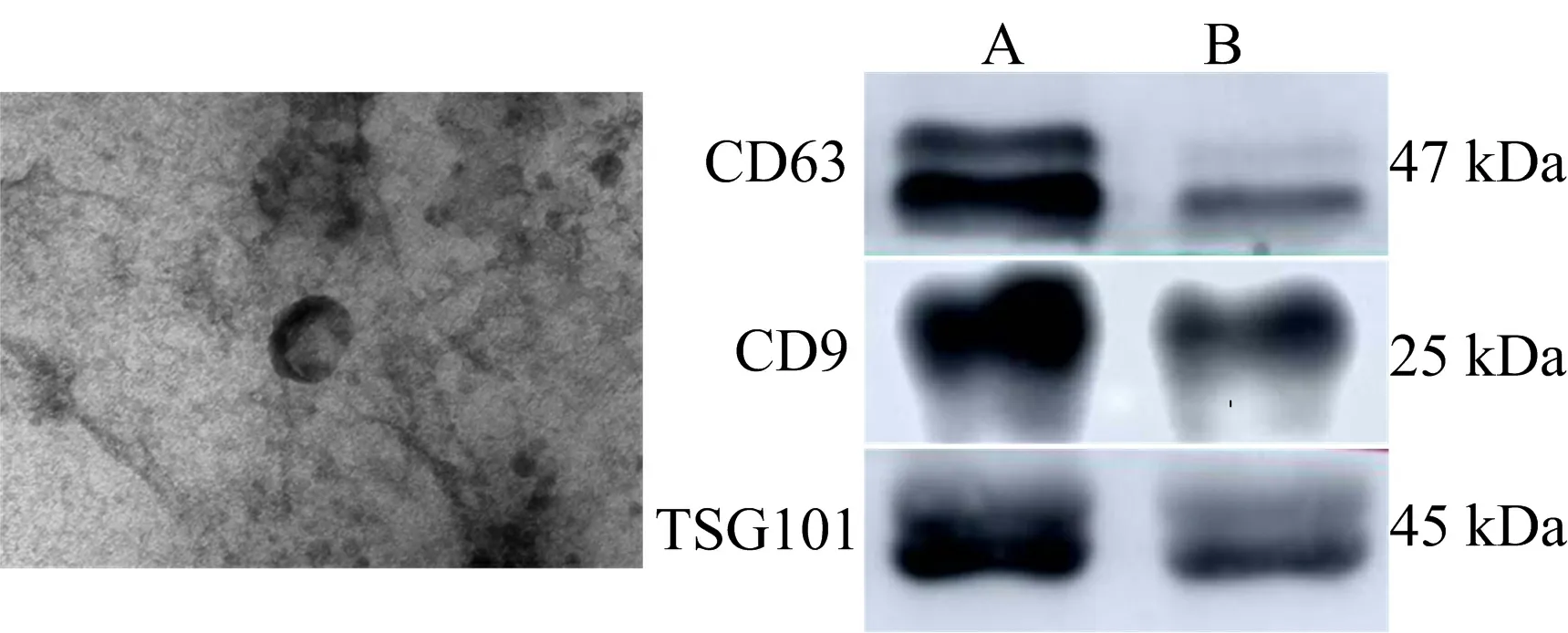
注:A.PLT-Exos;B.血小板
3.3 纳米粒径分析仪检测PLT-Exos的粒径 纳米粒径分析检测结果显示,外泌体样本的实测平均粒径为90.5 nm,提示本实验超速离心所提取的PLT-Exos的样本粒径符合30~100 nm的分布范围。见图2。

图2 纳米粒径分析仪实时观察PLT-Exos(A,箭头标记为
3.4 大鼠缺血侧脑血流量比较 与假手术组比较,模型组大鼠的脑血流量明显减少;与模型组比较,THSWD-PLT-Exos组、PLT-Exos组及对照组大鼠的脑血流量明显增加。见图3。

注:A.假手术组;B.模型组;C.THSWD-PLT-Exos组;D.PLT-Exos组;E.对照组;与假手术组比较,*P<0.05;与模型组比较,#P<0.05
3.5 各组大鼠脑海马组织病理变化 假手术组大鼠海马区的脑组织结构完整,神经细胞形态正常、边界清晰、排列规则,细胞核完整,核膜连续,细胞质饱满;模型组大鼠海马区脑组织结构比较疏松,神经细胞损伤比较严重、边界不清、排列不规则,细胞核固缩,核膜不完整,细胞周围间隙增大,胞质中可见空泡;THSWD-PLT-Exos组、PLT-Exos组大鼠海马组织均呈轻度缺血性改变,损伤程度较模型组轻,细胞状态较好,核大而圆,核仁较清晰,各项病理改变均有明显改善;对照组大鼠海马组织损伤情况较轻,细胞核皱缩和间质水肿的情况较模型组有较大减轻。见图4。


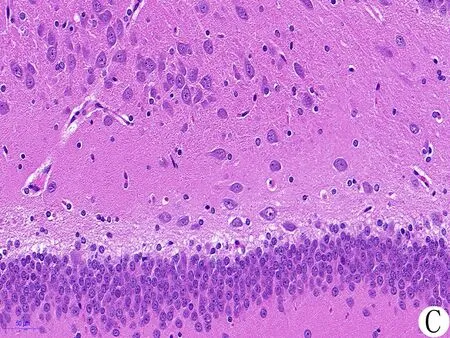

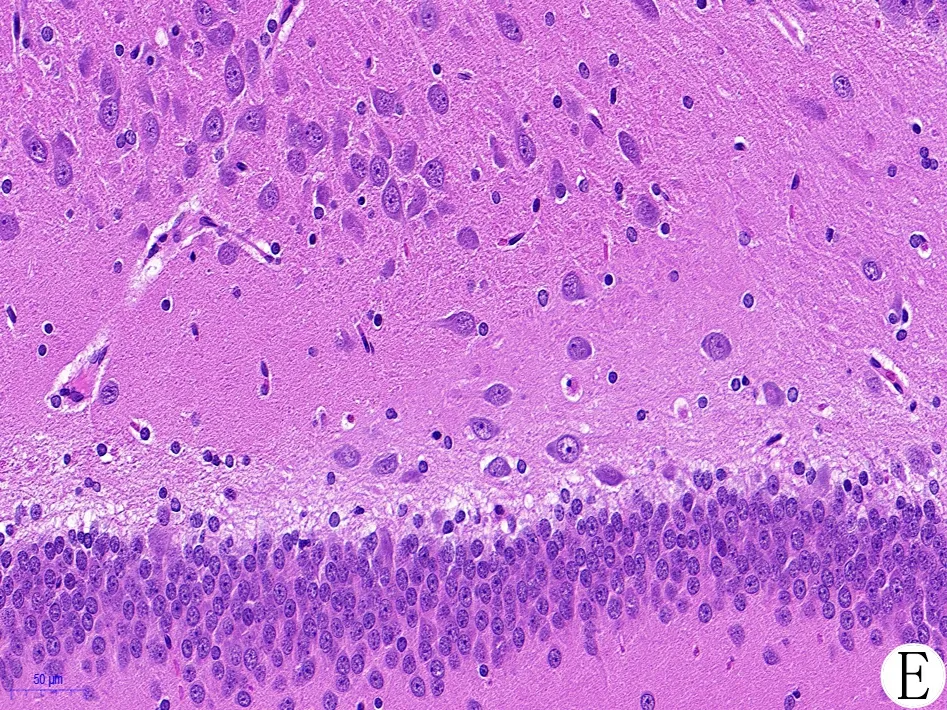
注:A.假手术组;B.模型组;C.THSWD-PLT-Exos组;D.PLT-Exos组;E.对照组
3.6 各组大鼠脑组织BrdU和vWF免疫荧光表达水平比较 免疫荧光染色结果显示,与假手术组比较,模型组脑组织中BrdU和vWF的表达水平明显增高(P<0.05);与模型组比较,THSWD-PLT-Exos组和PLT-Exos组脑组织中BrdU和vWF的表达水平明显升高(P<0.05)。见图5。

注:免疫荧光图(左图);BrdU/vWF荧光信号的定量(右图);A.假手术组;B.模型组;C.THSWD-PLT-Exos组;D.PLT-Exos组;E.对照组;与假手术组比较,*P<0.05;与模型组比较,#P<0.05
4 讨论
大量研究表明,脑缺血所导致的脑损伤是一个复杂的病理过程,发病早期以大量氧自由基的产生、脑水肿及兴奋性氨基酸毒性为主;中期以炎症、神经元凋亡为主;后期以神经再生、血管新生和胶质细胞增殖等脑重构表现为主。而脑血管新生为神经元重构提供了关键的神经血管底物,能及时恢复局部脑供血,对损伤后功能恢复非常关键[18]。缺血性脑卒中血管的新生在很大程度上依赖于血流量的恢复。新形成的血管将增加脑血流量,从而增加氧和营养物,使脑内的能量状态趋于稳定,脑组织得以生存。因此,血管新生对脑损伤后的恢复起着重要作用。
对Exos进行研究,首先应提取高纯度Exos并对其进行鉴定。常见的Exos分离方法主要有5种,包括超速差速离心法、超滤法、沉淀法、免疫亲和法和微流体分离法。目前,大多数研究者选用超速差速离心法分离Exos。此方法通过逐步递增的离心力和离心时间,以去除细胞、细胞碎片和较大的细胞外囊泡,从而获得纯度较高的Exos。国际细胞外囊泡学会在指南中给出了鉴定Exos的方法,即采用NTA、透射电子显微镜和标志蛋白的检测进行鉴定[19]。本研究首先分离出经THSWD灌胃1周的大鼠全血中的血小板,再通过逐步离心提取PLT-Exos,经过上述NTA和透射电子显微镜观察,选取CD9、CD63、TSG101标志蛋白对Exos进行鉴定,确定PLT-Exos已被成功提取分离。
相关研究[20]表明,THSWD具有干预血小板活化的抗凝祛瘀作用,包括抑制大鼠血小板聚集,降低血瘀大鼠血浆中血栓素B2(thromboxane B2,TXB2)、vWF等因子水平,调节血小板释放血管内皮生长因子(vascular endothelial cell growth factor, VEGF)及内皮抑素。PLT-Exos是从活化的血小板上脱落的脂膜,具有与血小板类似的生物功能[21],可将其生物内容物传递到受体细胞,参与血小板和内皮细胞的活化及凝血的调节[22]。有研究表明,PLT-Exos具有抗凝的作用,可以在体外抑制血小板聚集,并减少血小板与体内受损血管中胶原的黏附。PLT-Exos降低了血小板的反应性,抑制血管血栓的形成。如在动脉粥样硬化中,活化的PLT-Exos可显著降低血小板Ⅱ型清道夫受体CD36的表达水平,从而减少血小板聚集,抑制血栓形成[23]。
Exos具有的生物特点优势,可以使其可穿过血脑屏障。研究[24]表明,Exos可作为载体将药物传递至靶器官,一些中药可以干预某些细胞或其所释放的Exos,影响其中携带的内容物如蛋白、miRNA,从而达到治疗效果。如通过补阳还五汤调控后的间充质干细胞分泌的Exos可增加脑缺血大鼠脑血管的生成,其作用可能是补阳还五汤上调了间充质干细胞Exos中血管生成相关miRNA和血管内皮生长因子的表达水平。经黄芩苷干预的大鼠脑微血管内皮细胞Exos,对血脑屏障中紧密连接蛋白具有上调作用[25]。课题组前期研究已验证了THSWD可调节多种血小板微颗粒中携带的血管生成相关蛋白,包括生长因子、基质金属蛋白酶、趋化因子等[14]。因此,本研究观察THSWD-PLT-Exos对缺血大鼠脑的作用,发现THSWD-PLT-Exos对大鼠脑血管新生的作用优于PLT-Exos,推断THSWD-PLT-Exos存在,并且THSWD对PLT-Exos具有一定的调控作用,但其机制需进一步研究。
血管生成在脑缺血损伤后被激活,目前普遍认为血管新生改善了缺血区的血液供应[26]。临床常依据脑血流灌注量判断缺血性脑卒中患者的病情[27]。本研究结果显示,经THSWD-PLT-Exos处理的大鼠脑血流量明显上升。病理切片结果显示,THSWD-PLT-Exos组大鼠海马区细胞形态较完整、排列整齐,核仁和胞浆界限清晰,病变程度有明显改善。免疫荧光染色中,BrdU用于标记最近增殖的细胞,vWF由内皮细胞和巨核细胞释放,是一种大型多聚体糖蛋白,通过涉及VEGFR-2 信号传导和血管生成素-2的多种交叉通路调节血管生成[28],因此,vWF被认为是内皮细胞损伤的标志。本研究发现,两组Exos组中,脑组织中BrdU和vWF的表达水平较高。这表明THSWD-PLT-Exos可以促进新生细胞的增殖,并增加损伤后的血管内皮细胞,说明其具有神经和血管生成的作用。
前期研究结果表明,THSWD对脑缺血再灌注损伤具有良好的血管生成和神经保护作用,包括促进PMPs所携带血管生成相关信号分子的调节和Notch信号通路的激活。本研究发现,THSWD作为治疗缺血性脑卒中的药物,经其干预后提取的PLT-Exos也具有一定的血管生成和神经保护作用,其原因可能是调控了PLT-Exos中所携带的血管生成相关蛋白。今后将对其所携带的相关蛋白的表达进一步研究,以探讨其作用机制。
