基于生物信息学、网络药理学及分子对接探讨人参调控肺腺癌的铁死亡机制
2023-10-12汪雪莹杨银莉潘战宇姜战胜
汪雪莹,杨银莉,潘战宇,姜战胜※
(1.天津中医药大学,天津 301617;2.天津医科大学肿瘤医院国家肿瘤临床医学研究中心天津市“肿瘤防治”重点实验室天津市恶性肿瘤临床医学研究中心中西医结合科,天津 300060)
肺癌的发病率和死亡率均居世界首位[1],主要包括小细胞肺癌(Small cell lung cancer,SCLC)和非小细胞肺癌(Non-small cell lung cancer,NSCLC)。NSCLC患者约占所有肺癌患者的80%,其中肺腺癌(Lung adenocarcinoma,LUAD)是NSCLC 的主要组织学亚型,占所有肺癌病例的40%以上[2]。
铁死亡是一种不同于细胞凋亡、焦亡和坏死的程序性细胞死亡,这一过程特点是依赖铁离子及活性氧诱导脂质过氧化物堆积[3]。有证据表明,铁死亡在癌症尤其是肺癌的进展中起着至关重要的作用,特别是在肺癌中常常出现铁死亡被抑制的现象[4]。肺部组织相对于其他组织长期处于高氧浓度环境中,这种特殊环境使得肺部肿瘤需要承受很大的氧化压力,肺癌细胞为了避免在转化过程中出现被易化和强化的铁死亡,采取了多种措施提高铁死亡的诱导阈值,从而导致铁死亡受抑,进而促进肺癌的发生和发展[5]。
人参为五加科植物,具有大补元气,复脉固脱,补脾益肺,生津安神的功效。有大量研究证实,人参及其主要活性成分在治疗肺癌的发生和发展中发挥重要作用[6-8]。有研究显示,红参作为人参蒸熟、晒干或烘干后的产物,其主要成分红参多糖可以显著抑制肺癌或乳腺癌细胞的增殖并加速诱导铁死亡,使乳酸脱氢酶释放、脂质过氧化物积累[9]。这些研究表明人参、铁死亡与肺癌之间存在联系,然而迄今为止,人参调控铁死亡治疗肺癌尤其是LUAD的机制尚不十分明确。因此,本研究拟通过识别人参调控LUAD的铁死亡基因并构建更准确的预后模型,阐述人参调控铁死亡治疗LUAD 可能的作用机制,以期为后续研究提供理论依据和参考。
1 材料与方法
1.1 人参活性成分的获取和靶点预测
在TCMSP 数据库(https://tcmsp-e.com/)中以生物口服利用度(Oral bioavailability,OB)≥30%和类药性(Drug-likeness,DL)≥0.18 为筛选条件;在ETCM数据库(http://www.tcmip.cn/ETCM/index.php/Home/)中以score ≥0.8 为筛选条件;在Batman-TCM 数据库(http://bionet.ncpsb.org.cn/batman-tcm/)中以P <0.05、score ≥10 为筛选条件,分别下载人参活性成分及其作用靶基因,并通过Cytoscape v3.9.0 软件对人参活性成分及相关靶基因进行分析,绘制人参活性成分-靶点网络图,人参活性成分度值图。
1.2 鉴定人参治疗LUAD的铁死亡基因
从TCGA数据库(https://portal.gdc.cancer.gov/)下载了574 名LUAD 患者的RNA 测序(RNA-seq)FPKM数据集和临床信息,运行R软件“edgeR、gplots”程序包,以Fold change >1、P <0.05 为过滤条件对LUAD 患者的RNA-seq 基因进行差异基因筛选。从FerrDb 数据库(http://www.datjar.com:40013/bt2104/)下载铁死亡相关基因,并通过Draw Veen Contents 在线工具筛选出人参作用靶基因、铁死亡基因和LUAD差异基因的交集基因,并对交集基因的差异表达进行可视化。
1.3 GO功能分析与KEGG通路注释分析
通过David 数据库对交集基因分别进行基因本体(GO)功能分析、京都基因与基因组百科全书(KEGG)通路注释分析,以P <0.05 为筛选条件,进行可视化。
1.4 构建预后风险模型并筛选关键铁死亡基因
将交集基因相关的TCGA 数据集与患者临床信息合并,去除正常组织数据和脱落数据后,使用R 软件“survival”程序包进行单因素Cox分析,以P<0.05为条件筛选交集基因中与总体生存期(OS)有关的具有预后价值的基因。为了进一步筛选人参治疗LUAD的关键铁死亡基因,在相关预后基因的基础上,采用R软件“glmnet、survival”程序包进行Lasso回归分析,构建预后风险模型,筛选出关键铁死亡基因,并进行基因的相关性分析。
1.5 评估预后风险模型
通过以下公式计算风险评分:Riskscore=coef(关键铁死亡基因1)expr(关键铁死亡基因1)+coef(关键铁死亡基因2)expr(关键铁死亡基因2)+…+coef(关键铁死亡基因n)expr(关键铁死亡基因n)。根据风险评分中位数将患者划分为“高风险”和“低风险”组,构建风险曲线和散点图,观察风险评分对患者死亡与存活状态的影响,利用R 软件“survival”包对两组患者进行生存分析,通过建立时间依赖ROC 曲线以评估预后模型的可靠程度,应用R软件“ggplot2、Rtsne”程序包主成分分析(PCA)和分布式随机邻居嵌入(t-SNE)分析,以证明该模型的分组能力。
1.6 分子对接
通过Pubchem 数据库(https://pubchem.ncbi.nlm.nih.gov/)下载人参活性成分的化学结构,PDB 数据库(https://www.rcsb.org/)下载关键铁基因的靶点蛋白,分别将其导入AutoDock Vina 进行分子对接并预测分子与靶点结合能。
2 结果与分析
2.1 人参活性成分和作用靶点的筛选结果
从中药数据库中共筛选出人参活性成分77 个和人参作用靶点1 676 个(图1A);人参活性成分,根据度值排序结果,见图1B。
图1 人参活性成分-靶点分析图Fig.1 Ginseng active ingredient-target analysis diagram
2.2 人参治疗LUAD的铁死亡基因鉴定结果
从TCGA 数据库中共筛选出3 300 个LUAD 差异基因,其中包括1 166 个上调基因,2 134 个下调基因;通过对中药数据库中筛选出1 676 个人参作用靶点、FerrDb数据库中筛选出388个铁死亡基因和TCGA数据库中筛选出的3 300 个LUAD 差异基因,Venn分析后发现29 个人参治疗LUAD 的铁死亡基因(图2A),其中包括9个上调基因,20个下调基因,见图2B。
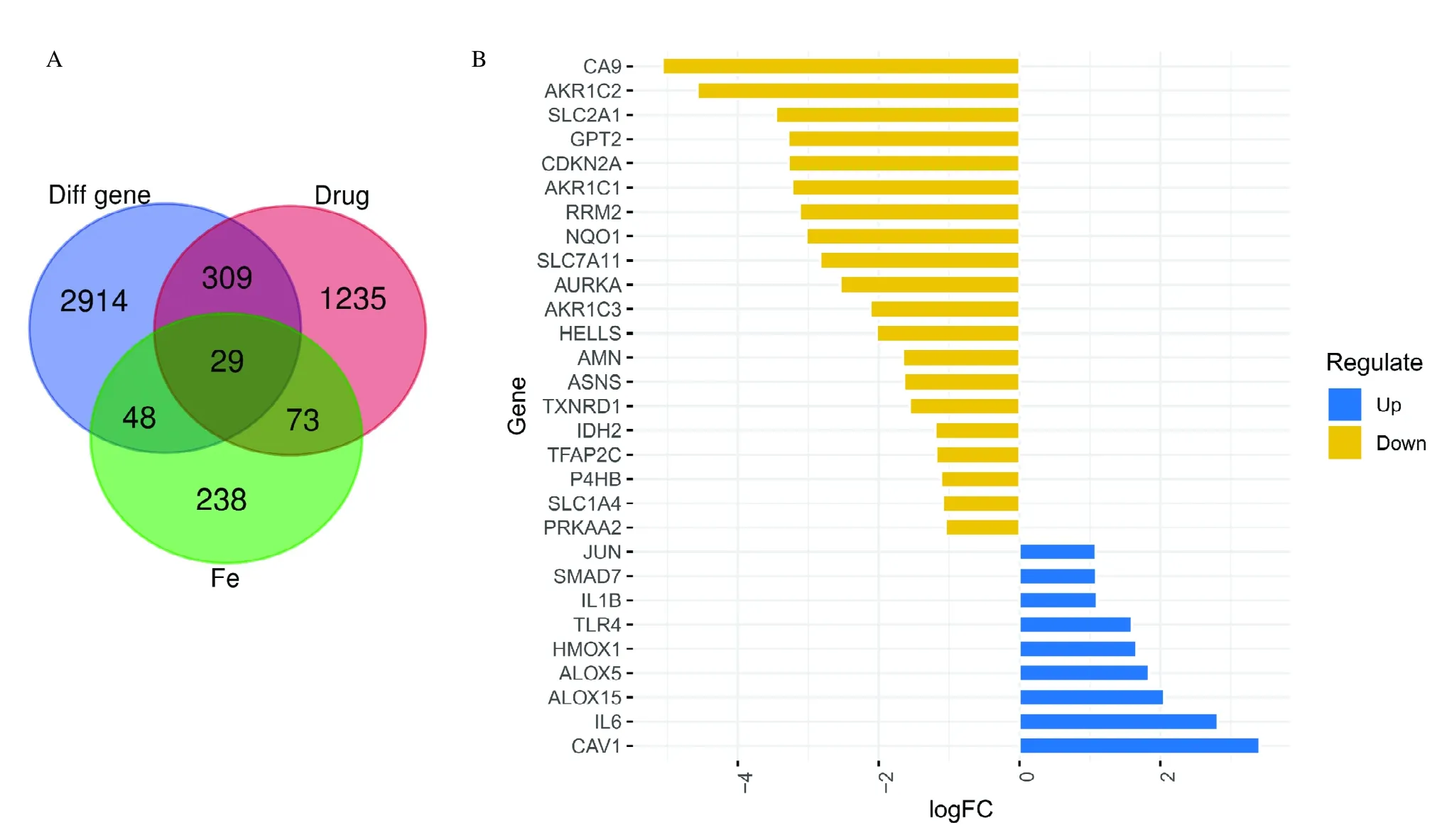
图2 人参治疗LUAD 的铁死亡基因的鉴定结果图Fig.2 Identification results of ferroptosis gene of Ginseng in treating LUAD
2.3 富集分析结果
针对29 个交集靶点通过GO 功能分析可知,在P <0.05水平筛选出生物过程(Biological process,BP)条目59 个,其中涉及RNA 聚合酶II 启动子转录的正调控、基因表达的正调控和凋亡过程的负调控等;细胞组分(Cellular component,CC)条目8 个,其中涉及基底外侧膜、细胞膜穴样凹陷和黑素体等;分子功能(Molecular function,MF)条目14 个,其中涉及蛋白质结合、蛋白异源二聚化活性和酶结合等;根据基因数进行排序,分别将前10 位的条目进行可视化,见图3A。
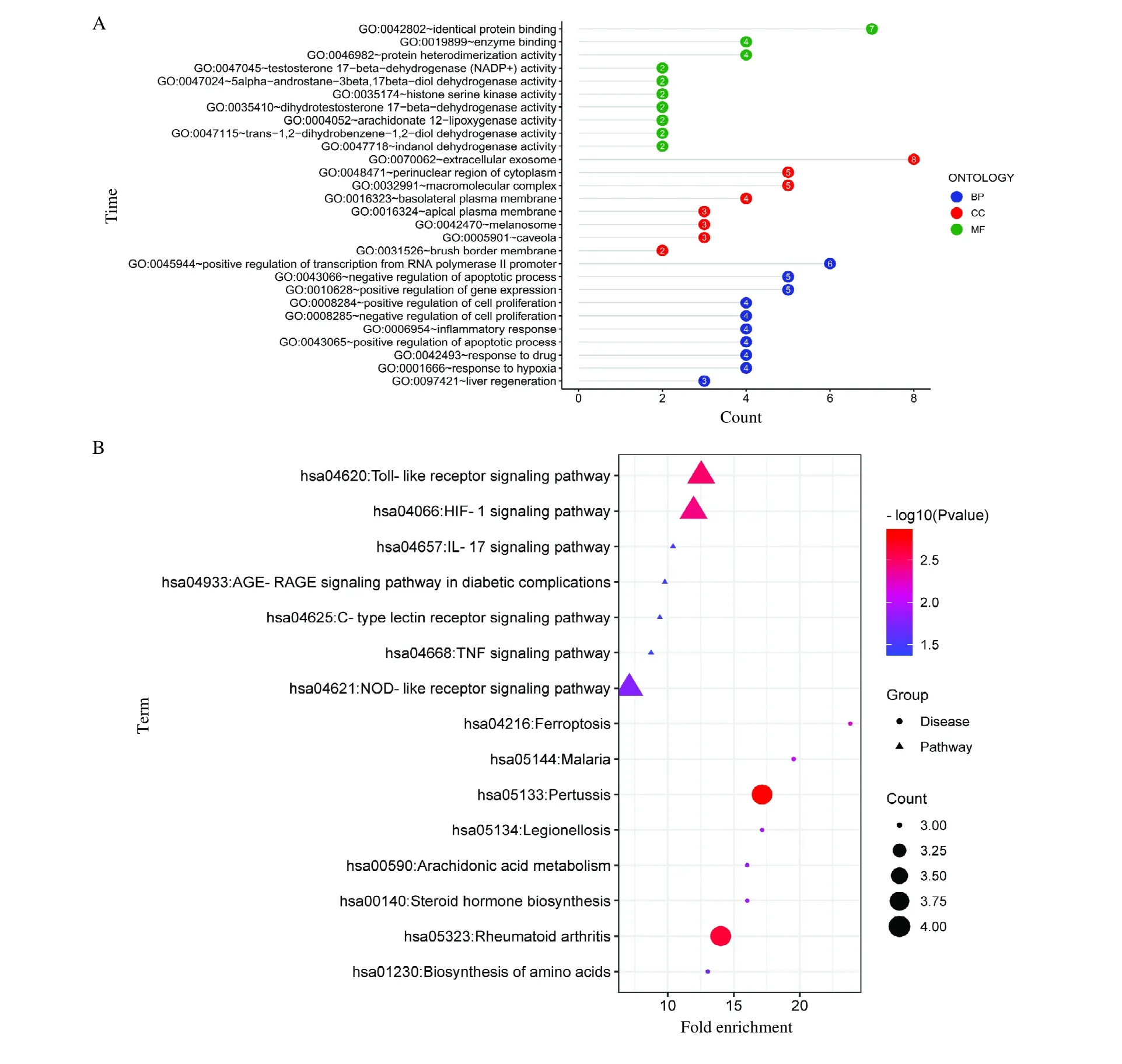
图3 富集分析结果图Fig.3 Enrichment analysis results
通过KEGG 分析获得32 条信号通路,分别对前8 条疾病途径和前7 条信号通路进行可视化(图3B),这些信号通路多与免疫炎症和低氧相关,提示人参治疗LUAD 的铁基因可能通过这些通路发挥作用。
2.4 相关预后基因筛选结果
去除正常组织数据和脱落数据后,剩余499 列LUAD 患者信息。对余下499 列患者进行分析,根据单因素Cox 回归分析筛选出6 个影响总体生存期(OS)预后的基因:RRM2、AURKA、SLC2A1、TXNRD1、TLR4 和CAV1。在预后基因的基础上进行Lasso 回归分析构建预后风险模型,发现由SLC2A1、RRM2、CAV1、TXNRD1 和TLR4 组成的预后风险模型最为稳定(图4A),这5 个基因可能是人参调节LUAD 的关键铁死亡基因。其中,TLR4 是LUAD 预后保护因素,SLC2A1、RRM2、CAV1 和TXNRD1 可能是LUAD 预后危险因素(图4B)。基因之间相关性分析发现TLR4 与SLC2A1、RRM2、CAV1 和TXNRD1呈负相关;SLC2A1、RRM2、CAV1 和TXNRD1 之间呈正相关,见图4C。
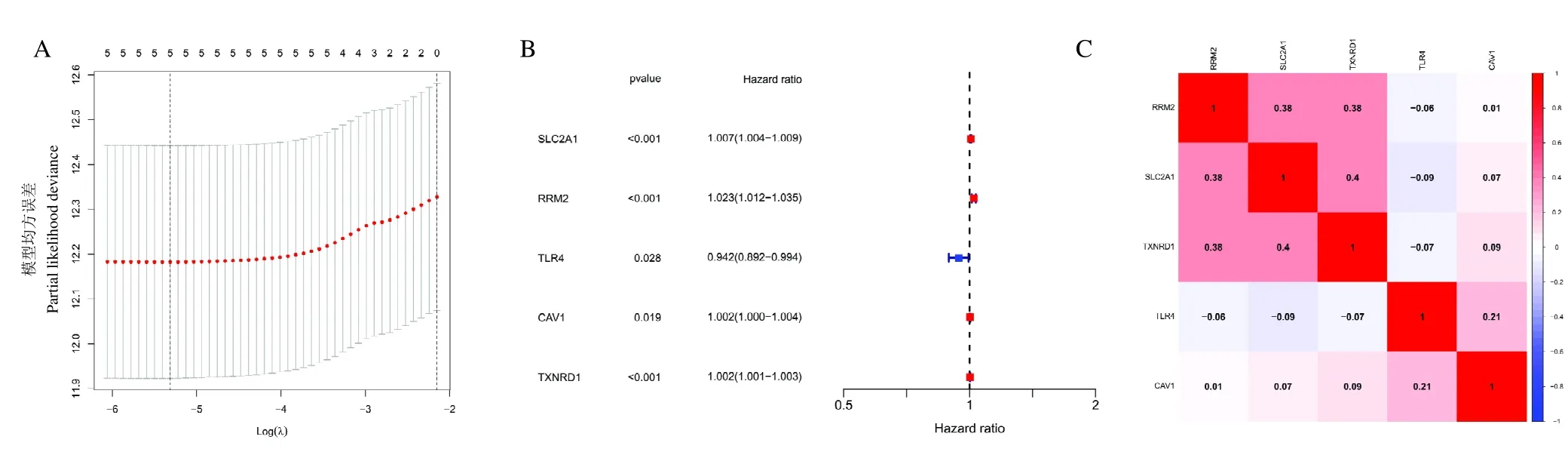
图4 风险预后模型和关键铁死亡基因分析结果图Fig.4 Risk prognostic model and analysis results of key ferroptosis genes
2.5 铁死亡基因预后模型的评估结果
根据风险评分中位值,将样本分为高风险组(n=249 例)和低风险组(n=250 例),高风险组患者死亡人数高于低风险组(图5A 和5B)。KM 生存曲线分析表明,远期低风险组的生存时间长于高风险组,并具有统计学意义(图5C);ROC 曲线(AUC=0.676)证明该预后模型具有可靠性(图5D);PCA 和t-SNE 虽有待优化,但基本证明该模型能将高风险组和低风险组样本区分(图5E-F)。经评估证明RRM2、SLC2A1、TXNRD1、TLR4 和CAV1 这5 个关键铁死亡基因对LUAD 的预后影响显著且模型稳定可靠。
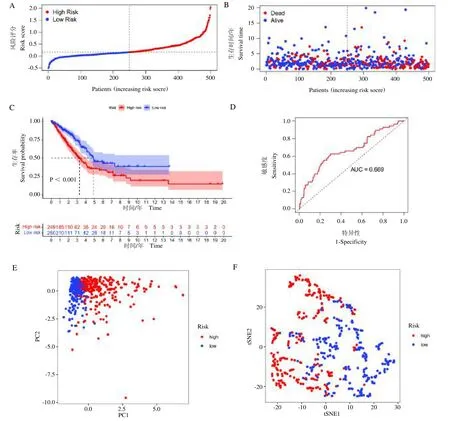
图5 风险预后模型评估结果Fig.5 Risk prognostic model assessment results
2.6 分子对接结果
大多数中药的皂苷、多糖和挥发油成分对肺癌具有一定的干预作用,皂苷类成分和多糖类成分主要通过促进肿瘤细胞凋亡从而抑制肿瘤生长[10]。人参化学成分有皂苷、有机酸、挥发油和多糖等[11]。根据人参化学成分分类,度值排名前3 位的活性成分作为配体,5个关键铁死亡基因作为受体,进行分子对接。一般认为,结合能小于0 说明配体与受体可以自发结合,结合能≤ 20.92 kJ/mol 表示具有较好的结合性,同时所需的能量越少,代表配体与受体的相互作用的亲和力越强,构象越稳定[12,13]。通过AutoDock Vina 分析,发现人参的重要活性成分与关键铁死亡基因均能自发结合,见表1。
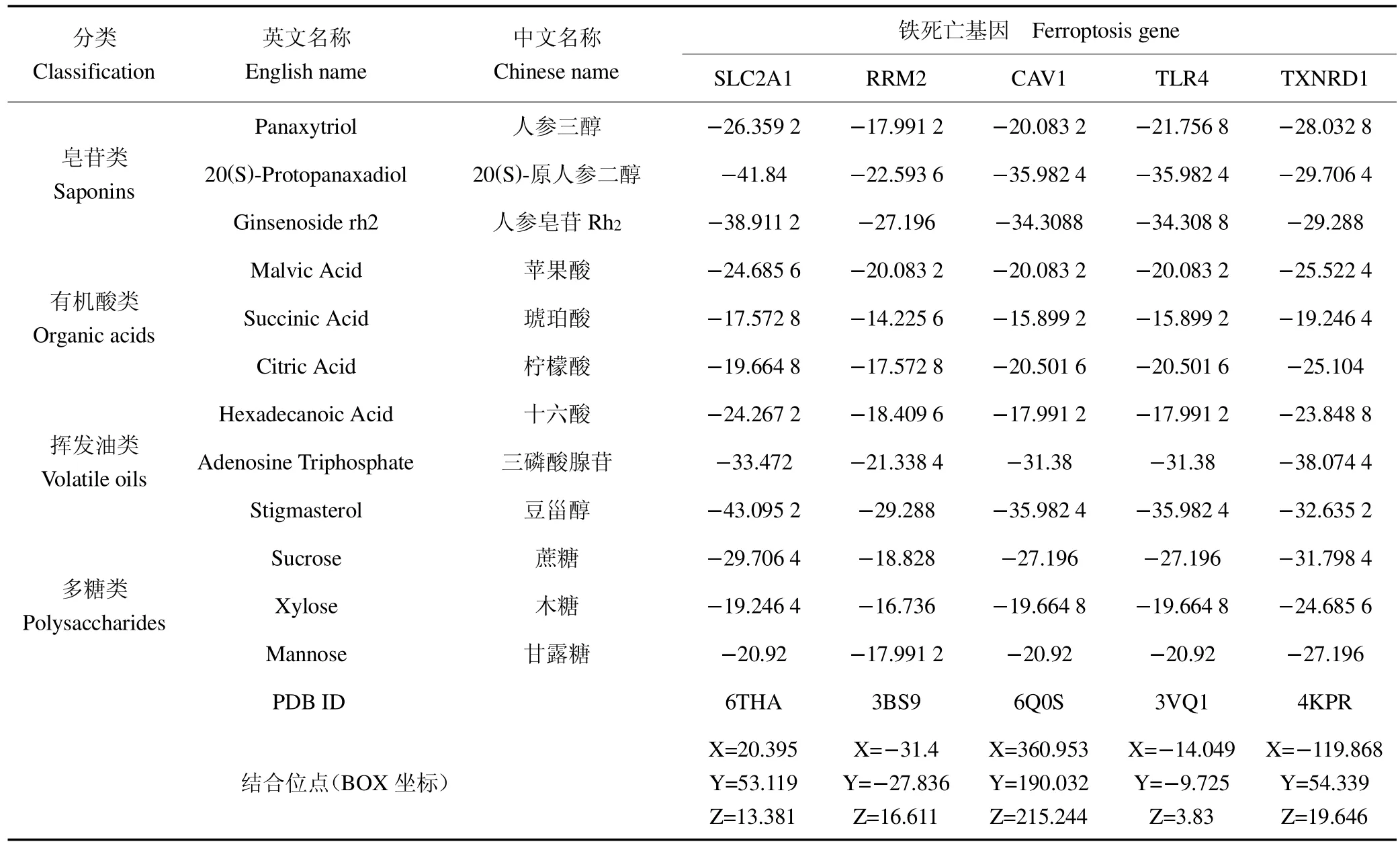
表1 人参主要活性成分与关键铁死亡基因结合能量表Table 1 Energy table of main active components of ginseng combined with ferroptosis genes 单位:kJ/mol
3 讨论
本研究通过对人参作用靶点、铁死亡基因和LUAD 差异基因进行Venn 分析发现29 个人参治疗LUAD 的铁死亡基因。通过KEGG 信号通路分析可知,Toll 样受体信号通路、HIF-1 信号通路等可能是人参调控铁死亡基因治疗LUAD的主要途径。基于Lasso回归分析构建了一个预后模型,分别由5 个铁死亡相关基因(SLC2A1、RRM2、CAV1、TXNRD1 和TLR4)组成,根据风险评分中位值将样本分为高风险组和低风险组,KM 生存曲线和ROC 曲线证明这5 个关键铁死亡基因对LUAD 的预后影响显著且模型具有可靠性,PCA 和t-SNE 证明该模型基本能将高风险组和低风险组样本区分,但后续需要基础试验的进一步优化及验证。分子对接结果显示,人参的主要活性成分与5 个铁死亡关键基因均能自发结合。由此推断这5 个铁死亡关键基因是人参通过调节铁死亡途径治疗LUAD 的关键靶点。
铁死亡在肺癌的发生和发展中起双重作用,一方面,药物可以通过半胱氨酸耗竭或抑制GPX4 来诱导铁死亡,从而遏制NSCLC 细胞的生长;另一方面,铁死亡可以引起免疫抑制,通过介导炎症反应促使NSCLC肿瘤生长[14]。人参是一种天然抗氧化剂,抗氧化剂的发现与天然存在的非酶抗氧化剂有关,后者形成完整的防御系统以防止体内氧化应激,而氧化应激被证明与铁死亡相关[15,16]。双氢青蒿素作为天然抗氧化剂青蒿的主要提取物,已经被证实与Ce6 光动力疗法联合应用可以抑制GPX4,升高活性氧,诱发铁死亡,抑制肺癌细胞的活力[17,18],为人参调控铁死亡治疗LUAD的机制提供了参考依据。
有研究发现,炎症在肿瘤进展中有着不可忽视的作用,Toll 样受体介导的疾病中多伴随着炎症反应的发生[19]。Toll样受体4 信号转导通过活性氧对NSCLC的生长和转移具有重要作用,其主要机制是上调NSCLC细胞中miR-21 促进原发性NSCLC 的生长,而通过清除活性氧可以减少原发性NSCLC 细胞中miR-21的上调从而减慢NSCLC 的生长。NADPH 氧化酶对于Toll样受体4 信号增强的NSCLC转移至关重要[20,21]。一旦产生了过量的活性氧,超过细胞自身抗氧化能力,活性氧可能发生氧化应激反应,从而损害细胞内的线粒体、内质网及核酸等,最后导致细胞死亡[22]。HIF-1信号通路在细胞、组织和器官的低氧损伤和适应过程中有关键的调控作用,低氧可以增加HIF-1 的稳定性,促进HIF-1 与低氧反应元件的结合,从而诱导低氧靶基因的激活。有研究证实EGLN1 基因和c-Myc 基因通过抑制HIF-1α直接激活淋巴特异性解旋酶的表达,淋巴特异性解旋酶与WDR76 相互作用,通过激活脂质代谢相关基因GLUT1 以及与铁死亡相关的基因SCD1 和FADS2 参与Warburg 效应抑制铁死亡,促进NSCLC 的进展[23,24]。由此可见,Toll 样受体信号通路、HIF-1 信号通路与LUAD 铁死亡有着紧密联系。
RRM2、SLC2A1 和TXNRD1 在一些研究中被证实可能与铁死亡和肺癌相关。RRM2 是核糖核苷酸还原酶的两个不同亚基之一,该还原酶催化核糖核苷酸形成脱氧核糖核苷酸,并以细胞周期依赖性的方式调节编码蛋白(M2)合成。敲除RRM2 能够通过介导铁死亡影响肺腺癌细胞的增殖,而铁死亡抑制剂Fer-1可以逆转RRM2 敲除后的抗肿瘤效果。由此证实了RRM2 不仅是铁死亡的标志基因,也是铁死亡的抑制基因[25]。SLC2A1 介导的葡萄糖摄取促进糖酵解,从而促进丙酮酸氧化,促进三羧酸循环,并刺激脂肪酸合成,最终加速诱导铁死亡[26]。在肺癌患者的癌前病变和肿瘤中检测到SLC2A1 的过表达,发现灭活SLC2A1会影响癌细胞中的糖酵解途径,使体内、外的肺癌细胞减少[27]。TXNRD1 参与抗氧化防御,并与癌细胞的耐药性相关,受TXNRD1 调节的代谢途径在癌症中至关重要。当细胞内半胱氨酸充足时,TXNRD1 和GSH/GPX4 共同作用,维持细胞内氧化还原平衡,避免铁死亡。当细胞内半胱氨酸缺乏时,半胱氨酸耗竭会引起一定程度的TXNRD1 酶活性和GSH/GPX4 水平下降,导致氧化水平急剧升高,发生铁死亡[28-30]。
生物信息学、网络药理学和分子对接为新药研发及临床用药提供理论依据,但是目前仍存在局限性,主要有:首先每个数据库收纳的药物活性成分不同,用不同数据库预测的作用靶点可能存在差异;其次受样本量限制,预后模型评估结果可能与真实情况存在误差;最后相关疾病的具体分子机制尚不完全清楚,因此,分子对接等技术可能与实际情况存在区别,需要后续进行基础试验验证。
综上所述,人参可通过SLC2A1、RRM2、CAV1、TXNRD1 和TLR4 等关键铁死亡基因介导Toll 样受体信号通路、HIF-1 信号通路等发挥治疗LUAD 的作用,为进一步研究提供了理论依据和参考。
