BVDV-1 E2蛋白抗原表位的串联表达及其多克隆抗体的制备
2023-10-12陈小金张俊哲侯文婷殷其刚张海滨
陈小金,张俊哲,曲 鹏,侯文婷,殷其刚,赵 丹,霍 蕾,肖 妍,张海滨
(1.天津海关工业产品安全技术中心,天津 300461;2.天津海关动植物与食品检测中心,天津 300461;3.中国动物卫生与流行病学中心,山东青岛 266032)
牛病毒性腹泻(bovine viral diarrhea,BVD)又称牛病毒性腹泻-黏膜病,临床上以发热、腹泻、黏膜病变以及怀孕母牛繁殖障碍为主要特征[1],其病原为牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)。除造成以上临床症状外,该病还能导致患畜免疫力降低,继而引起其他病原的继发感染,使病畜死亡率明显增加,给全世界养牛业造成了重大经济损失[2-3]。
根据5'UTR和自体蛋白酶的差异,BVDV可分为两种基因型——I型(BVDV-1)和II型(BVDV-2),目前我国流行的主要是BVDV-1[4]。在BVDV粒子表面的3种囊膜蛋白(Erns、E1和E2)中,E2蛋白是含量最丰富的表面蛋白,且包含BVDV主要的中和抗原位点,其诱导机体产生的中和抗体能预防BVDV感染[5]。E2蛋白通过二硫键形成的E2-E2同源二聚体和E2-E1异二聚体,镶嵌在病毒粒子表面[6]。E2蛋白在BVDV入侵过程中,帮助病毒附着在宿主细胞上,促进病毒进入细胞完成复制和增殖,且决定了病毒的种属嗜性[7]。鉴于E2蛋白功能多样性及重要性,E2蛋白一直是研究BVDV的主要热点蛋白,有关其表达及免疫原性的研究屡见报道[8]。
BVDV是黄病毒科瘟病毒属成员,同属成员包括猪瘟病毒(CSFV)、羊边界病病毒(BDV)等[9]。E2蛋白是瘟病毒最主要的抗原蛋白,在不同种间含有部分共同抗原表位及特异性抗原表位,由此带来了血清学交叉反应。BVDV与CSFV均能感染猪,因此猪群中这2种病原的抗体检测可相互干扰,给疾病诊断和防控带来挑战[10]。
本研究选取BVDV E2蛋白的5个保守抗原表位,以柔性氨基酸(GSGS)将5个表位(E1~5)串联(串联的多肽链被命名为5BE),利用原核表达系统表达重组蛋白His-5BE,纯化后免疫小鼠制备多克隆抗体并鉴定抗体的反应性,以期为制备单克隆抗体及建立BVDV检测方法奠定基础。
1 材料与方法
1.1 主要材料
质粒pET-28a(+),由宜春学院病原微生物实验室保存;感受态细胞TOP10和BL21(DE3),购自上海唯地生物技术有限公司。
1.2 主要试剂
2×RapidTaqMaster Mix和DL 2 000 plus DNA Maker,购自南京诺唯赞生物科技股份有限公司;HRP标记的羊抗鼠IgG、通用型ECL发光底物、BCA蛋白定量试剂盒、预染蛋白Maker,均购自上海圣尔生物科技有限公司;限制性核酸内切酶BamHI和XhoI,购自NEB(北京)有限公司;T4 DNA连接酶,购自普洛麦格(北京)生物技术有限公司;PCR凝胶回收试剂盒和质粒小提试剂盒,购自天根生化科技(北京)有限公司;His标签蛋白纯化试剂盒(可溶性蛋白),购自康为世纪生物有限公司。
1.3 基因合成及引物合成
按照图1所示基因序列,合成编码5BE多肽链基因。5BE编码基因由通用生物(安徽)股份有限公司合成,以pUC-5BE质粒形式提供。为将5BE编码基因克隆到原核表达载体pET-28a(+),设计一对携带酶切位点的引物5BE-F和5BE-R,通过BamHI和XhoI酶切位点连入pET-28a(+)载体。同时,设计一对载体引物pET-28a-F和pET-28a-R,用于鉴定在pET-28a(+)载体多克隆位点区插入的目的基因(表1)。

表1 设计的引物序列

图1 BVDV E2蛋白抗原表位的串联
1.4 重组载体构建与鉴定
以质粒pUC-5BE为模板,利用引物5BE-F和5BE-R扩增带有酶切位点的5BE片段。PCR扩增采用50 μL反应体系:2×RapidTaqMaster Mix 25 μL、上游引物2 μL、下游引物2 μL、质粒模板1 μL、ddH2O 20 μL。反应程序:95 ℃预变性5 min;95 ℃变性15 s,56 ℃退火15 s,72 ℃延伸15 s,共33个循环;72 ℃终末延伸5 min。PCR产物经1.2%琼脂糖凝胶电泳分析鉴定。
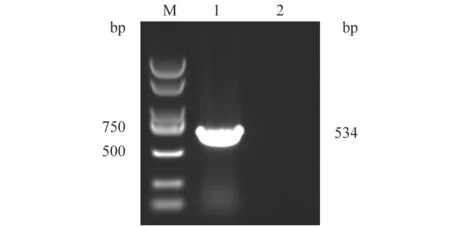
图2 PCR扩增5BE基因结果
采用PCR凝胶回收试剂盒,对PCR产物进行回收纯化。使用限制性内切酶BamHI和XhoI,对质粒pET-28a(+)和纯化的5BE片段进行双酶切。酶切产物不经凝胶分离,直接过柱回收。将双酶切后回收的5BE与载体pET-28a(+)连接。连接体系(10 μL):5BE 2 μL、载体6 μL、连接酶缓冲液1 μL、T4连接酶 1 μL。16 ℃连接4 h后,将连接产物转化至TOP10感受态细胞,转化完成后涂布于含卡那抗性的LB平板上,37 ℃过夜培养。
挑取若干单菌落进行摇菌,待菌液摇混,取菌液1 μL作为模板,利用载体引物pET-28a-F和pET-28a-R进行PCR扩增,鉴定阳性菌液。将经PCR鉴定为阳性的菌液,送公司进行测序鉴定。
1.5 重组蛋白诱导表达
将测序鉴定正确无误的菌液以1:100比例接种至10 mL卡那抗性LB培养基中,37 ℃,200 r/min培养。在菌液OD600达到0.6~0.8时,加入IPTG使其浓度达到0.5 mmol/L,继续于37 ℃诱导培养6 h。离心收集诱导后的菌体沉淀,加入1 mL PBS重悬菌体,置于冰上进行超声波破碎。超声条件设为功率20%、超声2 s、停歇2 s、超声时长10 min。超声后,10 000 r/min,4 ℃离心10 min,分成上清和沉淀。将沉淀用1 mL PBS重悬,分别取超声后的全菌样品、离心后上清样品以及离心后重悬的沉淀样品各40 μL,加入10 μL 5×Loading Buffer,煮沸5 min,制备蛋白样品。最后进行SDS-PAGE电泳及考马斯亮蓝染色,分析蛋白的表达情况。
1.6 蛋白纯化与鉴定
根据目的蛋白表达形式,采用康为世纪生物有限公司的可溶性His标签蛋白纯化试剂盒纯化重组蛋白His-5BE,通过SDS-PAGE及考马斯亮蓝染色分析蛋白纯度,利用BCA蛋白定量试剂盒测定纯化的蛋白浓度。
1.7 实验动物与免疫
选取6周龄左右的BALB/c雌性小鼠3只,免疫前尾静脉采血,将采集血清作为阴性血清对照。将纯化的重组蛋白稀释至1 μg/μL,与等体积弗氏佐剂充分混合乳化,在小鼠颈背部皮下多点注射,按200 μL/只免疫(抗原100 μg/只)。每次免疫间隔3周,共免疫3次,第3次免疫后14 d尾静脉采血分离血清。
1.8 多克隆抗体效价测定
采用间接ELISA测定多克隆抗体效价。用碳酸盐缓冲液将纯化的重组蛋白His-5BE稀释至1 μg/mL,每孔100 μL包被ELISA板,4 ℃包被过夜;包被后,PBST洗涤3次,将100 μL含5%脱脂乳的PBS加入孔中,于37 ℃封闭2 h;封闭后,PBST洗涤3次,加入倍比稀释的血清(1:1 000~1:640 000),37 ℃反应1 h;PBST洗涤3次,然后加入1:5 000稀释的HRP标记的羊抗鼠IgG,37 ℃孵育1 h;PBST洗涤3次,每孔加入100 μL TMB底物溶液,避光反应5 min,加入终止液(2 mol/L H2SO4)100 μL/孔;最后在酶标仪上测定OD450,计算抗体效价。
1.9 多克隆抗体反应性鉴定
重组蛋白His-5BE经SDS-PAGE电泳后,转印至NC膜上,用5%脱脂乳37 ℃封闭2 h;PBST洗涤3次,10 min/次(下同),将1:500稀释的5BE多抗血清作为一抗,于室温孵育NC膜2 h;PBST洗涤3次,以1:5 000稀释的HRP-羊抗鼠IgG作为二抗,于室温反应1 h;PBST洗涤3次,然后加入ECL发光液,置于曝膜仪显影拍照。
2 结果
2.1 5BE基因合成与重组载体构建
参照沈小芳[11]的研究结果,在BVDV NADL株E2蛋白上,选择与CSFV E2蛋白高度保守的5个抗原表位相对应的5个表位序列,分别命名为BVDV E1~5(表2)。将5个表位以氨基酸GSGS柔性串联(E1-E1-GSGS-E2-E2-GSGS-E3-E3-GSGS-E4-E4-GSGS-E5-E5,缩写为5BE,图1-A),5BE对应的基因序列如图1-B所示。5BE序列由公司合成,克隆到pUC载体上。

表2 BVDV NADL株E2蛋白的5个抗原表位
以pUC-5BE质粒为模板扩增出带有BamHI和XhoI酶切位点的5BE基因(图2)。通过传统的酶切连接方式,把5BE基因与原核表达载体pET-28a(+)连接;利用载体引物pET-28a-F和pET-28a-R,对连接转化所得的菌落进行PCR鉴定,将菌液鉴定阳性的克隆送公司进行序列测定。
测序结果(图3)表明,5BE被成功连入到pET-28a(+)载体的BamHI和XhoI位点之间,没有发生移码,且该克隆中的5BE基因与5BE原始基因对比,没有发生突变,重组载体pET-28a-5BE构建成功。

图3 重组质粒pET-28a-5BE测序鉴定结果
2.2 重组蛋白His-5BE表达与纯化
选取测序确证无误的克隆,从中提取质粒pET-28a-5BE,然后转化到表达感受态细胞BL21(DE3)。IPTG诱导表达后,将处理菌液分成全菌、上清、沉淀3种样品,进行SDS-PAGE及考马斯亮蓝染色。从图4可以看出,与空载体pET-28a诱导表达产物相比,重组蛋白His-5BE获得表达,位于17~25 kD,与预期大小(22 kD)相符。His-5BE表达量较大,主要以包涵体形式存在,但在上清中也有部分表达。
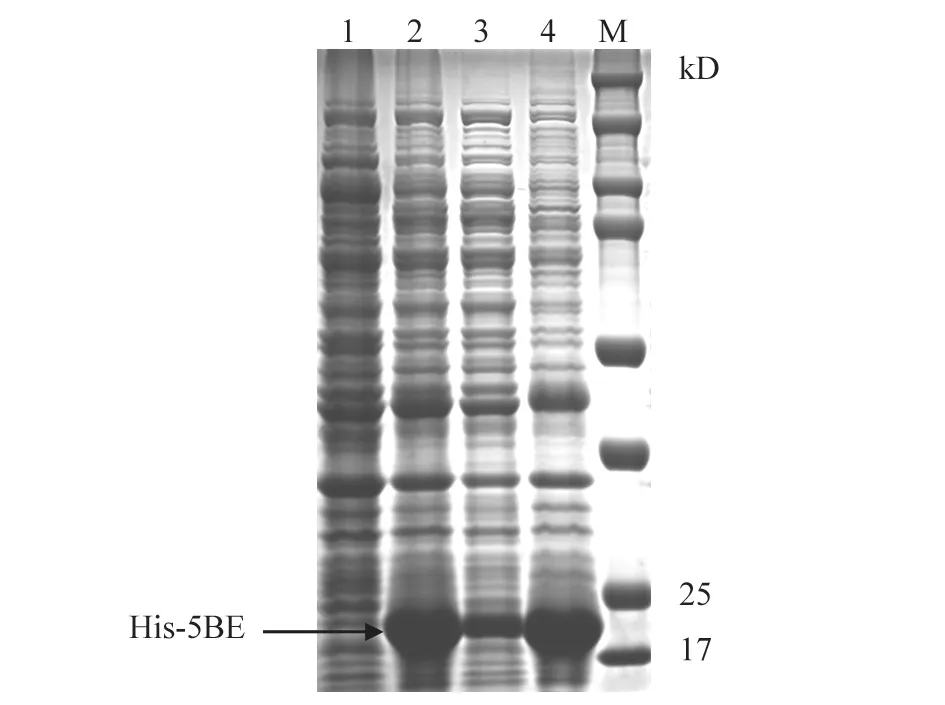
图4 重组蛋白His-5BE的表达分析结果
由于部分重组蛋白His-5BE是可溶性表达,因此采用Ni柱亲和层析方式纯化带有His标签的目的蛋白。纯化后,通过蛋白电泳及考马斯亮蓝染色分析蛋白纯化效果。结果(图5)显示,纯化的His-5BE纯度较高,杂带较少,且目测蛋白浓度也较高。通过BCA法测得纯化蛋白的质量浓度达到1.54 mg/mL,能够满足免疫要求。
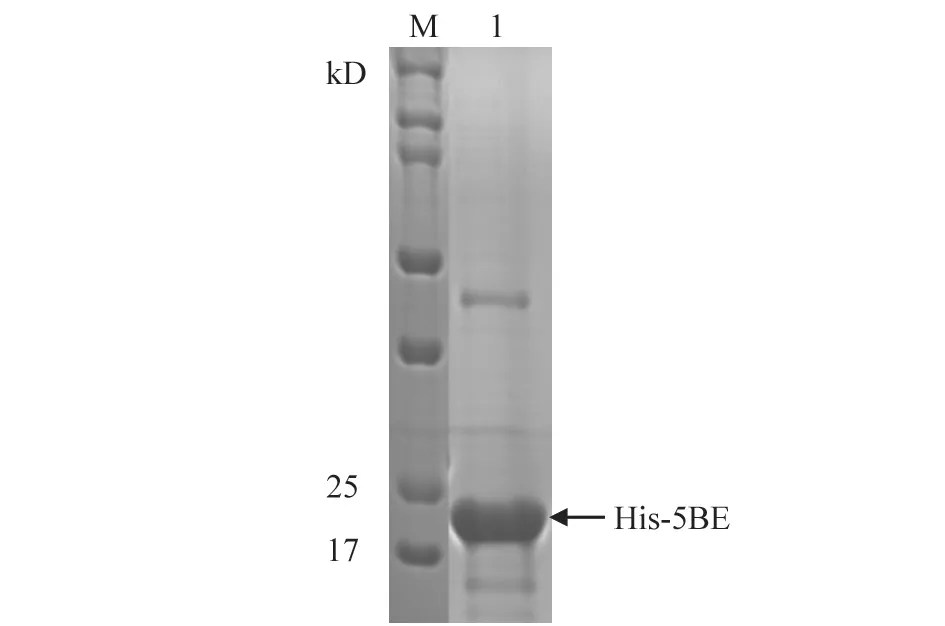
图5 纯化蛋白His-5BE考马斯亮蓝染色分析结果
2.3 5BE蛋白多克隆抗体ELISA效价测定
用建立的间接ELISA方法,对梯度稀释的多抗血清及阴性血清对照进行效价测定。结果(图6)显示:多抗血清1:1 000稀释时的OD450为3.68,而此稀释度下阴性血清的OD450仅为0.26;当多抗血清稀释至32万倍及以上时,多抗血清的OD逐渐接近阴性血清的OD,说明制备的His-5BE的多抗血清效价至少达到1:160 000。

图6 His-5BE蛋白多克隆抗体ELISA效价测定结果
2.4 5BE蛋白多抗血清Western Blot检测
为验证多抗血清的反应性及纯化蛋白纯度,以纯化的重组蛋白His-5BE为样品,以5BE蛋白多抗为一抗进行Western Blot检测。结果(图7)显示,在His-5BE预期位置,出现明显的特异性条带,说明制备的抗血清1:500稀释时具有良好的反应性。

图7 His-5BE蛋白多抗血清的Western Blot检测结果
3 讨论
BVDV宿主范围较广,包括牛、猪、羊、骆驼等动物[12]。牛群中BVDV血清抗体阳性率普遍很高,而且各地区流行的BVDV亚型各有不同,我国流行的以BVDV-1为主[10]。近年来,我国猪群中BVDV感染率逐渐升高。猪感染BVDV无明显临床症状或出现类似轻症猪瘟临床表现,但BVDV可引发仔猪持续性感染和免疫抑制,导致猪体免疫力下降,易诱发其他病原感染[13]。徐磊等[14]对福建省猪源BVDV流行与分布情况进行了批量检测,发现BVDV抗体阳性率为35.6%(5 891/16 537),400份样品中BVDV病原阳性率为15.3%,表明福建省猪源BVDV感染较普遍,且BVDV感染对CSFV抗体产生有抑制作用。近几年,我国多家研究单位从血清制品和生物制品中检测到BVDV污染,而诸如胎牛血清污染BVDV和细胞污染BVDV将给疫苗生产,特别是CSFV疫苗带来风险[15-17]。因此,在对猪进行CSFV检测的同时有必要进行BVDV检测。
E2蛋白是瘟病毒最主要的抗原蛋白,承载着BVDV与CSFV的主要抗原位点,同时E2蛋白保守性较低,其编码基因含有较多的变异位点,可作为BVDV分型的依据[2]。由于BVDV与CSFV有血清学交叉反应,常规血清学方法很难准确检测BVDV。为解决这一问题,拟制备E2蛋白的单克隆抗体,以E2蛋白特异性单抗来检测BVDV。为此,从BVDV E2蛋白上找到与CSFV E2上抗原表位差异较大的表位,将这些表位串联重复依次连接,采用原核表达系统表达、纯化重组蛋白His-5BE,以纯化的His-5BE蛋白作为免疫原,免疫小鼠制备多抗血清,并为单克隆抗体制备做准备。
本研究诱导表达的His-5BE主要存在于包涵体中,也有少量是可溶性表达。对上清中的His-5BE进行亲和层析纯化,将纯化的目的蛋白免疫小鼠制备了抗5BE多克隆抗体。以His-5BE为包被原,采用间接ELISA测得多抗血清的效价高达16万倍,且Western Blot试验也证实将该多抗稀释500倍,能与目的蛋白发生特异性抗原抗体反应,说明免疫His-5BE激发了BALB/c小鼠强烈的免疫应答。该研究为建立BVDV检测方法及后续制备单克隆抗体奠定了基础。
