传染性脾肾坏死病毒TaqMan荧光定量PCR检测方法的建立及应用
2023-10-12李望东张淑瓶盘润洪蓝间媛曾俊霞侯月娥
李望东,李 勇,张淑瓶,盘润洪,蓝间媛,曾俊霞,侯月娥
(1.珠海市现代农业发展中心,广东珠海 519070;2.珠海科艺普检测科技有限公司,广东珠海 519070)
传染性脾肾坏死病毒(infection spleen and kidney necrosis virus,ISKNV),属于虹彩病毒科巨大细胞病毒属成员,可感染鳜鱼(Siniperca chuatsi)、大口黑鲈(Micropterussalmoides)花鲈(Lateolabraxjaponicas)、乌鳢(Ophiocephalus argus)等50多种经济鱼类[1]。1994年ISKNV感染疫情在我国广东省首次暴发,随后迅速蔓延到其他省份[2]。吴淑勤等[2]在鳜鱼体内检测到一种粒径为150 nm的球状病毒,认为可能是鳜鱼暴发性感染的主要病原体。因为这种病毒主要在鳜鱼的脾脏和肾脏中传播,所以何健国等[3-4]把该病命名为“传染性脾肾坏死病”(infection spleen and kidney necrosis,ISKN),并对该病毒进行了基因组完整序列分析。ISKNV易与细菌发生继发感染,如无法得到及时有效的诊断和治疗,就会造成巨大经济损失[5-7]。目前,ISKNV的检测方法有很多种,包括病毒分离、电镜观察、普通PCR[8-9]。但这些方法均存在耗时长、操作复杂等弊端,不利于ISKNV的调查研究。因此,利用先进高效的分子生物学方法是目前诊断ISKNV感染最快速有效的手段。但是目前ISKNV的TaqMan荧光定量检测方法未形成统一标准,部分方法存在检测操作繁琐、耗时长,以及特异性、敏感性较差等问题,只能作为初步诊断方法[10]。TaqMan荧光定量方法相比较于其他分子生物学检测方法,具有高效、快速、精准的优点,并已在其他水生动物疾病诊断中得到成功应用,是未来水产行业病毒检测的发展趋势[11-12]。本研究旨在建立一种针对ISKNV的,具有特异性强、灵敏度高、精准的TaqMan荧光定量PCR方法,为快速、精准检测ISKNV提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 病毒株和检测样品 传染性造血器官坏死病毒(infectious hematopoietic necrosis virus,IHNV)、病毒性神经坏死病毒(viral nervous necrosis virus,VNNV)、大口黑鲈蛙虹彩病毒(Largemouth bass ranavirus,LMBV)、黄颡鱼杯状病毒(Yellow catfish calicivirus,YCCV)、鳜鱼弹状病毒(Sinipercachuatsirhabdovirus,SCRV)灭活阳性样品以及233份临床样品,均由珠海科艺普检测科技有限公司保存,并经PCR扩增及测序。
1.1.2 主要试剂 病毒DNA/RNA小量提取试剂盒,广州吉瑞基因科技有限公司产品;2×Superstart Premix plus(Probe qPCR),珠海宝锐生物科技有限公司产品;Taq酶、pMDl8-T载体、DL 1000 DNA Marker,TaKaRa公司产品;质粒小量提取试剂盒、DNA纯化回收试剂盒,OMEGA公司产品;E.coli.DH5α感受态细胞,爱思进生物技术(杭州)有限公司产品。
1.1.3 主要仪器 梯度PCR扩增仪(Thermal Cycler),型号S1000TM,Bio-Rad公司产品;荧光定量PCR仪,型号SLAN-96P,上海宏石医疗科技有限公司产品;电泳仪装置(PowerPacTMBasic),Bio-Rad公司产品;凝胶成像系统,型号65G-2000,珠海黑马医疗器械有限公司产品。
1.2 方法
1.2.1 实时荧光PCR引物和TaqMan探针 根据GenBank中登录的ISKNV(AF371960.1)基因序列,利用Primer Premier 5和Oligo 7设计软件,依据TaqMan荧光定量PCR引物和探针的设计原理和要求,设计特异性引物和荧光探针(表1)。引物探针由昆山普诺普和生物技术有限公司合成。

表1 ISKNV TaqMan荧光定量PCR探针及扩增引物
1.2.2 样品前处理 取发病鱼组织(鳃、脾脏、肝脏、心脏、肠、脑)剪碎,混匀后取100 mg,放入带有钢珠的2 mL研磨管中,加入0.5~1.0 mL PBS,将研磨管置于研磨机中60 Hz、3 min,取出研磨管,用离心机5 000 r/min离心3 min,吸取上清液200 μL到离心管中备用。
1.2.3 ISKNV总核酸提取 按照病毒DNA/RNA小量提取试剂盒说明书操作,将提取的核酸以及阳性对照保存在-20 ℃冰箱中。
1.2.4 标准品制备 取1.2.3中提取的总核酸,以ISKNV-qF/ISKNV-qR(10 pmol/L)为引物进行PCR扩增。扩增条件:94 ℃预变性3 min;94 ℃变性30 s,60 ℃退火20 s,72 ℃延伸30 s,共30个循环;72 ℃延伸5 min。反应结束后,取5 μL PCR反应产物进行琼脂糖凝胶电泳。将获得的ISKNV PCR产物琼脂糖凝胶电泳后,切胶回收纯化,分别克隆至pMD18-T载体中,转化到DH5α感受态细胞,筛选阳性克隆重组质粒,送生工生物工程(上海)股份有限公司进行测序鉴定。将鉴定正确的重组质粒命名为pMD-ISKNV。对阳性质粒进行浓度测定、拷贝数计算,然后分装,-80 ℃保存备用。
1.2.5 反应条件优化 ISKNV的引物和探针终浓度为0.1~0.6 mol/μL,退火温度为55~65 ℃,以不同浓度配比和不同退火温度进行荧光定量PCR反应,选择效果最佳的引物、探针浓度以及退火温度。
1.2.6 标准曲线建立 将制备好的ISKNV标准品进行10倍梯度稀释,用不同稀释梯度的核酸作为模板,每个梯度的核酸设立 3个重复;使用1.2.5筛选优化后的体系及条件进行TaqMan荧光定量PCR扩增。根据标准品拷贝数与Ct值建立标准曲线。
1.2.7 敏感性试验 将1.2.3提取到的总核酸进行浓度测定,并根据浓度进行10倍倍比稀释,共稀释5个浓度梯度(10-1~10-5),将其作为模板,参照水产行业标准《传染性脾肾坏死病毒检测方法》(SC/T 7211—2011)中的普通PCR方法和本研究建立的TaqMan荧光定量PCR分别进行扩增,比较两种方法的灵敏度。
1.2.8 特异性试验 使用本研究建立的方法,对IHNV、VNNV、LMBV、YCCV、SCRV进行 PCR扩增,验证本研究建立方法的特异性。
1.2.9 重复性试验 用建立的方法对已稀释的梯度质粒(1.0×101~1.0×105copies/μL)进行批内重复试验,间隔15 d分别进行3次批间重复试验,每个梯度浓度重复3次,对所得结果进行方差分析,计算批次内和批次间的变异系数。
1.2.10 临床样品检测 选取已知的ISKNV阳性样品76份、阴性样品157份,用本研究建立的ISKNVTaqMan荧光定量PCR进行检测。
2 结果与分析
2.1 标准品制备
重组质粒的PCR检测结果显示,ISKNV的扩增产物大小为87 bp,与预期大小一致;测序结果显示,ISKNV目的基因序列与GenBank公布的参考序列AF371960.1相似性达100%。结果表明,目的基因已被成功地插入载体上。
2.2 反应条件优化
对比不同的引物、探针浓度及退火温度,确定TaqMan荧光定量PCR反应体系:预混液12.5 μL,上游引物、下游引物各1.0 μL,探针0.5 μL,DNA模板2.0 μL,用水补足至25.0 μL。反应条件:95 ℃ 3 min;95 ℃ 10 s,60 ℃ 30 s,40个循环,每个循环第二步收集荧光信号。
2.3 标准曲线建立
利用本研究建立的方法扩增了ISKNV不同浓度梯度(1×101~1×105copies/μL)稀释的标准品,结果如图1。该方法所构建的检测标准曲线具有等距性和平行性,并具有较好的梯度性,得到标准曲线方程为Ct = -3.537 5X+ 40.465,相关系数R2=0.997 2,扩增效率符合要求。
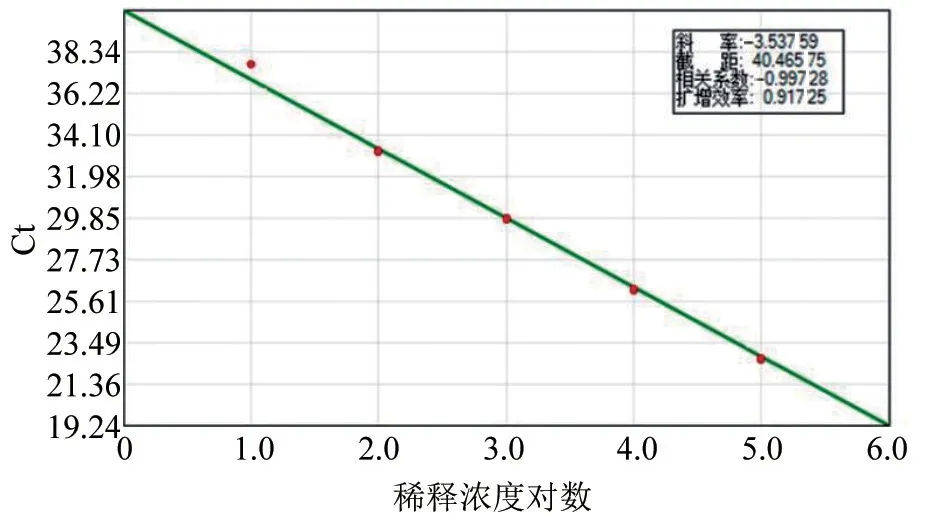
图1 ISKNV的 TaqMan荧光定量PCR标准曲线
2.4 敏感性试验
ISKNV的总核酸质量浓度为87 ng/μL。将ISKNV核酸样本10倍梯度稀释(8.7×101~8.7×10-4ng/μL),分别利用本研究建立的TaqMan荧光定量PCR和普通PCR进行扩增。结果(图2~3)显示,TaqMan荧光定量PCR的最小检测量为8.7×10-4ng/μL,普通PCR为8.7×10-3ng/μL,TaqMan荧光定量PCR敏感性是普通PCR的10倍。结果表明,本研究建立的TaqMan荧光定量PCR方法敏感性较好。

图2 ISKNV TaqMan 荧光定量PCR敏感性试验结果

图3 ISKNV普通PCR敏感性试验结果
2.5 特异性试验
利用建立的TaqMan荧光定量 PCR方法,对常见鱼类病毒 IHNV、VNNV、YCCV和 SCRV的核酸反转录产物cDNA,LMBV、ISKNV的核酸DNA进行扩增。结果(图4)显示,TaqMan荧光定量PCR方法只检测出ISKNV核酸样本为阳性,其余5种鱼类病毒核酸样本均未出现扩增曲线。试验重复3次,均得到相同结果,表明建立的TaqMan荧光定量PCR方法特异性良好。
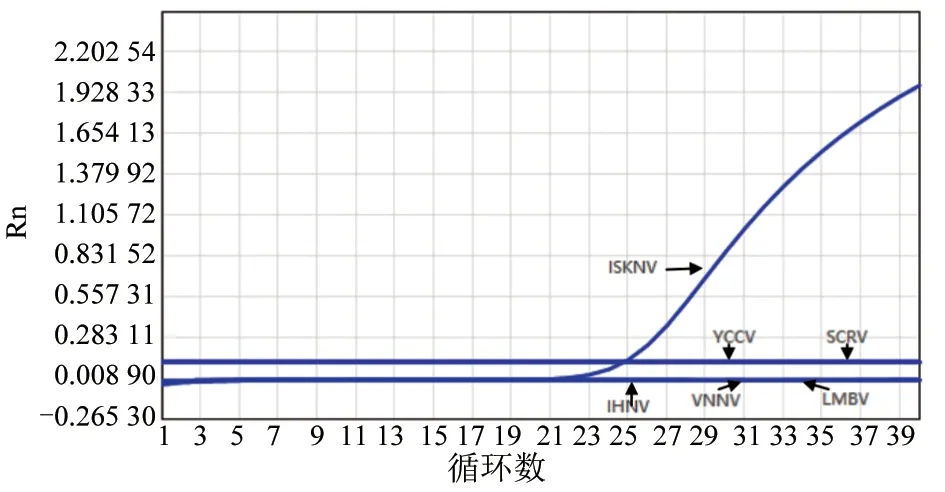
图4 ISKNV TaqMan荧光定量PCR特异性试验结果
2.6 重复性试验
利用本研究建立的TaqMan荧光定量PCR方法,对不同浓度梯度的标准品进行批次内及批次间的重复性试验。结果(表2)显示,批次内及批次间的变异系数均小于2.0%。结果表明,本研究所建立的TaqMan荧光定量PCR方法的重复性和稳定性好。

表2 ISKNV TaqMan荧光定量PCR重复性试验结果
2.7 临床样品检测
应用建立的TaqMan荧光定量PCR方法,对已知结果的233份临床样品进行检测,检出76份阳性、157份阴性,与已知结果一致,表明该方法检测结果准确,可用于临床样本检测。
3 讨论
ISKN是一种高传染性、高致死性鱼类病毒性疫病,导致水产养殖业遭受巨大经济损失[13]。水产养殖过程中,针对ISKN的防控以预防为主,而病原检测是预防的关键步骤,对该病的快速、精准诊断极为重要。
本研究建立的TaqMan 荧光定量PCR选取了主衣壳蛋白(MCP)编码基因。该基因是虹彩病毒在晚期表达的基因,其编码的MCP是构成病毒二十面体衣壳的重要结构成分,参与ISKNV感染宿主细胞的过程[14]。比较氨基酸序列可知,同属虹彩病毒 MCP的氨基酸序列同源性大于90%,含有几个序列几乎完全一致的高度保守区,说明其氨基酸序列高度保守。而细胞肿大病毒属、蛙病毒属等这些不同属的虹彩病毒之间的MCP氨基酸序列同源性为40%~50%[15]。在制备鳜鱼ISKNV单克隆抗体研究中,付小哲等[16]主要根据MCP序列来制作抗体,从而使抗体具有特异性识别能力。在非洲猪瘟研究中,黄布敏等[17]也是根据非洲猪瘟病毒(ASFV)的衣壳蛋白进行病毒致病机制分析和疫苗开发。于立等[18]针对鲤科疱疹病毒2型的MCP编码基因序列设计特异性引物,建立了PCR检测方法。因此,本研究根据GenBank中ISKNV衣壳蛋白MCP编码基因(ORF006)保守序列,设计特异性引物及探针,构建了一种ISKNVTaqMan实时荧光定量PCR技术。
荧光定量PCR技术自20世纪80年代由美国科学家发明之后,被广泛应用在生物学研究领域,而TaqMan荧光定量PCR技术发展成熟,具有高特异性、高敏感性、高精确度[19]。本研究设计ISKNV衣壳蛋白MCP编码基因保守序列的引物和探针,通过优化反应体系,提高了方法的灵敏度、特异性以及重复性。本研究建立的方法最低可检测到101copies/μL,是普通PCR的10倍,灵敏度高;操作方便,避免了传统PCR的开盖污染,减少了假阳性[20];与IHNV、VNNV、LMBV、YCCV、SCRV无交叉反应,特异性好。批内、批间变异系数均小于2.0%,稳定性良好。朱春艳等[21]建立的ISKNV快速PCR方法,最低也可以检测到相同拷贝数,但用时超过3 h,且需要电泳、凝胶成像采集等操作,存在气凝胶污染以及假阴性等问题,操作繁琐、误差大。Lin等[22]建立的鳜鱼ISKNVTaqMan PCR方法对LMBV出现了弱阳性,而本研究方法与LMBV不产生交叉反应,与其相比本研究方法特异性更高。TaqMan荧光定量PCR方法可以根据病毒保守序列设计探针,能够特异性结合目的病毒DNA,是检测病原的最佳方法之一[23]。本研究建立的ISKNVTaqMan荧光定量PCR检测方法,具有操作简便、灵敏度高、重复性好、特异性好、结果准确、耗时短等优点,在临床样品检测中具备可靠性,这对ISKN的早期诊断和控制病毒传播等有重要意义。
