甲状腺球蛋白联合甲状腺球蛋白抗体及促甲状腺素对分化型甲状腺癌病人预后的预测价值
2023-10-12李娟娟姚廷敬
张 超,李娟娟,姚廷敬
甲状腺癌发病率高,其中又以分化型甲状腺癌居多[1-2]。目前,甲状腺癌治疗以手术、口服甲状腺素片及131I放治疗为主,其整体治疗效果较好[3]。然而,部分甲状腺癌病人对放射性碘治疗抵抗,预后较差[4],易出现复发转移,威胁病人生命,准确预测甲状腺癌病人预后的临床意义重大。甲状腺球蛋白作为分化型甲状腺癌标志物,来源于甲状腺癌细胞或甲状腺组织,甲状腺癌术后甲状腺球蛋白水平持续升高往往提示甲状腺癌术后复发或是转移[5]。甲状腺球蛋白抗体(TgAb)伴随甲状腺球蛋白产生,为避免漏诊,针对甲状腺癌病人检测甲状腺球蛋白水平时,要同时行TgAb试验。本研究探讨血清甲状腺球蛋白/TgAb联合检测对分化型甲状腺癌预后的预测价值。现作报道。
1 资料与方法
1.1 一般资料 选择2018年6月至2020年6月我科手术治疗分化型甲状腺癌病人180例,均为乳头状癌,术后随访2年,按随访情况分为预后良好组141例和预后不良组39例。纳入标准:年龄18~75岁;确诊为甲状腺乳头状癌;经手术+术后口服甲状腺素片±131I治疗。排除标准:严重心、肺功能不全,肝、肾功能不全;其他部位恶性肿瘤、自身免疫系统疾病;合并严重血液系统疾病;合并严重精神疾病。病人及家属均知情同意。根据全身骨显像(WBS)标准[6]将病人分为预后良好组(Ⅰ级)141例和预后不良组(Ⅱ~Ⅳ级)39例。
1.2 方法 收集病人年龄、性别、原发灶情况、淋巴结转移情况等相关临床资料。术前抽病人取空腹静脉血3 mL进行甲状腺功能检测,离心血清-80 ℃保存待检,检测血清三碘甲状腺原氨酸、甲状腺素、促甲状腺素、甲状腺过氧化物酶抗体、甲状腺球蛋白、TgAb。
1.3 随访复查 病人术后随访2年,每3个月复查一次。通过颈部彩色多普勒超声观察剩余甲状腺及颈部淋巴结,观察甲状腺区域有无复发,中央区、侧颈区、锁骨上淋巴结有无转移。超声判断淋巴结有无异常特征:(1)囊性伴钙化;(2)淋巴结肿大、淋巴门消失;(3)淋巴结呈圆形;(4)淋巴结内血流丰富;(5)淋巴结皮髓质分解不清,超声出现以上2项或以上,列为甲状腺癌术后出现淋巴结转移。CT观察胸部有无异常等,观察肺部有无转移。
1.4 统计学方法 采用χ2检验、t检验、logistic回归分析和ROC曲线分析。
2 结果
2.1 2组病人相关临床资料比较 预后不良组病人原发灶T3/T4和颈部多发淋巴结转移比例均高于预后良好组(P<0.01和P<0.05),2组病人性别、年龄、转移淋巴结最大径等差异均无统计学意义(P>0.05)(见表1)。
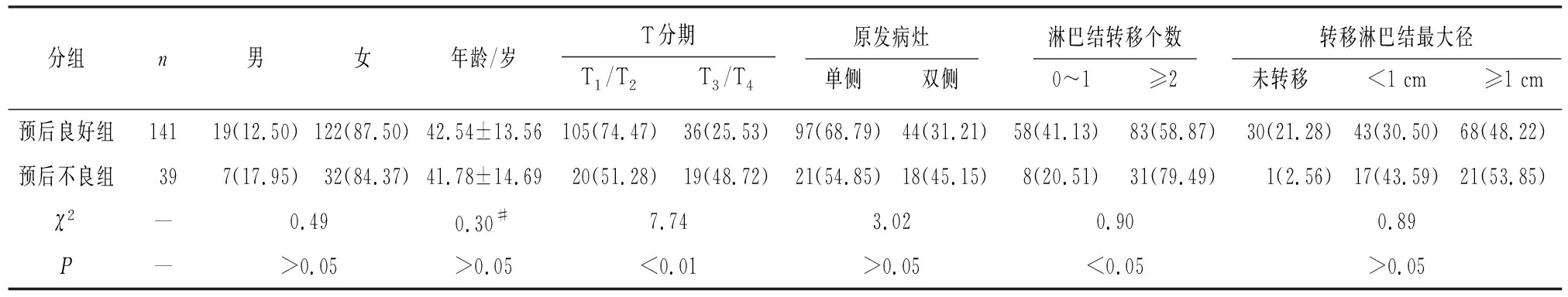
表1 2组病人相关临床资料比较[n;百分率(%)]
2.2 2组病人甲状腺功能指标比较 预后不良组病人甲状腺素、促甲状腺素、甲状腺球蛋白和TgAb水平均高于预后良好组(P<0.05~P<0.01),2组病人三碘甲状腺原氨酸、甲状腺过氧化物酶抗体水平差异均无统计学意义(P>0.05)(见表2)。

表2 2组病人甲状腺功能指标比较
2.3 甲状腺癌病人预后的多因素logistic回归分析 将单因素分析中差异有统计学意义的变量纳入logistic回归模型,纳入自变量甲状腺球蛋白、促甲状腺素、TgAb、T分期(1=T1~T2期,2=T3~T4期)、淋巴结转移(1=转移淋巴结>1,0=转移淋巴结≤1)、转移淋巴结最大直径(1=最大直径<1 cm或无淋巴结转移,2=最大直径≥1 cm),随访结果作为因变量(0=预后良好,1=预后不良),结果显示,高甲状腺球蛋白、促甲状腺素、TgAb和原发肿瘤T分期T3/T4及多发淋巴结转移、转移淋巴结最大径≥1 cm均为病人预后的独立危险因素(P<0.05~P<0.01)(见表3)。

表3 甲状腺癌术后病人预后的多因素分析
2.4 不同指标对分化型甲状腺癌切除术后病人预后的预测价值 ROC曲线分析显示,甲状腺球蛋白、促甲状腺素、TgAb及三者联合预测病人预后的AUC分别为0.878、0.831、0.811、0.978,三者联合对病人预后的预测价值均高于单项指标(Z=3.30、4.10、4.80,P<0.01)(见表4)。
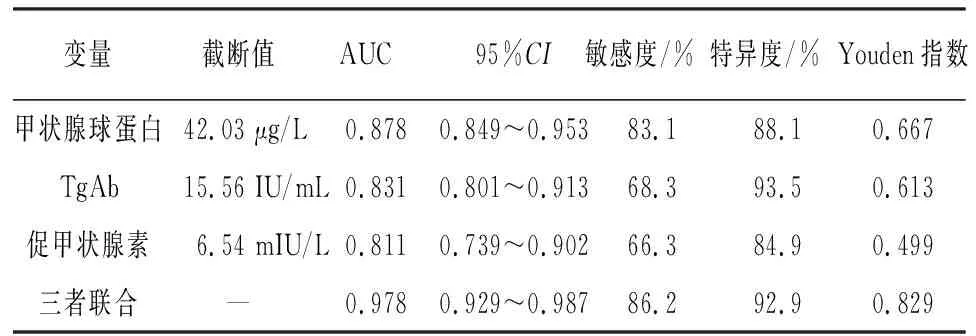
表4 不同指标对分化型甲状腺癌切除术后病人预后的预测价值
3 讨论
甲状腺癌发病率逐步上升,其中以乳头状癌最常见,其特点为预后好、生存率高[7-9],绝大多数病人经过手术及术后辅助治疗后预后较好,但仍有少部分病人术后存在复发转移,多数为颈部淋巴结转移,而部分术后复发转移病人预后较差[10-12],因此,寻找甲状腺乳头状癌预后指标意义重大。
本研究结果显示,肿瘤原发灶T分期中T3/T4期、淋巴结多发转移均为病人预后的危险因素。原发肿瘤T分期T3、T4提示瘤体大或突破包膜侵犯周围组织的分化型甲状腺癌,常作为预后欠佳的提示。局部淋巴结转移或远处转移作为预后较差因素,手术常无法完全切除,并且可能存在术后辅助治疗不敏感,这部分分化型甲状腺癌病人被列为晚期或中晚期,预后欠佳[13-14]。
甲状腺球蛋白表达于正常或发生癌变的甲状腺组织,理论上,在甲状腺腺叶全切除术后,以及在放射碘清除甲状腺残留腺体后,甲状腺球蛋白特异度增加。其作为肿瘤标志物,较为敏感,不但可以对甲状腺乳头状癌术后复发转移的病人进行检测,同时也可以对手术残留的甲状腺病变情况进行检测,因此,临床上被看作是检测残留腺体、肿瘤复发转移的理想检测指标[15-16]。TgAb是甲状腺球蛋白的特异性自身免疫抗体,TgAb与甲状腺球蛋白在血清中处于同步升高或降低的状态[17],甲状腺球蛋白和TgAb结合,会在一定程度上诱发Fc受体相互影响,间接影响并启动自然杀伤细胞损伤正常甲状腺腺体组织,研究[18-19]表明,TgAb高表达于分化型甲状腺癌病人的血清中,病人甲状腺术后体内TgAb水平明显高于术前,并且在术后复查的过程中,TgAb升高的程度与病人复发转移的风险呈正相关关系。促甲状腺激素作为生长因子,高表达状态下可诱导或加速甲状腺组织增殖,并与甲状腺本身的发生发展呈正相关关系。研究[20-21]发现,检测促甲状腺激素联合TgAb/甲状腺球蛋白可在一定程度上帮助判断甲状腺是否存在恶性肿瘤。本研究结果显示,高水平TgAb、甲状腺球蛋白和促甲状腺激素均为甲状腺癌病人预后的独立危险因素。ROC曲线分析显示,血清甲状腺球蛋白、TgAb、促甲状腺素及三者联合预测病人预后的AUC分别为0.878、0.831、0.811、0.978,三者联合预测价值高于单项指标。
综上,血清TgAb联合甲状腺球蛋白能有效对分化型甲状腺癌病人术后预后情况进行预测,二者联合促甲状腺激素具有较高的诊断价值及诊断效能。但本研究样本量有限,对结果的判断有局限性;此外,临床参考指标有限,并且随访复查时间相对较短,对结果尚有一定影响,有待进一步扩大研究病例,延长随访时间,形成多中心实验研究,为临床有效预测预后提供参考依据。
