新疆拜城县马铃薯疮痂病病原菌的分离鉴定及生物学特性分析
2023-10-11徐李娟王则玉艾尼江尔斯满李克梅宋素琴
徐李娟,陈 勇,王则玉,王 博,艾尼江·尔斯满,郭 瑞,李克梅,宋素琴,4
(1.新疆农业大学农学院,乌鲁木齐 830052;2.新疆农业科学院微生物应用研究所/新疆特殊环境微生物重点实验室,乌鲁木齐 830091;3.新疆农业科学院土壤肥料与农业节水研究所,乌鲁木齐 830091;4.新疆绿洲农业病虫害治理与植保资源利用自治区高校重点实验室/石河子大学农学院,新疆石河子 832003)
0 引 言
【研究意义】马铃薯疮痂病是由多种链霉菌(Streptomycesspp.)引起的一种土传病害,造成马铃薯品质下降[1]。致病菌中与致病性相关的基因分布在染色体中同一区域,致病岛(pathogenicity island,PAI)中,该区域可以从致病链霉菌菌株水平转移到其他不含致病基因的链霉菌属中的其他种中,从而产生新的致病菌株,因此致病链霉菌具有多样性,不同产区病原菌种类及组成有所不同;其中thaxtomin A(ThxA)毒素是其重要的致病因子,其合成基因位于PAI的第一部分,即“毒素区”[2-5]。感病马铃薯块茎表面粗糙,形成疮痂状病斑,不仅影响马铃薯的外观及品质,且马铃薯表皮组织遭到破坏,导致土壤中其它病原菌更容易侵染薯块[6-8]。马铃薯播种面积不断扩大,疮痂病的发生也日益严重,在山西、内蒙古等地疮痂病发病率达到30%~60%,严重地块高达100%[9,10]。新疆生脱毒马铃薯微型薯发病率最高可达80%以上[11]。疮痂病对马铃薯的生产造成严重损失,已成为制约马铃薯产业快速发展的因素之一。【前人研究进展】疮痂病致病菌由Roland Thaxter分离得到,命名为S.scabies[12]。除了S.scabies,S.acidiscabies和S.turgidiscabies3种常见病原菌外[13],其他国外已经报道病原有27种,包括S.atroolivaceous、S.cinerochromogenes、S.corchorusii、S.diastatochromogenes、S.lydicus、S.malachiticus、S.albogriseolus[14, 15]、S.europaeiscabiei[16]、S.violaceus、S.gnseus、S.exfoliatus、S.rocbei[17]、S.reticuliscabiei、S.aureofaciens、S.albidoflavus[18-20]、S.caviscabies[21]、S.luridiscabiei、S.puniciscabiei、S.niveiscabiei[22]、S.stelliscabies[19]、S.brasiliscabiei[23]、S.alkaliscabies[24]、S.cinereus、S.collinus、S.longisporoflavus[25]、S.flavidofuscus、S.ipomeae[26]。我国马铃薯疮痂病菌的分布也呈现地域气候的差异,目前已报道的致病疮痂链霉菌病原共有18种,包括S.caviscabies、S.anulatus、S.scabies、S.turgidiscabies、S.acidiscabies、S.europaeiscabiei、S.luridiscabiei、S.enissocaesilis、S.griseus、S.aureofaciens、S.bobili、S.galilaes、S.bottropensis、S.stelliscabiei、S.luridiscabiei、S.griseoaurantiacus、S.setonii、S.reticuliscabiei,分别在云南省[1]、内蒙古[10]、山东[13]、黑龙江[27]、甘肃[28]、贵州[29]等省(区)。【本研究切入点】新疆土质多为灰漠土,适宜马铃薯生长。2019年拜城县马铃薯种植面积2 666.67 hm2(4万余亩),单产4 t/667m2,总产量16×104t。但目前仅伊犁有报道病原菌为S.scabies、S.acidiscabies[30],缺乏对新疆不同地区马铃薯疮痂病病原菌的组成系统性研究,有关拜城马铃薯产区未见报道。需进一步探明新疆不同地区马铃薯疮痂病病原菌的种类。【拟解决的关键问题】采集新疆阿克苏地区拜城县疮痂病病薯及薯表土壤进行病原菌的分离鉴定及生物学特性研究,为该地区马铃薯疮痂病的防治提供研究基础。
1 材料与方法
1.1 材 料
供试土样及马铃薯块茎采集自新疆阿克苏地区拜城县察尔齐镇。培养基为高氏1号培养基(可溶性淀粉20 g,硫酸镁0.5 g,氯化钠 0.5 g,磷酸氢二钾 0.5 g,硝酸钾1.0 g,硫酸亚铁 0.01 g,琼脂15~20 g,水1 000 mL)、碳源利用基础培养基(氯化锰7.9 mg,磷酸氢二钾5.65 g,硫酸锌 1.5 g,硫酸镁1.0 g,硫酸铵1.5 g,硫酸铜6.4 mg,硫酸亚铁1.1 mg,磷酸二氢钾2.38 g,琼脂15~20 g,水1 000 mL)、氮源利用基础培养基(氯化钠5 g,葡萄糖10 g,磷酸氢二钾1.0 g,硫酸镁5.0 g,琼脂15~20 g,水1 000 mL)、燕麦琼脂培养基(燕麦30 g,琼脂琼脂15~20 g,水1 000 mL)、Tresner 琼脂培养基(柠檬酸铁0.5 g,蛋白胨10 g,琼脂15~20 g,水100 mL)、酪氨酸琼脂培养基(酪氨酸1.0 g,NaCl 8.5 g,酵母浸提物 1.0 g,琼脂 15~20 g,水1 000 mL)、淀粉水解培养基(氯化钠0.5 g,硝酸钾1.0 g,硫酸镁0.5 g,磷酸氢二钾0.5 g,可溶性淀粉10.0 g,水1 000 mL)。
对照菌株SteptomycesbottropensisAMCC40023,由山东农业大学提供。
1.2 方 法
1.2.1 病原菌的分离、纯化
用流水冲洗病薯,自然晾干,切取病健交界处进行消毒,无菌水冲洗3次后,将切取病健交界处的组织置于无菌研钵中研磨呈成匀浆,加入9 mL的无菌水,震荡10 min,取1 mL研磨的匀浆放入含有9 mL无菌水的试管中,梯度稀释,取各梯度稀释液100 μL均匀涂布于燕麦培养基及高氏I号培养基中,置于30℃培养5~7 d后,挑取不同形态的单菌落进行纯化,接入高氏1号斜面,4℃冰箱保存。图1

图1 田间感病马铃薯块茎的症状
1.2.2 马铃薯疮痂病病原的致病性测定
马铃薯疮痂病毒素产生的致病基因有txtAB、nec1 和tomA。通过PCR 扩增技术,以标准菌株SteptomycesbottropensisAMCC40023为对照,对txtAB、nec1、tomA基因检测。产物用1.5%琼脂糖凝胶电泳检测。表1~3
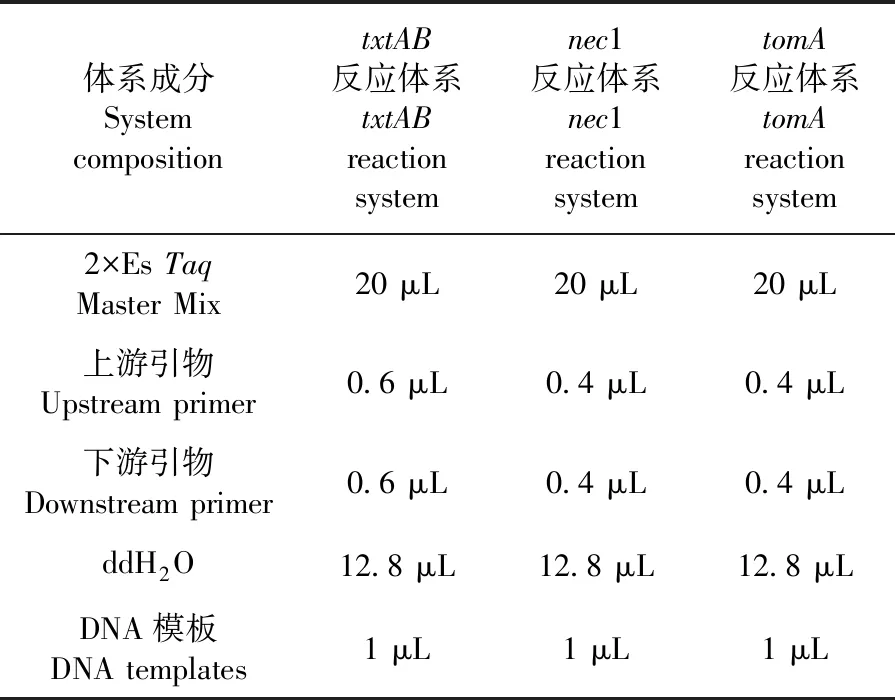
表1 PCR反应体系
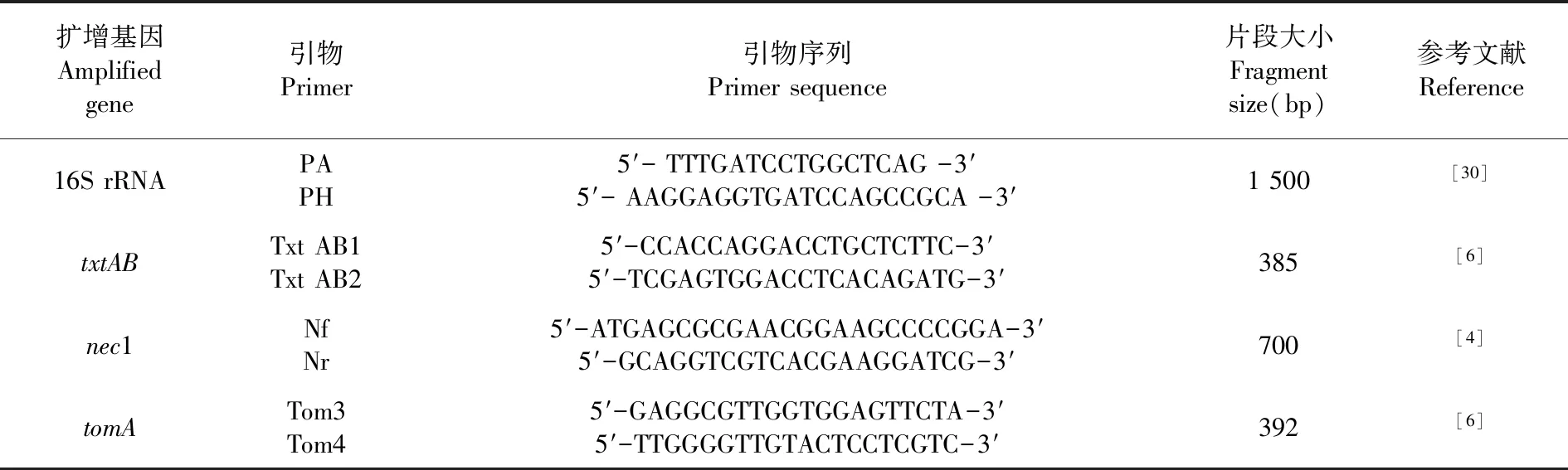
表2 菌株鉴定及相关引物序列
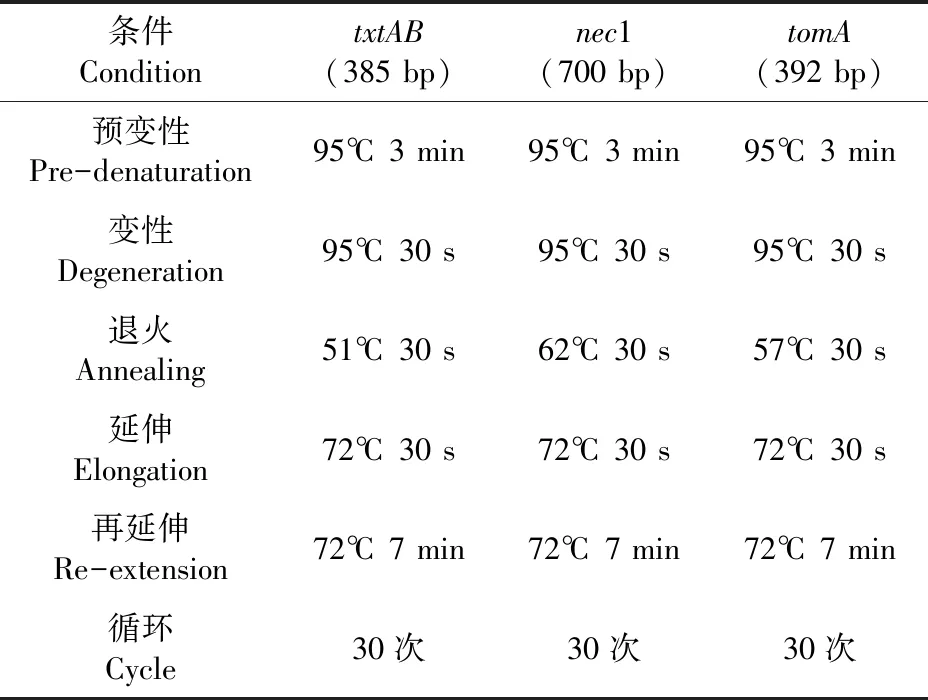
表3 马铃薯疮痂病致病基因PCR扩增条件
1.2.3 致病性测定
1.2.3.1 萝卜幼苗法
将菌株接种至高氏1号液体培养基中,30℃,150 r/min,培养7 d,用75%无水乙醇对萝卜种子表面消毒,再用无菌水连续冲洗3次,晾干,将晾干的种子放置于含有湿润无菌滤纸的培养皿中进行催芽,选取长势一致的种子分装到含有1%水琼脂的试管中,每试管放入3粒种子,将培养好的菌液200 μL接种至试管中,以接种无菌液体培养基为空白对照,每个处理重复3次,将试管放置于光照培养箱间歇培养,7 d后观察。
1.2.3.2 小薯片法
将菌株接种至高氏I号培养基中,30℃,培养7 d,选取健康的马铃薯(费乌瑞它)块茎,75%表面消毒,无菌水冲洗,用无菌打孔器在块茎上打孔,无菌手术刀切成厚度一致的薯片,放置于含有1%水琼脂的培养皿中,每皿放入4片,用打孔器在平板中打孔,将菌饼倒置放置在小薯片中央,以未接菌的培养基为对照,30℃恒温培养10 d,观察小薯片是否褐变坏死。
1.2.4 病原菌鉴定
1.2.4.1 病原菌形态特征
用接种针挑取生长7 d的菌落,接种至高氏I号培养基中,用无菌镊子夹取灭菌后的盖玻片,45°斜插在培养基中,培养7 d,在电子显微镜下观察病菌孢子链和孢子的形态特征。
1.2.4.2 病原菌生物学特性
根据国际链霉菌计划(ISP),进行病原菌的生理生化鉴定。
1.2.4.3 病原菌分子生物学鉴定
采用链霉菌16S rDNA通用扩增引物,PCR反应体系为20 μL:10 μL Mix;2 μL模板,上下游引物各1 μL,dd H2O 6.4 μL。通过1%琼脂糖凝胶电泳检测PCR产物。通用引物为PA/PH。由鼎国昌盛有限公司进行测定。测序结果在NCBI上进行比对,利用Mega7.0构建系统进化树。
1.3 数据处理
数据运用统计软件(SPSS 17.0软件)进行差异显著性分析,用Excel软件分析并作图;利用生物软件MEGA 7.0构建系统发育树。
2 结果与分析
2.1 病原菌的分离
研究表明,从新疆阿克苏地区拜城县察尔齐镇采集的马铃薯块茎样品中共分离放线菌72株,其中链霉菌28株。
2.2 马铃薯疮痂病病原的致病性测定
2.2.1 病原菌的致病基因 PCR检测
研究表明,菌株K6在385、700、392 bp大小处有清晰的条带,分别对应txtAB、nec1、tomA3种致病基因,并与标准菌株SteptomycesbottropensisAMCC40023条带一致,菌株K6同时具有txtAB、nec1、tomA3种基因。图2
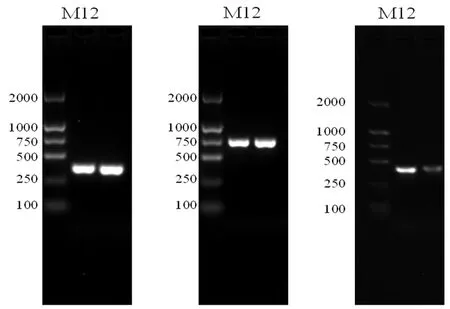
M:DL 2000 DNA Marker;1:Steptomyces bottropensis AMCC40023;2:K6菌株
2.2.2 萝卜幼苗法致病性测定
研究表明,K6菌株能够抑制萝卜幼苗的生长。图3
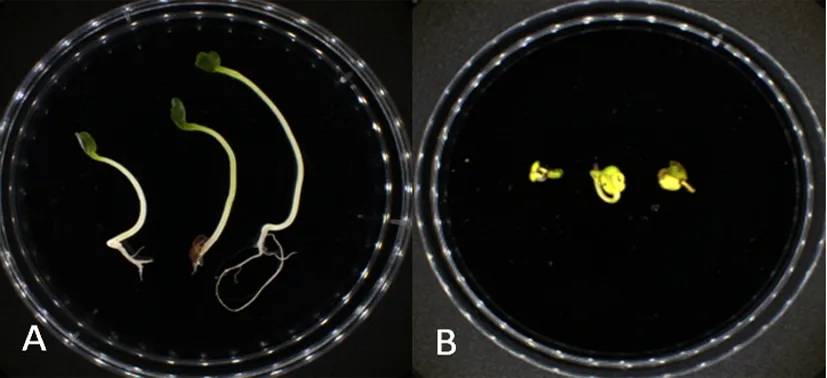
注:A:空白对照;B:接种K6菌株
2.2.3 小薯片法致病性测定
研究表明,接种菌饼的马铃薯片和萝卜片培养10 d 后,小薯片中央部位颜色变深,并产生坏死性病斑,而对照的小薯片和萝卜片无明显变化,说明K6菌株具有较强的致病性。图4
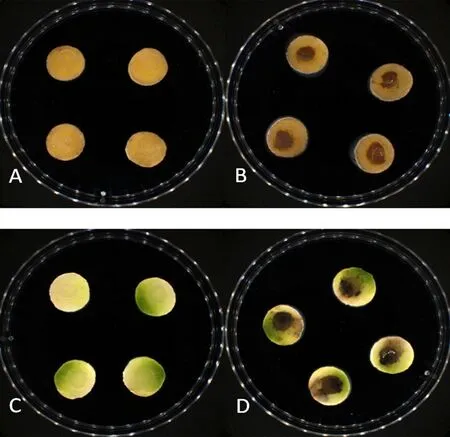
注:A:马铃薯片空白对照;B:马铃薯片接种K6菌株;C:萝卜片空白对照;D:萝卜片接种K6菌株
2.3 病原菌鉴定
2.3.1 病原菌形态特征观察
研究表明,菌株K6高氏1号培养基培养7 d后,菌落为圆形、孢子灰色,基丝红褐色,无色素产生。图5
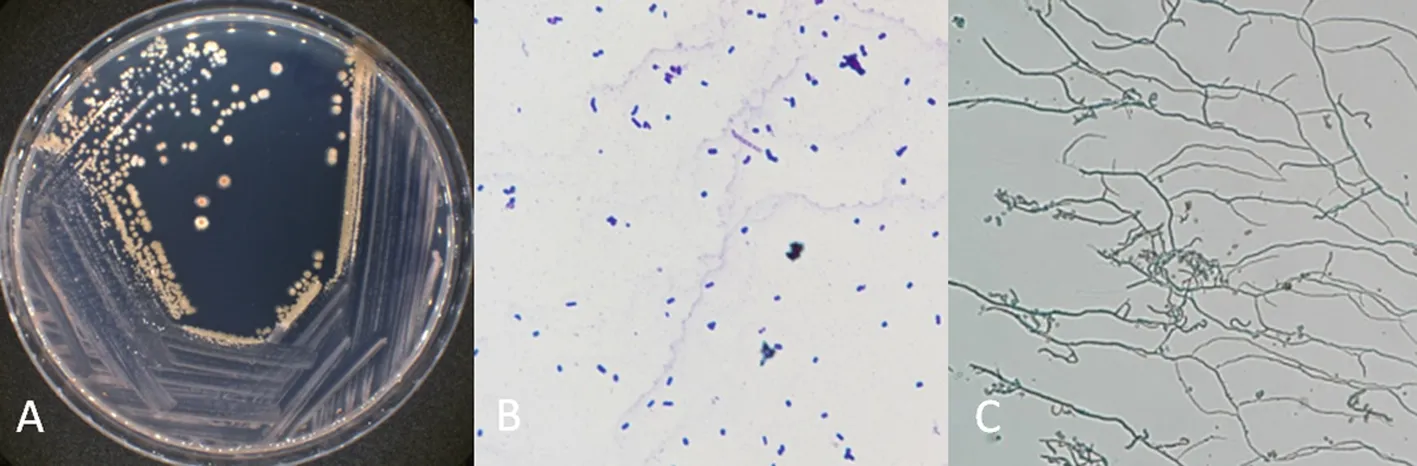
注:A:菌落形态;B:孢子形态;C:菌丝形态
2.3.2 病原菌的生理生化特征
研究表明,菌株K6能够以D-葡萄糖、D-甘露醇、棉子糖、α-乳糖、D-果糖、海藻糖、山梨醇、L-阿拉伯糖、肌醇等作为单一碳源。能够以甲硫氨酸、硫酸铵、酵母粉、组氨酸等作为单一氮源,能够产生H2S,可以使淀粉水解,对6%NaCl、苯酚(0.1%)、链霉素(20 μg/mL))敏感,在pH4的条件下不能正常生长。表4

表4 菌株K6生理生化特征
2.3.3 病原菌16S rDNA序列
研究表明,菌株K6 与S.bobili(NR 112584.1)亲缘关系最近,序列相似度为99.64%,鉴定为S.bobili。图6
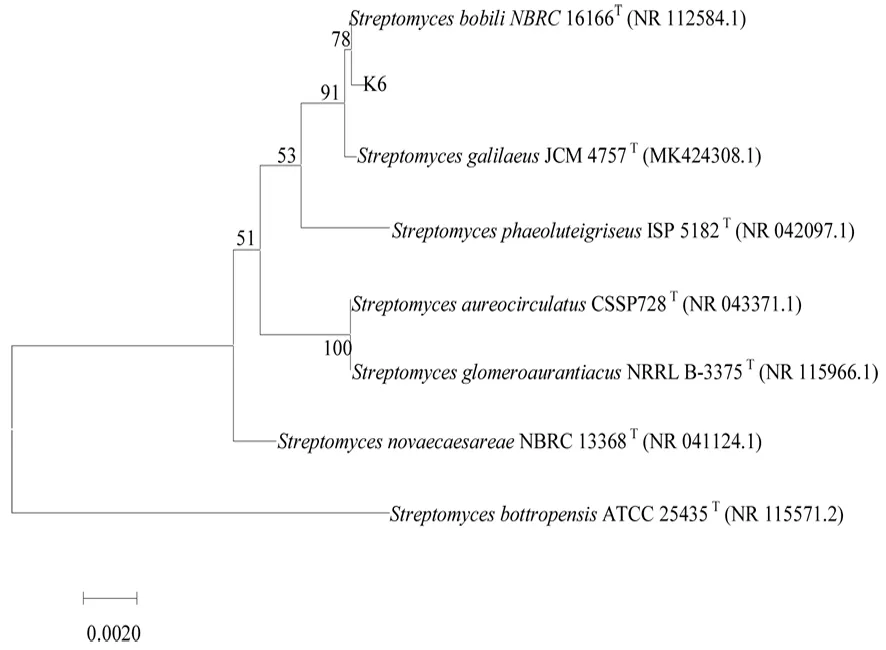
图6 基于16S rDNA构建的菌株K6系统发育树
3 讨 论
疮痂链霉菌病原多样性和种群分布受马铃薯品种、种植季节、海拔高度及土壤pH等多种因素影响,且寄主范围较广,除马铃薯外,还有萝卜、甜菜和胡萝卜等寄主[27,31]。国外已报道的疮痂病菌有30多种,其中S.scabies,S.acidiscabies和S.turgidiscabies分布最为广泛[32]。国内对马铃薯疮痂病菌的研究起步较晚,目前国内已报道的疮痂链霉菌病原有18种,杜娟在新疆伊犁地区分离到S.acidiscabies和S.scabies[30]。研究从新疆拜城县分离得到1种致病菌S.bobiliK6,在我国河北、内蒙古、甘肃、山东等省(区)地均发现该病原菌[30]。但是试验中并没有分离得到S.acidiscabies和S.scabies,可能是由于地区原因所导致。
4 结 论
引起新疆拜城县马铃薯疮痂病的病原为S.bobili,致病性较强,菌株K6的碳源和氮源广泛,能够产生H2S,可使淀粉水解,对6%NaCl、0.1%苯酚和20 μg/mL链霉素敏感,在pH4的条件下不能正常生长。
