国际近视研究院2023摘要
2023-10-11著者国际近视研究院译者龚蔚陈军杜林琳何鲜桂许迅
著者:国际近视研究院 译者:龚蔚 陈军 杜林琳 何鲜桂,2 许迅,2
1上海市眼病防治中心 上海市眼科医院/上海市视觉健康中心,上海 200050;2上海交通大学医学院附属第一人民医院 国家眼部疾病临床医学研究中心,上海 200080
近视防控的技术进步和创新步伐正不断加快。与2019年国际近视研究院(International Myopia Institute,IMI)发表的第一份白皮书相比,“护理标准”已经显著转向减缓近视的发展。
本摘要的主要目的是对近期发表的近视领域的证据进行全面和系统的回顾。本摘要的编写和呈现依赖于近视领域专家对大量已发表数据的筛选和消化,以及对所发生变化简洁总结。对于学术圈、从业者以及其他感兴趣的专业人士和公众,本摘要可作为一个简明的资源库,并提供一种记录近视领域进展的方法,以传播该领域的最新进展。2021年的年度摘要[1]回顾了自2019年2月第一套IMI白皮书出版以来近视领域的进展。
在本摘要中,专家小组明确并总结了以下关键方面:(1)近视的定义和分类;(2)正视化的实验模型;(3)近视控制临床试验和仪器;(4)控制近视发作和进展的干预措施;(5)行业指南和伦理考虑;(6)临床管理指南。
除了行业指南和伦理考虑部分是对原本的IMI白皮书进行了回顾,其余部分都提供了自2021年年度摘要发布以来近视领域的最新情况[2]。
1 近视的定义和分类
1.1 近视、高近视、远视、散光和正视的阈值
考虑到定义近视中设定固定阈值的挑战性和局限性,最初的IMI报告建议调整阈值以适应研究的性质,并在不同的阈值下提供敏感性分析[3]。最近一项覆盖了100多万名参与者的大规模人口调查描述了中国潍坊市基于人口的近视患病率数据[4]。该研究在非睫状肌麻痹的情况下进行,近视被定义为等效球镜(spherical equivalent,SE)屈光(SE refraction,SER)≤-0.75屈光度(D)。在近视和高度近视的2个不同阈值下进行分析,其中包括IMI推荐的近视≤-0.5 D水平和≤-6.0 D水平。在非睫状肌麻痹调查中,设定较高的近视阈值变得越来越普遍。He等[5]在非睫状肌麻痹的情况下,分别使用阈值≤-1.0 D和≤-5.0 D报告了近视患病率和高度近视患病率。众所周知,非睫状肌麻痹的研究将高估近视的患病率,并提供相对较高的近视屈光度,特别是在远视个体中。这些差异支持近视采用更高的诊断阈值,但不支持高度近视采用更低的诊断阈值。值得注意的是,He等[5]也报告了≤-6.0 D阈值的高度近视患病率数据,以便与先前发表的数据进行比较。
改变近视的诊断阈值来对睫状肌麻痹缺乏进行解释是一种有效的方法。在最初的IMI白皮书中,近视的定义没有对睫状肌麻痹作要求,但提及“眼部调节放松”。这是为了避免许多成人流行病学研究的潜在无效,但现在大量研究报告了非睫状肌麻痹的儿童近视患病率数据。在2021年的IMI摘要中,我们注意到在非睫状肌麻痹研究中,越来越多推荐组合使用SER阈值联合未矫正视力(visual acuity,VA)阈值来诊断近视[1]。更复杂的校正分析可能进一步提高非睫状肌麻痹近视患病率估计的有效性。例如,He等[6]使用先前发表的校正公式,包括未校正VA、年龄和非睫状肌麻痹屈光来估计真实的睫状肌麻痹屈光。
近视仍然是目前研究兴趣最大的屈光不正,而其他种类的屈光不正受到的关注较少。IMI白皮书中推荐的对近视进行定义和分类的近视和高度近视阈值是为了促进报告的一致性,并有助于研究比较和meta分析。探究其他形式屈光不正的定义是否具有高度的一致性是有意义的。最近的一项对中国人口屈光数据的meta分析纳入了41项研究,超过100万名参与者,揭示了一个有趣的模式,如图1所示[7]。在41项研究中,对-0.5 D作为近视阈值和-6.0 D作为高度近视阈值有很好的共识,但在定义内使用≤或<不一致。对于远视,人们明显倾向于使用SE≥2.0 D的阈值,但实际只有刚刚超过一半的调查(23/41)报告了远视的阈值或患病率数值。关于散光的报告显示出更多的变异性,其中SE≥0.75 D的阈值是最常见的。

图1 41项研究中用于定义近视、高度近视、远视和散光的标准,摘自Tang等[7] NA:无
在这个庞大的研究集合中,正视的定义通常是排除性的(即眼睛不符合近视或远视的条件),因此正视定义的变异性反映了近视和远视定义的变异性。尽管这导致在23项定义近视和远视的研究中有9个不同的数值定义,但其中11项研究有一个明确的共识,即正视定义为SE>-0.50 D和SE<2.0 D。这一定义可被认为是分类功能性正视的合理基础,适用于聚焦条件良好的儿童,但不适用于老年人群。此外,不同于传统的正视的光学定义,正视是一种眼睛的屈光状态,即当睫状肌完全放松时,远处的物体在视网膜上聚焦。值得注意的是,如果将正视等同于清晰的远距离视力,那么基于SE定义正视忽略了散光对视力的有害影响。
最初的关于近视定义与分类的白皮书根据SER提出了近视和高度近视的阈值,同时承认对散光和离轴屈光的考虑可能与某些研究问题更为相关。SER在流行病学和近视控制试验中的主导地位很可能是基于将屈光作为单一标量变量进行统计分析的简易性。但这是屈光状态的不完美表征。正如最近的一篇文章所指出的那样,散光和眼间差异可以更完整地描述屈光不正[8]。该研究提出的正视的绝对SE误差为<0.50 D,散光的绝对SE误差为≤0.75 D,这将提供与年龄无关的、良好的、独立的VA。在积极进行屈光不正管理时,正视可以被认为是预防近视的目标。当近视控制成功的衡量标准是最终屈光度数和/或眼轴长度(axial length,AL)接近正视值时,对正视的定义缺乏共识就更加值得注意并解决。
1.2 近视前状态
学龄儿童的屈光状态通常在数年内发生变化,远视者的近视化较慢,而近视者的近视化较快。在这个年龄段,远视可能是一种短暂的状态。事实上,由于很少有孩子天生近视,几乎所有的成人近视者都在某个时候经历过正视。近视前状态的概念在之前的IMI白皮书中被正式定义,解决了幼儿正视的动态本质。在IMI 2021年摘要中,涉及近视前状态概念的新出版物相对较少,但自那以后,它一直受到关注,并且成为近年来部分论文的焦点[9-11]。
由睫状肌麻痹验光所确定的近视前状态是中国台湾学龄前儿童中最常见的屈光状态,这一事实表明,导致亚洲近视高发率的许多因素甚至在学龄前就已经起作用了。最近,中国的一系列研究证明了小学生屈光不正存在类似分布,并将这一特征称为低远视储备,但它似乎与近视前状态的概念一致[12-14]。
许多研究试图预测近视的发生,通过近视前状态识别未来的近视患者为其早期干预提供了机会。明确发展为近视的预测因素将使近视前状态的定义更加精确。反过来,这将有助于将年轻的准近视者与稳定的正视者区分开来[10,15]。详细的纵向研究为从近视前状态到显现近视的动态发展提供了最好的前景。最近的一篇研究也强调,此类研究应该将眼睛的所有光学部件考虑在内,包括晶状体[16]。
正如IMI 2021年摘要所指出的,有几项针对近视前状态进行干预的大型试验正在进行,比如阿托品。近期一项小型试验结果表明,低浓度阿托品是一种有效的干预方法,但需要更大规模、更明确的研究[11]。
1.3 高度近视的结构性影响
最初的IMI关于近视的定义和分类的白皮书指出,关于高度近视的结构性影响的术语至今还没有得到解决。虽然病理性近视仍然是一个常用的术语来描述这个整体概念,但有一系列的术语被用来描述这种情况的各个方面。对于视网膜并发症的描述,“近视黄斑病变”和“近视黄斑变性”都是常见的,几乎可以互换使用。最近的一篇研究展示了建立健全定义所具有的挑战性。高度近视患者的脉络膜新生血管不符合病理性近视meta分析研究小组的病理性近视定义,最终未归类为年龄相关性黄斑变性或近视脉络膜新生血管[17]。
在“近视黄斑病变”和“近视黄斑变性”这2个术语所涵盖的领域中,最近的研究在大体上可以分为纵向观察性研究、解剖/功能研究和近视相关并发症干预研究。虽然这些情况和年龄之间的联系已得到了很好的记录,有价值的支持证据发表于2022年,描述了在亚洲和欧洲年龄和近视黄斑并发症之间的交互关系[18-21]。现代技术,如超广角光学相干断层扫描为病理性近视的巩膜并发症提供了新的见解[22]。在一系列提供新见解的研究中,毛细血管灌注在近视黄斑并发症发展中的作用仍然是一个重要的话题[23-25]。关于病理性近视的手术治疗,在玻璃体切割术和内界膜剥离手术结果的研究和meta分析中越来越多地使用“近视牵引性黄斑病变”这一术语[26-28]。
虽然屈光不正、AL和年龄仍然是病理性近视发展的最强预测因素,但识别其他可改变的视力丧失风险因素将是非常有价值的。来自新加坡的一项有趣的初步研究证明了自身免疫可能对近视黄斑病变产生作用,在这个16例患者的小队列中,所有患者都存在一种或多种血清抗视网膜自身抗体[29]。超过50%的患者抗碳酸酐酶Ⅱ抗体呈阳性,这种抗体在癌症相关视网膜病变患者中更为常见。这些新的研究方向很重要,因为对于成人高度近视来说,屈光度和年龄都是无法改变的危险因素。对于成长于无任何近视控制疗法时代的大量成年近视患者迫切需要进行干预研究以有效避免近视所带来的损伤视力的后果。
1.4 近视的定义和国际疾病分类 第十一版
在撰写2019年关于近视定义的IMI白皮书时,国际近视研究院世界卫生组织(World Health Organization,WHO)收到了一份提案,建议改进当时的《国际疾病分类第11次修订版》(ICD-11)草案中的几个定义。提出的描述性近视定义(代码9D00.0)已经在很大程度上纳入了当前的定义,将大多数近视归因于眼轴增长,同时认可角膜和/或晶状体的可能作用(见下面的新定义)。这一进展是对国际疾病分类第十次修订(ICD-10)定义的重大改进。ICD-11和IMI对近视的定义十分一致,只是措辞略有不同。
ICD-11近视定义:“一种屈光不正,当眼睛调节放松时,平行于视轴进入眼睛的光线在视网膜前聚焦。这通常是由于眼球从前到后太长,但也可能是由于角膜过度弯曲、晶状体屈光力增加或两者兼而有之造成的。”
IMI近视定义:“一种屈光不正,当眼部调节放松时,平行于视轴进入眼睛的光线在视网膜前聚焦。这通常是由于眼球从前到后太长,但也可能是由角膜过度弯曲和/或晶状体屈光力增加引起的。”
随着已获批准的减缓近视进展的干预措施的出现,也可以提出一个包括“进行性近视”的代码和定义。这样的代码将有助于识别可能从近视控制治疗中获益的年轻进行性近视患者。这可能是将此类治疗纳入政府和基于保险的健康计划的有益步骤。目前还没有干预方法被批准用来降低从近视前状态发展为近视的风险,但如果这种干预方法被引入,设立近视前状态的诊断代码也值得考虑。
2018年IMI还向WHO提出建议,从ICD-10到ICD-11,将已经过时的“退行性近视”替换为在临床实践中使用更为广泛的“病理性近视”。一系列同义词被建议纳入,增加对这类情况进行准确编码的机会。目前使用的术语多种多样,ICD-11编码工具的最新版本(https://icd.who.int/ct11/icd11_mms/en/release)现在包含了一个广泛的匹配术语列表,包括病理性近视,这将使编码更加一致。尽管如此,在编写本摘要时,术语退行性高度近视(代码9B76)仍然是ICD-11分类中“视网膜疾病”下列出的近视并发症的主要诊断术语,定义如下:
“发生在近视患者(通常是高度近视)的黄斑病变,导致最佳矫正视力下降,包括近视性脉络膜萎缩、近视性脉络膜新生血管和近视性视网膜劈裂。”
ICD-11中其他待定的定义包括反映近视的某些特定视网膜并发症的新代码,包括以下内容:9B76.1近视性黄斑变性;9B76.2近视性牵引性黄斑病变;9B76.3高度近视黄斑裂孔;9B76.4高度近视视网膜脱离。
在ICD-11中,退行性高度近视被归类为视网膜疾病,但未能描述高度近视的视力威胁并发症,如后巩膜葡萄肿和近视相关视神经病变。由于视网膜、视神经和巩膜疾病属于不同的类别,这些额外的特征在ICD-11的层次结构中难以体现。因此,在现有的结构中,退行性高度近视可以用WHO批准的术语“近视黄斑变性”或“近视黄斑病变”来代替。定义也可以进一步更新,以近视牵引性黄斑病变取代近视视网膜裂孔,以更好地符合当下的用法。这就需要将高度近视的视神经和巩膜并发症放在分类结构中其他位置。
视神经疾病,如青光眼视神经病变(9C40.9),在代码9C40(视神经紊乱)的“视觉通路或中心紊乱”类别下列出。高度近视相关视神经病变可以合理地与9C40.10归为同一组。虽然已有巩膜葡萄肿(9B52)的编码,但退行性近视(9B76)被明确排除在外。因此,在目前的分类中不存在近视相关性后巩膜葡萄肿,而“高度近视后巩膜葡萄肿”的编码如9B53是有充分理由的。这样的解决方案将在ICD-11中为病理性近视的组成部分提供一个连贯的位置,但将该术语本身作为涵盖所有近视结构性并发症的总体概念。这也符合2019年IMI白皮书的观点。
鉴于这些问题的复杂性和目前使用的术语范围,可能需要一段时间才能达成共识,但在ICD-11中为结构性复杂性建立一个逻辑框架将是一个良好的起点。明确ICD-11对各种结构性近视并发症的分类和定义,也可能帮助人们注意到需要更好的干预措施来改变病理性近视的自然史。
2 IMI摘要-正视和近视的实验模型
在眼球生长领域使用动物模型有助于我们对近视的理解和制定治疗策略。研究人员使用动物模型证实,正视化是一个基于视觉反馈的主动过程[30]。在此基础上,形觉剥夺和离焦诱导的实验性近视为研究视觉信号和药物对眼睛生长的影响提供了框架,在许多情况下,这已经转化为儿童近视控制策略。本文回顾了自IMI 2021年摘要以来该领域的现状,并介绍了利用动物模型研究正视和近视的新发现。
2.1 信号通路
当暴露于离焦时,视网膜产生信号级联,该信号级联通过视网膜色素上皮和脉络膜,最终对局部邻近巩膜的成纤维细胞产生影响。巩膜成纤维细胞引起细胞外基质的改变,从而促进或抑制巩膜的重塑和玻璃体腔深度的改变。然而,化学信号和候选基因网络介导视觉引导的眼球生长尚未得到很好的理解。关于脉络膜,Summers和Martinez[31]在雏鸡身上证明了一种促炎细胞因子白细胞介素6可能在眼球生长的脉络膜反应中起重要作用。在巩膜中,Wu等[32]证明了lumican过表达通过调节TIMP-2、MMP-2和MMP-14的表达导致大鼠形觉剥夺,并导致巩膜成纤维细胞凋亡。另一项近期对雏鸡进行的研究,对比了5种成熟的不同的抑制近视的方法,发现各方法均普遍激活转录因子EGR1及其下游产物,表明存在一个不能绕过的定义明确的视网膜网络[33]。后续研究将进一步明确影响眼轴增长的视网膜到巩膜的信号通路,这有助于提高对近视的认知和开发新的治疗干预措施。
2.2 致近视刺激的时间整合
在动物模型中,使用正(+)透镜的强制近视模糊持续减缓眼球生长,导致远视,而使用负(-)透镜的强制远视模糊会增加眼球生长,导致近视。使用长期综合视觉体验来评估离焦的程度和症状,发现相对短暂的近视模糊能够抵消相对较长时间的远视模糊[2,7,8]。
Zhu等[34]最近报道,与之前对雏鸡的研究类似,当短期暴露在视力不受限制或一天中大约10%的黑暗中时,远视离焦狨猴的近视进展较少。这些发现表明,正视化离焦信号的整合在本质上是非线性的,这对儿童近视控制策略的应用具有重要意义。
2.3 外周视网膜作为近视的控制目标
在恒河猴实验中一个更重要的发现是,中央凹对正视化并不重要[35],这意味着外周视网膜可以调控眼球的生长。这一结果对我们对正视化的认识和近视控制光学镜片的设计产生了深远的影响。最近在恒河猴身上进行的一项研究试图描述离焦通过外周正向屈光力影响屈光发育[36]。外周距中央凹20°以上的近视离焦对屈光发育的调控不一致。这些发现强调了在动物模型中进行对照研究对于设计有效的儿童近视光学治疗方法的重要性。
2.4 药理治疗
基于先前对恒河猴和人类的研究,口服一种咖啡因的代谢物,7-甲基黄嘌呤(7-methylxanthine,7-mx),被发现对减缓近视有效[37]。咖啡因和7-mx都是非选择性腺苷受体拮抗剂。咖啡因可以合成局部眼药水,并且已经是一种常见的、耐受性良好的膳食元素。研究结果表明,在预防恒河猴实验性近视方面,外用咖啡因与口服7-mx同样有效[38]。接受局部咖啡因治疗的猴子的眼球生长速度减慢,反映为玻璃体腔深度缩短和脉络膜厚度增加。这些发现表明,局部咖啡因治疗可能在儿童近视的治疗策略中具有潜力。然而,最近越南的一项研究表明,与未经治疗的近视儿童相比,2%的局部咖啡因治疗在减缓儿童近视进展方面没有积极作用[39]。
2.5 昼夜节律、多巴胺和照明强度
50多年来,人们一直认为昼夜节律和正视化是有联系的[40]。大量的研究表明,白天的光线,特别是户外的高强度光线,本质上激活了感光的视网膜神经节细胞(intrinsically photosensitive retinal ganglion cell,ipRGCs),该细胞与多巴胺能无突出细胞相互联系[41]。多巴胺在白天释放,已被证明可以减少眼睛的近视倾向[42-43]。最近对雏鸡[44]、豚鼠[45]和老鼠[46]的研究进一步支持多巴胺在正视化和近视中的作用,研究结果指向D2样受体机制[47]。在雏鸡中,左旋多巴(多巴胺的前体)和左旋多巴+卡比多巴都能抑制剥夺性近视并增加玻璃体多巴胺[44]。该研究认为,左旋多巴与卡比多巴联合使用可能是控制儿童近视的一种潜在的治疗方法。
ipRGCs含有光色素黑视素,投射到视交叉上核,传递环境光信息,调节昼夜节律。最近的一项研究使用了2种基因敲除小鼠:一种缺乏黑视素(由基因OPN4编码)但仍有ipRGCs,另一种完全缺乏ipRGCs[48]。研究结果显示,缺乏黑视素的形觉剥夺小鼠中视网膜多巴胺信号减少,近视增加。此外,全身左旋多巴治疗可以部分逆转近视。该研究得出结论,黑视素对小鼠屈光发育和减缓近视进展至关重要。
此外,还研究了环境光照降低(约50 lux)对恒河猴晶状体诱发性近视的影响[49]。虽然这种低光照强度并不直接导致近视,但它显著降低了矫正屈光不正的能力矫正近视。这些发现与先前的研究一致,表明至少一定程度的高强度光照对最佳屈光发育至关重要[50]。
2.6 纵向色差
几乎所有脊椎动物照相机式的眼睛都有明显的纵向色差(longitudinal chromatic aberration,LCA)∶短波聚焦在长波前面[51]。因此,LCA似乎是一种理想的正视化的视觉提示,因为离焦的程度和表征都可以从较短和较长波长的视网膜图像的相对清晰度推断出来。然而,一些早期的结果表明,实验动物可以在光谱窄带光下正视,这不会为离焦提供LCA线索[52-54]。因为短波视锥细胞在空间上通常是稀疏的,并且似乎不足以准确地判断离焦以实现正视,因此LCA并不被认为是正视化的关键。然而,最近的研究结果表明,离焦的色彩线索对于精确的正视化通常是必不可少的[55],光学建模表明,短波视锥细胞的空间分布足以利用LCA来精确介导正视化[56-57]。最近一项以树鼩为对象的研究表明,带有近视模糊色彩模拟的视频显示终端可以克服近视性环境,进一步证明了色彩线索对正视化的巨大效力[58]。
2.7 窄带环境照明
虽然正视化通常是在宽带光谱照明下进行,但考虑到颜色线索的显著重要性,对环境光谱特别是窄带光的剧烈改变对正视化产生深远影响也就不足为奇了。
2.7.1窄带长波长光——红光和琥珀光 长波红光在树鼩[59-61]和恒河猴[62,63]身上都能产生强大而一致的远视化/抗近视作用。最近的研究表明,琥珀色的光跨越了相对较宽的频带,但缺少了短于500 nm的频带,也会促进树鼩远视[64]。然而,在其他常见的近视动物模型中,长波光并没有被发现会一致地减慢眼球生长。事实上,红光饲养可以促进鸡[54、65-66]、豚鼠[67-70]和鱼的眼球生长[71-72]。红光尚未在老鼠身上进行广泛研究,尽管一项研究确实表明红光会促进老鼠的远视[73]。目前,对于长波环境光在不同物种之间的影响差异,还没有足够的解释,这仍然是该领域的一个主要难题。然而,树鼩和恒河猴的研究结果最近被转化为短时间红光疗法,以控制儿童近视[74-75]。为了解长波光对眼睛生长的剂量-反应效应和潜在的作用机制,需要进行进一步的动物模型实验。
2.7.2窄带短波长光——蓝光和紫光 蓝光和紫光比红光和琥珀光的波长更短、能量更高。有研究报道,用蓝光饲养雏鸟可以减缓形觉剥夺性近视[76],而且,在豚鼠中,可能通过维甲酸相关的机制来减缓离焦引起的近视[77]。另一方面,蓝光会导致树鼩眼球生长失调,最终导致从远视到近视的各种屈光不正[78]。
最近,人们的注意力转向了紫光,其波长在360到400 nm之间,在室内环境中基本没有,并且大多数被眼镜和接触镜阻挡。此外,眼介质也能过滤掉大部分该波长的光[79]。已经有研究提出,缺乏紫光照射可能会引起近视,而增加紫光照射可能有助于预防近视[80]。目前,大多数关于紫光的研究都是在老鼠身上进行的,发现了一种新的视蛋白神经胶质蛋白,或称OPN5,其吸光度峰约为385 nm[81],同时人体临床试验表明紫光确实可能抗近视化[82],最近一篇关于小鼠的研究表明,紫光通过OPN5介导的机制抑制晶状体诱导的近视[83]。同样,基于来自小鼠的数据,有人认为视网膜固有的昼夜节律是由紫光和OPN5介导的[84],尽管这种解释一直存在争议[85]。这一领域的研究随着时间在持续增多,未来可从其他动物模型中获得更多实验数据,尤其是来自眼介质吸收特性接近人类的日间哺乳动物。
2.8 ON与OFF通路
所有经典的光感受器(视杆细胞和视锥细胞)依赖于光照发生超极化。在第一个突触,视网膜产生ON和OFF通路,这对于检测亮度的增加和减少很重要。有证据表明,正视化更多地依赖于ON通路,而不是OFF通路[86,87],并利用动物模型继续探索这一主题。进一步支持了ON通路对于视网膜加工比OFF更重要的观点,最近一篇关于小鼠的论文表明,ON通路破坏比OFF通路破坏导致更大的视觉功能和多巴胺信号缺陷[88]。值得注意的是,虽然短波长和长波长敏感的视锥细胞都有专用的ON双极细胞,但短波长视锥细胞缺乏OFF双极细胞[89]。因此,可以只使用ON通路而不能只使用OFF通路来计算短波长与长波长的色度信号(或者至少不那么容易)。可以想象,ON相对于OFF通路的重要性可能是由于正视化依赖于短波长和长波长对比度。对这一领域进一步研究可以深入了解驱动正视化的特定视网膜回路。
2.9 巩膜交联
随着年龄的增长,正视化最终停止,可能是因为胶原纤维之间自然交联的积累使巩膜相对固定[90]。因此,有人提出,加速巩膜中的胶原蛋白交联可能是控制近视的一种有效手段[91]。最近一项对树鼩使用球后注射交联剂的研究显示,巩膜交联可以有效抵抗形觉剥夺近视[92],但也与显著的视网膜病变相关[93]。豚鼠的巩膜交联也会产生病理改变[94]。先前对家兔的研究表明,使用蓝光-核黄素联合诱导巩膜交联可以增加巩膜的刚度,且不造成病理性改变[95]。虽然最近另一项针对恒河猴的研究也表明,这种方法是相对良性的,但到目前为止,这种方法在减缓近视方面的有效性尚未得到证实[96]。巩膜交联在原则上可以成为控制近视的有效手段,但必须开发出诱导巩膜交联的安全技术。
3 近视控制临床试验和仪器
2019年IMI临床近视控制试验和仪器报告[97]回顾了当时进行至少1年的近视控制试验的证据,以及辅助支持的学术文献。IMI 2021年度摘要更新了这一证据[1]。这些综述为未来临床试验的设计提供了有依据的建议,以证明治疗对减缓近视进展的有效性,以及这些治疗对患者的影响。截至2022年9月的相关已发展文献包括5项关于眼镜干预的研究[98-101](1项部分时间佩戴单光镜)[102],4项软性角膜接触镜(soft contact lens,SCL)试验[103-106],1项角膜塑形镜研究[107],10项阿托品(其中一项前瞻性试验中只有一半受试者评估了疗效)[108-117],以及阿托品联合角膜塑形镜的试验[118]或SCL[119]或耳穴刺激[120]。近视控制的前瞻性临床试验数量有所增加。2018年有25项试验[97],2018—2020[1]年另有12次试验,2020—2022年再进行26次试验。此外,还有2项涉及硬性角膜接触镜[121]及阿托品[122]的回顾性试验,但未包括在本报告中。
3.1 参与者选择标准
最近的试验主要使用了睫状肌麻痹屈光,参与者的选择标准为最大散光-0.75~-2.50 D(通常在光学干预研究中较低),最大屈光参差1.00~2.00 D(尽管在一些研究中没有报道),最短距离VA从16/20到20/40(尽管相较于以前推荐的20/20,更多地使用20/25,一项研究表明,在不同最大尺寸的图表中,所读取的LogMAR字母的数量会有所不同)[107],最小年龄为3~9岁,最大年龄通常为10~16岁(表1)。招募高度散光和屈光参差的患者使得评估任何近视干预的效果变得更加困难,因为他们可能有非常不同的光学环境(例如焦深增加)[123]。因此,建议排除这些患者,除非将其作为研究的重点。儿童近视的发展随着年龄的增长而减缓。因此,以毫米或屈光度为单位记录眼球生长时,在持续数年的试验中16岁以下的高龄儿童可能会降低干预的有效性。另一方面,如果治疗效果以百分比降低的形式报告,那么正如前面强调的那样[1,124],招募年龄较大的儿童可能会产生虚假的更好的疗效表现。招募年龄较大的儿童也增加了复杂性,例如,在新的研究性设备/药物试验中需要额外的排除标准,如“对具有生育能力的女性进行阴性妊娠试验”。根据证据,除了最低VA外,似乎没有任何先前推荐的参与者选择标准需要修订。因此,更新后的参与者纳入标准如下:

表1 近期前瞻性近视控制临床试验的选择标准
(1)屈光不正:每只眼的扩瞳后柱镜值或SE至少-0.75 D;每眼散光≤1.00 D;屈光参差≤1.50 D;(2)年龄:6~12岁;(3)视力:每眼0.10 LogMAR。排除标准:(1)病史 既往佩戴硬性接触镜或接受近视控制治疗;(2)眼部疾病:任何(近视除外);(3)双眼视力:异常(斜视);(4)全身性疾病:可能会影响视力、视力发展或治疗方式的疾病;(5)药物:可能影响瞳孔大小、调节性或对眼部组织有影响的药物。
偏离这些标准通常会导致一种治疗方法的疗效被显著低估或高估,而治疗方法的差异使不同的研究更难进行比较[124]。值得注意的是,年龄、VA、散光和屈光参差的纳入标准最近有所扩大,这也反映在最近发表的近视控制研究中。
3.2 研究设计
过去,大多数研究随访队列2年时间,在一些研究中有额外的1年用于检查是否有反弹,如今研究结果会更早发表[74,102,106,111,114,120,125]和/或变得更复杂,有时涉及更长时间的“交叉”为对照组[103]或者更长时间的追踪快速进展的近视[109](表2)。然而,所有的研究仍然显示,在第2年,治疗的有效性有所降低,这表明需要进行1年以上的随访,以充分评估治疗的长期疗效。将1年的治疗效果外推到多年后(例如,许多近视计算者所采用的一种方法)可能会导致不正确的结论[124],因此,目前仍支持之前IMI建议临床试验评估的近视控制疗效应以3年为最低研究时间(至少2年的治疗加上额外的1年无治疗检查反弹效应)。最近的研究没有应用随机化[109,119],而一些应用随机化的研究没有适当设盲[102,105,107,113],且常对参与者进行分层[99,104,105,112,116,118,120],最近的几项研究没有设置对照组[109,111],而其他一些研究则使用了历史对照[98,119]。尽管如此,大多数研究还是选择了适当的对照,在使用不易设盲的角膜塑形镜和硬性角膜接触镜的情况下,使用单视眼镜(single-vision spectacles,SVSs)作为对照[107]。然而,一些阿托品研究[110,115]和一项SCL研究[105]使用SVS作为对照(没有滴药),因此参与者无法设盲,依从性可能会发生改变。此外,许多研究并没有试图对对照组进行真正的设盲[74,82,113,120,125],从而增加了潜在的误差。

表2 近期近视控制临床试验的对照组、随机化和设盲
尽管越来越多的证据表明各种近视控制疗法的有效性,但在研究中纳入对照组的伦理困境仍未得到解决[1]。终止治疗以调查反弹的可能性也提出了类似的伦理问题。正如行业指南和道德考虑部分所强调的,一些研究遇到了很高比例的对照组退出(特别是如果参与者没有被很好地设盲)和父母不希望自己的孩子冒险接受安慰剂,对照组也更难以招募。另一种方法是使用最近2项研究采用的历史对照,但需要仔细匹配重要的协变量,如年龄、性别、季节(较短的研究)、屈光不正、AL、环境暴露、父母近视和种族/民族。其他替代方法包括与金标准的比较,尽管其等效性分析或生存分析存在需要仔细考虑[126-127],例如参与者近视进展超过-0.50 D所需的时间,允许安慰剂参与者早期退出,而其他治疗仍然有益,但这种方法排除了更长时间内疗效的评估。多地点研究通常包括更多的参与者,从更广泛的地理位置招募的人群队列,以及跨研究地点比较结果的能力,所有这些都增加了研究结果的普遍性,但到目前为止,多地点研究很少见[99,128]。
3.3 结果检查
近视进展临床试验的结果仍可分为原发性(屈光不正和/或AL)、继发性(患者报告的结果和治疗依从性)和探索性(外周屈光、适应性变化、眼对齐、瞳孔大小、户外活动/光照水平、前后节成像和组织生物力学)[97]。视觉障碍(主观报告的症状,如光晕和眩光或客观测量,如光饱和度测定法)和患者报告的结果已添加到2021年摘要中不同治疗方式的最低数据要求中[129]。此外,脉络膜厚度已被推荐为一项关键探索和可能的预测性指标,用于所有形式的近视控制(表3;见IMI 2023脉络膜白皮书)[132]。

表3 每种方法预期检查的最少数据
IMI 2021年摘要提倡在未来的临床试验报告中报告近视进展/眼轴增长减少的百分比和绝对值[129],这一观点得到了不久后发表的立场文件的支持[124]。百分比可能会产生误导,因此不应该单独报告。95%置信区间也应该连同变化幅度一起报告。亚组分析必须事先计划,并进行适当的统计力/样本量计算。任何事后亚组分析都应明确确定为探索性的,应用于形成新的假设,而不是证明疗效。
3.4 仪器仪表
基于A扫描(传统上称为生物测量仪)[133]和B扫描(称为光学相干断层扫描)[131,134,135]成像和分割脉络膜厚度(特别是使用机器学习)来更好地理解近视控制的机制,也可以作为治疗的长期疗效的潜在预测因子(见IMI 2023年脉络膜白皮书)[132]。一个主要使用基线瞳孔面积、3 mm(平坦)和5 mm(平坦/陡峭)角膜测量区1个月变化的模型能够预测使用角膜塑形镜1年AL增长的54%~63%的变化[136]。此外,已经开发了利用人口统计学、非睫状肌麻痹SER、AL/角膜曲率半径比、未校正VA和眼压来预测屈光不正的模型,结果解释了中国学龄儿童(5~18岁)92%~93%的变异性[137,138]以及日本儿童(2~9岁)96%的变异性[139]。
4 控制近视发病和进展的干预措施
减缓近视发展的干预措施日益成为“护理标准”,专业光学产品的使用率也在稳步上升[140]。此外,正在探索联合或多模式干预措施(例如,角膜塑形镜与低浓度阿托品),目的是提高疗效。回顾IMI白皮书[141]和2021年度摘要[1]以来的证据,此次更新主要限于近期前瞻性、随机临床或分组匹配试验的结果,重点关注将SE屈光不正和/或AL数据作为疗效和治疗停药反弹效应的关键结局指标。本摘要未全面综述涉及视觉表现和安全等方面的数据;也未对来自不符合标准临床试验设计的研究数据(例如各种研究[102,142-146])进行全面综述。
4.1 眼镜镜片设计
新颖的眼镜镜片设计在近视控制方面代表了一个显著发展的领域。2021年摘要中介绍的离焦合并多区(defocus incorporated multcfocal segments,DIMS)镜片的新性能数据现已发布。具体来说,在试验的第2年结束时,一些对照组的孩子从SVS镜片换成了DIMS镜片,并与DIMS组一起随访了1年,2个组的孩子都在10岁左右。与前1年相比,从对照组切换到DIMS组的儿童近视进展明显减少(即SE/AL变化为(-0.52±0.69)D/(0.31±0.26)mm vs (-0.92±0.81)D/(0.57±0.33)mm),与第1年使用DIMS的儿童进展相当。然而,值得注意的是,年龄是AL比较中的潜在混淆因素。
另外2种密切相关的眼镜镜片设计(在外周有较低或较高的非球面微透镜,分别为SAL和HAL)也有2年的临床试验数据(表4)[101,147]。8~14岁的儿童被随机分配佩戴SAL、HAL或SVS镜片。2种镜片的近视进展都明显减少,HAL镜片的效果优于SAL镜片[147]。以未经调整的SER和AL的平均变化为指标,在第1年末的近视控制效果明显且持久;2年后,与SVS相比,HAL和SAL透镜组的进展仍然显著减少:HAL、SAL和SVS透镜组的SER分别为-0.66(0.09)、-1.04(0.06)和-1.46(0.09)D,AL分别为0.34(0.03)、0.51(0.04)和0.69(0.04)mm[101]。
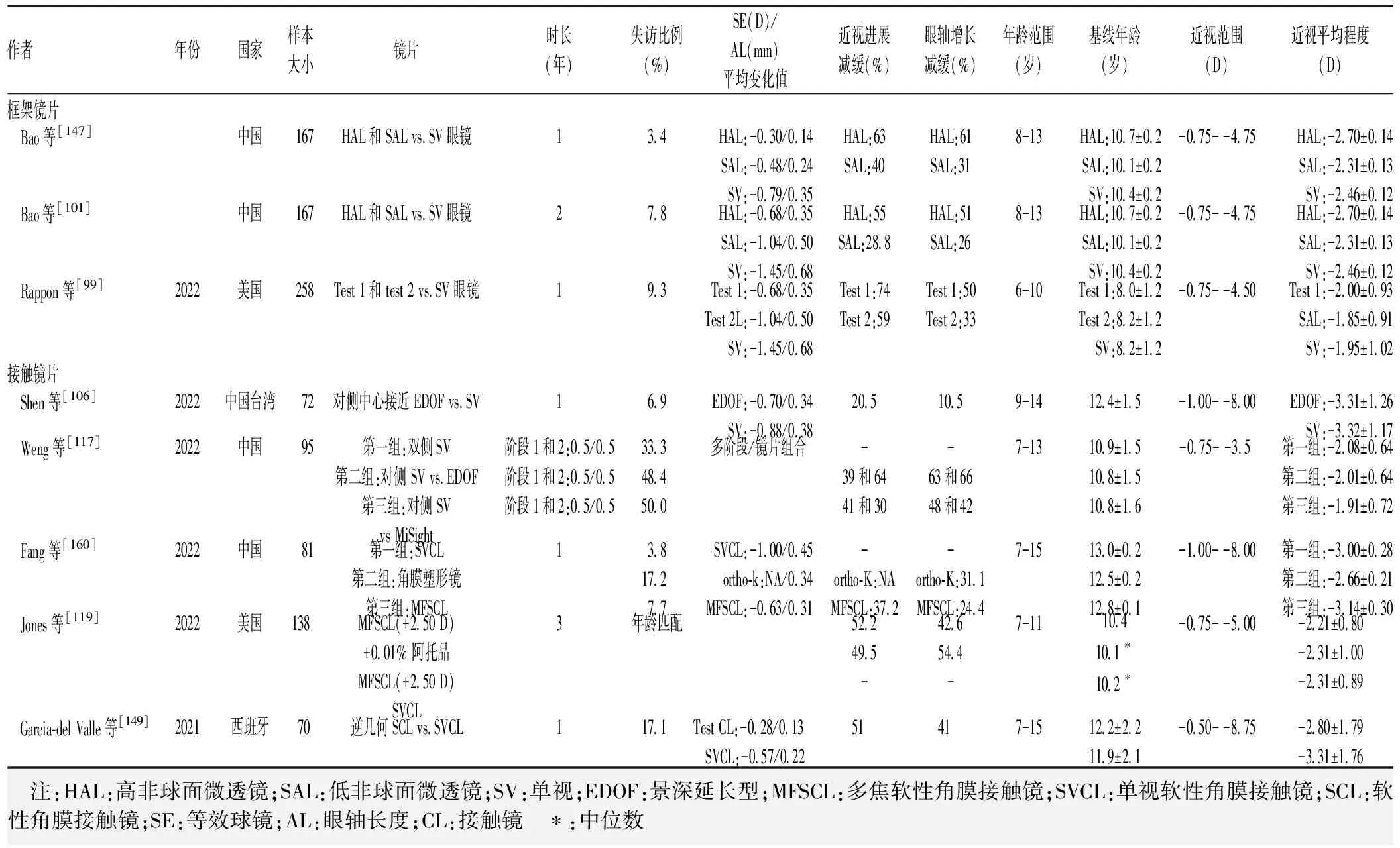
表4 涉及新型眼镜或软性角膜接触镜的近视干预试验的关键研究设计特征和结果总结
第1年的数据现在也可用于另一种新型眼镜镜片设计的3年试验,该设计采用扩散光学技术,旨在降低空间对比度(只有一小块,约5 mm,镜片的中心区域没有扩散元件)。在这项试验中,6~10岁的儿童被随机分配佩戴浅色的SVS镜片(对照组)或点密度不同的2种测试镜片中的一种,其中测试镜片1的点密度比测试镜片2低。第1年的测试结果表明,近视控制效果良好,其中使用测试镜片1的效果明显更好。测试镜片1和测试镜片2的SER/AL平均变化为-0.14 D/0.15 mm和-0.22 D/0.20 mm,而使用SVS镜片的SER/AL平均变化为-0.54 D/0.30 mm。
4.2 SCL设计
最近的临床试验证实,近视控制策略对年龄较大的儿童是有效的。在一项为期3年的双焦点与单焦点SCL(SV SCL)试验的扩展中,一组大约13岁的参与者继续使用双焦点SCL 3年,在此期间,发现从SV SCL切换到双焦点SCL的患者近视进展明显减缓,并且继续使用双焦点SCL患者的治疗效果仍持续[103]。
在一项为期12个月的随机、对侧交叉临床试验中,包括双眼SV SCL、对侧SV与景深延长型(EDOF) SCL,以及对侧SV与MiSight SCL(对侧组按眼睛随机分配镜片),发现与SV SCL相比,EDOF SCL和MiSight SCL都能减缓近视进展,且疗效相似[148]。参与者年龄在7~13岁之间。在另一项类似设计的试验中,靠近中心的EDOF SCL与SV SCL相比,可显著减缓近视进展[106],但其治疗效果(比如,0.18 D/0.04 mm)与其他设计镜片相比小一些。
近视控制接触镜(contact lens,CL)设计清单在不断增加。一个定制的、车床切割的SCL加上在前边表面增加外围渐进的+2.00 D就是其中一种设计。这个设计的细节很少,其反向几何设计旨在帮助镜片的稳定性,同时提供连续的外围离焦[149]。在一项涉及7~15岁儿童的SCL随机试验中,近视进展在12个月内减少了约50%(如SE/AL的平均变化为-0.28 D/0.13 mm,而对照组为-0.57 D/0.22 mm)。
4.3 角膜塑形镜
新颖的(直距)镜片设计是最近一些小规模试验的主要研究对象。在一项涉及对侧设计的此类试验中,试验18个月后,传统的角膜塑形镜与多焦点角膜塑形镜(中心距离+2.50 D)的AL增长有显著的不同,这与后者的优越疗效一致[150]。另外2项研究的共同结论是,通过减小角膜塑形镜的后视区直径(back optic zone diameter,BOZD)可以加强近视控制效果。在一项研究中,与6 mm BOZD镜片相比,5 mm BOZD镜片在12个月内AL增加了 0.72 mm(表5)[151],治疗区域的差异也与AL变化呈正相关。第2项研究涉及了青少年[(13.34±1.38)岁],报道在12个月内AL伸长的绝对值减少了0.13 mm[152]。压缩系数代表了角膜塑形镜的第3个设计特征,新型角膜塑形镜与传统角膜塑形镜(即额外的1.00 D压缩系数)相比,AL增长较慢,压缩系数更高(1.75 D vs.0.75 D),配戴镜片2年后,AL增长延缓34%(0.35±0.29 mm vs.0.53±0.29 mm)[153]。

表5 在角膜塑形镜的各种研究中报告了眼轴增长(mm)
角膜塑形镜作为一种控制屈光参差的干预手段的功效最近也被探讨[154-158],一致认为这是一种有效的治疗方法。特别是近视程度越深,AL增长越慢,有效地减少了屈光参差。在另一项值得关注的研究中,20名最初根据眼轴增长率被归类为缓慢进展者的受试者在从SVS切换到角膜塑形镜后7个月没有出现显著临床变化,而24名被确定为快速进展者中21名却出现了显著变化。
在另一项比较疗效的试验中,非球面多焦软性角膜接触镜(multifocal SCLs,MFSCLs,+6.00 D max,外周屈光力)、角膜塑形镜和SVS镜片被纳入了一项为期1年的单盲随机临床试验,以AL变化作为进展指数[160]。该研究显示,MFSCL与角膜塑形镜疗效相近;AL变化分别为0.30和0.31 mm,而SVS透镜的AL变化为0.41 mm[160]。
4.4 药物干预
4.4.1口服7-甲基黄嘌呤 这种腺苷拮抗剂,与咖啡因类似,并已获批在丹麦使用[161],其中,数据来自7~15岁的患者队列(<-0.5 D或更严重的近视;n=711),被用于检测年龄和剂量(400~1 200 mg)的影响;主要的结论是,该药呈剂量依赖性,即最高剂量提供了最好的控制效果。
4.4.2局部应用阿托品 局部应用阿托品仍然是唯一可广泛获得的疗效确定的眼科制剂,但其组成成分的差异可能会影响结果[162]。最近的数据表明,至少在中国儿童中,年龄较小的儿童需要更高的浓度来实现类似的近视进展控制效果[110,163](如0.05%和0.025%分别对应6岁和8岁)[110]。浓度和年龄影响反弹反应在LAMP研究的第3年数据中得到了很好的证明,该研究比较了洗脱期(无治疗)与继续治疗(0.05%、0.025%和0.01%)相比。那些之前接受更高浓度治疗的患者表现出更快的(反弹)进展,对于年龄较大的年龄组,洗脱组和继续治疗组之间的差异较小[116]。在另外2项值得关注的研究中,第一项研究使用单眼0.125%阿托品干预屈光参差的AL较长眼,发现通过减缓AL增长可以有效减少眼间差异[164];第2项研究是一项涉及近视前儿童(4~12岁)和0.01%阿托品的小型试验,表明局部阿托品可以延缓近视的发生[165]。
局部阿托品和近视控制光学干预的联合试验产生了混合结果,在一项为期3年的试验中,使用MFSCL加上+2.50 D[119],每日添加0.01%的阿托品并没有改善疗效。然而,在另一项随机临床试验中,涉及一个单独的角膜塑形镜(OK)组和一个联合0.01%阿托品-角膜塑形镜(AOK)组,在2年的试验结束时,AOK组的眼轴增长明显慢于OK组[166]。较慢的眼轴增长也与感光瞳孔大小的明显增加有关,这可能意味着高阶像差的增加是定向离焦模式的来源[166]。
4.5 反弹效应-光学干预与药物干预的相对风险
长期使用药物后观察到的反弹现象与光学干预的相关性存在争议。因此,MiSight SCL停戴后的进展与SVS相似也就不足为奇了,尽管该研究的样本量较小。在一项比较EDOF和MiSight SCL与对侧SV SCL进展的试验中,在停戴2种SCL后,没有观察到反弹[117]。
4.6 光疗法
自2021年以来,已有4篇出版物报道了涉及低强度红光(low-level red loght,LLRL)治疗的临床试验结果和一篇回顾性研究[74,75,167-169]。在所有情况下,受试者每天接受2次3分钟的LLRL直接暴露,间隔至少4小时,通过台式,长波长(635~650 nm)激光二极管装置作为光源,能量输出范围为0.29~0.4 mW。在一些病例中,治疗仅限于工作日,参与治疗的主要是儿童。在一项回顾性研究中,儿童的年龄低至3岁,只有一个短期(6个月)的试验包括假治疗,以较暗的红光治疗(0.03 mW与0.29 mW相比)进行干预,最长的随访期为2年,168例患者的AL/SE变化为(0.16±0.37)mm/(-0.31±0.79)D,而单独使用SVS的AL/SE变化为(0.64±0.29)mm/(-1.24±0.63)D。虽然大的治疗效果(通常比其他药物和光学干预报道的效果更大)引起了很多关注,但仍有与这些试验数据相关的重要问题需要解决。所有研究的一致之处是,大量眼睛早期(在第1个月内可检测到)AL收缩,近视(即远视移位)也随之减少[74,168],同时脉络膜增厚,而对照组脉络膜变薄。然而,这种AL收缩的机制仍然不确定,不能用脉络膜厚度的变化来解释。同样,为什么在终止LLRL治疗时只有不大的反弹效应[168,169]?此类LLRL疗法的安全性仍有待确定,因为迄今为止没有一项试验包括适当敏感的客观功能测试和长期随访计划。此外,不良事件监测在很大程度上是基于问卷调查的,在某些研究中则参考光学相干断层扫描(optical coherence tomography,OCT)成像[74,168,169]。
紫外线和近视控制。在迄今为止唯一的临床试验中[82],使用紫外线(360~400 nm)传输眼镜或传统眼镜进行干预,追踪6~12岁的儿童近视进展。紫外线传输眼镜的治疗效果被证明很小且不显著(2年AL和SE增长分别减缓0.03 mm和0.11D,眼轴增长率相对降低21.4%)。
5 行业指南和伦理考虑
自最初的IMI关于行业指南和伦理考虑的报告发布以来[2],随着全球眼科保健从业者越来越多地采用近视控制策略,近视控制领域取得了重大进展和发展。本摘要更新了自上次报告以来的发现,并扩展了最近获得的知识领域。
5.1 安全性
2019年IMI关于行业指南和伦理考虑的原始报告[2]声称,“无论是佩戴OK镜或SCL,儿童戴接触镜相关并发症的风险并不比成年人高。”最近的研究在很大程度上支持了这一论断[170-174]。虽然眼镜没有感染风险,但可能会影响视力。因此,需要注意的是,专门为近视控制而设计的新型眼镜对视觉表现有一定影响(使用高对比度视力、阅读速度和周边对比敏感度测量)[175-177],尽管接触镜的使用已经被证明可以改善儿童和青少年对其外表和参与活动的感觉,从而提高他们对屈光不正矫正的满意程度[178-181]。阿托品在较高浓度下可引起睫状肌麻痹和畏光[182],需要使用光致变色渐进多焦镜,但在较低浓度时不需要[183]。正如在“4.6光疗法”部分所讨论的那样,目前还缺乏关于新兴的光疗法的全面数据和安全性综述。
5.2 有效性
2019年IMI关于行业指南和伦理考虑的报告[2]注意到屈光不正和AL都可以用来评估近视控制的疗效,二者测量的精确性要求极高,其中屈光不正理想情况下使用睫状肌麻痹性电脑验光来减少患者和检查者的偏倚,AL测量采用光学生物测量仪。眼轴增长是令人信服的首选的主要结果[124],这是基于其与视力损害更密切的关系[184]、优越的精度[185,186],以及其不受调节因素影响的特点[187]。最重要的是,一些近视控制方式,主要是夜间佩戴角膜塑形镜[188],通过改变角膜的形状影响眼睛的屈光状态,使屈光测量无法评估近视的进展[124]。
近视控制的疗效通常通过比较治疗和未治疗的近视儿童的年度屈光不正进展、眼轴增长或两者一同来评估。重要的观察是,治疗第1年的疗效通常大于随后的几年[124],对于光学和药物模型这一点似乎都是适用的。这种平均进展的比较也是美国食品和药物管理局(US Food and Drug Administration,FDA)设备临床试验的主要结果,无论是接触镜还是眼镜[128,189]。研究药物由FDA的不同单位进行评估,受欢迎的主要结果似乎是3年后近视进展达设定值(-0.50或-0.75 D)的受试者比例的组间差异。
FDA批准的严格要求包括对安全性和患者报告的结果的评估,以及对潜在反弹效应的评估,正如在一些涉及近视控制干预措施的研究中已经证明的那样[190-192],虽然不是全部[116,193,194]。
5.3 疗法的全球监管状况
近视管理一词被世界各地的眼科护理从业人员和视光协会使用,泛指眼科护理医生用来解决患者即时屈光不正状况的临床策略,即矫正患者的近视,以及评估他们的病情随时间的进展(比如,减少近视的进展)和眼轴增长。然而,这一术语并没有区分专门批准用于近视控制的产品(符合适应证)和仅批准用于矫正或暂时减缓近视的产品——尽管后者可能会减缓儿童近视的进展(超适应证)。通常情况下,需要获得监管部门的批准,以确保医疗产品在被授权使用之前符合一定的安全性和有效性标准。在开具近视控制治疗处方时,在可能的情况下,眼科护理专业人员应首先考虑符合适应证的产品,并在符合适应证的产品无效或不合适时考虑超适应证的处方[2]。
在最初的2019年IMI报告中,似乎只有2种多区域SCL镜片产品在世界上任何地方获得了监管许可,且都有欧洲合格(Conformité Européenne,CE)标志,这是制造商自我证明产品符合欧洲标准。从那时起,一些软性和OK镜获得了专门用于减少儿童近视进展的CE标志批准,这不仅允许这些产品在欧盟用于这一适应证的商业化,而且有助于在世界其他地区(如澳大利亚和新加坡)寻求近视控制的上市许可。特别令人感兴趣的是,FDA已经批准了第一个SCL(MiSight,美国Coopervision公司)专门用于近视控制。尽管FDA区分了近视控制(用于减慢近视进展的设备)和广义的近视管理,但这2个术语被美国国内外的眼科医生和验光协会相互替换使用。
在亚洲部分地区,特别是新加坡,低浓度阿托品滴眼液似乎可用于减缓儿童近视的进展。此外,0.01%阿托品滴眼液的专利解决方案最近在澳大利亚获得监管机构批准,以减缓儿童近视的进展(https://www.nps.org.au/medicine-finder/eikance-0-01)[162]。在包括美国在内的其他国家,低浓度阿托品越来越多地超适应证使用,但必须与程序和配方的变化相结合[162]。
监管审批程序在世界各地的范围和严格程度各不相同。FDA通常需要3年的随机对照临床试验数据,并在治疗结束后进行1年的随访,以评估潜在的反弹效应[189],而其他司法管辖区可能接受短期研究或其他形式的证据。例如,亚洲部分地区的监管机构可能以FDA的立场为基础,对FDA立场的讨论与其他地区密切相关。自2019年IMI报告发布以来,已批准用于减缓近视进展并在不同国家销售的产品范围急剧增加,预计其数量和多样性将继续扩大。因此,任何按地区记录批准产品的尝试都可能不完整,而且很快就会过时。
5.4 信息传播
2019年IMI关于行业指导方针和伦理考虑的报告指出,“一个主要问题涉及这样一个事实,即控制近视的措施不会立即产生效果,而是未来几年的预期性结果。”最近的研究量化了近视控制项目可能减轻的长期视力损害,并将其置于短期风险的背景下[195]。尽管如此,一些机构认为,成人在儿童时期控制近视的长期视力获益应该通过前瞻性研究来证实(英国验光师学院,https://www.college-optometrists.org/the-college/policy/myopia-management.html,访问日期为2023年1月),尽管这样的过程需要50~60年的时间。此外,控制近视的潜在好处应该考虑其成本[196]。
5.5 研究地的考量
2019年IMI关于行业指南和伦理考虑的报告认为,“之前的研究表明,在不同国家和种族群体进行的临床试验中,特定的治疗方法(例如角膜塑形镜)可能不会表现出相同的疗效。”大多数临床试验是单中心研究,民族和种族多样性有限。多中心试验较罕见,多国研究更为罕见[99,128]。尽管如此,越来越多的证据表明,在东亚和非东亚人群中,夜间佩戴角膜塑形镜可以在相似程度上减缓眼轴增长,在全球不同地点进行的研究也报告了非常相似的治疗效果[107,197-204]。渐进式眼镜镜片在东亚和非东亚人群中同样无效[193,206-210]。低浓度阿托品在东亚、南亚和澳大利亚人群中的疗效有限,然而对小亚组的低统计学效力分析表明可能存在差异[110,112,114,183,211,212]。
5.6 近视控制临床试验未来的伦理问题
IMI 2021年摘要[129]提出了问题:“如果治疗方法足够成熟,足以减缓或预防近视进展,鉴于受试者有发展为近视或有近视进展的可能性,将其随机分配到无效的假治疗/对照组是否道德?”结论是“目前,选择适当对照组进行近视对照试验仍然是符合伦理的。”有人对不给参与者使用有效的近视控制措施的伦理问题感到担忧。随着近视水平和视力障碍之间关系的证据不断增加[184,195],且治疗措施可以有效减缓近视进展,上述问题应该定期回顾。在临床试验中,为了评估一种新的治疗方法,对对照受试者保留有效的治疗方法,这对临床试验的进行还有一些实际的挑战。正如“3.2研究设计”部分和最近的一项研究所总结的那样,其中包括分配到非治疗组孩子的父母立即退出研究,对照组中长期退出研究的比例更高[212,215]。最终,伦理问题的解答应该因地制宜,主要考虑因素是符合适应证的近视控制方式的可用性和普遍的护理标准。在“3.2研究设计”一节中总结了可供选择的临床试验设计,包括使用基于先前研究的虚拟对照组[216],与已建立的治疗方法进行比较,或治疗失败时间(生存分析)方法[217]。
6 临床管理指南
通过提供对以前的IMI出版物的广泛更新,本摘要补充了2019年IMI白皮书临床管理指南[218]以及IMI 2021年摘要[1]。关于近视新治疗方法的具体更新,读者可以参考前面关于控制近视发生和发展的干预措施的章节。在本节中,我们从相关已发表研究中提取了有关近视控制干预措施的相对有效性、安全性和视力结果的新信息,并进行了整理,以帮助了解和指导临床实践。本节还探讨了临床考虑,包括平衡短期风险和长期利益。
6.1 对治疗方法和疗效的新认识
6.1.1比较治疗效果 最近对近视控制治疗的回顾突出了当前近视研究的空白[124]。一个关键的观点是眼轴增长累积绝对减少(cumulative absolute reduction in axial elongation,CARE)的概念,被提议作为评估治疗和比较单一研究之外治疗时“百分比功效”的替代方案。百分比功效是与对照组相比,治疗后近视进展减少的百分比。然而,由于治疗结果受到许多因素的影响,如研究持续时间和参与者特征,这些因素在临床试验之间可能存在显著差异,因此无法在研究之间有效地比较百分比疗效。相反,建议以绝对值报告近视控制治疗效果——即治疗组与对照组相比,眼轴生长的总减少量。该文首次比较了各种眼镜、MFSCL和角膜塑形镜研究的绝对疗效结果,所有这些研究都包括至少10个数据点。药物干预由于其浓度依赖性而未被纳入,但“角膜塑形镜、MFSCL、眼镜和阿托品的最佳效果相似。”最近的临床试验进一步支持了这一说法,这些试验发现,与对照组相比,MFSCL与角膜塑形镜以及MFSCL与EDOF镜片之间的近视控制效果相似[117,160]。
虽然一些控制近视的方法可能不太有效,而且副作用和可能的反弹都会影响结果,但眼科医生在为个别患者选择治疗方法时,应考虑自己的技能、治疗方法的可用性、患者和家长的偏好和能力,最后还要考虑监管方面[124]。
虽然CARE的概念有可能进一步扩大我们对近视控制治疗效果的理解,但眼科保健医生需要将患者的结果与对照组进行比较,以眼轴增长为指标,确定患者是否经历了低于预期的累积绝对进展。对照组可能因年龄、种族、性别和父母近视而变化。此外,正如一项为期6年的研究所显示的那样,CARE没有考虑治疗效果的变化或比例治疗结果(即在治疗前表现出更快进展的儿童得到了更大的近视控制效果)[103]。尽管关于绝对治疗效果和比例治疗效果的报道仍存在争议,但建议对所有青少年近视,特别是12岁以下的青少年进行积极治疗[124]。
6.1.2最大化效果之佩戴时间 研究支持将佩戴时间和/或治疗依从性作为探索最大限度提高治疗结果的潜在途径,数据表明整日佩戴近视控制设备获得了最好的结果。对于HAL眼镜,每天佩戴至少12小时的儿童近视控制效果最高[101]。这一观察结果也与之前MFSCL试验的结果一致,这些试验发现,随着以每天小时数或者每周天数为单位的佩戴时间的延长,近视控制效果也增加。关于双焦点SCL和DIMS眼镜的其他研究报道也显示,随着佩戴时间的延长,也有类似的好处[128,217,219-220]。
6.1.3最大化效果之联合和增强治疗 联合策略提供了另一种方法来进一步提高现有近视控制的疗效。然而,正如前一节关于控制近视发病和进展的干预措施的结果一样,好坏参半[166],还有报告认为联合治疗相比单一治疗并没有获得额外的好处[119]。明确阿托品与近视控制眼镜联合治疗或使用更高浓度的阿托品联合治疗是否可以提高疗效是很有意义的。然而,一项回顾性研究发现,联合应用较高浓度的阿托品(0.125%)的角膜塑形镜不如较低浓度的阿托品(0.025%)有效[221]。此结果似乎与几项阿托品研究的浓度依赖性结果[110,183,222]是矛盾的,尽管迄今为止只有一项试验直接比较了高于和低于0.1%浓度的阿托品的效果[222]。
角膜塑形镜的设计也可能影响治疗效果。正如干预措施部分所述,6 mm 角膜塑形镜与5 mm BOZD佩戴1年后相比,后者的眼轴增长较慢,但其镜片的首次配合成功率略低。然而,仅在前6个月,2个组之间的AL增长差异为0.12 mm,差异显著,在6~12个月期间,2个组的AL继续以相似的速度增长[151]。
6.1.4近视反弹 一篇关于近视控制效果的综述指出,“在证明反弹不存在之前,应该假设存在反弹[223]。”在这方面,尽管本文总结的数据和前一节关于干预措施的汇总表明,停止目前的近视控制SCL和低浓度阿托品干预后反弹最小,但在13~14岁之前停止治疗应谨慎进行。特别的是,当(13.2±1.2)岁的儿童在佩戴双焦SCL 2年后停止佩戴时,没有观察到反弹[105]。同样,在治疗2年后停用低浓度阿托品(0.025%和0.01%)也没有引起任何明显的反弹效应,而停用0.05%阿托品后,观察到眼球生长更快(1年0.04 mm),但差异被认为临床不显著。此外,在6~8岁的儿童中,停用所有3种浓度(0.05%、0.025%和0.01%)阿托品可导致类似的眼球生长率[116]。
先前的一项研究发现,在14岁之前停止佩戴OK镜儿童的眼球生长与佩戴SVS的年幼儿童相当,并且比同期对照组的儿童更快,这表明可能存在反弹效应。6个月后重新佩戴OK镜时,眼轴增长率再次减慢[192]。目前,还没有关于近视控制眼镜反弹的数据。
6.1.5大龄儿童开展近视控制治疗 最近的数据表明,即使年龄较大的儿童也可能从控制近视的治疗中受益。在临床试验中,11~15岁的较大儿童配戴双焦SCL[103],10~15岁的儿童配戴 DIMS镜片[98],8~12岁的儿童配戴0.05%阿托品[116]的效果得到了证实。这些试验中的,儿童最初被分配到对照组,但分别在3年、2年和1年后被切换到治疗组。然而,由于在每项研究中都取消了具有这种转换的对照组,因此只能通过与历史对照组的比较来评估这些年龄较大儿童的疗效。似乎存在一种“累积治疗效果”,显示早期和较长时间的治疗具有最大的总体效益,即使治疗开始较晚,也有明显的效益[103]。
新的数据表明,38%的成人近视在20~30岁时进展了至少0.50 D,同时伴有小而显著的AL和晶状体厚度的变化[224],因此,正如IMI:年轻人近视白皮书中所述,对青少年近视进展进行进一步研究是有必要的[225]。
6.2 近视控制治疗的视力和视觉功能结果
总体而言,近视控制治疗似乎对VA和双目视觉功能的负面影响很小,但应该注意的是,关于其他视觉功能和主观视觉质量以及生活质量影响的研究有限。
双焦和中距MFSCL的临床试验显示,+1.50 D或+2.50 D的MFSCL的高对比距离和近距离VA与对照SV组相当[128,226]。类似地,使用DIMS[220]和HAL[101]眼镜镜片的远距离和近距离VA与使用SVS获得的VA没有差异。当受试者通过DIMS和HAL镜片的“处理”区域观看时,发现两者都将远距离VA减少了不到1行(分别为0.09和0.07 LogMAR单位)。然而,尽管眩光对视力结果的影响很小,但DIMS和非球面微镜片设计中的透镜配置对空间对比度视觉的影响相对更大,尤其是在低照度和低对比度的情况下[175]。
接受0.05%、0.025%和0.01%阿托品干预的儿童的远距离和近距离VA彼此相似,与安慰剂对照组无明显差异,所有病例的VA均在0.00 LogMAR单位左右[183]。据报道,角膜塑形镜联合0.01%阿托品对远视视力无影响,但具体结果未见报道[166]。将角膜塑形镜 BOZD从6 mm降低到5 mm不影响远距离VA,均为0.00 LogMAR单位或更好,但该研究未报告近距离视力[151]。
最近的研究探讨了近视控制治疗对调节和聚光功能的影响,并与SV矫正进行了比较。在儿童中,DIMS[220]和HAL[227]眼镜镜片对近处的视距和调节没有影响。双焦SCL对光性和调节反应的影响也很小[228-230]。新的数据表明,角膜塑形镜会增加调节反应,并在近距离用眼的儿童中产生外视位移,这与以前的研究结果一致,似乎与更好的近视控制有关[231-234]。相比之下,非球面MFSCL在儿童和年轻人中降低了调节反应,但诱导了小的外视移位,不同的外视添加功率对这些反应没有差异影响[228,230,235-237]。对于角膜塑形镜,更准确的调节反应与更大的近视控制效果相关[235]。
6.3 近视控制治疗的安全性
尽管各种近视控制疗法的安全性各不相同,但目前的数据表明,近视控制疗法总体上是安全的。与传统SVS相比,近视控制眼镜的相关身体风险最小。对于接触镜来说,最大的风险是微生物角膜炎,这是一种潜在的视力威胁。然而,微生物性角膜炎的发病率极低,这一罕见事件的量化具有挑战性,需要大量样本才能提供明确的发病率估计。为期6年的双焦SCL临床试验报告了3例停用病例,其中只有1例与接触镜佩戴(浸润性角膜炎)有关[174]。其他不显著的不良事件包括乳头状结膜炎、睑缘炎、睑板炎、结膜炎(细菌性、病毒性或过敏性)、浅表点性角膜炎和轻度脓肿。10岁以下儿童未观察到不良事件[174]。12岁及以下儿童的角膜浸润性事件或微生角膜炎的发生率也不高于成人,进一步支持了接触镜在儿童中的使用[170]。
最近一项对佩戴角膜塑形镜的俄罗斯儿童微生物性角膜炎的分析报告称,其年发病率为每1万名患者年4.9~5.3例[170]。这一数值低于美国之前估计的每1万名患者年13.9例[238],这与其他成人夜间佩戴接触镜的观察结果相当或更低[195]。
阿托品的眼部副作用是很确定的,包括畏光和由于失去适应能力而造成的近视困难[116,239]。过敏性结膜炎也被报道与阿托品治疗有关,并被认为与配方中的防腐剂有关[195]。然而,随着不含防腐剂制剂的增加,预计过敏性结膜炎的报告将会减少。
虽然观察数据表明,近视控制治疗通常是安全的,但其长期安全性还没有得到严格的研究,临床试验通常局限于2~3年的治疗周期,例如,阿托品使用的长期影响以及睫状肌麻痹诱发的视网膜光暴露尚未确定[195]。
6.4 平衡风险和好处
近视控制治疗的主要目的是减缓近视的进展,降低发生相关视力威胁眼部病理的风险,特别是近视黄斑病变[184,240]。对于AL较长的近视者来说,近视控制的潜在益处尤其显著,因为其发生不可逆视力丧失的风险更大[184]。与对照治疗相关的风险相比,减少近视进展的益处[124,195]是正在讨论的主题,尽管控制近视在降低不可逆视力丧失风险方面的长期益处仍有待证实,但潜在的益处被认为大于风险[195]。一般来说,控制近视的方法是安全的,不会增加风险。实现较低近视水平的其他益处包括更好的矫正/未矫正VA,改善视力相关的生活质量,减少对矫正的依赖,并进一步支持使用近视控制治疗[241]。
7 总结
近视眼的研究领域正在不断迅速扩大。近视≤-0.5 D和高度近视≤-6.0 D的IMI定义现在被广泛采用,人们对近视前状态的兴趣越来越大。仍然需要对高度近视的结构后果进行分类、定义和了解,并了解和探索针对高度近视的具体治疗方法。除了减缓儿童近视的发展,我们还需要有效的治疗方法来减缓病理性近视的年龄依赖性发展。对病理性近视的各个方面建立明确的定义和分类是这一研究的重要起点。动物研究正在继续建立和提高我们对视觉反馈作用的理解,以及近视中控制视觉体验和发育的各种途径。研究正在解决关键问题,如表征影响眼轴增长的光处理和从视网膜到巩膜的信号通路,影响屈光不正发展的刺激的时间整合的性质,以及昼夜节律和照明的影响。最近的研究进一步支持了多巴胺和黑视素在远视化和近视中的作用,同时也表明弱光在近视中起作用。在阐明光的作用的尝试中,窄带长波长和短波长的光与眼睛发育失调有关。新的治疗策略,如局部咖啡因和巩膜交联目前也在探索中。
在人体临床试验中,新的眼镜镜片设计包含多个分区、微透镜或扩散点,在减缓近视方面显示出希望。一种新的近视控制治疗方法包括基于光的治疗,通过桌面式设备提供低强度的红光,其中一些方法正在试验中,效果看好,但安全性数据不足。目前,外用阿托品是唯一广泛使用的治疗药物,最近的一项临床研究发现外用咖啡因对近视进展没有积极影响。联合治疗在提高疗效方面的作用仍在考虑之中,一些研究显示疗效有所改善,一些则没有。在较高浓度的阿托品中观察到的反弹效应似乎可以通过较低浓度和光学策略来避免。在将研究结果转化到临床实践的过程中,我们发现,这些治疗对VA和双眼视觉功能的负面影响极小,甚至在年龄较大的儿童中也是有效的,并且更长的佩戴时间可以最大化某些光学治疗的效果。尽管此类治疗还需要额外的长期疗效、安全性、耐受性和视觉功能数据,但在儿童和青少年进展性近视中,它们的益处似乎大于风险,目前的证据表明,在临床实践中,积极的近视控制处方是有利的。未来评估近视控制治疗效果的试验应采用一种告知临床实践和潜在作用机制的设计。最近的一些试验被发现缺乏减少偏倚的要素,如设盲、随机化、同步对照组和明确定义的入组标准,这可能导致结论不准确。我们鼓励研究人员、行业、临床医生和监管机构使用本更新中提供的信息以及原始IMI报告[97]和IMI 2021年摘要[1]来解释已发表证据的强度,比较治疗之间的风险和益处,并设计临床试验和计划,以便在临床实践中实现近视控制。
利益冲突由国际近视研究院支持。国际近视研究院报告的出版和传播费用得到了Brien Holden Vision Institute、Carl Zeiss Vision、CooperVision、Essilor Luxottica、Hoya、Thea、Alcon和Oculus的捐赠支持;本文所有作者均声明不存在利益冲突
志谢特别感谢Christine Wildsoet对本白皮书的润色。感谢Rebecca Yan Shun Weng 对本翻译稿的支持。
声明本文著者并未参与本次翻译过程
参考文献(略)
