miR-150-5p对脑小血管病大鼠脑微血管内皮细胞凋亡的影响
2023-10-10杨波刘曙艳王林姬松波李玉生
杨波 刘曙艳 王林 姬松波 李玉生
(焦作市第二人民医院 1神经内科,河南 焦作 454150;2内分泌科;3郑州大学第一附属医院神经内科)
脑小血管病(CSVD)是小血管病变中一组特殊的实体综合征,包括各种病理改变对脑组织结构的破坏,需要影像学辅助诊断。对于已经受损的小血管来说,一旦堵塞或出血,就无法恢复〔1〕。在解剖学上CSVD是脑血管的一部分,在病理学中CSVD归属于脑血管病,CSVD的病理进展过程非常缓慢。脑微血管内皮细胞中释放的氧自由基可诱导细胞色素C释放至细胞质,细胞质中的细胞色素C可诱导细胞凋亡,从而加重脑组织损伤〔2,3〕。miR-150-5p与CSVD发生有一定关系,参与微血管内皮细胞的CSVD患者外周血miR-150-5p表达明显降低〔4〕。因此,本研究将干扰miR-150-5p表达量来分析CSVD大鼠脑微血管内皮细胞凋亡的情况。
1 材料与方法
1.1动物 雄性健康大鼠56只,3~4个月龄,体质量(300±28)g,动物实验许可证号为SCXK(京)2017-0003,购自北京斯贝有限公司,在标准环境下饲养大鼠1 w,提供自由进水、饮食。5 d开始实验,本试验严格按照动物实验道德伦理要求进行,并经过医院伦理委员会审批和同意。
1.2主要试剂及仪器 miR-150-5p激动剂、 miR-150-5p抑制剂(上海宝曼生物科技有限公司)、miRNA 脂质体转染试剂(北京伊塔生物科技有限公司)、胰蛋白酶(北京孚博生物科技有限公司)、RIPA裂解液(北京邦兴业科技有限公司)。
1.3分组及建模 56只大鼠随机分为正常组、模型组、上调组、下调组各14只。正常组不做任何处理,剩余组进行建模,采用同种系微栓子体外注入法。自体血栓制备:大鼠左心室采血,放在干燥箱内完全干燥后,将干燥血凝块研细,过200 μm筛孔制成栓。建模时用盐水配成10∶1混合液。使用1.5%戊巴比妥钠在大鼠腹腔内注射进行麻醉后,由颈外动脉的近心端逆行注射0.3 ml混合液入颈内动脉。缝合颈前切口,表面消毒。大鼠发作癫痫、四肢瘫痪和异常运动表示建模成功,建模过程中死亡6只,最终建模成功42只。
1.4miR-150-5p转染 在建模完成后5 d做miR-150-5p转染,正常组、模型组不做处理,上调组和下调组分别用 miRNA 脂质体转染试剂混合miR-150-5p激动剂或 miR-150-5p抑制剂,静止30 min左右,滴入脑组织细胞中。
1.5转染效率鉴定 在转染2 d后随机选取各组5只大鼠,使用脱颈法处死大鼠后取脑组织,所提取的RNA浓度、完整性采用比色法、琼脂糖凝胶电泳法测定,使用多基因梯度做实时荧光定量聚合酶链反应(qRT-PCR)鉴定miR-150-5p转染效率,以U6为内参照,反应过程为95 ℃ 12 s,60 ℃ 30 s,72 ℃ 5 s延伸,40个循环。相对表达量用2-ΔΔCt计算。
1.6样本采集 采用脱颈法处死大鼠,放入75%乙醇中浸泡5 min,沿脑部正中线剪开颅骨,去除硬脑膜,剔除小脑及脑干,脑组织于磷酸盐缓冲液(PBS)中冲洗,去除大血管等组织,剪切脑组织呈1 mm组织块,采用PBS洗涤灰质组织,加入0.05%胰蛋白酶消化25 min,加入有胎牛血清的培养基停止消化,采用200目尼龙筛过滤,4 ℃条件下1 000 r/min离心5 min,收集细胞沉淀,加入0.1%胶原酶,室温育30 min,加入培养基悬浮细胞,将细胞于培养箱内培养4 d,采用0.25%胰蛋白酶消化进行传代培养,取细胞进行实验。
1.7病理学观察 取组织切片常规处理后苏木素-伊红(HE)染色,观察各组内皮血管组织病理变化。
1.8指标检测 丙二醛(MDA)、超氧化物歧化酶(SOD)水平检测:取各组脑微血管内皮细胞,使用RIPA裂解液裂解细胞,用超声破碎细胞,在4 ℃温度下经1 000 r/min离心5 min,取上清,采用化学比色法检测各组MDA、SOD活性,严格遵守检测试剂盒上的说明书进行操作。细胞凋亡率检测:收集细胞,预冷 PBS 漂洗,加入结合缓冲液重悬,加入膜联蛋白Ⅴ异硫氰酸荧光素(Annexin Ⅴ-FITC)和碘化丙啶(PI)混匀后避光孵育10 min,细胞凋亡率使用流式细胞仪进行检测。每组设3个复孔,实验重复3次。乳酸脱氢酶(LDH)释放率检测:收集培养基上清和细胞,用含有胎牛血清的RPMI1640培养液,将靶细胞调整到5×104~2×105个/ml,根据说明书进行LDH释放量检测。LDH释放率(%)=LDH上清/(LDH 上清+ LDH 细胞)×100%。
1.9磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)信号通路蛋白表达检测 使用Western印迹检测,取转染2 d的脑微血管组织细胞,放入RIPA裂解液,等待30 min,4 ℃环境下2 500 r/min离心15 min,集上清,二喹啉甲酸(BCA)试剂盒检测蛋白浓度,将蛋白样品和上样缓冲液混合,100 ℃变性5 min,加入十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶上样孔中,每孔30 μl,浓缩胶电压60 V,分离胶120 V,结束后取凝胶,4 ℃转膜1.5 h,用5%脱脂奶粉封闭聚偏氟乙烯(PVDF)膜2 h,加入PI3K、Akt、p-Akt一抗,放置一夜,Tris盐酸缓冲液吐温(TBST)洗膜后加入羊抗兔IgG,37 ℃育2 h后加入电化学发光(ECL)显影,以磷酸甘油醛脱氢酶(GAPDH)作为内参。
1.10统计学分析 采用SPSS25.0软件进行方差分析、独立样本t检验。
2 结 果
2.1miR-150-5p转染效率鉴定 与正常组(1.00±0.07)、模型组(0.45±0.04)相比,上调组miR-150-5p表达量(2.86±0.03)显著升高,下调组miR-150-5p表达量(0.23±0.02)显著降低(P<0.05),证明miR-150-5p转染成功。
2.2病理组织学观察 如图1所示,HE染色结果显示,正常组内皮细胞为长棍形,排列不规则,核淡,胞膜明显;模型组细胞胞体变细、变小,部分损伤细胞缩小或变圆。上调组内皮细胞明显接近正常组,下调组内皮细胞胞体缩小,损伤严重。
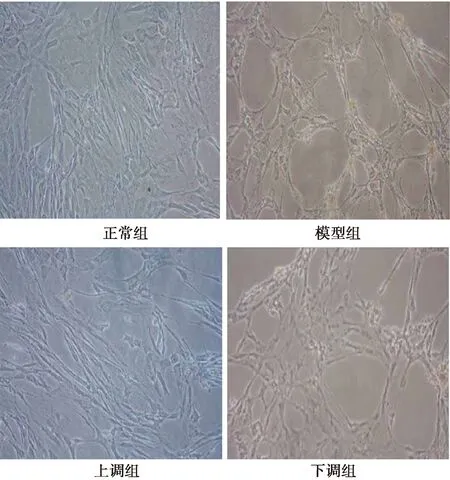
图1 各组海马区组织(HE染色,×400)
2.3各组氧化应激指标水平比较 如表1所示,与正常组相比,模型组及下调组MDA水平升高、SOD水平降低,上调组MDA水平降低,SOD水平升高,具有统计学差异(P<0.05);与模型组相比,下调组MDA水平升高,SOD水平降低,上调组MDA水平降低,SOD水平升高,具有统计学差异(P<0.05);与上调组相比,下调组MDA水平升高,SOD水平降低,具有统计学差异(P<0.05)。

表1 各组氧化应激指标、内皮细胞凋亡率、LDH释放率和PI3K/Akt 信号通路蛋白水平比较
2.4各组脑微血管内皮细胞凋亡率和LDH释放率比较 如表1所示,与正常组相比,模型组及下调组细胞凋亡率、LDH释放率升高,上调组细胞凋亡率、LDH释放率降低,具有统计学差异(P<0.05);与模型组相比,下调组细胞凋亡率、LDH释放率升高,上调组细胞凋亡率、LDH释放率降低,具有统计学差异(P<0.05);与上调组相比,下调组细胞凋亡率、LDH释放率升高,具有统计学差异(P<0.05)。
2.5脑组织PI3K/Akt 信号通路蛋白表达 如表1、图2所示,与正常组相比,模型组及下调组PI3K、Akt、p-PI3K含量降低,上调组PI3K、Akt、p-PI3K含量升高,差异有统计学意义(P<0.05);与模型组相比,上调组PI3K、Akt、p-PI3K 含量升高,下调组PI3K、Akt、p-PI3K含量降低,差异有统计学意义(P<0.05);与上调组相比,下调组PI3K、Akt、p-PI3K含量显著降低(P<0.05)。
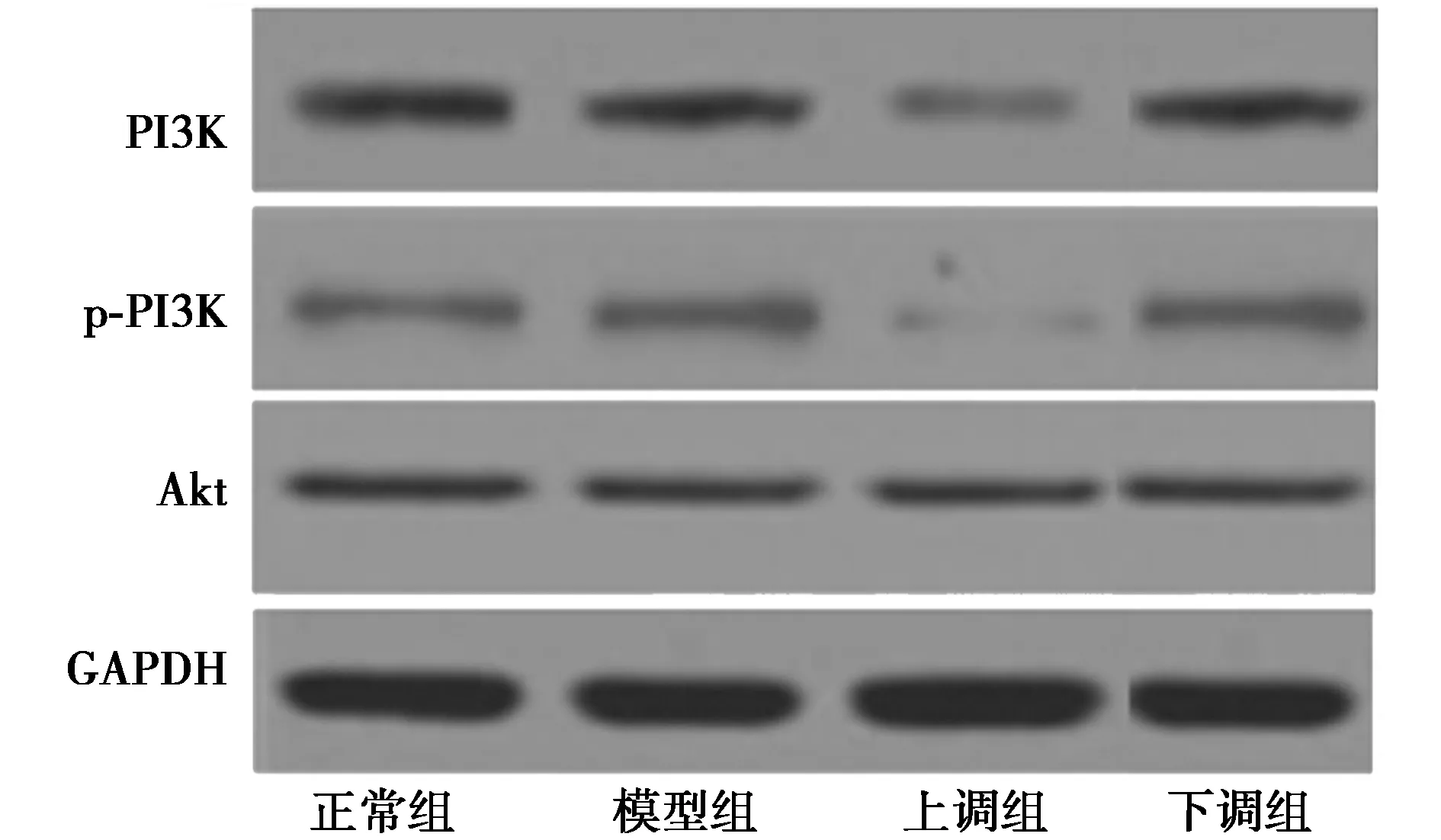
图2 Western印迹检测脑组织PI3K/Akt信号通路蛋白表达
3 讨 论
CSVD是一组脑部小血管病变导致的临床、影像学、病理表现和认知改变的综合征。脑小血管病凋亡的重要原因是脑微血管内皮细胞具有合成、分泌、代谢和免疫等复杂功能〔5,6〕。其细胞间紧密连接、细胞膜转运系统及窗口缺乏等因素,使其在脑组织和血液之间的物质交换中发挥关键作用,保持大脑环境的稳定〔7〕。其功能结构在脑血管疾病的发生发展等过程中起重要作用〔8〕。因此,保护微血管内皮细胞免受损伤,对CSVD治疗具有重要意义。
miR-150-5p表达水平可能与大鼠脑出血有关,升高其表达量可以减少其脑组织的损伤。miRNA是长度在21~25 nt的非编码单链小分子RNA,在真核细胞中广泛存在〔9,10〕。其中miR-150-5p是相对研究最早的miRNA,研究表明,在很多癌组织中miR-150-5p表达上调,能够明显抑制细胞的损伤凋亡〔11,12〕。随着研究深入,发现miR-150-5p参与细胞的凋亡、分化、增殖等生物学过程〔13〕。本研究发现,上调miR-150-5p可以抑制脑微血管内皮细胞的凋亡,减轻CSVD患者的临床症状。
造成脑微血管内皮细胞损伤主要的原因为氧化应激反应。对治疗CSVD具有重要意义〔14〕。而MDA、SOD则是氧化反应的重要标志物,MDA水平升高证明了氧化应激损伤比较严重,相反MDA水平降低则表明氧化应激影响的程度减轻〔15,16〕。SOD可以将细胞内的活性氧物质清除掉,在维持细胞氧化及抗氧化方面起重要作用。已有研究证实,细胞内活性氧的增加可能会降低细胞生存率,导致细胞凋亡的增加〔17,18〕。本研究发现,上调miR-150-5p水平能有效减轻氧化应激损伤。
导致细胞凋亡的机制很多并且很复杂,B细胞淋巴瘤(Bcl)-2家族包括抗凋亡蛋白Bcl-2、Bcl-xl和促凋亡蛋白Bcl-2相关X基因(Bax)、Bcl-2拮抗因子(Bak)两大类,是内源性凋亡途径相关蛋白,可将外界刺激信号传至线粒体,致使细胞凋亡,研究发现miR-150-5p可以通过信号传导途径PI3K/Akt来调节细胞活性和细胞凋亡〔19〕。本研究也证明,miR-150-5p可通过PI3K/Akt通路增加细胞活性,从而减少细胞的损伤凋亡。
PI3K/Akt信号转导途径是重要的细胞内信号转导途径。PI3K/Akt信号系统在多种细胞中广泛分布,PI3K通过磷脂酰肌醇环上3-羟脯氨酸氧化,生成磷酸化钾,与Akt的pH区域结合,使Akt从细胞质分离成细胞膜,使结构发生变化,然后通过影响后续效应分子的激活状态,在内皮细胞凋亡中起关键作用〔20〕。PI3K/Akt信号通路可以调控细胞的增长、增生、黏附等多种生物学功能。PI3K被激活后,可募集并激活Akt,Akt被激活后可抑制下游靶蛋白表达,从而进行调节细胞的增生及凋亡过程〔21〕。根据上述结果,本研究认为上调miR-150-5p可影响CSVD大鼠脑微血管内皮细胞凋亡,可能与PI3K/Akt信号通路相关,但其机制还需进一步研究。
