外源促生菌联合有机肥对干旱胁迫下参地土壤性状及人参抗逆性影响
2023-10-10王艳成张纪月冯帅奇梁雪张振董微巍姬文秀
王艳成, 张纪月, 冯帅奇, 梁雪, 张振, 董微巍, 姬文秀
(延边大学农学院,吉林 延吉 133002)
人参(Panax ginsengC. A. Meyer)为五加科人参属多年生草本宿根植物,是名贵中药材,具有安神补气、养血复脉、健脾益肺、益智延年等诸多功效[1]。我国的人参种植面积及总产值位居世界之首,其中吉林省长白山地区的人参产量和品质最高,是世界人参主产区。目前,我国由于农田参栽培技术尚未形成标准化体系,且人参主栽地区频发春旱,在水资源相对紧缺的状况下,干旱影响人参缓苗及展叶,严重制约了农田栽参产业的绿色健康发展。
植物通过产生乙烯前体物质1-氨基环丙烷 -1- 羧 酸(1-amino-cyclopropane-1-carboxylic acid,ACC)来抵抗寒冷、干旱、洪水、病原体侵染和重金属污染等,但ACC 随蒸腾液流上升到植物地上部分,会加速叶片成熟和衰老,导致光合能力下降,从而降低作物产量[2]。植物生长促进根际细菌(plant growth promoting rhizobacteria,PGPR)具有降解根际ACC 的作用,使植物退化周期缩短,保持根系健壮,能够较好地耐受环境胁迫。有机肥部分替代氮肥能够优化冠层氮素分配,使植物叶片的蒸腾速度显著降低,当植物处于干旱状态时,能够协助其减少水分散失以提升抗旱能力。李刚等[3]研究表明,施用生物有机肥种植人参可以促进人参地上部生长,增强叶片光合作用,加强植株抗逆能力。薛振东等[4]对消毒后的土壤进行试验,通过施加有机肥对农田栽参土壤进行改良,不仅能够降低人参根部的感病率、提高人参抗逆能力,还能够改善土壤结构、增强土壤肥力,获得高质高产的人参。
有益微生物群落具有改善植物健康的应用潜力,植物与微生物互作能够提升宿主植物的抗逆性,挖掘与植物高生产力相关的潜在有益细菌是农业生物肥料开发的前提条件[5]。目前对干旱胁迫下农田人参促生菌促生效应协同有机肥方面的研究鲜见报道。因此,本研究通过外源接种ACC脱氨酶产生菌,结合施用有机肥处理,用化学和现代分子生物学手段相结合的方法,评价施用菌肥对土壤肥效与土壤酶活力、微生物群落以及人参根系酶活力的影响,探讨微生物菌肥提高人参抗逆性的可行性,以改善当地土壤肥力条件,提高作物产量和品质,为人参种植中应对春季干旱、开发农田栽参专用生物菌肥提供依据,为促进农田栽参产业可持续发展奠定基础。
1 材料与方法
1.1 供试材料
OchrobactrumG119 菌株[6]由延边大学农学实验室保存,为人参根际促生功能菌(PGPR)。人参苗(2 年生)由吉林省延边朝鲜族自治州和龙参场提供。试验有机肥产品由实验室腐熟鸡粪堆肥发酵而成,其含水量25.7%、总碳285.4 g·kg-1、总氮19.6 g·kg-1、碳氮比(C/N)16.9、全磷 35.4 g·kg-1、全钾12.6 g·kg-1。
1.2 试验仪器
制冰机(SIM-124)购自南京晧海仪器仪表有限公司,恒温恒湿试验箱(JATH802000)购自上海井岸仪器有限公司,PCR 仪(T100)购自美国伯乐有限公司,连续流动分析仪(AA3)购自天津中通科技发展有限公司,马弗炉(HYP-308)购自深圳市三莉科技有限公司,火焰光度计(FP640)购自青岛聚创环保集团有限公司。
1.3 试验设计
筛选健壮人参苗进行试验,共设计4 个处理。处理1:未添加有机肥和促生菌的对照组(CK);处理2:仅施用有机肥(F);处理3:仅施用促生菌(J);处理4:有机肥和促生菌混合施用(J+F)。每处理重复3次,每重复3盆,每盆栽植人参苗3株。塑料花盆尺寸25 cm×10 cm,装入1.65 kg 试验用土。其中,有机肥施用量均为500 g·盆-1;施用的促生菌为G119,菌含量1.0×10-8cfu·mL-1,用量25 mL。试验前各处理进行统一灌溉,试验期间为盆栽人参搭建避雨棚并加盖1 层遮阴网,以防止降雨对试验的干扰。当各处理含水量达70%后不再浇水,自然干旱10 d,使各盆栽土壤含水量达到35%~45%时取人参植株及其根际土壤带回实验室,用于各项指标的测定。
1.4 测定指标和方法
1.4.1土壤含水量测定 收集土壤样品,立即称量鲜重(fresh weight,FW),然后放入105 ℃烘干箱烘干48 h,称干重(dry weight,DW),并计算土壤含水量(soil water content,SWC)。
1.4.2土壤pH与电导率测定 土壤pH和电导率(electric conductivity,EC)采用5∶1的水土比,分别用雷磁pH计和电导率仪测定。
1.4.3土壤养分含量测定 采用CaCl2浸提土壤后,用培养皿扩散法测定土壤碱解氮含量;采用0.5 mol·L-1NaHCO3法测定土壤速效磷含量;采用火焰光度法和火焰光度计测定土壤速效钾含量[7]。
1.4.4土壤酶活性测定 采用苯酚钠-次氯酸钠比色法测定土壤脲酶(urease)活性,以24 h 后每克土壤中NH3-N 的毫克数来表示脲酶活性;采用3,5-二硝基水杨酸比色法测定土壤蔗糖酶(sucrase)活性,用24 h 后每克土壤葡萄糖的毫克数表示[8-9]。
1.4.5土壤总DNA 提取、PCR 扩增及高通量测序 采用 PowerSoil®DNA Isolation Kit 试剂盒提取土壤 DNA,通过高通量测序测定16S rRNA 基因的V3~V4 区,PCR 扩增引物为F:5’-ACTCCTACGGGAGGCAGCA-3’;R:5’-GGACTA CHVGGGTWTCTAAT-3’。PCR 体系20 µL:5×PCR Buffer Ⅱ 4 µL,2.5 mmol·L-1dNTPs 2 µL,0.4 µmol·L-1的正、反向引物各0.8 µL,TransStart FastPfu DNA Polymerase 0.4 µL,DNA 模板2 µL,ddH2O 补充至20 µL。PCR 程序:95 ℃ 5 min;95 ℃ 1 min,50 ℃ 1 min,72 ℃ 1 min,25 个循环;72 ℃ 10 min。PCR 产物经试剂盒回收后,采用Illumina HiSeq 测序平台进行高通量测序(北京百迈客生物科技有限公司)。
1.4.6人参抗氧化酶测定 采用氮蓝四唑(nitroblue tetrazolium,NBT)法检测人参超氧化物歧化酶(superoxide dismutase,SOD)活性;采用愈创木酚比色法检测人参过氧化物酶(peroxidase,POD)活性;采用高锰酸钾滴定法测定过氧化氢酶(catalase,CAT)活性;采用硫代巴比妥酸(thiobarbituric acid,TBA)比色法测定丙二醛(malonaldehyde,MDA)含量[9]。
1.5 数据分析
基于 Illumina HiSeq 测序平台,利用双末端测序(paired-end)的方法,构建小片文库进行测序。通过对Reads 拼接过滤,在相似性97%水平上进行操作分类单元(operational taxonomic units,OTU)划分,对物种进行注释及丰度分析。进一步利用Mothur 1.30 软件分析α 多样性,包括Chao1指数和Shannon 指数。利用QIIME1.8.0 软件分析β 多样性,通过主成分分析(principal component analysis,PCA)土壤细菌群落结构的相似性与差异性。采用Excel 2016 与SPSS 17 进行各处理间土壤理化性质、土壤酶活力以及人参酶活力数据整理和差异显著性分析。
2 结果与分析
2.1 干旱胁迫下施加促生菌与有机肥对土壤理化性质的影响
土壤含水率、pH 和EC 的变化对植物的生长有显著影响,土壤中的碱解氮、有效磷和速效钾是人参生长所必需的矿质营养元素。从表1 可以看出,不同处理组间的理化性质存在显著差异(P<0.05),其中J+F 处理的土壤含水率、pH、EC 及碱解氮、有效磷和速效钾含量均高于其他处理,说明促生菌和有机肥具有协同作用,有利于提高土壤有效养分含量。F 处理土壤的碱解氮和有效磷含量显著高于J 处理,而速效钾含量相反,表明对于提高土壤氮、磷含量,有机肥的作用高于促生菌,而在提高土壤钾含量上,促生菌的作用优于有机肥。

表1 不同处理组土壤的理化性质Table 1 Physicochemical properties of soil of different treatments
2.2 干旱胁迫下施加促生菌与有机肥对土壤酶活性的影响
土壤脲酶活性与土壤的微生物数量及有机质、全氮和速效磷含量呈正相关,因此常用土壤脲酶活性表征土壤的氮素状况;蔗糖酶活性与土壤肥力呈正相关,土壤肥力越高,酶活性越高。从表2可以看出,J+F处理土壤的脲酶和蔗糖酶活性显著高于其他处理(P<0.05);且单独施用有机肥或促生菌都能有效提高土壤脲酶和蔗糖酶活性。对于提高土壤脲酶活性,促生菌的作用优于有机肥;而对于提高蔗糖酶活性,有机肥的作用优于促生菌。
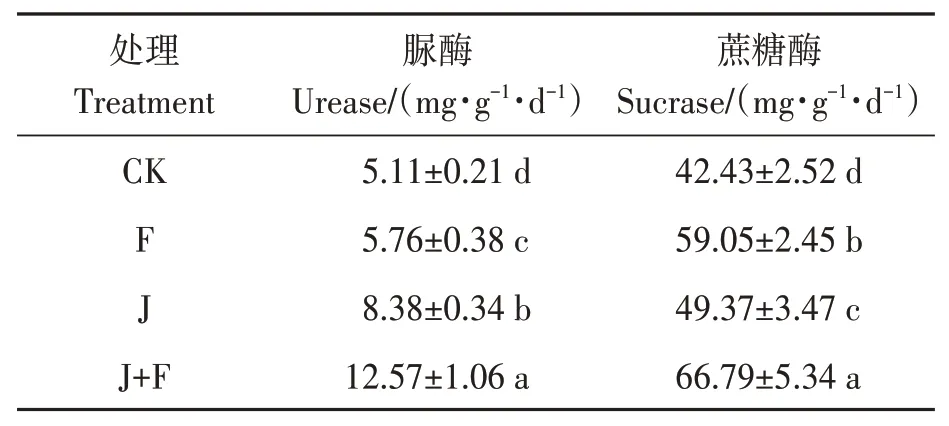
表2 不同处理组的土壤酶活性Table 2 Soil enzyme activities of different treatments
2.3 干旱胁迫下施加促生菌与有机肥对土壤细菌群落的影响
不同处理人参根际细菌在门水平的群落组成如图1 所示。各处理均共检测到7 个主要优势菌门,分别为变形菌门(Proteobacteria),拟杆菌门(Bacteroidetes),酸杆菌门(Acidobacteria),放线菌门(Actinobacteria),厚壁菌门(Firmicutes),疣微菌门(Verrucomicrobia)和芽单胞菌门(Gemmatimonadete)。与CK 相比,变形菌门在3 个处理组的相对丰度显著降低,芽单胞菌门的相对丰度增高。各处理根际细菌门水平相对丰度差异较大。拟杆菌门和酸杆菌门在F 和J+F 处理的相对丰度有所升高,但在J 处理的相对丰度变化较小。
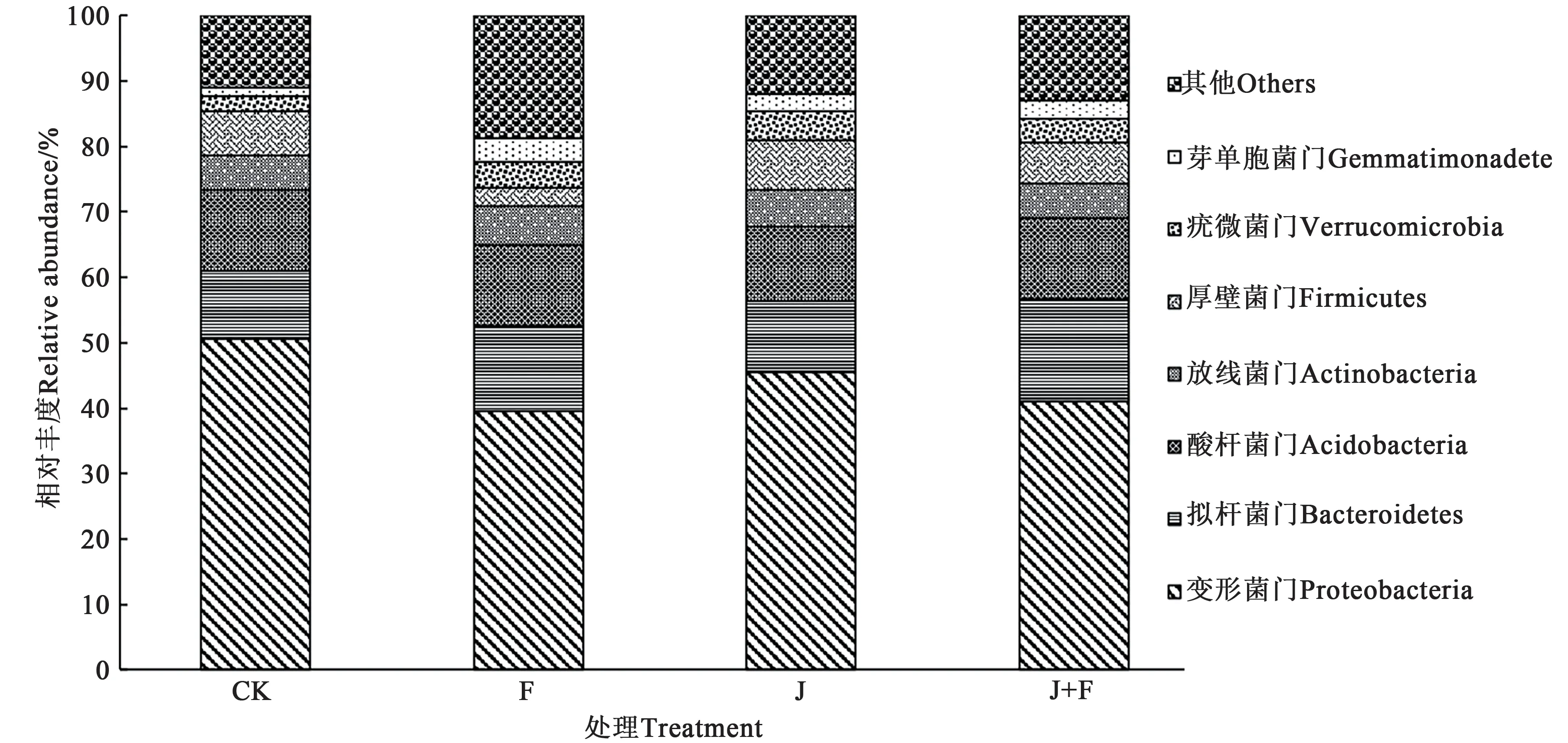
图1 不同处理组人参根际细菌门的组成Fig. 1 Composition of ginseng rhizosphere bacteria in different treatment groups at phylum level
在属水平上,4 个处理组的细菌群落组成如图2所示,共检测到鞘脂单胞菌属(Sphingomonas)、假单胞菌属 (Pseudomonas)、溶杆菌属(Lysobacter)、盐单胞菌属(Halomonas)、叶黄素单胞菌(Luteimonas)、德沃斯氏菌属(Devosia)、短波单胞菌属(Brevundimonas)、波瓦利杆菌(Povalibacter)和新鞘脂菌属(Novosphingobium)9个菌属。
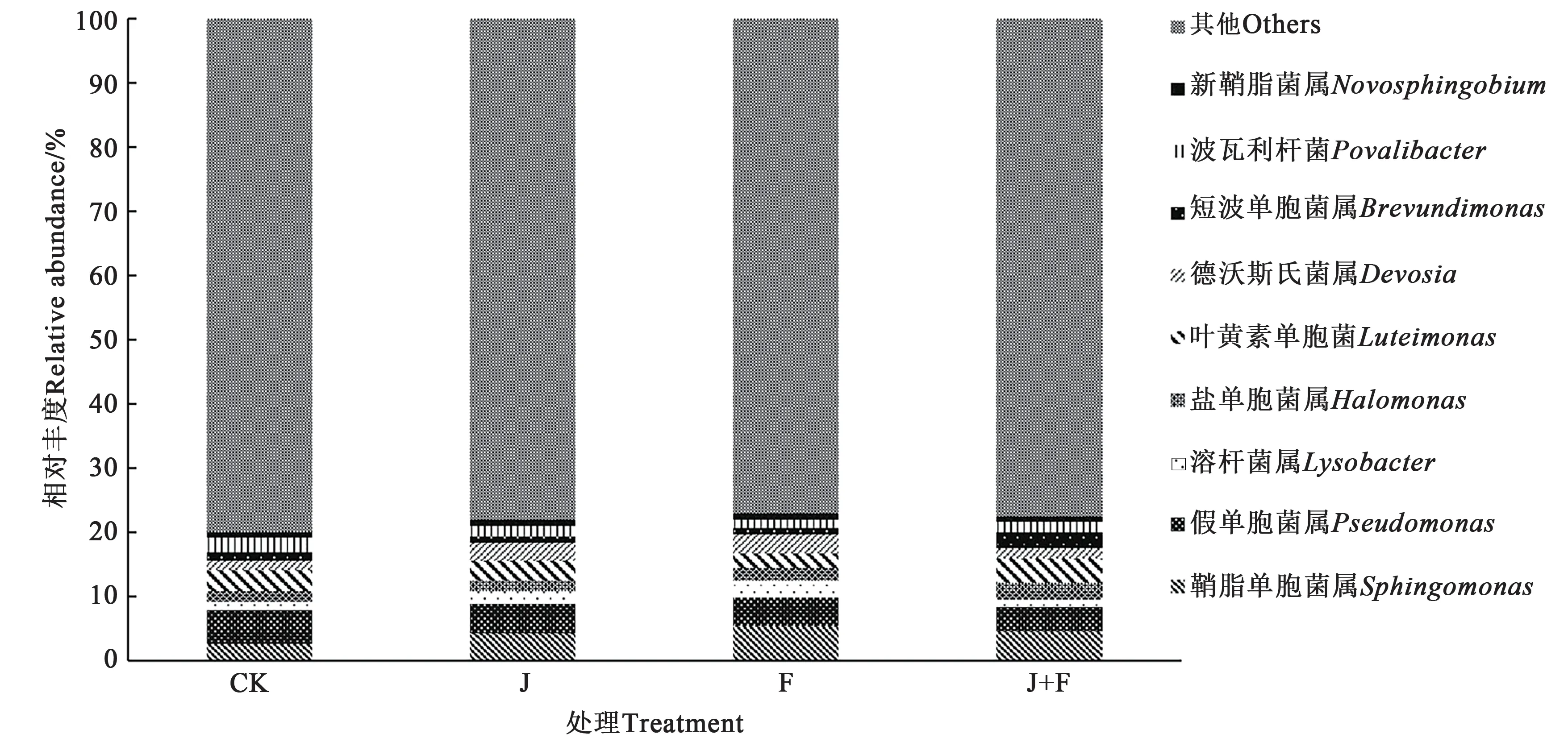
图2 不同处理组人参根际细菌在属水平上的群落组成Fig. 2 Composition of ginseng rhizosphere bacteria in different treatments at genus level
与CK 相比,J 处理中鞘脂单胞菌属、溶杆菌属和德沃斯氏菌属的相对丰度增加;F 处理中溶杆菌属的相对丰度增加,假单胞菌属的相对丰度减少;J+F 处理中假单胞菌属的相对丰度减少,盐单胞菌属的相对丰度最高。即不同处理根际细菌群落组成在属水平上存在显著差异,通过外源施用有机肥或促生菌处理可以改变人参根际细菌群落在属水平上的组成和丰度,其中,溶杆菌属是促生菌处理后与对照差异较大的共有菌属。
2.4 干旱胁迫下施加促生菌与有机肥对人参抗逆性的影响
植物正常代谢过程和在各种环境胁迫下均能产生活性氧和自由基,活性氧和自由基的积累引起细胞结构和功能的损伤,因此,植物需要启动一系列抗氧化酶系统以清除这些物质。过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)是活性氧清除系统中的重要抗氧化酶。丙二醛(MDA)含量是植物细胞膜质过氧化程度的体现,MDA 含量高,说明植物细胞膜质过氧化程度高,细胞膜受到的伤害严重。从表3 可以看出,J+F 处理人参的POD、SOD 和CAT 的酶活性显著高于其他处理(P<0.05);除CAT外,促生菌对提高酶活性的作用均优于有机肥,且两者间还具有协同作用。J+F处理人参的MDA含量显著低于其他处理;J 处理的MDA 含量又低于F 处理,说明促生菌对于缓解干旱对细胞的伤害起主要作用,且有机肥与促生菌间还具有协同作用。以上结果表明,在干旱胁迫条件下,单独施用有机肥或促生菌处理均能提升人参在干旱胁迫下的抗氧化能力,而有机肥和促生菌配合施用效果最优。
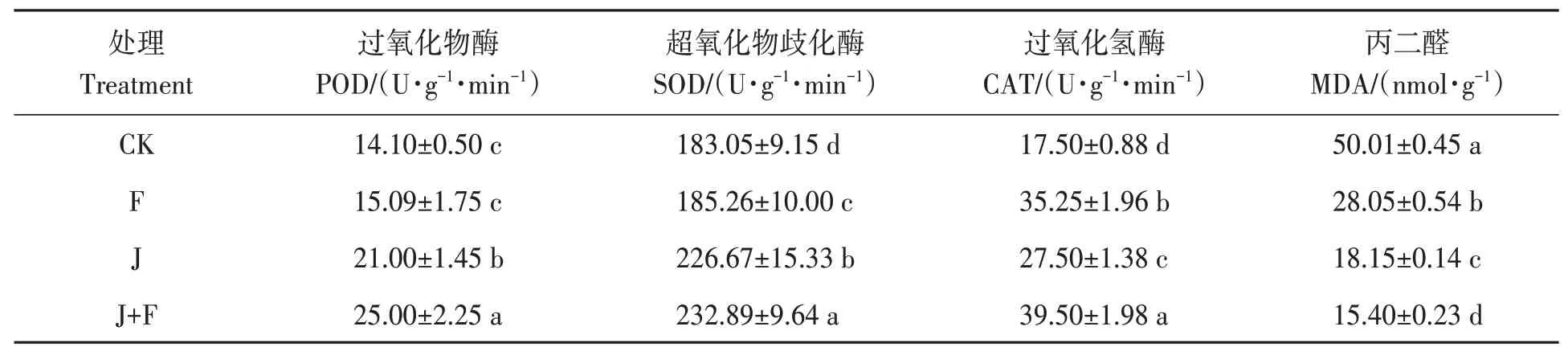
表3 不同处理组之间抗逆性相关因子的变化Table 3 Changes of stress resistance-related factors among different treatment groups
3 讨论
活性氧是氧化伤害的最重要来源,当植物处于不利环境时,会启动保护自身的抗氧化酶系统以消除过量的氧自由基。在胁迫环境下,植物的抗氧化酶活性越高,清除体内活性氧的能力越强,对植物体自身的保护程度越高[10]。有关人参干旱胁迫的研究中,大多从干旱胁迫下人参的栽培技术、不同种人参抗性生理指标的比较以及干旱胁迫程度对人参生理生化指标的影响等方面展开[11-13]。然而,通过PGPR 和有机肥的不同组合探讨其对人参抗旱性影响的研究还鲜见报道。研究表明,将产ACC 脱氨酶的促生菌接入可降解乙烯的中间产物 ACC,有利于植物抵御干旱胁迫[14]。本研究表明,将人参接种PGPR,或与有机肥配合施用,其抗氧化酶(SOD、POD 和CAT)活性均较CK 显著提高,表明PGPR 的施用有利于提高人参的抗旱性。
郑冬梅[15]研究表明,三七的抗氧化酶活性在一定范围内随着硝态氮含量的增加逐渐上升,这是由于植物吸收大量的硝酸根离子,对根系起到一定的保护作用,使根部抗氧化酶活性较高。李宪利等[16]研究表明,在一定范围内增加土壤硝态氮和铵态氮含量,苹果根系的SOD 和POD 活性升高。本研究表明,添加有机肥或有机肥协同促生菌处理土壤的硝态氮含量明显较高,且人参SOD、POD活性显著高于CK,与前人研究结果一致。
作物在吸收硝态氮过程中,会引起土壤pH特别是根际土壤环境pH的变化,若能使土壤保持较好的气体流动和通气效果,土壤中的硝化细菌可将硝态氮转化为铵态氮,同时释放某种物质,从而引起土壤pH 下降,这种现象又会影响植物对2 种氮素的吸收利用[17]。本研究表明,施用有机肥或有机肥与促生菌配合施用处理的土壤硝态氮含量较高,且人参根际土壤环境 pH较低。张卫东等[18]研究表明,施入有机肥后短期内不能被完全吸收,引起盐分的聚集,导致土壤EC 上升,但随着肥料被吸收土壤EC 会逐渐下降,这与本研究结果一致。
有机肥的施入使土壤营养元素得到转化,同时能够加速土壤环境中的有机-无机物转化,这些过程有大量细菌、真菌等微生物参与,尤其在植物根部微生物活动更加活跃[19]。植物残体作为肥料施入土壤后不仅能够提高土壤肥沃程度,改善土壤结构,对土壤的生物学特性也有重要影响[20]。此外,将秸秆作为肥料施入土壤2 个月后,对土壤肥沃程度和微生物群落组成影响较大,这是由于植物残体中含有大量的纤维素等物质,激活了土壤环境中纤维素降解菌群的繁殖和代谢能力[21]。因此有机肥或有机肥与促生菌配施2 个处理中的营养元素含量显著高于CK,且施入有机肥后的土壤更适宜促生菌生长,使其发挥作用,显著提升根系土壤的铵态氮、速效磷含量。
田稼等[22]研究发现,土壤脲酶与蔗糖酶活性呈极显著正相关,同时在一定范围内这2 种酶的活性与土壤肥沃程度呈正比。土壤中氮肥的水解需要脲酶,脲酶发生酶促反应后其产物可为作物提供营养元素。宋日等[23]研究表明,生物有机肥可显著提高土壤脲酶、蔗糖酶活性。有机肥不仅能够改善植物根际营养条件,改良土壤结构,增加微生物丰度等,还能显著提高植物抗逆性[24-25]。因此在干旱条件下单独施用促生菌虽不能提高土壤脲酶活性,但能够显著提升蔗糖酶活性,且配合有机肥混合施用效果更显著。
综上所述,产ACC 脱氨酶促生菌G119 与有机肥协同配合施用能够提高人参抵御干旱胁迫的能力,表现为人参SOD、POD 和CAT 活性增加,分别可达232.89、25.00 和39.50 U·g-1·min-1。促生菌和有机肥处理参地土壤对根际细菌在门水平和属水平的群落组成和丰度存在较大影响,能适度降低人参根际土壤pH,同时提高土壤EC;人参根际土壤养分含量以及土壤脲酶、蔗糖酶活性均显著上升。
