氢气和氧气共存下三氯乙烯高效降解菌Pseudomonas putida HO1的分离鉴定与降解特性
2023-10-09刘明慧余锦涛欧阳葳葳
薛 晨,李 翠,刘明慧,余锦涛,欧阳葳葳,刘 慧
(中国地质大学(武汉)环境学院,湖北 武汉 430078)
三氯乙烯 (trichloroethylene,TCE) 是一种优良的有机溶剂,广泛应用在机械、电子、农药等工业领域中,可用作制冷剂、金属清洁剂、脱脂剂、洗涤剂和杀虫剂等[1]。随着现代工业的迅速发展,TCE被大量使用和不恰当排放,由于其具有致癌、致畸、致突变效应,从而威胁着人类健康[2-3]。TCE可通过多种途径进入土壤和地下水中,而且具有较强的迁移性,使其成为地下环境中主要的有机污染物之一[4-5]。目前国内外对于有机污染场地的修复方法有很多,而利用微生物代谢降解有机污染物具有成本低廉、高效无害且无二次污染的特点,成为氯代烃污染场地的主要修复方法之一[6]。
TCE可以通过厌氧还原脱氯[7]、直接好氧氧化[8]和好氧共代谢[9]等途径被微生物降解。在厌氧还原脱氯的过程中,高氯代烃常作为电子受体,H2作为常用的电子供体,从放能脱卤反应中产生能量用于微生物生长[7]。在厌氧条件下,已发现和分离鉴定的能够还原脱氯TCE的微生物有很多。如Maymó-Gatell等[7]从环境中获得了一株能将四氯乙烯(PCE) 完全脱氯为乙烯 (VC) 的细菌Dehalococcoidesethenogenes195,这些微生物已被发现广泛存在于土壤、地下水、河口沉积物等环境中。好氧氧化过程是在有氧条件下,O2作为电子受体,微生物利用TCE作为电子供体或碳源或依靠其他基质生长并代谢降解TCE[10]。O2是一种重要的电子受体,充足的O2供给可以促进好氧微生物代谢,从而促进污染物的好氧降解。如Dey等[8]和Mukherjee等[11]分别报道了以TCE作为唯一碳源的细菌Bacillussp.2479和Stenotrophomonasmaltophiliastrain PM102。许多微生物虽不能以TCE为直接碳源,但可在有氧条件下利用其他底物生长而共代谢降解低氯代烃[12-14],如假单胞菌属(Pseudomonas)、亚硝化单胞菌属(Nitrosomonas)、不动杆菌属(Acinetobacter)、分支杆菌属(Mycobacterium)、黄色杆菌属(Xanthobacter)等。由于各类菌属是在不同环境中筛选出来的,其氯代烃降解性能也存在一定的差异。如:Chen[15]在含有甲苯为碳源的土壤中分离得到一株假单胞菌属菌株PseudomonasputidaASA86,在甲苯双加氧酶作用下降解TCE;Chen等[16]分离得到一株以苯酚为共代谢基质的TCE高效好氧菌Pseudomonasputida。
本课题组前期研究发现,通过电化学体系向地下水环境中同时通入氢气(H2)和氧气(O2)显著促进了TCE的降解,并指示该环境中可能存在能利用H2和O2降解TCE的微生物[17]。为此,本文研究的目的是在H2/O2共存的TCE污染沉积物中分离纯化能同时利用H2和O2且能降解TCE的特殊微生物,通过对该特殊微生物进行分离与鉴定,研究其在H2/O2共存条件下对TCE的降解特性,考察其对TCE污染沉积物的强化修复的效果,为创建TCE污染地下环境修复新方法提供依据。
1 材料与方法
1.1 沉积物样品来源
本试验所用的沉积物来自天津某废弃的化工厂,沉积物取样深度约为5 m,此区域曾被高浓度的氯化溶剂污染。
1.2 H2/O2共存TCE污染沉积物体系中微生物的富集、分离与纯化
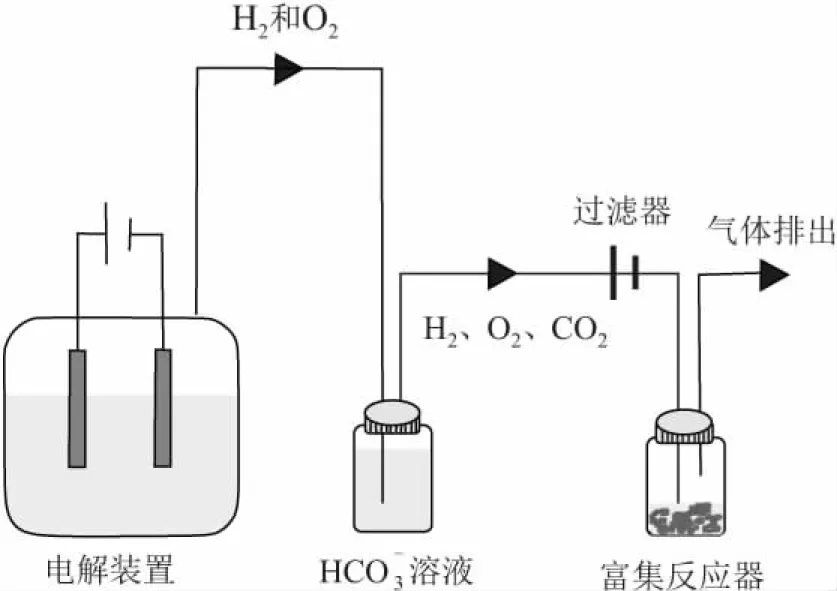
图1 微生物的富集培养装置示意图Fig.1 Microbial enrichment and cultivation device
1.3 菌株的形态观察、碳源利用与物种鉴定
菌株的细胞形态采用扫描电子显微镜 (SEM,SU8010,日立公司,日本) 进行观察,并采用BIOLOG ECO-plateTM(1506,BIOLOG公司,美国)研究该菌株对31 种不同单一碳源(6个生化类)的利用情况[19]。
菌株的种类鉴定:使用DNA提取试剂盒(天根DP302离心柱型,TIANGEN公司,北京)依照厂家说明书步骤提取细菌DNA;采用细菌16S rRNA 通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和 1492R(5′-CTACGGCTACCTTGTTACGA-3′)在PCR扩增仪上进行DNA扩增,取菌种纯化后的PCR产物,使用测序仪ABI3730-XL进行DNA测序;使用NCBI Blast程序将拼接后的序列文件与NCBI 16S数据库中的数据进行比对,并利用MEGA 7.0软件对序列进行编辑,采用邻接法构建系统发育树。
1.4 H2/O2共存条件下TCE的降解动力学和强化TCE污染沉积物的生物修复试验
将分离获得的菌株用于不同H2、O2条件下TCE的降解动力学试验,试验装置见本课题组发表的文献[17]。试验采用220 mL玻璃瓶体系,混合培养基提前灭菌除氧后在厌氧手套箱 (COY,美国) 中加入玻璃瓶中,再加入5% 的菌悬液及TCE储备液,在25 ℃、150 r/min下振荡1 h后,测定样品中TCE的初始浓度。未接种的螺口玻璃瓶作为对照,每组设两个平行。提前在300 mL的聚四氟乙烯气袋中分别装入150 mL H2、150 mL O2、150 mL N2以及100 mL H2和50 mL O2的混合气体,并将气袋分别与玻璃瓶相连。试验装置在25 ℃的旋转激振器上以150 r/min的转速摇动。微生物强化TCE污染修复试验采用250 mL玻璃瓶体系,在螺口玻璃瓶中加入40 g场地沉积物、200 mL无菌水、5%的菌悬液及TCE储备液,瓶外连接装有100 mL H2和50 mL O2的300 mL聚四氟乙烯气袋,培养条件同上。定期从玻璃瓶取样口收集2 mL样品,迅速取1 mL加入至42 mL的棕色瓶中(提前装入40 mL的超纯水),测定样品中TCE及可能中间产物的浓度。
1.5 分析方法
样品中TCE及可能中间产物的浓度依据国家标准《水质挥发性有机物的测定 吹扫捕集/气相色谱-质谱法》(HJ 639—2012)中方法,采用吹扫捕集-气相色谱-质谱联用仪(PT-GC-MS)(PT: Atomx,Teledyne Tekmar,美国;GC-MS:Thermo Fisher Scientific Inc.,美国)、Aligent DB-624毛细管柱(30 m×0.25 mm×1.4 μm)进行测定;样品中溶解氢(DH)浓度采用DH仪(DH200,CLEAN,美国)进行测定,采用非侵入式O2传感器(FIBOX 3,Pre-Sens GmbH,德国)对瓶内溶解氧(DO)浓度进行测量,氧气传感器贴片预先粘在玻璃瓶的内壁上[17]。
2 结果与讨论
2.1 菌株HO1的形态特征、碳源类型与鉴定结果
2.1.1 菌株HO1的形态特征
在持续通入H2、O2、CO2气体的条件下,从氯代烃污染沉积物中分离得到一个菌株(编号为HO1),具有降解TCE的能力。该菌株在LB平板上的菌落表面光滑,不透明,有凸起,呈浅粉色,大部分菌落直径在0.9~1.1 mm之间[图2(a)]。扫描电镜结果显示,该菌株细胞呈杆状,长约1.5 μm,呈单细胞形态,细胞表面光滑[图2(b)和2(c)]。

图2 菌株HO1菌落及细胞形态Fig.2 Colony and cell morphology of strain HO1
2.1.2 菌株HO1的碳源类型
菌株HO1能利用1506微孔板的以下化合物作为唯一碳源生长:D-木糖/戊醛糖、D-半乳糖醛酸、L-精氨酸、L-天门冬酰胺、L-丝氨酸、甘氨酰-L-谷氨酸、γ-羟丁酸、2-羟基苯甲酸、4-羟基苯甲酸、吐温 40、吐温 80、D-苹果酸、苯乙胺、丙酮酸甲酯和肝糖,见表1。
2.1.3 菌株HO1的鉴定
通过测序得到菌株HO1的16S rRNA基因序列,提交GenBank,并利用Blast进行同源性序列比对,发现该菌株的16S rRNA基因序列与假单胞菌属(Pseudomonas)成员高度同源,达到100%。与其关系最密切的菌株是土壤假单胞菌菌株Pseudomonasputidastrain ATCC-17485(登录号AF094739.1),故选取15 株假单胞菌属菌株的16S rRNA部分基因序列通过MEGA7软件以Neighbor-Joining计算方式构建系统发育树,见图3。

图3 菌株HO1的系统发育树Fig.3 Phylogenetic tree of strain HO1
由图3可知,菌株HO1与已报道的假单胞菌属亲源关系最近,与Blast同源性序列比对结果一致。因此,该菌株被鉴定为假单胞菌Pseudomonasputida,命名为PseudomonasputidaHO1。
2.2 菌株HO1在不同H2和O2条件下对TCE的降解动力学过程
菌株HO1在不同H2和O2条件下对TCE的降解动力学过程曲线,见图4。
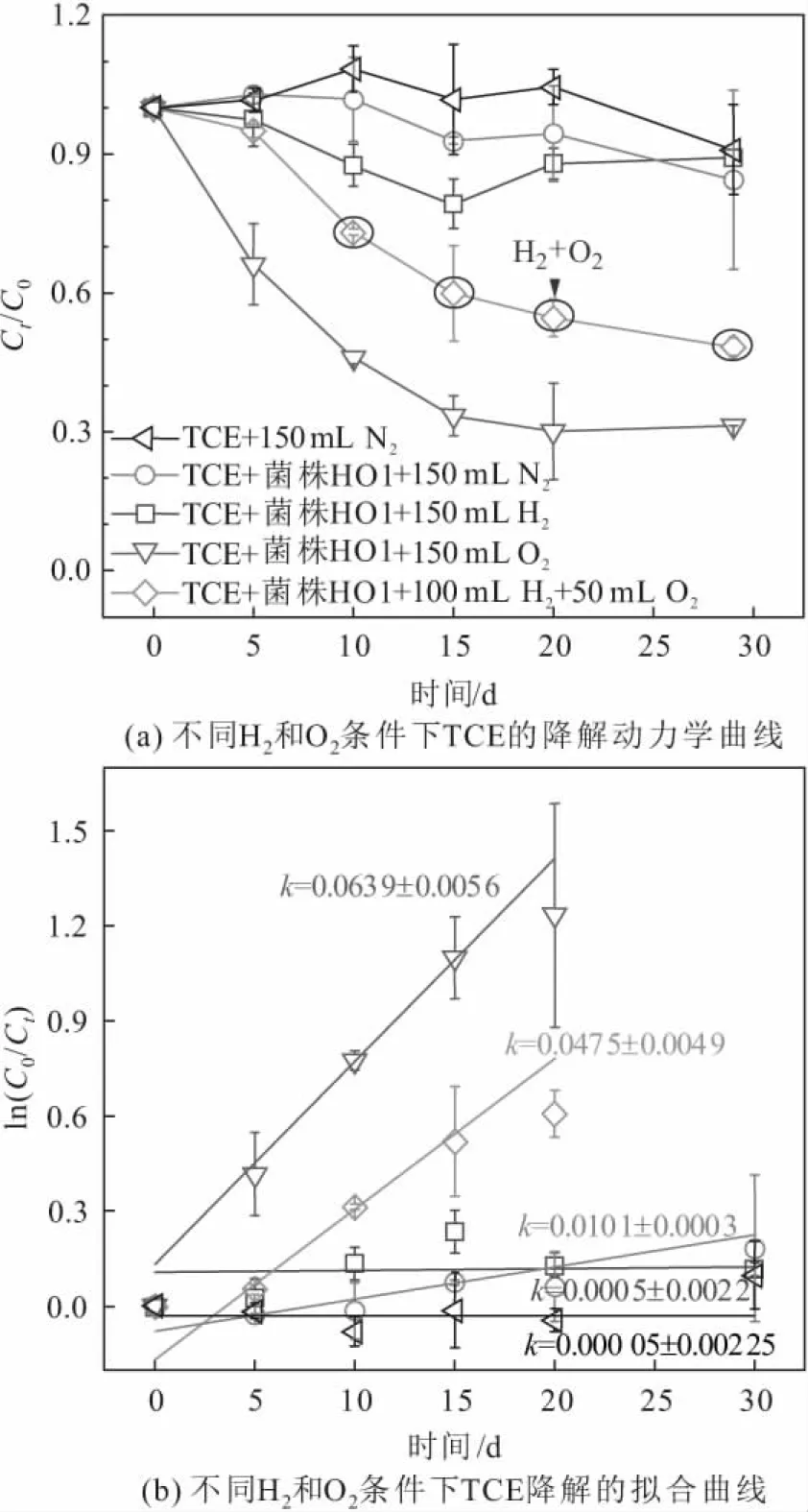
注:Ct为t时刻TCE的浓度;C0为TCE的初始浓度。图4 菌株HO1在不同H2、O2条件下对TCE的降解 动力学过程曲线Fig.4 Degradation kinetics curves of TCE by strain HO1 under different H2 and O2 conditions
由图4(a)可知:菌株HO1在纯N2条件下不能去除TCE,加入H2对TCE去除的影响不大,没有产物的生成,而在加入O2条件下TCE浓度从反应的第1天就开始快速下降,在反应的前15 d内降解率为66.6%,之后TCE的降解变缓并趋于停止;在H2/O2(体积比为2∶1)共存条件下,TCE浓度在反应的前5 d下降较慢,表现出明显的滞后期,说明该菌株最初不适应这种H2/O2共存的条件,而经过5 d的培养后TCE浓度开始较快地下降,30 d内去除了51.7%(13.9 μM) 的TCE。针对上述两种TCE发生降解的体系,在培养液中没有检测到顺式二氯乙烯(cDCE) 或三氯乙醛等中间产物,推断是直接好氧代谢。
为了定量对比菌株HO1对TCE的降解速率,通过对TCE的降解曲线进行拟合,发现所试体系中TCE的降解过程符合一级动力学模型(相关系数R2>0.95),模拟结果与一级反应速率常数k值见图4(b)所示。
由图4(b)可知,在纯O2和H2/O2共存的条件下,TCE降解的k值分别为(0.063 9±0.005 6) d-1和(0.047 5±0.004 9) d-1。
一般来说,假单胞菌属的菌株更容易通过好氧降解进行TCE转化[20-23]。本课题组前期的研究结果表明,在H2/O2共存条件下沉积物中形成了特定的微生物群落,其中假单胞菌属的一些物种是H2/O2共存条件下特有的[17]。试验过程中发现,不同试验组的气体消耗情况存在明显的区别。在H2/O2共存体系中,菌株HO1对气体的利用率很高,每5 d气袋中100 mL H2和50 mL O2完全消耗,所以每隔5 d在原气袋中补充100 mL H2和50 mL O2[如图4(a)中紫色圆圈所示]。该现象表明菌株HO1能同时利用H2和O2。为了进一步弄清反应体系中H2和O2的浓度状况和菌株HO1对H2和O2的利用情况,本试验过程中监测了反应液中DH和DO浓度的变化情况,其监测结果见图5。

图5 菌株HO1在不同H2和O2条件下反应液中DH、 DO变化情况Fig.5 Changes of DH and DO in the reaction solution under different H2 and O2 conditions
由图5可知:单独供H2和O2的体系中一直维持较高浓度的DH和DO;而在H2/O2共存体系中DO浓度低于纯O2体系,DH浓度始终在极低的水平,进一步说明该菌能同时利用H2和O2。
氢氧化细菌(hydrogen-oxidizing bacteria) 是一类能够利用H2作为电子供体、以O2作为电子受体并同化CO2的无机化能自养细菌[24]。李忠玲等[25]报道了一株具有促生作用的氢氧化细菌为荧光假单胞菌(Pseudomonasfluorescens),该菌株能同时利用H2和O2作为能量供细胞生长。本研究分离得到的PseudomonasputidaHO1与Pseudomonasfluorescens一样,其能够同时利用H2和O2,在H2/O2/CO2共存的条件下生长,本研究首次报道了假单胞菌种Pseudomonasputida能够在利用H2和O2的同时降解TCE。
2.3 菌株HO1对TCE污染沉积物的强化修复效果
为了探究菌株HO1对TCE污染的强化修复能力,本研究将该菌株加入到采自污染场地的实际沉积物中,对比了未加菌TCE污染沉积物体系,检测TCE的降解效果,其结果见图6。
由图6可知:在H2/O2共存体系中,原始沉积物中的土著菌群能够代谢TCE,即在3次添加TCE(TCE的初始浓度为30 μmol/L)溶液时,土著微生物需要6~19 d能够将加入的TCE降解完全,期间生成14.98 μmol/L厌氧降解产物cDCE;当加入菌株HO1时,TCE的降解时间缩短至2~4 d,尤其是在第3次添加TCE后其降解速率更快,生成的cDCE在第13 d达到了最大浓度20.37 μmol/L,随后cDCE浓度则快速下降至0 μmol/L;在灭菌沉积物组中,TCE的浓度有所减少但是始终没有cDCE的产生,说明上述两处体系中TCE的降解是微生物作用导致。
此外,图6结果表明,H2/O2共存体系中加入和未加入菌株HO1的沉积物中TCE降解的第一步是将TCE还原脱氯成cDCE,但体系中未检测到进一步还原脱氯的中间产物。因此,推断cDCE可能通过好氧途径降解。
图7为不同体系试验后的CO2检测结果。

图7 不同试验体系中CO2的GC-MS谱图Fig.7 GC-MS spectra of CO2 in different experimental systems
由图7可知:在灭菌沉积物组中几乎没有CO2的生成;而在加菌和未加菌的沉积物组中检测到了CO2的生成,其峰面积分别为1 984 174 136和1 522 660 655。由此判断,试验体系中的CO2主要来自沉积物中有机物(包括TCE)的好氧降解,而相对于未加菌试验体系,加了菌株HO1的试验体系中增加的CO2产生量暗示着TCE发生了好氧降解。基于以上分析可以推断,菌株HO1降解TCE的途径为:先将TCE厌氧脱氯至cDCE,然后再好氧降解为CO2。
2.4 菌株HO1的科学价值与应用前景
本研究获得的菌株PseudomonasputidaHO1为首次报道的一株能利用H2和O2生长同时降解TCE的细菌,能够在纯O2环境中或H2/O2共存环境中将TCE最终降解为CO2,并且能够利用H2作为电子供体,以O2为电子受体,CO2作为无机碳源合成自身有机物质,为细胞生长提供能量。这表明该菌能够在寡有机物的地下环境中利用H2和O2,同时参与环境中的TCE降解,对TCE污染地下环境的生物修复起着重要作用。通过电化学体系向地下环境中同时通入H2和O2能显著促进TCE的降解[17],加入特征微生物能有效强化TCE污染沉积物的修复效果。菌株HO1以H2为电子供体、O2为电子受体并降解TCE的方式为去除寡有机质环境中的氯代污染物提供了一种有效的途径。因此,该菌株不但对于认识氢氧共存环境中氯代有机污染物的降解机制具有重要的科学价值,而且有望为强化寡有机物的地下环境中TCE污染的生物修复提供新思路。
3 结 论
1) 从受氯代烃污染的沉积物中富集、分离得到一株能利用H2和O2降解TCE的菌株PseudomonasputidaHO1。
2) 该菌株在纯O2和H2/O2共存条件下对TCE的降解过程符合一级动力学模型,其TCE降解的一级反应速率常数k分别为(0.063 9±0.005 6) d-1和(0.047 5±0.004 9) d-1。
3) 将菌株HO1添加至污染场地沉积物中,在H2/O2共存条件下显著促进了TCE的降解速率,利用该菌株,通过通入H2/O2有望强化TCE污染地下环境的生物修复。
4) H2/O2共存条件下菌株HO1对TCE的降解途径为:先将TCE脱氯为cDCE,然后再好氧降解为CO2。
