基于Py-GC-MS和UHPLC-TOF-MS研究不同靛蓝提取物的化学组成差异
2023-10-09王成章颜洋洋刘丹阳商士斌张华兴
王成章, 颜洋洋, 刘丹阳, 周 昊, 商士斌, 张华兴
(1.中国林业科学研究院 林产化学工业研究所;江苏省生物质能源与材料重点实验室;国家林业和草原局林产化学工程重点实验室;林木生物质低碳高效利用国家工程研究中心;江苏省林业资源高效加工利用协同创新中心,江苏 南京 210042; 2.南京林业大学 江苏省林业资源高效加工利用协同创新中心,江苏 南京 210037; 3.凯里小生物科技有限公司,贵州 凯里 556000)
天然靛蓝源于马蓝、木蓝、蓼蓝或菘蓝等含靛植物[1-3],传统的靛膏是含靛植物茎叶经自然浸泡、过滤、加入石灰、搅拌、过滤(弃去滤液)得到靛膏,再经晒干和粉碎得到靛蓝粗提取物[4-9]。天然靛蓝具有绿色安全、环境相容性好等优点,在纺织品上染、建筑用涂料、绘画用颜料、化妆品和药品等领域广泛使用[10-12]。石岩等[13]通过药典标准检测方法分析了青黛无机物组成中总灰分为65%~85%、酸不溶性灰分为5%~29%。李永生等[14]采用反向高效液相色谱法同时测定青黛中5种核苷类成分。吴青青等[15]采用高效液相色谱法同时测定青黛中色胺酮、靛蓝及靛玉红的含量。传统青黛炮制仅采用简单搅拌收集浮沫得到靛花来制备较高靛蓝(>8%)或有机物含量的青黛[16],但产量很低难以满足临床用药需求,且不能满足靛蓝纯度高或灰分含量低的要求,以及对不同新工艺得到的青黛的深入研究鲜有报道,青黛和靛蓝提取物药理活性与作用机制尚不清晰。因此,本研究以马蓝鲜叶自然发酵和生石灰打靛产生的靛膏为原料,分别通过预处理去杂、酸化、还原和溶剂萃取等工艺,制备靛蓝粗提物、酸化-靛蓝提取物、葡萄糖还原-靛蓝提取物及乙酸乙酯萃取-靛蓝提取物。采用热裂解-气相色谱/质谱联用(Py-GC-MS)和超高效液相色谱-四级杆飞行时间串联质谱(UHPLC-TOF-MS)技术对不同提取工艺的靛蓝提取物中化学成分进行整体轮廓分析,并结合相关文献,快速分析并鉴定其化学成分,以期为靛蓝提取物中药效物质分析及利用提供基础,并为高品质靛蓝提取物中生物碱、酸类、多酚类、黄酮类等活性物质有效富集提供参考。
1 材料与方法
1.1 原料、试剂与仪器
马蓝鲜叶发酵制备的靛蓝膏(靛蓝质量分数2.09%,含水量50%~60%,灰分65.23%),由贵州小生源有限公司提供;靛蓝标准品(HPLC≥97%)、甲醇(色谱纯),购于阿拉丁生化试剂有限公司;乙酸乙酯、氢氧化钠、葡萄糖、N,N-二甲基甲酰胺,均为市售分析纯;盐酸,市售化学纯。
CBM-10A VP Plus型高效液相色谱仪,日本岛津公司;KF1100型箱式炉,南京博蕴通仪器科技有限公司;QUINTIX35-1CN PC型电子天平,德国赛多利斯公司;LXJ-IIB型低速离心机,海安亭科学仪器厂;KH5200E型超声波清洗器,昆山禾创超声仪器有限公司;RE-5LC型旋转蒸发仪和DF-101S型恒温加热磁力搅拌器,河南省予华仪器有限公司;209 F1 Libra型热重分析仪,德国耐驰仪器制造有限公司;ICAP 7400型双通道电感耦合等离子体发射光谱仪,UltiMate 3000型超高压液相色谱(UHPLC)仪,美国赛默飞世尔科技公司;5600 QTOF型高分辨串联质谱仪,美国AB SCIEX公司;PY-3030D/7890B-5977A型热裂解色谱质谱联用仪,美国安捷伦科技有限公司。
1.2 靛蓝提取物的制备
1.2.1靛蓝粗提物 将靛蓝膏按质量比1∶3加水搅拌30 min,用粒径0.18 mm滤布挤压过滤,离心,滤渣经80 ℃烘干,研磨成粉,过0.18 mm筛,得到靛蓝粗提物(ICE)。
1.2.2酸化-靛蓝提取物 取30 g ICE置于250 mL锥形瓶内,加入150 mL水,置于80 ℃ 的恒温水浴锅中搅拌10 min。然后缓慢滴加质量分数20%盐酸水溶液直到反应液pH值为2~3,搅拌反应40 min。离心得沉淀,用100 ℃水洗涤沉淀至中性,离心,滤渣经80 ℃烘干,制得酸化-靛蓝提取物(AIE)。
1.2.3葡萄糖还原-靛蓝提取物 取2 g AIE置于250 mL锥形瓶中,加入100 mL水和3 g氢氧化钠,置于80 ℃恒温水浴锅中搅拌30 min。离心后将下层滤渣转入锥形瓶中,再加入100 mL水、 3 g氢氧化钠和2.5 g葡萄糖,瓶口用封口膜密封后在60 ℃恒温水浴下搅拌反应50 min。反应后离心得上层液体,用气泵通入空气2 min,再滴加质量分数20%盐酸调pH值为3~4,再次离心分离,下层沉淀用超纯水洗涤至中性,沉淀烘干,制得葡萄糖还原-靛蓝提取物(GRIE)。
1.2.4乙酸乙酯萃取-靛蓝提取物 取20 g AIE置于500 mL烧杯中,加入200 mL乙酸乙酯后超声波振荡30 min。过滤,滤渣重复萃取2次,合并萃取液,蒸发乙酸乙酯溶剂后,烘干制得乙酸乙酯萃取-靛蓝提取物(EAEI)。
1.3 分析方法
1.3.1HPLC分析 采用HPLC分析检测不同提取工艺下的靛蓝提取物的靛蓝含量。HPLC条件:PRAZIS C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇/水(体积比70∶30);流速1.0 mL/min;检测波长289 nm。
1.3.2灰分和酸不溶灰分的测定 靛蓝提取物中总灰分和酸不溶性灰分[17]参照2020年版《中华人民共和国药典》中灰分测定法测定。
1.3.3Py-GC-MS分析 ICE、AIE、GRIE和EAEI 4种靛蓝提取物的化学组成通过Py-GC-MS分析。分析条件:进样量3 mg,在氦气气氛下,以20 ℃/min的升温速率从室温升至600 ℃,保持20 s以确保待测样品裂解完全,进行GC-MS在线分析。色谱柱为HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm);柱温250 ℃,程序升温:初始温度55 ℃ 保持1 min,然后以15 ℃/min升至250 ℃ 并保持3 min;分流比为 50∶1;流速1 mL/min;载气为氦气;进样口温度为300 ℃;传输线温度为280 ℃。质谱采用EI离子源,离子源温度250 ℃,扫描范围25~400 u[18-19]。
1.3.4UHPLC-TOF-MS分析 通过UHPLC-TOF-MS分析AIE和EAEI的化学组成。色谱条件:色谱柱ACQUITY UPLC HSS T3柱(100 mm×2.1 mm×1.8 μm);柱温40 ℃,进样量3 μL;正离子模式流动相,A为0.1%甲酸水,B为0.1%甲酸乙腈;负离子模式流动相,A为2 mmol/L乙酸铵水溶液,B为乙腈。梯度洗脱:0~2 min,95% A;>2~30 min,95%~7% A;>30~47 min,7% A;>47~53 min,7%~0% A;>53~54 min,0%~95% A;>54~58 min,95% A。质谱条件:AB 5600 Triple TOF质谱仪为电喷雾离子源:正负离子检测模式;一级采集范围(m/z)为50~1 200;轰击能量30 eV,每50 ms 10张二级谱图。ESI离子源参数设置如下:雾化气压(GS1)414 kPa;辅助气压414 kPa;气帘气压241 kPa;温度650 ℃;喷雾电压5 000 V(正离子模式)或-4 000 V(负离子模式)[20]。
2 结果与分析
2.1 提取工艺对靛蓝提取物主要成分的影响
不同提取工艺处理后的靛蓝提取物的主要成分分布见表1。由表可知,市售靛蓝膏中靛蓝质量分数为2.09%,刚达到2020年版《中华人民共和国药典》标准,并且其灰分质量分数高达65.23%。经简单地预处理去杂得到的靛蓝粗提物中靛蓝含量提高至未处理时的3倍,灰分也明显减少,但仍有较多的SiO2类非石灰类杂质;以靛蓝粗提物为原料,经过酸化、还原和溶剂萃取等工艺得到的AIE、GRIE和EAEI中的靛蓝含量均得到大幅提升,灰分含量也大幅减少。其中酸化处理步骤可以除去靛蓝粗提物中绝大多数碳酸钙、氢氧化钙等,所以灰分质量分数由接近50%变为15%以下;而在酸化基础上继续采用葡萄糖还原工艺能除去大量的多糖、胶质体、植物纤维、叶绿素等有机物和石灰类等无机物,以及少量酸不溶灰分杂质,得到高纯度靛蓝,但在酸化基础上继续采用乙酸乙酯萃取工艺,其提纯效果不佳。由此可见,葡萄糖还原工艺是一种绿色、高效、简便的高纯度靛蓝分离纯化新工艺,可解决靛蓝纯化效率低和易造成环境污染等现实问题。
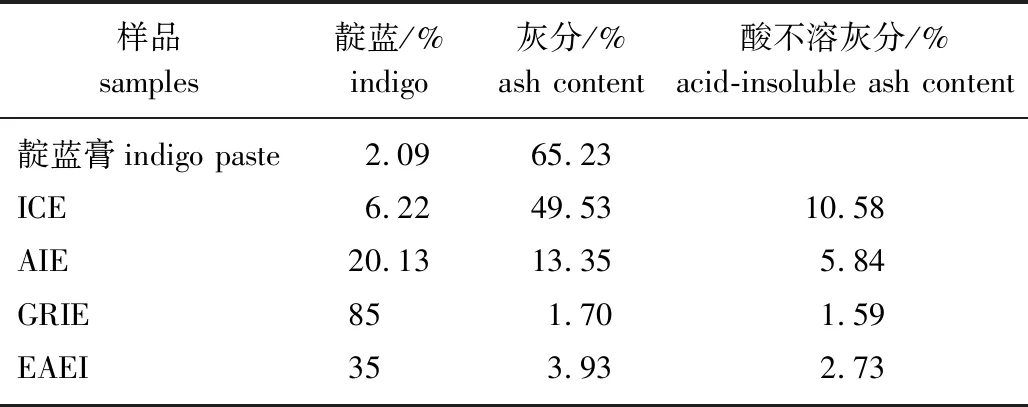
表1 不同提取工艺处理后的靛蓝提取物的成分分布
靛蓝一直以来被认为是青黛的主要活性物质,由不同工艺制备得到靛蓝提取物样品中的靛蓝含量显著高于原料中靛蓝的含量,由实验结果可知,可以根据不同青黛靛蓝含量需要选择不同工艺。
2.2 Py-GC-MS法分析靛蓝提取物挥发性成分
对4种靛蓝提取物进行Py-GC-MS裂解气质(室温~600 ℃)成分分析。4个样品的裂解气质图及其化学组成分别见图1和表2。

a.ICE; b.AIE; c.GRIE; d.EAEI
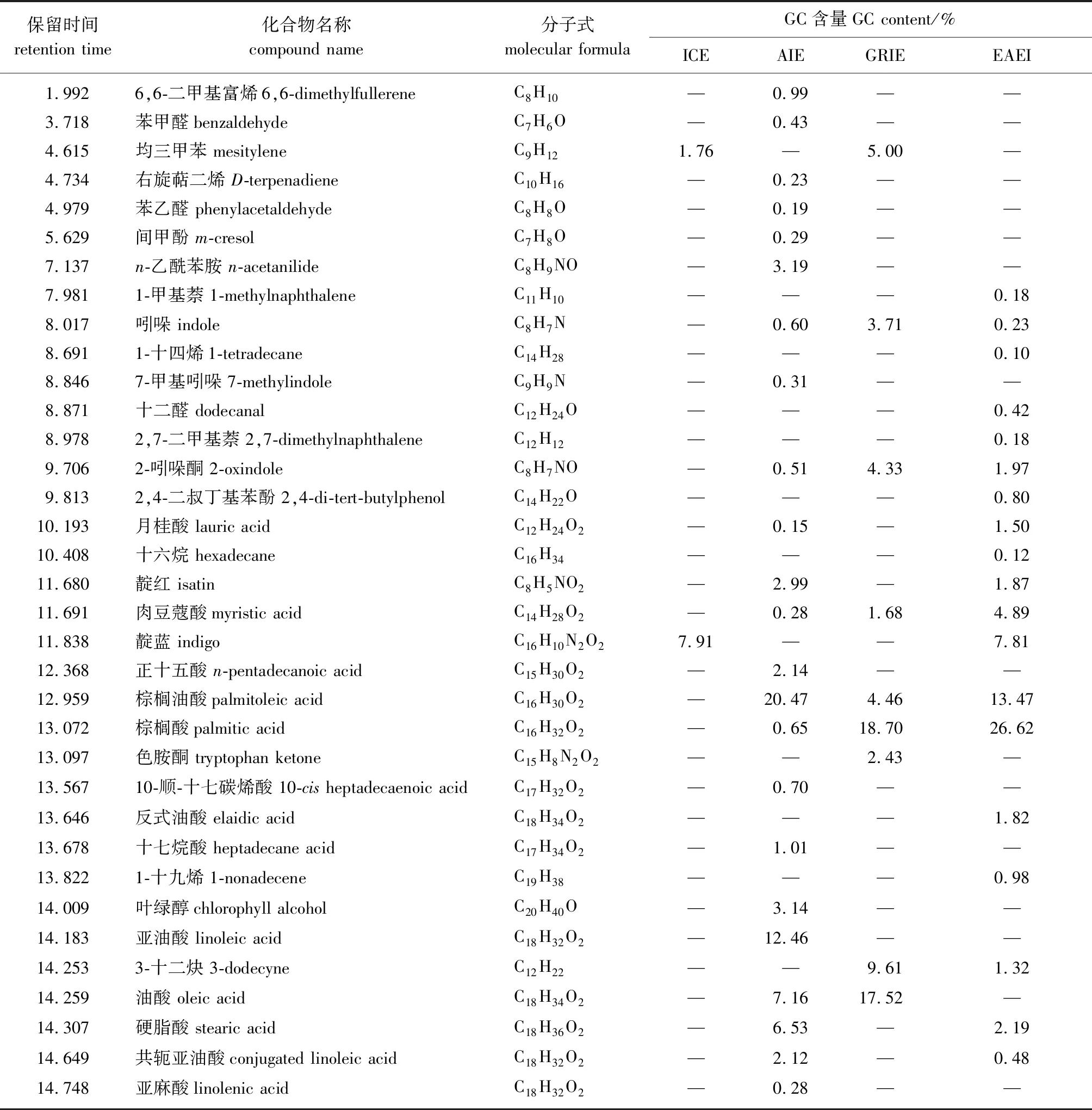
表2 不同靛蓝提取物裂解组分的Py-GC-MS分析结果
由表2可知,靛蓝提取物裂解后化合物组成复杂,12个碳以下的小分子种类较少,12碳及以上种类多且GC含量较高,因此,以 12个碳为分界点来对裂解产物的组分进行分类。由表可知,ICE、AIE、GRIE和EAEI 4个样品的裂解产物中12个碳以下的小分子组分较少,分别为1.76%、 9.73%、 13.04%和4.25%;而12~20个碳的组分较多,分别为7.91%、 57.09%、 54.4%和62.7%。
此外,从表2中还可以看出,仅在ICE与EAEI中检测到靛蓝,说明AIE和GRIE中的靛蓝已完全裂解。ICE中仅检测到2种裂解产物,且GC含量之和小于10%,说明ICE中有机物成分很少。AIE中检测到23种裂解产物,说明酸化工艺可以提高产品中有机物含量,且检测到较多酸类物质。GRIE中检测到9种裂解产物,主要是吲哚类与酸类,应是由靛蓝裂解生成。EAEI共检测到19种裂解产物,且分类较多,中等极性产物含量也较高,说明乙酸乙酯萃取工艺可得到较多的有机物,导致裂解产物组成较为复杂。
2.3 UHPLC-TOF-MS法分析靛蓝提取物化学组成
利用UHPLC-TOF-MS对AIE和EAEI中化学成分进行检测分析,通过与NIST 08质谱数据库比对,并利用面积归一法得到各成分的相对峰面积,其UHPLC-TOF-MS图谱及化学组分分类分别见图2和表3。

图2 2种靛蓝提取物AIE(a)、EAEI(b)的UHPLC-TOF-MS分析
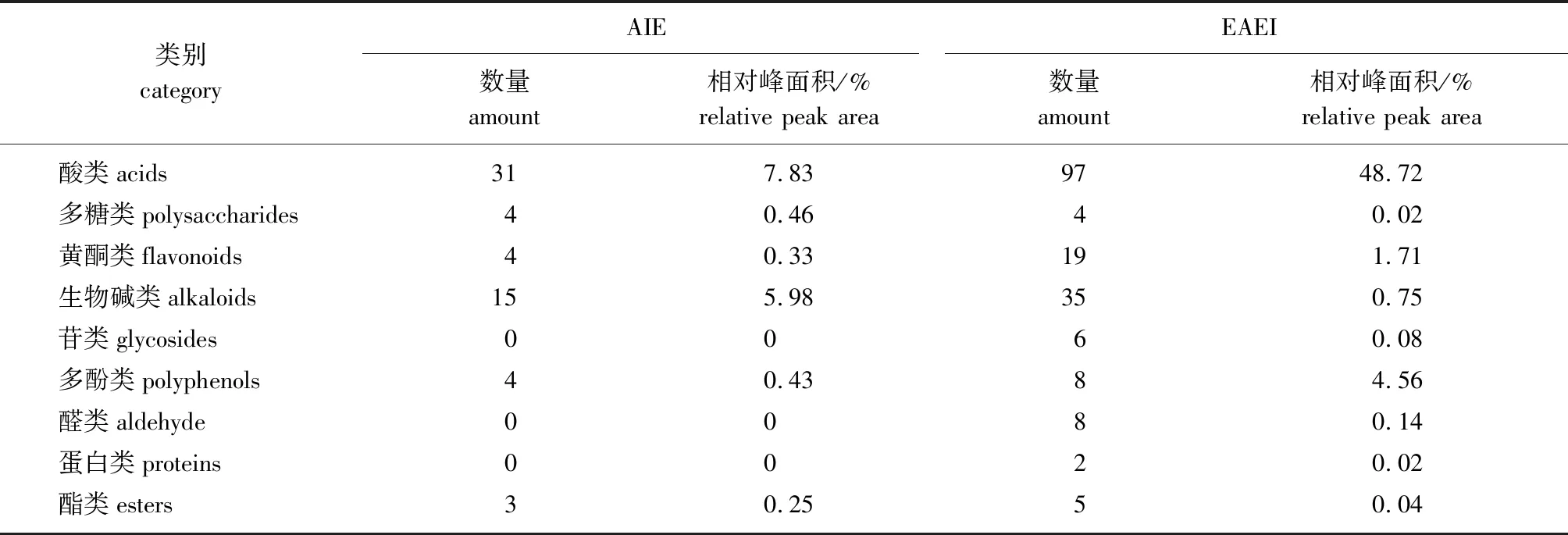
表3 不同靛蓝提取物组分的UHPLC-TOF-MS分析结果
由表3可知,AIE中共鉴定出61种化合物,相对峰面积为15.28%;EAEI中鉴定出184种化合物,主要包括酸类、多糖类、黄酮类、生物碱类、苷类、多酚类、醛类、蛋白类、酯类9类物质,相对峰面积为56.04%。酸化-靛蓝提取物通过乙酸乙酯萃取工艺处理后,酸类物质由7.83%增加到48.72%;多酚类物质由0.43%增加到4.56%;黄酮类物质由0.33%增加到1.71%。可见,乙酸乙酯萃取工艺对靛蓝提取物中酸类、多酚类、黄酮类等实现了有效富集。
在相同分析条件下,EAEI中检测到的有机化合物种类远远多于AIE中的,可能是因为AIE中部分有机化合物含量太低,未达到检测限,所以未被检测出;而乙酸乙酯萃取过程对这些有机物实现了有效富集,使得EAEI中检测到的化合物增多。两种样品中共检测到16种相同化合物,其中酸类化合物9种,分别为12-羟基十二烷酸、蓖麻油酸、肉豆蔻烯酸、 5-氨基-2-对甲苯基苯磺酸、 8-(4-磺基苯基)辛酸、肉豆蔻酸、油酸、棕榈酸和硬脂酸;黄酮类化合物1种,为小豆蔻素;生物碱类化合物3种,分别为吲哚阿霉素、 2-(3-吡啶基)-苯并咪唑和4-羟基喹啉;酯类化合物1种,为雷公藤内酯醇;多糖类化合物2种,分别为蔗糖和α-环糊精。基于UHPLC-TOF-MS全面分析靛蓝提取物样品中的化学成分,结果显示EAEI中的有机化合物明显多于AIE,说明乙酸乙酯萃取工艺可对靛蓝酸化物中多种有机化合物实现有效富集。
3 结 论
3.1以靛蓝膏为原料,利用不同工艺处理制备得到靛蓝粗提物(ICE)、酸化-靛蓝提取物(AIE)、葡萄糖还原-靛蓝提取物(GRIE)和乙酸乙酯萃取-靛蓝提取物(EAEI)。对4种靛蓝提取物中靛蓝成分测定结果表明:相比于靛蓝膏,4种提取工艺制备的靛蓝提取物中靛蓝质量分数均得到显著提高,其中,GRIE中靛蓝质量分数达到85%。
3.2采用Py-GC-MS技术对靛蓝提取物中挥发性成分进行分析,结果表明:ICE、AIE、GRIE和EAEI的裂解产物中含有12~20个碳的组分较多,相应的GC含量分别为7.91%、 57.09%、 54.4%和62.7%。其中,EAEI的裂解产物中中等极性产物含量较高,说明乙酸乙酯萃取工艺可得到较多的有机物。
3.3采用UHPLC-TOF-MS技术对AIE和EAEI中的化学成分进行分析,结果表明:AIE和EAEI分别鉴定出61和184种化合物,主要包括酸类、多糖类、黄酮类、生物碱类、苷类、多酚类、醛类、蛋白类、酯类9类物质,其中,乙酸乙酯萃取工艺对靛蓝提取物中酸类、多酚类、黄酮类等实现了有效富集。
