深海多金属结核气-固协同还原热力学分析
2023-10-09居殿春徐思语堵伟桐邱家用
居殿春,李 凡,徐思语,堵伟桐,陈 卓,邱家用
(江苏科技大学 冶金工程学院,张家港215600)
深海多金属结核是一种海底自生沉积矿物,含有大量的Mn、Fe、Ni、Co、Cu等元素,其中Mn、Ni、Co、Cu的回收价值最高.深海多金属结核也是目前发现储量最大、分布最广的海底矿物[1],是国家未来发展所需战略元素来源的关键[2].结核结晶度较差,一般呈非晶态、半晶态或隐晶态,矿物组成复杂,以锰矿物相、铁矿物相和脉石矿物为主[3].此外,结核中除了Mn、Fe有独立的矿物相,其他金属元素(如Cu、Ni、Co)没有独立的矿相,多赋存在锰铁矿物中.传统的选矿工艺不能将各金属元素分离出来,需先将锰铁矿物进行解离,破坏其矿物结构,从而将有价值的金属元素释放出来[4].在对深海多金属结核进行高效综合利用的过程中,冶炼工艺的选择将起到至关重要的作用.
目前对深海多金属结核的冶炼工艺有湿法处理和火法处理,工艺方案包括酸浸、氨浸、焙烧、熔融等[5].湿法处理是在酸性或氨性介质中用还原剂对矿物进行选择性还原浸出.文献[6]以CO为还原剂、矿物自身带有的Cu为催化剂对深海多金属结核进行常温常压氨浸还原,Ni、Co、Cu的浸出率分别达到98%、90%、98%.文献[7]以甘油作还原剂对深海多金属结核酸浸,在80℃下浸出1h,Ni浸出率大于95%,Cu、Co、Mn的浸出率大于98%.文献[8]以苯二酚作深海多金属结核酸浸的还原剂,Mn、Ni、Co、Cu的浸出率大于93%~99%.火法处理主要是通过焙烧或熔融对深海多金属结核进行还原处理,生成合金和富锰渣[9].文献[10]提出多金属结核“零废弃物”的可持续火法处理,在1 400℃下生成含Ni、Co、Cu、Mo的合金,97%的Mn被保留在渣中,并在第二个冶炼步骤中作为锰铁回收,最终的炉渣不含重金属.文献[11]对深海多金属结核进行高温碳热还原发现,在MnO/SiO2质量比为1.6、石墨添加量为4%、还原温度1 350℃的条件下,渣金分离效果最好.湿法处理工艺可以避免过高的能耗,但是流程长且复杂;火法处理工艺能耗较高,但因其流程短、操作简单且金属收得率高,而得到广泛应用.
在气基(CO+H2)和固基(C)协同还原深海多金属结核球团的过程中,有价金属元素Mn、Fe、Ni、Co、Cu的氧化物价态会发生转变,对各反应的热力学条件进行计算,分析不同还原阶段的反应程度是非常重要的.采用Factsag热力学计算软件中的Reaction、Equilib模块对还原过程中所涉及到的化学反应的吉布斯自由能和反应气相平衡进行计算,为气-固协同还原深海多金属结核工艺的研究提供理论支撑.
1 多金属结核物相分析
采用X射线荧光光谱仪(XRF)对深海多金属结核的主要化学组成进行分析,结果如表1.深海多金属结核的X射线衍射图谱如图1.从衍射图谱分析表明,结核中的锰矿物主要由钡镁锰矿、钠水锰矿和水羟锰矿组成,铁矿物则主要以针铁矿形式存在,石英和钙十字沸石是主要的脉石矿物.
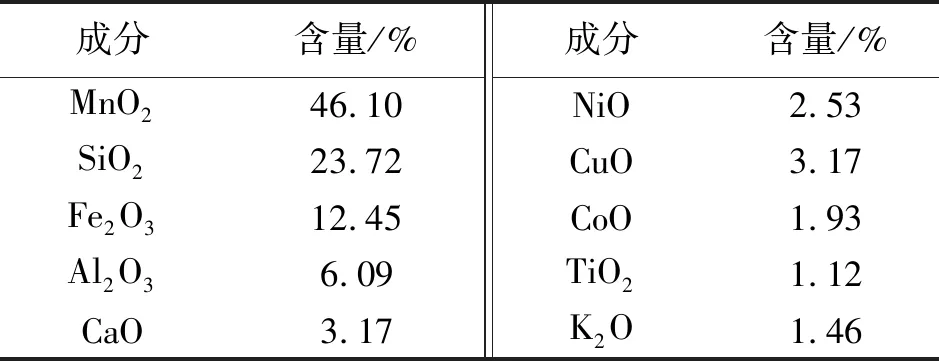
表1 深海多金属结核主要化学组成
2 热力学分析
采用气-固协同还原深海多金属结核工艺综合回收Mn、Fe、Ni、Co、Cu,还原过程由多个复杂的物理化学反应构成,在不同的还原阶段各还原剂的还原能力不同,需先分别计算各还原剂还原多金属结核的热力学条件.因此,采用Factsage 8.1热力学计算软件对固-固和气-固还原过程进行计算,分析判断各还原反应发生的热力学条件和方向,计算温度范围为0~1 600℃.
2.1 Fe、Ni、Co、Cu的还原热力学
深海多金属结核中FeO、NiO、CoO、CuO的还原比MnO的还原容易,可以实现选择性还原.在还原过程中除了各氧化物与还原剂C、CO、H2的反应,同时还有C的溶解损失反应和水煤气反应,具体反应方程式如表2[10,12-13].深海多金属结核中Fe2O3、NiO、CoO、CuO被C还原的反应式为(1-7),图2是C还原各金属氧化物的ΔrG-T图.

图2 C还原各氧化物的ΔrG-T图

表2 深海多金属结核中Fe、Ni、Co、Cu的氧化物还原过程中的化学反应
从图2可以看出,各反应的标准吉布斯自由能随还原温度的升高而降低,各反应的开始温度由低到高依次为(3)、(4)、(1)、(2)、(6)、(8)、(5)、(7).CuO极不稳定,与C的反应在低温下便可自发进行,随着还原温度的升高,NiO、CoO依次被还原,当还原温度高于500 ℃时,CuO、NiO、CoO与C皆可发生还原反应生成相应的金属单质.用固体C直接还原各氧化物并不意味着体系中只有固-固反应,相反,两个固相之间的接触条件差,不能够有效地推动反应向前进行.实际上的直接还原反应是由C的溶解损失反应与间接反应相互叠加形成的.在705 ℃以前,C的溶解损失反应不能自发进行,只有当温度高于705 ℃时,C与CO2的反应才能自发进行.对于铁氧化物的还原而言,结核中的铁氧化物主要是Fe2O3,在290 ℃左右被还原成Fe3O4,反应(5)的开始温度要高于反应(6),而反应(7)在温度低于720 ℃时无法自发进行,温度高于720 ℃时才可自发进行.因此,温度越高,越有利于C还原各氧化物的进行.
此外,Fe在790 ℃时会发生渗碳反应(3Fe+C=Fe3C)[14].在升温过程中,CO主要参与还原反应,所以Fe的间接渗碳比较困难;在高温下C的溶损反应消耗了大量的固体碳,且固-固接触条件变差,Fe的直接渗碳也变得缓慢.FeC3在温度低于810 ℃时不能稳定存,在降温过程中C会被析出(Fe3C=3Fe+C).由于深海多金属结核中Fe的含量不多,Fe的渗碳对还原过程影响并不明显.
在气-固协同还原过程中,低温下C的还原优势并不明显,通入的CO气体能够促进还原,Fe2O3、NiO、CoO、CuO与CO的反应为(9~15),各反应ΔrG-T的关系如图3.
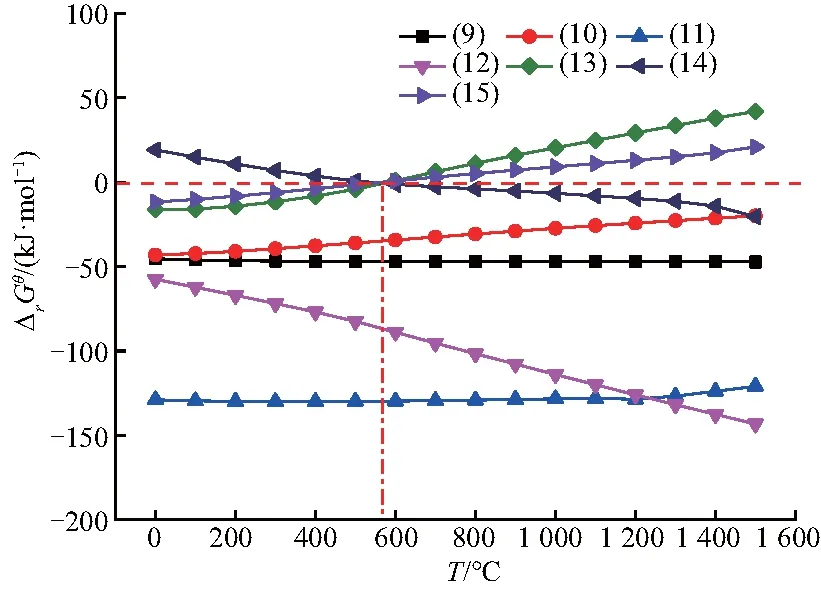
图3 CO还原各氧化物的ΔrG-T图
从图3可以看出,式(9)、(10)、(11)的标准吉布斯自由能在计算温度范围内均小于0,即CuO、NiO、CoO与CO的反应可自发进行,式(10)、(11)的标准吉布斯自由能随着温度的升高呈上升趋势,但是始终小于0.当还原温度高于570 ℃时,式(15)的标准吉布斯自由能大于0,即在570 ℃以上FeO不能被CO还原,而在实际生产过程中FeO能够被CO还原成Fe.这主要是由于图中计算的是标准吉布斯自由能随温度的变化,参与反应的气氛ψ(CO2)/ψ(CO)=1;而实际生产过程中,ψ(CO2)/ψ(CO)的值很容易就小于1,即式(15)的实际吉布斯自由能小于标准吉布斯自由能,FeO可以被CO还原成Fe.此外,除了通入的CO气体,固体还原剂C在温度较高时会发生气化反应生成CO,进一步促进球团的还原.
H2还原深海多金属结核中Fe2O3、NiO、CoO、CuO的ΔrG-T关系如图4,随着温度的升高,各反应的标准吉布斯自由能逐渐减小,即升高温度有利于还原反应的进行.式(16)、(17)、(18)的标准吉布斯自由能在计算温度范围内均小于0,即NiO、CoO、CuO与H2的反应可自发进行,且温度越高,反应越彻底.

图4 H2还原各氧化物的ΔrG-T图
对于铁氧化物的还原而言,当温度达到710 ℃和980 ℃时,Fe3O4可分别被H2还原成FeO和Fe,但是在计算的温度范围内,式(21)的标准吉布斯自由能始终大于0,也就是说H2很难在标准状态下实现FeO到Fe的还原.这主要是由于图中计算的是标准吉布斯自由能随温度的变化,参与反应的气氛ψ(H2O)/ψ(H2)=1;但是在高温下H2O是很难稳定存在的,这就造成了实际的吉布斯自由能要小于标准吉布斯自由能,H2就可以很容易的将FeO还原成Fe.在气-固协同还原过程中,当还原温度高于690 ℃时,固体C会与H2O发生水煤气反应,生成H2和CO.
由以上热力学计算结果可知,C作单一还原剂时NiO、CoO的还原温度高于500 ℃,Fe2O3被还原成Fe的开始温度为720 ℃,且固固接触条件差,在一定程度上阻碍还原的进行.而在气体还原剂(H2+CO)中,NiO、CoO、CuO的还原可自发进行,因此,采用气-固协同还原可降低各氧化物还原开始的温度,在低温下利用气体还原剂预还原多金属结核中的Fe2O3、NiO、CoO、CuO,减少固体还原剂的消耗.
2.2 Mn的还原热力学
深海多金属结核中含量最多的元素Mn主要以MnO2以及少量MnO的形式存在,还原温度较高,有必要对Mn的还原热力学进行详细的计算.在气-固还原的过程中,除了锰氧化物的还原反应,还会发生锰的渗碳反应和脱碳反应,用气基还原剂(CO、H2)和固基还原剂(C)还原深海多金属结核中的锰氧化物所涉及到的化学反应如表3.
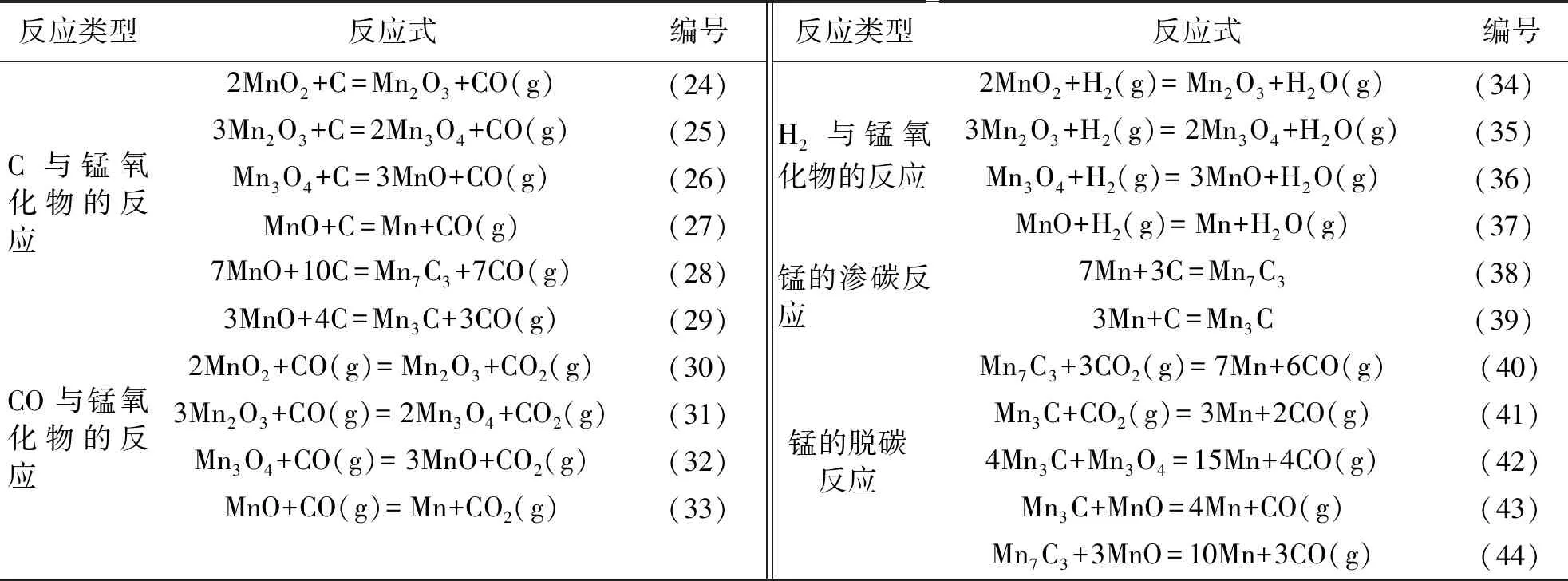
表3 深海多金属结核中锰氧化物在还原过程中涉及的化学反应
C还原锰氧化物与还原铁氧化物相似,还原温度升高有利于各反应的进行,且都是由高价氧化物逐级向低价氧化物转变,不同的是,金属Mn的生成温度远高于金属Fe的生成温度.图5为C还原锰氧化物ΔrG-T的关系图.
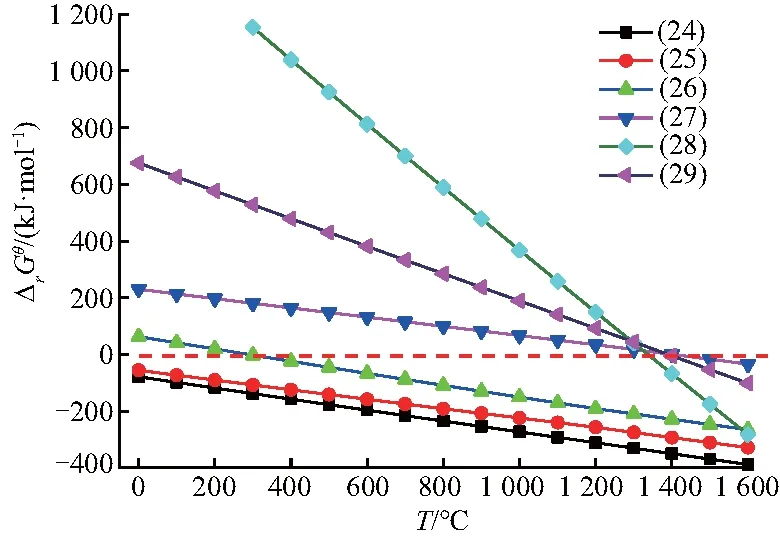
图5 C还原锰氧化物的ΔrG-T图
从图5可以看出,各反应的开始温度由低到高依次为式(24)、(25)、(26)、(28)、(29)、(27),锰氧化物的价态转变顺序为MnO2→Mn2O3→Mn3O4→MnO→Mn.值得注意的是,式(27)的开始温度为1 420 ℃,而式(28)、(29)的开始温度分别是1 336 ℃和1 389 ℃,即MnO会先与C反应生成锰的碳化物,碳化物的生成要优先于Mn的生成.以固体C还原锰氧化物制备金属Mn时,还原温度为限制性因素.
图6是C-MnO2体系中平衡产物CO分压与温度的关系图,曲线以下为产物的稳定区域,曲线以上为反应物的稳定区.CO分压越高,说明反应的程度越大,MnO2、Mn2O3、Mn3O4极不稳定,很容易被C还原,各稳定区域由上到下依次为:MnO2、Mn2O3、Mn3O4、MnO、Mn、Mn7C3、Mn3C;但是当还原温度高于1 300 ℃时,式(28)的反应程度高于式(27),式(29)的反应程度高于式(28),即在高温下Mn3C、Mn7C3优先于Mn的生成.
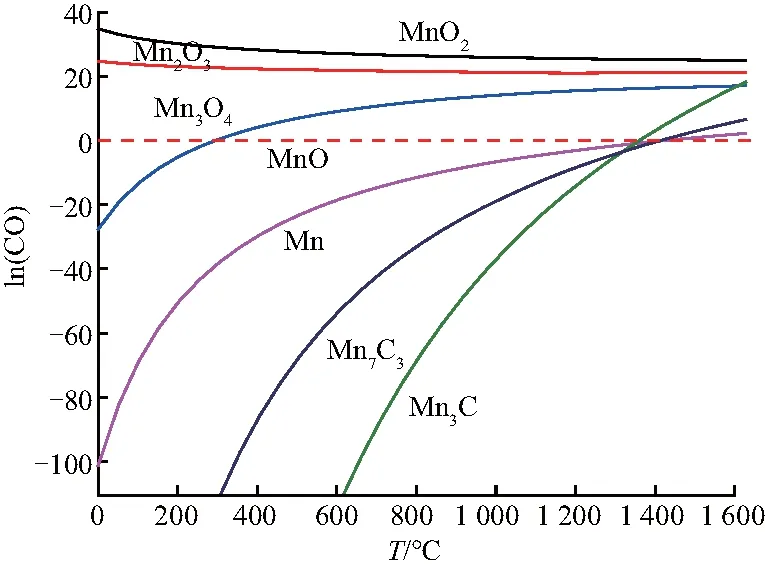
图6 C还原锰氧化物的气相平衡图
在气-固协同还原深海多金属结核体系中,CO以间接还原的方式参与Mn的还原,图7为CO还原锰氧化物ΔrG-T的关系图.

图7 CO还原锰氧化物的ΔrG-T图
从图7可以看出,式(30)、(31)、(32)的标准吉布斯自由能小于0,在低温下便可自发进行;式(33)的标准吉布斯自由能远大于0,即CO无法将MnO还原成Mn.图8是CO-MnO2体系中平衡产物CO2分压与温度的关系图.从图8可以看出,锰氧化物的还原是由高价氧化物向低价氧化物逐级还原的,且CO的还原程度要高于C的还原程度.

图8 CO还原锰氧化物的气相平衡图
H2对锰氧化物的还原类似于CO,均无法将MnO还原成金属Mn,只有还原剂C才能还原MnO.从图9可以看出,式(34)、(35)、(36)的标准吉布斯自由能小于0,在低温下便可自发进行.从图10可以看出,锰氧化物的还原同样是由高价氧化物向低价氧化物逐级还原的,且H2的还原程度要低于CO的还原程度,但是比C的还原程度高.因此,CO对锰氧化物的还原能力高于H2,H2的还原能力高于C.
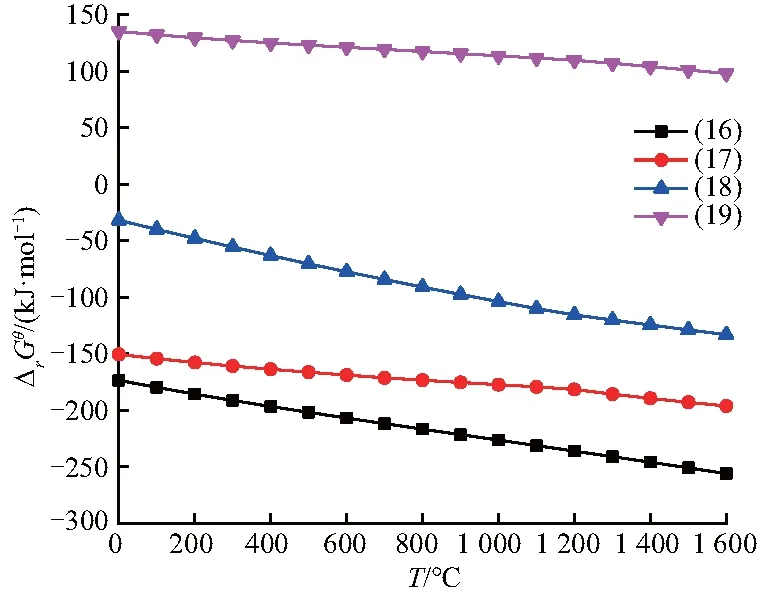
图9 H2还原锰氧化物的ΔrG-T图
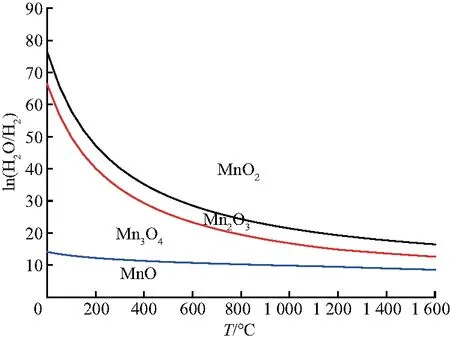
图10 H2还原锰氧化物的气相平衡图
除了反应(28)、(29)能够生成锰碳化物,反应(38)、(39)也能够生成锰碳化物,即在还原过程中生成的金属Mn会与C发生渗碳反应,生成碳化物.碳化物会继续与体系中的CO2、锰氧化物发生反应,推进Mn的还原.锰的渗碳及脱碳反应的ΔrG-T关系如图11.在1 500 ℃之前锰的渗碳反应可自发进行,在1 500 ℃之后,Mn3C不能生成,但仍可以生成Mn7C3.生成锰碳化物有两种途径,一是MnO与C反应生成碳化物,且优先于生成Mn,二是还原生成的金属Mn会与C自发反应生成碳化物.式(40)、(41)是锰碳化物与CO2生成金属Mn的反应,反应开始温度分别为882 ℃和769 ℃.式(42)、(43)、(44)是锰碳化物与锰氧化物生成金属Mn的反应,反应开始温度分别为1 120 ℃、1 440 ℃和1 543 ℃.因此,金属Mn出现的温度可能会低于C还原MnO生成Mn的开始温度.
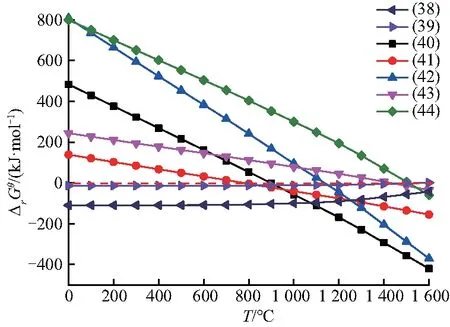
图11 Mn的渗碳及脱碳反应的ΔrG-T图
3 气-固还原体系平衡状态图
随着反应的进行,含氧量高的高价氧化物逐渐向含氧量低的低价氧化物转变,含氧量越低的氧化物越难被还原,在不同的还原温度下,各反应所需的还原气氛也大不相同[15].利用Equilib模块对气-固还原平衡产物组成进行理论计算,绘制各氧化物气-固平衡状态图.
CO还原Mn、Fe、Ni、Cu、Co氧化物的平衡状态如图12,MnO2极不稳定,可在极低的CO分压下被还原成低价氧化物,而还原MnO的CO分压无限趋近与1,说明CO无法还原MnO.在还原过程中少量的CO便可将CuO、NiO、CoO还原成金属单质.Fe2O3的曲线几乎与MnO2的重叠,可将Fe3O4作为铁氧化物还原的起点,当还原温度为570 ℃时,铁氧化物与CO的3个反应交于一点,当还原温度低于570 ℃时,Fe3O4直接转变为Fe,没有中间产物FeO的生成,当还原温度高于570 ℃时,Fe3O4先是转变成FeO再转变成Fe.温度越高,还原FeO的平衡气相成分中要求CO分压的值越高,还原反应也就越难进行.
图13为H2还原Mn、Fe、Ni、Cu、Co氧化物的平衡图.由图13可以看出,MnO2、CuO、NiO、CoO都可在极低的H2分压下进行还原反应,且需要的H2分压比CO低,即在高温下,H2的还原能力要高于CO.无论是何种还原剂对铁氧化物的还原,都是由高价氧化物向低价氧化物逐级转变,当还原温度高于570℃,Fe3O4先是被还原成FeO再被还原成Fe,当还原温度低于570 ℃时,Fe3O4直接被还原成Fe.MnO不能被气体还原剂还原,因此,MnO还原成Mn这一步骤成为整个体系耗碳量的关键.

图13 H2还原各氧化物的平衡图
4 结论
(1) 热力学计算结果表明,单一C作还原剂时,CoO、NiO的开始还原温度分别为439 ℃和500 ℃,而CO和H2作还原剂时,CoO、NiO的还原均可自发进行,因此,采用气固协同还原工艺可降低部分氧化物的还原开始温度.无论是何种还原剂对铁、锰氧化物进行还原,都是由高价氧化物向低价氧化物逐级转变,不同的是,FeO能够被间接还原成Fe,而MnO的间接还原是不可能.因此,对深海多金属结核进行气-固协同还原,从理论上讲可降低还原开始温度、降低碳耗.
(2) MnO与C反应生成Mn3C、Mn7C3的温度低于生成Mn的温度,且生成Mn的反应程度最低,即在高温下Mn3C、Mn7C3优先于金属Mn的生成.Mn3C、Mn7C3可与CO2或锰氧化物反应生成金属Mn,反应开始温度低于C还原MnO生成Mn的开始温度.因此,在Mn可在低于1 420 ℃的还原温度下出现.在还原末期,若体系中有过剩的C,还原产物Mn便会发生渗碳反应,继续生成Mn3C、Mn7C3,促使还原反应不断的往前推进.
(3) 在整个还原过程中,MnO2、Mn2O3、Mn3O4、CuO、CoO、NiO均可在较低的CO或H2分压下被还原,随着温度的升高,还原所需的CO或H2的分压逐渐增加,且在高温下用H2还原所需的分压更小;对于CO和H2还原FeO的过程中来说,随着温度的升高,还原所需的H2的分压逐渐减小,而所需CO的分压逐渐增加.在还原的前中期,CO和H2的还原能力强于C的还原能力,当温度低于810 ℃时,CO的还原能力强于H2,当温度高于810 ℃时,H2的还原能力强于CO.可根据在不同的还原阶段各还原剂还原能力的不同,适当调节还原气氛,提高资源利用率和还原效率.
