利用牛乳腺细胞和小鼠乳腺组织分析异绿原酸C通过NF-κB信号通路对乳腺炎症反应的抑制效应
2023-10-09陈喜宏路桂聪王浩磊苟少校玉永雄蒋曹德
陈喜宏,路桂聪,王浩磊,苟少校,玉永雄,林 涛,2*,蒋曹德*
(1.西南大学动物科学技术学院 重庆市食草动物资源保护与利用工程技术研究中心,重庆 400715;2.广安市饲料工业管理站,广安 638000)
奶牛乳腺炎又称乳房炎(mastitis),是奶牛养殖过程中一种常见且危害严重的炎性疾病。奶牛乳房炎会减少奶牛泌乳量、降低乳产品质量、增加奶牛淘汰率,造成养殖场的经济损失上升[1]。奶牛乳房炎主要分为隐性和临床乳房炎。奶牛乳房炎主要由病原微生物引起,主要的病原菌包括金黄色葡萄球菌、大肠杆菌和链球菌等。此外,布氏杆菌可能造成全身性感染而导致奶牛乳房病变[2]。研究发现,由大肠杆菌引起的奶牛乳房炎会从血液中调动白细胞进入乳腺,使临床型的乳腺炎发病风险增加[3]。
目前国内外对于奶牛乳房炎的治疗主要采用抗生素疗法。抗生素在乳房炎发生初期可以有效杀死病原菌,特别是急性临床型乳房炎。但是,抗生素的大量使用会导致动物机体产生副作用,如机体免疫机能下降、胃肠道菌群紊乱等[4]。此外,抗生素会导致病原菌产生耐药性,奶牛乳汁也会残留抗生素危害人类健康。植物提取物具有安全性高、无药物残留和无耐药性等优点,可以改善动物机体的免疫力,因此被广泛应用于畜禽饲料添加剂[5]。因此,研究植物提取物的抗炎作用,对于筛选奶牛乳房炎的抗生素替代防治方法具有重要的理论和实践意义[6]。
研究发现,异绿原酸(isochlorogenic acid, ICA)具有抗氧化、心血管保护、抗菌、抗病毒、降糖、保护肝、抗炎和神经保护等多种药理作用[7]。ICA最初于1950年从咖啡提取物中分离出来,现发现于茶、蔬菜和中药材等多种天然植物中[7]。ICA是一种由一分子奎宁酸和两分子咖啡酸组成的多酚类物质——双咖啡酰奎宁酸,有异绿原酸A、B和C(ICAA、ICAB、ICAC)三种异构体[7]。茶叶、西红柿和甘薯的相关研究揭示了ICAA为抗氧化剂和醛糖还原酶抑制剂[8-10]。Wang等[9]报道ICA抑制了LPS(lipopolysaccharide)诱导的RAW 264.7细胞中NO的水平;体内试验证实,异绿原酸A对胶原蛋白诱导关节炎小鼠模型有较好的抗炎作用,剂量依赖性地逆转了LPS诱导的超氧化物歧化酶(SOD)、乳酸脱氢酶(LDH)、丙二醛(MDA)、白介素6 (IL-6)、IL-1β水平[11-12];其他研究进一步证实了ICAA通过NF-κB (nuclear factor kappa B)/NLRP3 (NLR family pyrin domain containing 3)通路抑制LPS诱导的小鼠急性肺炎[13-14]。迄今为止发表的文献集中在ICAA药代动力学研究以及在小鼠模型中ICAA、ICAB抗氧化和抗炎作用,但是ICAC的相关功能以及ICA对牛奶乳腺炎抑制作用很少有研究报道。
NF-κB是经典的炎性反应通路[15],NF-κB信号通路在炎症反应中的重要作用已在小鼠乳腺上皮细胞[16-19]、RAW264.7细胞[20-21]、BV-2细胞[22]中得到广泛证实。因此,本研究选择牛乳腺上皮细胞MAC-T,采用LPS诱导MAC-T细胞建立炎症模型,分析ICAC对炎症因子和NF-κB通路关键成员的表达及其活性的调控作用。
1 材料与方法
1.1 细胞培养
在25 cm2培养瓶内,将MAC-T细胞(BMCC,CHN)培养于5% CO2、37 ℃培养箱(Forma Series 3 WJ, Thermo, USA)。细胞培养采用DMEM基础培养液,加入10% FBS(Gibco, AUS)、1%青链霉素(Solarbio, CHN)和100 mg·L-1的链霉素(Solarbio, CHN)。当细胞贴壁生长到90%时用0.25%胰酶(Solarbio, CHN)消化并传代。
1.2 细胞活性检测
MAC-T细胞按照2×106个·孔-1的浓度接种在6孔板中,待其贴壁后添加不同浓度的ICAC(0、20、40、60、80、100、120、160 mg·L-1),并设置5个重复。处理细胞24 h后,吸弃上清,加入10 μL MTT(Solarbio, CHN)和90 μL DMEM基础培养液,继续培养4 h。培养结束后,弃去培养液,再加入110 μL Formazan(Solarbio,CHN)共育10 min,光密度计(Multiskan GO, Thermo, USA)检测490 nm处的光密度(OD),并计算处理组相对对照组的细胞活性。细胞活性 =(处理组OD值/对照组OD值)×100%。
1.3 动物试验
选取50只(30只雌鼠和20只公鼠)6~8周龄的BALB/c小鼠(伯恩斯韦尔生物技术有限公司,重庆),母鼠每笼2只,公鼠每笼1只,并在无菌环境下饲养1周,自由采食(光照/黑暗各12 h)。1周后,2只母鼠和1只公鼠合1笼进行交配。1周后将公鼠分出,母鼠单笼饲养。母鼠分娩7 d后,将哺乳期母鼠随机分成6组,每组5只,各组分别为空白对照组、LPS组、LPS+DEX(dexamethasone)(Macklin,CHN)[23]、LPS+ICAC(60 mg·kg-1)、LPS+ICAC(80 mg·kg-1)、LPS+ICAC(100 mg·kg-1)组[16]。LPS(200 mg·L-1,50 μL)溶于磷酸盐缓冲液(PBS)中,用2 mL注射器(6号针头)注射到每只哺乳期母鼠最容易观察和采集的第四对乳头(R4和L4)的乳腺导管中[24]。ICAC处理组的每只哺乳期母鼠用9 μL 4%水合氯醛深度麻醉,在LPS滴注前1 h腹腔注射不同浓度ICAC(60、80、100 mg·kg-1),空白对照组和LPS组腹腔注射等体积的PBS,DEX组注射0.5 mg·kg-1的DEX[24]。注射LPS 24 h后,通过颈椎脱臼处死小鼠,收集乳腺组织,一部分储存在-80 ℃,另一部分存放于4%多聚甲醛组织固定液里。
1.4 炎症因子表达水平检测
MAC-T细胞按照2×106个·孔-1接种于6孔板中待其贴壁,随后培养在含有不同浓度ICAC(0、20、50、80 mg·L-1)和1 mg·L-1LPS的培养液中,并设置未处理和20 mg·L-1的DEX处理对照[24]。24 h后收集细胞上清液,按照IL-1β、IL-6、TNF-α、COX-2和iNOS ELISA试剂盒说明书(重庆博诺恒生物科技有限公司)测定各炎性因子的浓度。
1.5 Western blot分析
上述“1.4”培养的细胞采用细胞总蛋白提取试剂盒(Solarbio,CHN)提取总蛋白,随后用BCA蛋白定量试剂盒(Vazyme,CHN)进行总蛋白定量。取16 μL蛋白样品,加入4 μL上样缓冲液(Solarbio,CHN)后煮沸5 min使蛋白变性,采用10% SDS-PAGE电泳(PowerPac HC,Bio-rad,USA)。电泳条带通过转印设备(1703812,Bio-rad,USA)转移到PVDF膜(Biosharp,CHN),在含有5%牛血清白蛋白(Biotopped,CHN)的封闭液中室温封闭1 h(磷酸化蛋白封闭4 h),进一步与一抗4 ℃孵育过夜,其中一抗包括β-actin(bsm-33036M;稀释比1∶10 000)、p65(bs-23217R,稀释比1∶1 000)、磷酸化p65(p-p65)(bs-0982R,稀释比1∶1 000)、IκBα(bs-1287R,稀释比1∶1 000)、磷酸化IκB(p-IκB)(bs-2513R,稀释比1∶1 000)。将上述一抗杂交膜使用TBST洗涤(6 min,5次),随后与二抗Goat Anti-rabbit IgG/HRP(AB501-01A,Novoprotein,CHN)室温孵育1 h。孵育结束后,使用ECL化学发光系统(Gel Doc XR,Bio-Rad,USA)检测目标条带,并使用Image Lab(version 5.2.1, Bio-Rad, USA)和GraphPad Prism(version 8.2)进行定量分析。每个试验设置3个重复,以20 mg·L-1DEX和1 mg·L-1LPS共处理作为阳性对照。
1.6 p65核转移免疫荧光检测
MAC-T细胞培养在96孔板至90%融合,将细胞分为6组:空白对照组、LPS组、LPS+DEX组、LPS+ICAC(20、50、80 mg·L-1),按照Beyotime试剂盒说明书进行操作。
1.7 乳腺组织免疫组织化学试验
将处理好的乳腺组织在甲醇中脱水,随后使用石蜡包埋,制作成5 μm石蜡切片,将CD3抗体(Abcam,稀释比1∶150)与石蜡切片一起放入4 ℃孵育过夜。用PBS洗涤3次,在室温下与Goat Anti-rabbit IgG/HRP(AB501-01A,Novoprotein,CHN)在室温下孵育1 h,通过DAB染色将信号可视化,苏木精进行细胞核染后在光学显微镜下进行拍照。
1.8 数据分析
利用SPSS 19.0进行单因素方差分析(One-way ANOVA),多重比较采用Duncan’s法,P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 ICAC对MAC-T细胞活性的影响
采用不同浓度ICAC处理MAC-T细胞,检测ICAC对MAC-T细胞活性的影响(图1)。与对照组相比,浓度为20、40、60、80和100 mg·L-1的ICAC对MAC-T细胞活性均没有显著影响(P>0.05)。当ICAC浓度大于120 mg·L-1时,与对照组相比,MAC-T细胞的活性显著降低(P<0.05)。因此,选用20、50、80 mg·L-1的ICAC处理MAC-T细胞进行下一步研究。

柱形图上相同小写字母表示P>0.05,不同小写字母表示P<0.05(下同)The same lowercase letters above the bars indicate P>0.05, and different lowercase letters mean P<0.05 (the same below)图1 不同浓度的ICAC处理对MAC-T细胞活性的影响Fig.1 Effects of ICAC treatment with different concentrations on the activity of MAC-T cells
2.2 ICAC对LPS诱导的MAC-T炎症反应与氧化应激的抑制
采用不同浓度的ICAC和 LPS共处理MAC-T细胞,检测ICAC对炎性与氧化应激因子的表达(图2)。与空白对照组相比,LPS处理组炎性因子IL-1β、IL-6、TNF-α的蛋白质水平极显著增加(P<0.01),氧化应激因子COX-2和iNOS的表达量也极显著上调(P<0.01)。与LPS处理组相比,20、50、80 mg·L-1ICAC处理组IL-1β、IL-6、TNF-α、COX-2和iNOS的表达量极显著下调(P<0.01)。
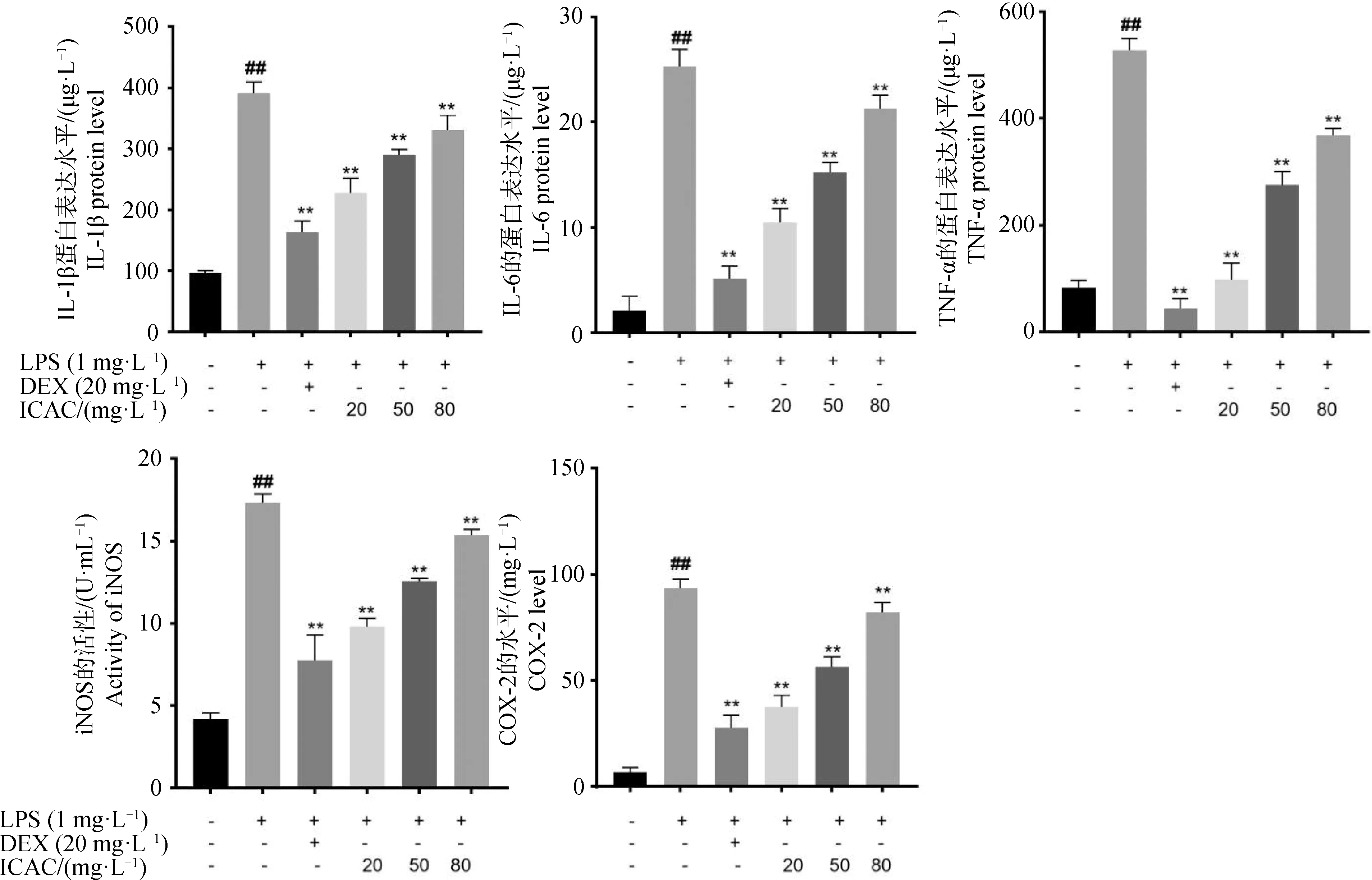
与空白对照相比,柱形图上##表示P<0.01;与LPS处理组相比,*和**分别表示P<0.05和P<0.01,下同Compared with the blank control, ## on the bar chart represents P<0.01; compared with LPS treatment group, * and ** represent P<0.05 and P<0.01, respectively, the same as below图2 ICAC对LPS诱导的炎性因子表达的影响Fig.2 Effect of ICAC on LPS-induced expression of inflammatory factors
2.3 ICAC对MAC-T细胞NF-κB信号通路的抑制
利用Western blot检测ICAC对NF-κB信号通路关键蛋白(p65和IκB)磷酸化水平的影响(图3)。与空白对照组相比,LPS处理后p65和IκB的蛋白质水平没有显著差异(P>0.05,图3A~C),但是p-p65和p-IκB水平显著上升(P<0.05)(图3D)。相反,20、50和80 mg·L-1ICAC处理显著降低了LPS诱导的p-p65和p-IκB水平(P<0.05),且ICAC处理组p-p65水平显著低于DEX处理组(P<0.05)。
进一步利用免疫荧光方法观察p65核转移情况。图4A显示,在空白对照组中p65(红色荧光)分散在细胞中,但是在LPS处理组中p65大量向细胞核(蓝色荧光)聚集;与LPS处理组相比,DEX和ICAC处理组(20、50、80 mg·L-1)的细胞核红色荧光聚集较少。图4B结果进一步证实LPS处理组的细胞核p65蛋白质水平相对于空白对照组极显著上升(P<0.01);与LPS组相比,DEX组和ICAC处理组(20、50、80 mg·L-1)细胞核p65极显著下降(P<0.01)。

A.p65核转移免疫荧光检测(细胞核标记为蓝色荧光,p65蛋白标记为红色荧光);B.细胞核p65蛋白质相对β-actin的含量A. Immunofluorescence of p65 nuclear transfer. The nucleus was labeled with blue fluorescence, while p65 proteins were labeled with red fluorescence. B. Nuclear p65 protein content relative to β-actin图4 ICAC对LPS诱导的p65核转移的抑制Fig.4 Inhibition of LPS-induced p65 nuclear transfer by ICAC
2.4 ICAC对LPS诱导小鼠乳腺炎症的抑制
采用组织免疫组化方法体内证实ICAC对LPS诱导的小鼠乳房炎症的保护作用。如图5所示,空白对照组的乳腺组织形态表现正常,LPS处理组中的T细胞标记物CD3明显增多,表明乳腺组织T淋巴细胞浸润增多。与LPS处理组相比,DEX对照组与ICAC处理组的小鼠乳腺组织的T淋巴细胞浸润明显减少,且ICAC处理组比DEX组效果更明显。
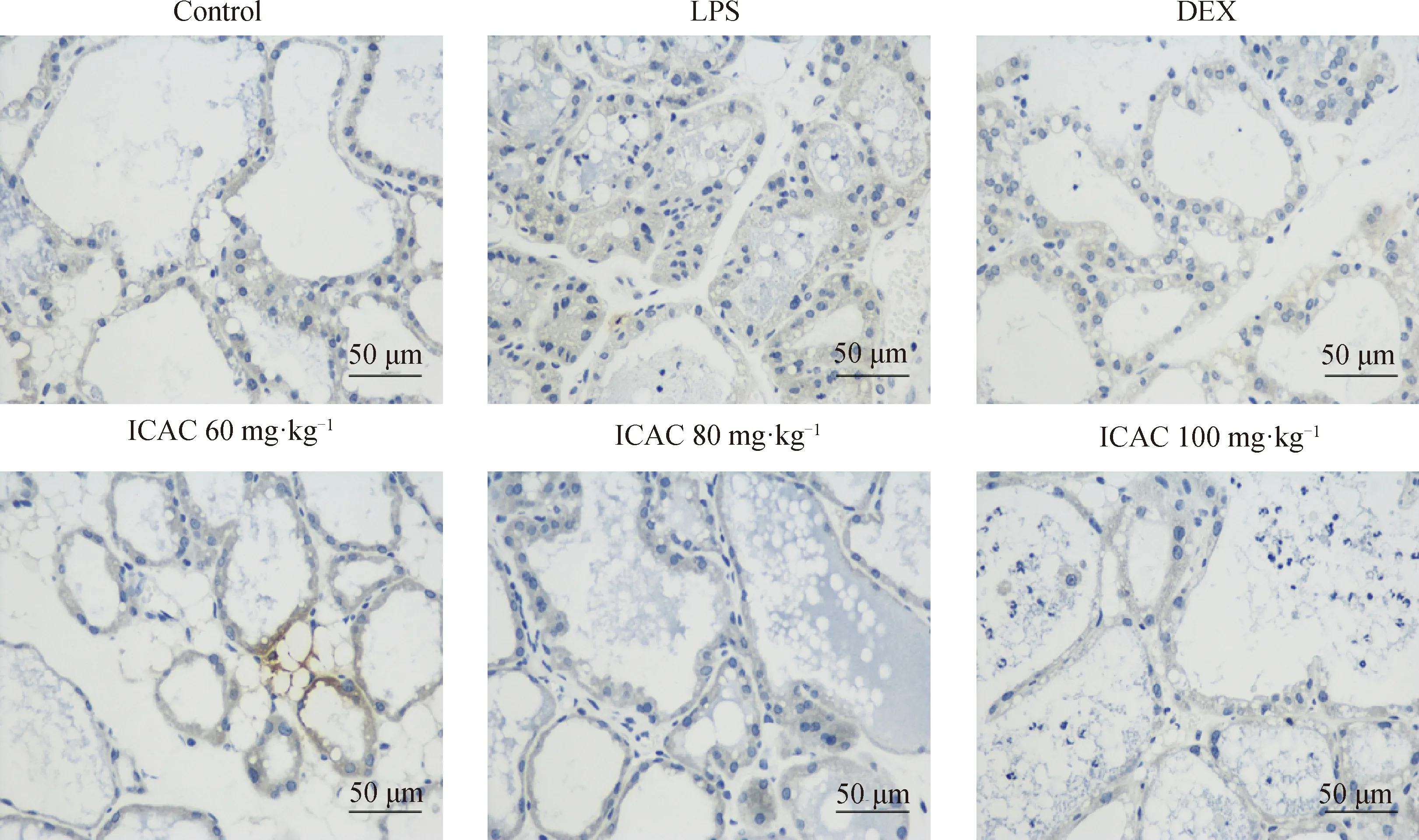
图5 小鼠乳腺组织CD3免疫组织化学染色(400×)Fig.5 Immunohistochemical staining (400×) of CD3 in mouse mammary gland tissues
2.5 ICAC对小鼠乳腺组织NF-κB信号通路的抑制
利用Western blot检测小鼠乳腺组织中ICAC对NF-κB信号通路关键成员p65和IκB的磷酸化影响(图6)。与对照组相比,LPS处理后p65和IκB蛋白表达显著上调(P<0.05,图6B~C),但是60、80和100 mg·kg-1的 ICAC处理均显著下调了LPS诱导的p65和IκB的表达(P<0.05),而且ICAC处理组中两种蛋白的表达量也显著低于DEX处理组(P<0.05)。同样,ICAC的处理也显著降低了p-p65和p-IκB蛋白质水平(P<0.05,图6D~F)。

A. p65和IκB的Western blot条带;B、C. p65和IκB相对β-actin的表达量;D. p-p65和p-IκB的Western blot条带;E、F. p-p65和p-IκB相对β-actin的表达量A. Western blotting for p65 and IκB; B, C. p65/β-actin and IκB/β-actin ratio, respectively; D. Western blotting for p-p65 and p-IκB; E, F. p-p65/β-actin and p-IκB/β-actin ratio, respectively图6 ICAC对小鼠乳腺组织NF-κB通路的影响Fig.6 Effect of ICAC on NF-κB pathway in mouse mammary gland tissue
3 讨 论
临床型牛乳腺炎主要由细菌感染引起奶牛局部以及全身炎症,最常见的病原体是金黄色葡萄球菌和大肠杆菌。大肠杆菌引发的急性临床症状,使机体产生免疫应答和免疫损伤效应,包括细胞因子和趋化因子的表达[25]。LPS是大肠杆菌细胞壁的主要组成成分,通过TLR4/NF-κB级联激活引起炎症反应[26]。另一方面,MAC-T细胞是通过转染猴病毒-40的大T抗原后从牛乳腺上皮细胞中分离出来的;由于MAC-T与原代细胞具有相似的生物学反应,经常被用来作为牛乳腺炎的炎症模型[27]。因此,本研究根据前期研究采用1 mg·L-1的LPS刺激MAC-T细胞炎性反应;通过筛选ICAC处理浓度(图1),选择20、50、80 mg·L-1的ICAC探究其对MAC-T细胞炎性反应的影响。
先前的研究证明了细胞因子在细菌病原体促进细胞炎症反应中的重要作用[27]。LPS诱导的促炎因子IL-6、TNF-α和IL-1β对牛乳腺组织造成严重损伤,ICA减轻小鼠自身免疫性关节炎和RAW264.7巨噬细胞中的炎症[13-14,16]。本研究发现,ICAC降低了LPS诱导的IL-1β和IL-6的表达量,并且ICAC还抑制了炎症介导因子COX-2和iNOS的表达(图2),证明了ICAC可以减轻LPS诱导的MAC-T细胞的炎症反应。COX-2是一种诱导酶,在炎症反应过程中表达量上调,并且诱导PGE2的表达[28];iNOS主要在巨噬细胞和白细胞内表达,在炎症反应中,iNOS促进释放NO[29-31],说明COX-2和iNOS介导炎症的发生,它们的表达与氧化应激密切相关[15,32]。近期的研究进一步证实ICAC降低EV71感染小鼠脑部IL-6和TNF-α表示水平以及 GSH/GSSG比值和活性氧水平[33];ICAC抑制了高脂肪日粮小鼠巨噬细胞中iNOS, COX2和IL-1β的表达[34]。上述结果证明ICAC具有抗氧化应急和抗炎性反应的作用。
NF-κB是LPS诱导炎症过程中经典的信号传导路径,许多植物提取物是通过阻断NF-κB信号传导途径来抑制炎症反应[35-37]。NF-κB是细胞中广泛存在的转录因子。在静息状态下,位于细胞质中的NF-κB与IκB结合而处于无活性状态[38]。LPS刺激产生IκBα和p65磷酸化,p-IκBα通过泛素化被降解,释放出p-p65迁移到细胞核启动COX-2、TNF-α、IL-6和IL-1β等炎性因子基因的转录[33]。本研究的体内与体外实验结果均表明,ICAC处理降低p-p65和p-IκB的水平,尤其降低p-p65在细胞核内的含量。免疫组化试验进一步发现,ICAC处理后LPS引起的小鼠乳腺组织T淋巴细胞浸润明显减轻。近期的研究也指出,异绿原酸的抗炎机制与抑制NLRP3炎性复合体的形成和NF-κB磷酸化有关[37]。综上,ICAC通过抑制IκB和p65磷酸化从而抑制LPS诱导MAC-T细胞和小鼠乳腺炎性反应。
4 结 论
本研究表明,ICAC能降低LPS诱导的MAC-T细胞炎性因子IL-1β、IL-6、TNF-α和炎症介导因子COX-2和iNOS的表达;ICAC通过抑制NF-κB信号通路抑制MAC-T细胞和小鼠乳腺炎症反应,但是异绿原酸C在奶牛乳腺炎防治中的应用有待进一步研究。
