食管静脉曲张硬化术后并发食管血肿1例
2023-10-09梁育飞于永礼邹涵李春英
梁育飞,于永礼,邹涵,李春英
1.沧州市中心医院 消化内科,河北 沧州 061000;2.沧州市中心医院 消化窥镜室,河北 沧州 061000;3.兰州大学第二临床医学院,甘肃 兰州 730030
食管血肿(esophageal hematoma,EH)是黏膜层与黏膜下层之间的出血,可以继发于食管静脉曲张硬化术(endoscopic injection sclerotherapy,EIS)后[1],临床相对少见。笔者报道1例沧州市中心医院收治的EIS术后并发EH的肝硬化患者,并结合文献复习,总结诊治体会。
1 病例资料
患者,男,63岁,因“乙肝后肝硬化食管胃底静脉曲张破裂出血(esophagogastric variceal bleeding,EGVB)”于2022年4月27日收住沧州市中心医院消化内科。既往乙肝病史。于2022年4月29日行食管胃底静脉曲张治疗,术中见食管中下段及胃底静脉曲张(Lemi,gf,D1.5,Rf1),于胃底曲张静脉套扎5点,食管曲张静脉套扎9点。2022年5月12日行食管静脉曲张套扎术,食管及胃底均见套扎术后瘢痕,给予食管残余曲张静脉套扎7点。于2022年5月25日查血小板:21×109/L,血红蛋白:83 g/L,凝血酶原时间(prothrombin time,PT):18.2 s,白蛋白:32 g/L。2022年5月27日行序贯EIS治疗术,胃镜下于食管残余曲张静脉内注射聚桂醇注射液(1%乙氧硬化醇,陕西天宇制药有限公司,规格10 mL)治疗5点,共30 mL。每次穿刺后,回抽有回血,以确保穿刺针位于血管内,再进行注射。注射完毕后,透明帽压迫止血1~2 min,观察注射点无出血后退镜,患者安返病房。EIS术后2 h,患者突发胸骨后持续性疼痛,恶心,呕吐鲜红色不凝血约50 mL,呕吐后疼痛无缓解,伴有心慌气促。给予禁食水、吸氧、心电血压监护、止吐、止血、生长抑素降低门脉压力、奥美拉唑抑酸、头孢唑肟抗炎及补液支持治疗,患者逐渐出现意识模糊,测血压86/58 mmHg,查血浆氨:124 μmol/L,血红蛋白:72 g/L。给予门冬氨酸鸟氨酸降血氨,输注血浆改善凝血,补液纠正休克后,患者意识逐渐好转。2022年5月28日查胸部平扫CT示:食管中下段管壁增厚,管腔呈偏心性狭窄,考虑黏膜下血肿;右侧大量胸腔积液,见图1A。2022年5月29日查胃镜示:距门齿约30 cm见粗大长条形蓝色黏膜下血肿,占据1/2的食管腔,向下延伸至贲门,进镜受阻,见图1B。继续给予禁食水、抑酸、降低门脉压力、抗炎及营养支持等治疗,行右侧胸腔穿刺引流术,每日引流500~700 mL,检测胸水呈漏出液改变。2022年6月14日复查胃镜示:食管中下段静脉充盈,黏膜片状糜烂,食管腔略狭窄,胃镜可通过,见图1C。于2022年6月16日出院,嘱院外注意饮食,定期复查。2023年1月30日复查胃镜显示食管中下段静脉略充盈,管腔通畅,见图1D。继续随访中。
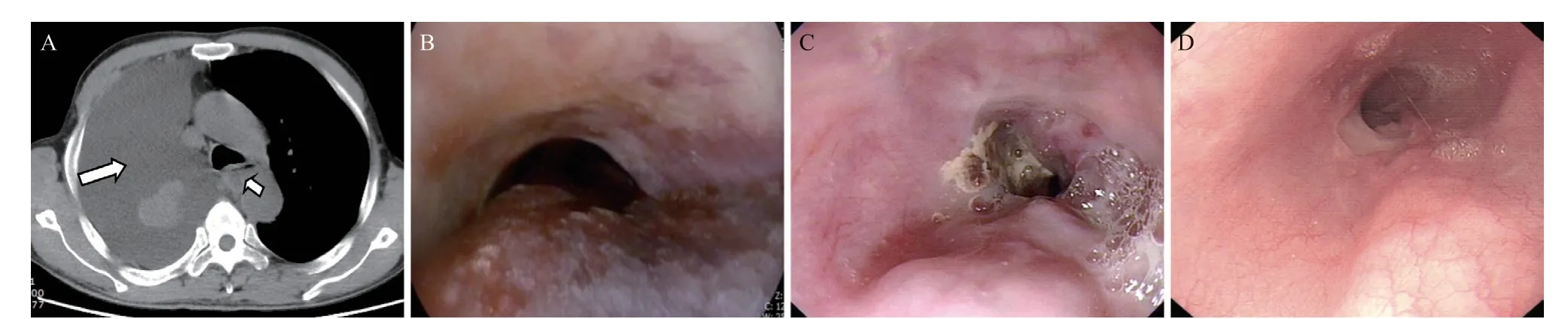
图1 EIS术后CT及胃镜检查
2 讨论
EGVB是肝硬化常见的急危重并发症之一。内镜下治疗已成为主要手段,疗效及预后与操作人员内镜技能、注射药物、套扎材质、注射或套扎方法及部位、治疗间期、患者的机能及依从性等有关,常见的并发症有出血、穿孔、食管狭窄、纵膈炎、异位栓塞等。
EH是内镜术后相对少见的危重并发症之一[2],该病好发于食管中下段,一般不累及肌层,血肿持续受重力和胸腔负压影响可以向下进一步蔓延扩大至贲门。自WILLIAMS[3]于1957年首次报道了该病以来,国内外陆续出现相关报道。该病的主要诱因有以下几点:①食管内压急剧变化,如:饮酒、妊娠等所致剧烈呕吐;②食管直接损伤,如:进食硬物、异物吞入、不恰当的内镜操作、内镜治疗(如扩张术)等;③自发性血肿形成,如:食管小血管发育异常、贲门失弛缓症、血友病、应用抗血小板药物、抗凝剂及溶栓剂等[4]。根据出血的性质,EH可以分为5个亚型:外伤性、致吐性、异常止血相关、主动脉相关和自发性[5]。关于内镜引起的食管黏膜下血肿,HABU等[6]在医学杂志和PubMed搜索“食管黏膜下血肿”和“内镜”,共检索到14篇报道,有9篇报道黏膜下血肿是由EIS引起。本例EH患者继发于EIS术后,考虑与以下因素有关:①硬化治疗损伤食管黏膜及黏膜下血管;②硬化治疗出现黏膜下无菌性炎症及组织坏死;③患者凝血指标及血小板异常。这需要引起临床医师重视。
KOIKE等[5]曾对79例日本EH患者进行了统计,其中男35例,女44例,发病年龄32~80岁,平均(61.6±12.9)岁。笔者在万方医学网、中国知网上输入关键词“食管血肿”,排除重复报道病例,共检索2010年以来国内相关报道84例,包括51名男性,33名女性,发病年龄15~81岁,平均(54.9±13.2)岁。EH的主要临床表现包括:消化道出血,呕吐,胸痛,吞咽困难,咽部不适,胸骨后异物感等。其典型的临床三联征包括急性胸痛伴胸闷憋气(84%);吞咽痛或吞咽困难(59%);恶心或呕血(54%)[7]。MEININGER等[8]发现,66%~87%的EH患者会出现不同程度的胸骨后疼痛,70%的EH患者合并有上消化道出血症状。朱国玲等[9]发现,84.7%的EH患者出现胸痛,19.4%的EH患者有呕血表现。本例患者在术后出现胸痛、呕血、血压下降、意识模糊等症状,考虑EIS后突发急性食管大量出血所致失血性休克,经CT及胃镜等检查后确诊。患者食管黏膜下巨大血肿未出现破溃导致恶性事件。
食管血肿的诊断方法主要包括胸部CT、上消化道造影、胃镜等。胸部CT是一种无创性检查,可作为初步诊断及鉴别的首选。EH的典型CT征象为边界清晰的食管壁偏心性增厚,食管腔狭窄,CT值接近血液密度,可根据血肿密度值判断其形成时间[10]。钡餐可显示纵向食管腔内充盈缺损,并伴有食管腔“双管征”或“黏膜条状征”[11]。胃镜对于本病具有确诊意义,在无明显禁忌证情况下,可尽早行胃镜检查,明确病变范围、性质等,内镜下主要表现为:食管纵行黏膜下隆起,表面粗糙,基底呈现蓝紫色改变,直径通常在1~3 cm之间,食管腔狭窄。但需要注意检查过程轻柔,禁止触碰或活检,否则会引发血肿加重或大出血。超声内镜可探知血肿深度,是一种有益补充。笔者认为,某些病情严重者,存在内镜禁忌证时,可优先考虑相对安全的胸部CT等影像学检查。鉴别诊断上,以呕血为首发症状者需与EGVB、贲门黏膜撕裂征、消化道溃疡出血等鉴别。胸痛患者需与食管穿孔以及急性心肌梗死、心绞痛,主动脉夹层,主动脉瘤、肺栓塞等疾病鉴别[12-13]。本例患者在EIS术后出现呕血、胸痛等,为排除心肺疾病及协助诊断,故先完善无创、相对安全的胸部CT检查,在明确为食管内病变后才进一步完善胃镜检查,得以确诊。
因EH病变常见于黏膜层及黏膜下层,很少累及肌层,且食管黏膜修复迅速,故本病以内科保守治疗为主,包括禁食水,卧床,抑酸,保护黏膜,抗感染,营养支持,纠正凝血功能障碍等[14],绝大多数EH在2~3周后可自行吸收,形成浅溃疡或瘢痕,预后良好[4]。本病例中,经过综合治疗后,随访胃镜,患者的EH自行吸收,预后良好。因此,寻找EIS后引起EH的危险因素,有效预防其发生,显得尤为重要。
有研究[15]报道,血小板计数、PT等为肝硬化EGVB的独立危险因素。血小板计数≤100×103/mL的患者发生EH的风险是血小板较高患者的3.6 倍(P=0.015),其与出血率呈负相关[16]。SORBI等[17]建议将血小板计数50×103/mL作为在无血小板功能障碍的情况下行侵入性手术的阈限。LUKASHOK等[18]认为,EH是由于硬化治疗后食管黏膜易碎而引起的,凝血功能受损可能通过食管黏膜下层促进血肿的形成和扩展。PT>16 s是导致肝硬化门静脉高压并发上消化道出血的独立危险因素[19]。血红蛋白越低,血压越低,血流动力学不稳定,不利于实施检查或治疗,还会增加心脑血管等意外发生风险,指南[20]推荐维持血红蛋白在70~80 g/L即可。本病例中,患者的肝硬化虽然未处于Child-Pugh C级,但存在诸多食管胃底静脉曲张手术治疗的危险因素,包括血小板重度减低(<50×103/mL)、PT异常(>16 s)及中度贫血等。在此种情况下行硬化治疗,再出血的发生率势必大大增加。
通过本病例,笔者体会如下:①血小板减少、凝血功能异常、硬化治疗是促成EIS术后并发EH的危险因素。遇到肝硬化食管胃底静脉曲张出血内镜下序贯治疗患者,术前尽可能保证患者的血小板>50×109/L,PT<16 s,血红蛋白大于80 g/L。本例中,内镜下治疗术前未注意患者的血液学指标,导致EH的发生。这提示我们在临床治疗过程中,术前应积极纠正患者的出血相关危险因素,可帮助患者尽可能避免术后并发症的发生。②在内镜硬化治疗过程中,以血管内注射为主,遵循多点穿刺、小剂量、适中速度注药的原则[21],穿刺针与血管呈30°~45°夹角,防止刺穿血管造成黏膜下血肿,可加美兰示踪。穿刺过程中的动作应轻柔,切忌用力过猛,抽针后应用针鞘按压穿刺点,并尽可能吸净胃腔内气体及液体,减少术后恶心呕吐等症状的发生。本例中,内镜操作医师行规范性内镜下EIS操作,术后出现EH,与患者的血清学检测明显异常有关。另外,EH能够在短期内机化吸收,这与术后积极抑酸、降低血管压力、抗炎、营养支持等综合治疗密不可分。
综上所述,对于肝硬化伴EGVB患者,EIS术前要控制血常规、凝血常规等指标在合理范围,做好全程管理(术前评估、术中规范、术后监测)以有效预防。EIS术后并发EH在我院尚属首次,相信随着内镜下静脉曲张操作的日渐增多,EH等少见并发症可能时有发生,治疗经验也在不断积累中。
