水相中GOx@ZIF-7/PDA的制备及酶学性能研究
2023-10-09刘思媛刘精杏王则奋朱小璐李妍雪兰雄雕刘彭如蓝平
刘思媛,刘精杏,王则奋,朱小璐,李妍雪,兰雄雕*,刘彭如,蓝平*
1(广西民族大学 化学化工学院,广西多糖材料与改性重点实验室,广西高校化学与生物转化过程新技术实验室,广西 南宁,530006)2(广西大学 化学化工学院,广西 南宁,530000)3(广西产研院生物制造技术研究所有限公司,广西 南宁,530000)
葡萄糖氧化酶(glucose oxidase,GOx)是一种能够催化葡萄糖生成葡萄糖酸和过氧化氢的生物催化剂[1]。因其具有安全性、高效性、高度特异性和反应条件温和等特点,GOx在多种工业和商业应用中发挥着重要作用[2]。在食品领域,GOx常作为乳制品、烘焙和饮料加工等工业中的天然保鲜剂、抗氧化剂、褐变抑制剂和改性剂等[3]。在生物医药领域,GOx在癌症治疗、糖尿病的检测和治疗以及伤口护理等方面均受到广泛关注[4]。然而,GOx的本质是蛋白质,在生产中常见的有机溶剂、高温、高压、过高/过低pH值等环境下易失活且贮存稳定性不足限制了GOx高效催化的发挥[5-6]。同时,游离GOx难以从产物中分离,不利于重复使用,增加了生产成本[7]。研究表明,固定化GOx不仅可以实现酶和产物的分离,还能改善酶的稳定性,提高重复使用性,降低生产成本,符合绿色化学和可持续发展需求[8-9]。
金属有机骨架(metal-organic frameworks,MOFs)材料是由金属离子(或金属簇)和有机配体通过配位作用构成的多孔有机-无机杂化材料[6],具有结构多样、稳定性高、孔隙率高、孔道可调等优势,被认为是有前景的酶固定化载体材料[10]。目前,常用的酶-MOFs复合材料的制备方法包括表面吸附法[11]、共价结合法[12]和原位包埋法[9]。前两种方法制得的固定化酶稳定性有所提高,但是它们属于合成后修饰酶,存在酶浸出、不完全保护或固定过程中酶易失活的问题,并且MOFs的空间结构没有得到充分利用[13-14]。原位包埋法属于从头合成法,在MOFs形成的过程中将酶分子固定在材料中,酶被保护在MOFs空间结构中,同时允许底物和产物通过。该方法制备得到的固定化酶减少了酶浸出,提高了酶的稳定性[15-16]。目前,能成功用于酶原位包埋的MOFs很少,主要是ZIF(zeolitic imidazolate frameworks)系列的MOFs[14,16],这是因为大多数MOFs需要在有机溶剂中合成,会破坏酶的构象,造成酶失活。此外,一些研究发现常用于酶固定化的ZIF-8在酸性pH值条件下和某些缓冲液(如磷酸盐缓冲液)中是不稳定的,会导致ZIF-8结构破坏[17-18]。因此,还需合理设计出更稳定的MOFs材料,从而推动酶-MOFs生物复合材料的应用。
ZIF-7与ZIF-8同属于ZIF系列金属有机骨架材料,由锌离子与苯并咪唑配位连接而成[19]。与ZIF-8类似,ZIF-7同样具有高负载率、良好的生物相容性、高的热稳定性和化学稳定性,甚至有研究表明ZIF-7的稳定性优于ZIF-8[20]。但到目前为止,关于将ZIF-7作为酶固定化基质的研究较少,可能是由于ZIF-7疏水性较强且通常在有机溶剂中进行合成,如N,N-二甲基甲酰胺(dimethylformamide,DMF)[21],不适于原位包埋法制备酶-MOFs复合材料。
本研究首次在水相中采用原位包埋法制备了固定化酶GOx@ZIF-7。此外,为了改善ZIF-7材料的疏水性、防止可能发生的酶浸出并进一步提高固定化酶GOx@ZIF-7生物复合材料的稳定性,本研究利用多巴胺的生物相容性和自聚合特性,在固定化酶GOx@ZIF-7生物复合材料上合成了亲水性的聚多巴胺(polydopamine,PDA)修饰层,得到固定化酶GOx@ZIF-7/PDA[9]。本研究优化了固定化酶GOx@ZIF-7/PDA各种固定化条件,采用傅里叶变换红外光谱(Fourier transform infrared spectrometer,FT-IR)、X-射线多晶粉末衍射(powder X-ray diffractometry,PXRD)对材料进行了表征分析,并对其酶学性质和稳定性进行研究。
1 材料与方法
1.1 材料与试剂
葡萄糖氧化酶(GOx,E.C.1.1.3.4源于黑曲霉,100 U/mg)、辣根过氧化物酶(horseradish peroxidase,HRP,E.C.1.11.1.7源于辣根,300 U/mg)、ABTS、Zn(NO3)2·6H2O、苯并咪唑(benzimidazole,Bim)(均为分析纯),上海阿拉丁生化科技股份有限公司;三(羟甲基)氨基甲烷(Tris)(超级纯),上海麦克林生化有限公司;十二水合磷酸氢二钠、D-葡萄糖(均为分析纯),广东光华科技有限公司;磷酸二氢钾(分析纯),天津市大茂化学试剂厂。
1.2 仪器与设备
H1850R低温高速离心机,湖南湘仪实验室仪器开发有限公司;HNY-200B台式全温振荡器,天津欧诺仪器股份有限公司;UV-2600 紫外可见分光光度计,日本岛津公司;MiniFlex600 X-射线多晶粉末衍射仪,日本理学公司;Nicolet IS10傅里叶变换红外光谱仪, 美国Thermo公司。
1.3 实验方法
1.3.1 GOx活力测定
用分光光度法测定游离GOx和固定化酶的活性,参照文献[22]方法进行,略加修改。将10 μL 5 mg/L 游离酶溶液/固定化酶溶液加入含有100 μL 100 mg/L HRP溶液、780 μL pH 7.4的50 mmol/L磷酸盐缓冲液、100 μL 1 mol/L葡萄糖溶液和10 μL 50 mmol/L ABTS溶液的反应体系中,在室温下反应3 min,同时在分光光度计上连续监测415 nm处吸光度的增加量。
GOx的酶活力单位(U)定义为在一定条件下,1 min 内产生1 μmol H2O2所需的酶量。
酶固定化效率指固定的游离酶活力占初始加入的总游离酶活力的百分数,计算如公式(1)所示:
(1)
式中:A1为加入的总游离酶活力,U;A2为上清液的总游离酶活力,U。
酶活回收率指固定化酶所测定的酶活力占所固定的游离酶活力的百分数,计算如公式(2)所示:

(2)
式中:A1为加入的总游离酶活力,U;A2为上清液的总游离酶活力,U;A3为固定化酶的总酶活力,U。
酶泄露率指固定化酶在缓冲液中浸泡一段时间后泄露的总游离酶活与浸泡前固定化酶固定的总游离酶活的百分数,计算如公式(3)所示:
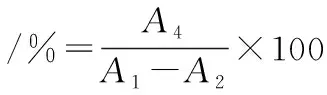
(3)
式中:A1为加入的总游离酶活力,U;A2为上清液的总游离酶活力,U;A4为泄露的总游离酶活力,U。
1.3.2 固定化酶GOx@ZIF-7/PDA的制备及表征
1.3.2.1 GOx@ZIF-7的制备
称取一定量的GOx溶解于5 mL Tris-HCl缓冲液(50 mmol/L,pH 6.0~8.0)中,然后分别加入25 mL 5~75 mmol/L Bim溶液和2.5 mL 39~500 mmol/L硝酸锌溶液,在一定温度25~45 ℃下搅拌反应一定时间后,在10 000 r/min下离心10 min,并用去离子水洗涤3次,收集上清液和沉淀,沉淀冷冻干燥,得到GOx@ZIF-7。
1.3.2.2 GOx@ZIF-7/PDA的制备
取1.3.2.1节制备得到的沉淀0.78 g分散于10 mL新鲜制备的Tris-HCl缓冲液(10 mmol/L,pH 8.5)中,加入10~30 mg盐酸多巴胺,于25 ℃恒温摇床中180 r/min振荡10 h,10 000 r/min离心10 min,并用去离子水洗涤3次,冷冻干燥,得到GOx@ZIF-7/PDA。制备流程图如图1所示。
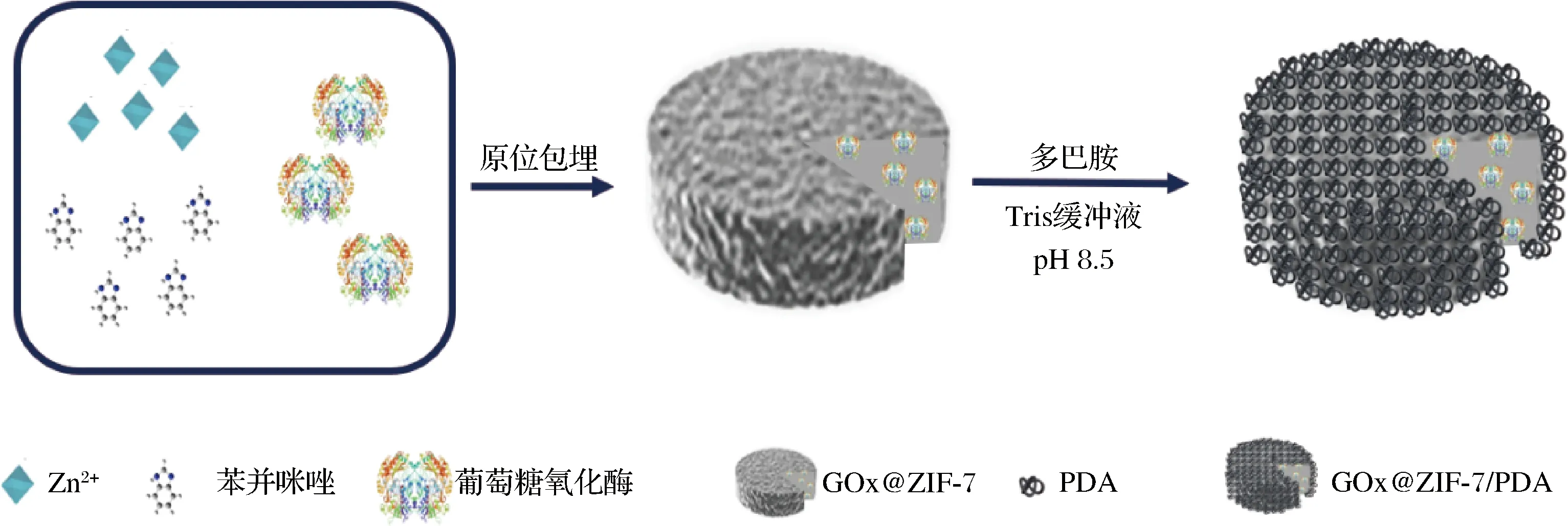
图1 GOx@ZIF-7/PDA的制备示意图Fig.1 Schematic preparation of GOx@ZIF-7/PDA
1.3.2.3 表征
分别用PXRD、FT-IR对ZIF-7, GOx@ZIF-7及GOx@ZIF-7/PDA进行表征。
1.3.3 GOx@ZIF-7/PDA的酶学性质
1.3.3.1 最适pH值
将10 μL游离GOx和GOx@ZIF-7/PDA分别加入含有100 μL 100 mg/L HRP溶液、780 μL的50 mmol/L磷酸盐缓冲液(pH 5.0~8.0)、100 μL 1 mol/L葡萄糖溶液和10 μL 50 mmol/L ABTS溶液的反应体系中,在25 ℃下进行酶促反应,测定酶活力。以同组酶活力的最高值为100%,计算相对活力。
1.3.3.2 最适温度
将10 μL游离GOx和GOx@ZIF-7/PDA分别加入含有100 μL 100 mg/L HRP溶液、780 μL pH 6.0的50 mmol/L磷酸盐缓冲液、100 μL 1 mol/L葡萄糖溶液和10 μL 50 mmol/L ABTS溶液的反应体系中,在25~75 ℃下进行酶促反应,测定酶活力。以同组酶活力的最高值为100%,计算相对活力。
1.3.3.3 酶催化动力学参数测定
在最适pH和温度下,通过记录1 min内在415 nm处吸光度的增加,测量了游离GOx和固定化酶催化浓度为2~100 mmol/L的葡萄糖的初始速率,并通过Lineweaver-Burk方程计算米氏常数(Km),如公式(4)所示:
(4)
式中:V0为初始反应速率,μmol/(L·min),Vmax为最大反应速率,μmol/(L·min),[S]为初始葡萄糖浓度,mmol/L,Km为Michaelis-Menten常数,mmol/L。
1.3.3.4 pH稳定性
在25 ℃下,将蛋白质含量相同的游离GOx和GOx@ZIF-7/PDA分别在50 mmol/L Tris-HCl 缓冲液(pH 4.5~9.5)的中放置30 min,然后测定酶活力。以未处理的样品酶活力为100%,计算相对活力。
1.3.3.5 温度稳定性
将相同蛋白质含量的游离GOx和GOx@ZIF-7/PDA分别分散在50 mmol/L Tris-HCl缓冲液(pH 6.0)中,在40~70 ℃的温度下处理30 min后测定酶活力,以未处理的样品酶活力为100%,计算相对活力。
1.3.3.6 贮存稳定性
将具有相同蛋白质含量的游离GOx和GOx@ZIF-7/PDA重悬50 mmol/L Tris-HCl缓冲液(pH 6.0)中,在4 ℃条件下贮存,每隔1 d各取出一部分相同体积的酶液测定酶活力。以未进行贮存的酶活力为100%,计算相对活力。
1.3.3.7 重复操作稳定性
取30 mg GOx@ZIF-7/PDA,在最适温度和最适pH条件下,重复测定其活性,以第一次测定的酶活力为100%,计算相对活力,确定固定化酶的重复操作稳定性。
2 结果与分析
2.1 GOx固定化工艺优化
2.1.1 固定化时间对固定化效果的影响
固定化时间对固定化效果的影响如图2-a所示。随着固定化时间的增加,酶活回收率先增加后减少,在固定时间为40 min时,固定化酶的酶活回收率达到最高,为(17.08±2.27)%;而固定化时间为10~40 min时,酶固定化效率明显增加,在40 min后,酶固定化效率缓慢增加。这可能是由于随着固定时间的延长,固定的酶量增多,但固定时间超过40 min后,GOx周围堆积的ZIF-7过多,底物难以接近接近酶活性中心,从而使固定化酶活力降低。因此,固定化时间选择为40 min。
2.1.2 加酶量对固定化效果的影响
加酶量对固定化效果的影响如图2-b所示。随着加酶量的增加,酶固定化效率无明显变化。在加酶量为5 g/L时,酶活回收率最高,为(17.88±1.89)%,随着加酶量的进一步增加,酶活回收率逐渐下降,这一现象可能是由于固定化酶空间过于拥挤而阻碍了底物的传质[23]。因此,加酶量选择为5 g/L。
2.1.3 Bim的浓度对固定化效果的影响
Bim的浓度对固定化效果的影响如图2-c所示。当Bim浓度低于50 mmol/L时,酶活回收率和酶固定化效率随着浓度增大而升高,50 mmol/L时达到最高值[(17.88±1.92)%]。继续增大Bim的浓度,酶固定化效率无明显变化,而酶活回收率明显降低。这是因为有机配体Bim的浓度过低时,难以形成ZIF-7,不能将GOx充分包埋,Bim的浓度过高,GOx周围堆积的ZIF-7过多,导致固定化酶的酶活力降低。因此,Bim浓度选择为50 mmol/L。
2.1.4 Zn2+与Bim的摩尔比对固定化效果的影响
分别按不同比例加入25 mL 50 mmol/L Bim水溶液和2.5 mL 39~500 mmol/L Zn(NO3)2·6H2O水溶液,使Zn2+与Bim的摩尔比依次为1:13, 1:11, 1:9, 1:7, 1:5, 1:3和1:1。Zn2+与Bim的摩尔比对固定化效果的影响如图2-d所示。改变Zn2+与Bim的摩尔比对酶固定化效率的影响不明显,但对酶活回收率有影响,当Zn2+与Bim的摩尔比为1:9时,酶活回收率达到最高值,为(22.31±1.92)%,这可能是由于调节Zn2+和有机配体物质的量浓度可以控制MOFs的形状,在该摩尔比下,ZIF-7形状更规则,分散更均匀,底物更容易接近酶的催化中心,从而提高了固定化酶活力[10,24]。因此,Zn2+与Bim的摩尔比选择为1:9。
2.1.5 固定化温度对固定化效果的影响
固定化温度对固定化效果的影响如图2-e所示。随着固定化温度的升高,酶固定化效率变化范围较小,而固定化酶的酶活回收率变化明显。当固定化温度为35 ℃时,酶活回收率达到最高,为(32.49±1.99)%。当固定化温度超过35 ℃时,酶活回收率快速下降。这是由于温度的变化会引起酶的构象发生变化,酶在过高的温度下会变性,导致酶活力降低甚至失活。因此,固定化温度选择为35 ℃。
2.1.6 酶液pH值对固定化效果的影响
酶液pH值对固定化效果的影响如图2-f所示。当酶液pH值为7.0时,固定化酶的酶活回收率最高,为(32.91±2.17)%,pH值低于7.0,酶活回收率逐渐升高;pH值高于7.0,酶活回收率逐渐下降。酶液pH 6.0~7.0,酶固定化效率呈增加趋势;pH 7.0~8.0,酶固定化效率趋于平稳。这表明,酶液pH 6.0~7.0,Zn2+与Bim的配位作用逐渐增强,越来越多的GOx被包封在ZIF-7中;此外,pH值也会对酶的空间构像产生影响,当酶液pH值超过7.0时,GOx部分失活,造成固定化酶活力下降。因此,固定化pH值选择为7.0。
2.1.7 多巴胺浓度对固定化效果的影响
多巴胺浓度对固定化效果的影响如图2-g所示。固定化酶的酶泄露率随着多巴胺浓度增加而降低,当多巴胺质量浓度达到2.0 g/L时,酶泄露率降低至(0.11±1.00)%;而酶活回收率随着多巴胺浓度增加先升高后降低,最大值为(43.34±2.00)%。这是由于多巴胺中的邻苯二酚基团能与ZIF-7表面的锌离子产生络合作用,并在固定化酶表面形成了厚度可控的亲水性PDA涂层,能防止固定化酶塌陷和溶解[22,25]。随着多巴胺浓度增加,亲水性涂层逐渐增厚,固定化酶亲水性提高,酶活力逐渐提高,但当多巴胺质量浓度超过2.0 g/L时,PDA层过厚,阻碍了底物接近酶的催化中心,固定化酶活力逐渐降低。因此,多巴胺质量浓度选择为2.0 g/L时,GOx固定化效果最佳。
2.2 固定化酶的表征
2.2.1 PXRD分析
对ZIF-7、GOx@ZIF-7和GOx@ZIF-7/PDA进行PXRD分析,结果如图3所示。图中ZIF-7出现的衍射峰与报道的ZIF-7特征峰基本吻合,表明ZIF-7的成功合成[26-27]。GOx@ZIF-7、GOx@ZIF-7/PDA 与ZIF-7材料的特征衍射峰位置一致,进一步证明GOx和PDA的引入不会对ZIF-7材料的晶体结构造成显著影响。此外,所有样品在2θ为15.5°~25.9°均存在2个宽峰,这是由长程无序结构造成的,表明样品中存在部分无定形结构和配位缺陷。

图3 ZIF-7、GOx@ZIF-7及GOx@ZIF-7/PDA的PXRD分析Fig.3 PXRD analysis of ZIF-7, GOx@ZIF-7 and GOx@ZIF-7/PDA
2.2.2 FT-IR分析

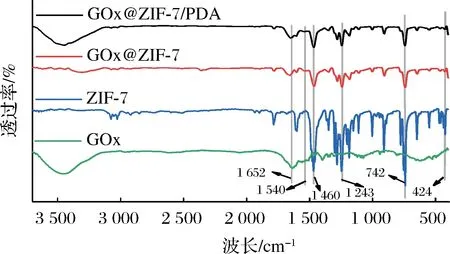
图4 GOx、ZIF-7、GOx@ZIF-7及GOx@ZIF-7/PDA的傅里叶变换红外光谱图Fig.4 FT-IR spectra of GOx, ZIF-7, GOx@ZIF-7 and GOx@ZIF-7/PDA
2.3 固定化酶的酶学性质
2.3.1 最适pH值
由图5-a可知,固定化酶GOx@ZIF-7/PDA的最适催化pH值为6.0,与游离GOx相同,说明酶在被固定化后最适pH并不受影响。游离酶和固定化酶的相对活力都是随着pH的增大呈现先增大后减小的趋势,但游离酶的变化趋势更加剧烈。这是因为ZIF-7刚性结构的存在能更好地保证GOx的空间结构,受pH值影响较小。
2.3.2 最适温度
由图5-b可知,游离GOx的最适温度是40 ℃,固定化酶GOx@ZIF-7/PDA的最适温度是55 ℃,GOx被固定化后最适反应温度有较大幅度的上升。与游离GOx相比,固定化酶曲线走向较为陡峭,可能是由于固定化酶GOx@ZIF-7/PDA在催化底物反应过程中较游离酶有更大的传质阻力。
2.3.3 动力学参数
由图5-c可知,固定化酶GOx@ZIF-7/PDA的Km值为(25.55±1.84)mmol/L,略大于游离酶Km值[(19.55±1.28) mmol/L],表明固定化酶对底物的亲和力略小于游离酶,这是因为固定化酶GOx@ZIF-7/PDA在催化底物反应过程中存在更大的传质限制,从而造成固定化酶GOx@ZIF-7/PDA较游离酶反应速率降低[7,31]。
2.3.4 pH稳定性
GOx是一种蛋白质,其催化性能易受环境pH值影响,过高或过低的pH值会破坏酶的三维结构或者阻碍底物与酶结合,从而导致酶分子活性降低甚至失活。图6-a为在不同pH值下处理30 min后游离酶和固定化酶GOx@ZIF-7/PDA的稳定性。与游离酶相比,GOx@ZIF-7/PDA在较宽的pH值范围内表现出更好的稳定性。一方面是因为ZIF-7/PDA致密的结构对酶的保护作用,另一方面GOx@ZIF-7/PDA表面的不同电荷对酶催化反应微环境存在一定的缓冲作用,使GOx@ZIF-7/PDA受pH值影响更小。
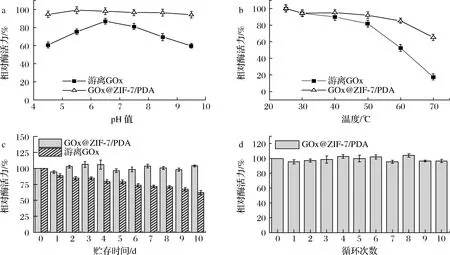
a-pH稳定性;b-温度稳定性;c-贮存稳定性;d-重复操作稳定性图6 GOx@ZIF-7/PDA的pH稳定性、温度稳定性、贮存稳定性和重复操作稳定性Fig.6 pH stability, thermal stability, storage stability and reusability of GOx@ZIF-7/PDA
2.3.5 温度稳定性
图6-b对游离酶GOx和固定化酶GOx@ZIF-7/PDA的温度稳定性进行了评价。高于30 ℃后固定化酶GOx@ZIF-7/PDA的相对活力降低趋势相对于游离酶更小,在70 ℃时,游离酶GOx的相对活力仅有(17.69±3.76)%,而GOx@ZIF-7/PDA仍具(65.29±3.84)%的相对活力。表明固定化酶GOx@ZIF-7/PDA的热稳定性明显高于游离酶。这是由于高温环境会破坏GOx的空间结构,导致不可逆失活,而GOx@ZIF-7/PDA为GOx提供了刚性的保护层,提高了热稳定性。
2.3.6 贮存稳定性
图6-c为游离酶GOx和固定化酶GOx@ZIF-7/PDA在4 ℃条件下的贮存稳定性曲线。在4 ℃冷藏保存10 d后,游离酶GOx仅能保持(62.21±3.26)%的相对活力,而GOx@ZIF-7/PDA仍能保持接近100%的相对活力。结果表明,固定化酶GOx@ZIF-7/PDA酶反应器的贮存稳定性较游离酶显著提高。这是由于固定化后的GOx@ZIF-7/PDA跟游离酶相比酶活性中心附近的微环境发生了变化,结构更加稳定,减少了外界环境对酶活性的影响[32]。
2.3.7 重复操作稳定性
固定化酶能通过固液分离实现酶的重复使用,克服了游离酶难以从产物中分离出来的缺陷,有利于实现酶的大规模工业应用。由图6-d可知,GOx@ZIF-7/PDA经10次循环使用后,仍保持(96.53±2.26)%的相对活力。
3 结论
本研究在水相中通过原位包埋法成功合成了GOx@ZIF-7生物复合材料,再利用多巴胺的自聚合特性制备得到固定化酶GOx@ZIF-7/PDA,通过单因素试验确定了固定化酶的最佳工艺条件。通过PXRD和FT-IR分析表明GOx成功固定在GOx@ZIF-7/PDA上。制备得到的GOx@ZIF-7/PDA的pH和温度耐受性有所提高。在4 ℃贮藏10 d,酶活力基本保持不变,表现出良好的贮存稳定性。此外,GOx@ZIF-7/PDA重复使用10次后,还能保持(96.53±2.26)%的活性,表现出良好的操作稳定性。综上,此方法得到的酶-MOF生物复合材料操作简单,能提高酶的稳定性,具有广泛的发展前景。后续可在此基础上进一步提高GOx@ZIF-7/PDA生物复合材料的酶活回收率,有望能在酶催化、分子识别、生物分析等领域实现高效率、低成本的实际应用。
