不同发酵剂对发酵香肠品质的影响
2023-10-09杨小莹肖珊庞煜王波蔡燕雪王际辉
杨小莹,肖珊,*,庞煜,王波,蔡燕雪,王际辉,*
1(东莞理工学院 生命健康技术学院,广东 东莞,523808)2(大连工业大学 生物工程学院,辽宁 大连,116034)
发酵香肠风味独特,其主要是以猪肉为原料,靠人工接种或自然附着的菌种进行发酵制备而成的发酵肉制品。发酵食品品质特征形成的重要因素之一是微生物群落的作用,在肉制品发酵过程中,微生物群落主要参与蛋白质水解和脂质分解反应,不仅可以改善产品的品质、提高营养价值,还可以提高产品的安全性[1-2]。肉制品中有益于发酵的微生物主要有酵母菌、霉菌以及各种细菌。酵母属主要包括假丝酵母属、隐球菌属、德巴酵母属、克鲁维酵母属、毕赤酵母属、红酵母属、丝孢酵母属和耶氏酵母属,其中德巴汉逊氏酵母是主要的酵母种类,研究表明其可以改善发酵肉制品的风味,延长产品货架期[2-3]。霉菌主要有产黄青霉和纳地青霉。细菌主要有乳杆菌、片球菌、微球菌和凝固酶阴性葡萄球菌,研究表明凝固酶阴性葡萄球菌可以改善发酵肉制品的产品色泽,延缓产品酸败[4]。在发酵香肠发酵剂的研究中,乳酸菌、霉菌、片球菌、酵母菌作为单菌发酵剂的研究相对较为深入,在混菌发酵剂的研究中,很多研究集中在以乳酸菌为主要发酵剂,添加不同比例的其他细菌或酵母菌,例如乳杆菌与木糖葡萄球菌、乳杆菌与酵母菌、乳杆菌与木糖葡萄球菌和肉葡萄球菌[5-8]。虽然酵母菌在发酵肉制品中的应用研究比较深入,但酵母菌与腐生葡萄球菌混合接种应用于发酵肉制品中的研究,尚未见报道。本文利用从宣威火腿中筛选出的优良菌株德巴汉逊氏酵母与腐生葡萄球菌,分别作为单菌发酵剂和形成复配发酵剂发酵香肠,研究不同发酵剂对发酵猪肉香肠品质的影响,以期为发酵肉制品发酵剂的研发和应用提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验菌种
腐生葡萄球菌(Staphylococcussaprophyticus)与德巴汉逊氏酵母(Debaryomyceshansenii)筛选自宣威火腿,发酵性能测定结果表明其具有较高的脂肪酶和蛋白酶活力,其中腐生葡萄球菌脂肪酶活力为21.03 U/L、蛋白酶活力为9.18 U/mL,德巴汉逊氏酵母菌脂肪酶活力为32.16 U/L、蛋白酶活力为3.01 U/mL,安全性实验表明两者均为安全性菌株。
1.1.2 实验试剂
孟加拉红培养基、葡萄糖、琼脂、酚红、抗坏血酸、三氯乙酸、硫代巴比妥酸(thiobarbituric acid,TBA)、乙二醇-双-(2-氨基乙醚)四乙酸[ethylene glycol bis(2-aminoethyl ether)tetraacetic acid,EGTA]、焦磷酸钠、氯化钾、氯化镁、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、正己烷、盐酸胍、氯仿、磷酸二氢钾、乙醇,广东环凯微生物科技有限公司。
1.2 仪器与设备
100~1 000 μL移液器,德国Eppendorf;LC-N-1100D旋转蒸发仪、力辰;FlavourSpec®气相离子迁移谱联用仪(gas chromatography-ion mobility spectrometry,GC-IMS),美国GAS;MD200-2氮吹仪,杭州奥盛;T10高速分散机,ultra turrax;HSP-80B恒温恒湿培养箱,上海坤天;TGL-16GB高速离心机,上海安亭科学仪器;NH310高品质便携式电脑色差仪,深圳三恩驰。
1.3 实验方法
1.3.1 发酵香肠的制作
取新宰杀的雄猪上肩胛肉部位5 000 g按照肥瘦比2:8的比例绞碎。加入盐120 g,搅拌均匀后4 ℃腌制3 h。发酵剂(德巴汉逊氏酵母和腐生葡萄球菌)提前活化,按原料肉质量的1%加入,并搅拌均匀。清洗肠衣后,浸泡20 min后开始灌肠。灌肠7~8分饱,有空气的地方扎孔,并在约15 cm处扎结。灌制好的香肠置于22 ℃培养箱中发酵成熟15 d。
1.3.2 实验设计
本次实验共设4个处理组,分别为空白对照组(自然发酵组)、添加德巴汉逊氏酵母组、添加腐葡萄球菌组和添加腐生葡萄球菌与德巴汉逊氏酵母复配菌组(1:1,质量比)。分别在发酵香肠成熟的第0、3、6、9、15天取样,测定发酵香肠的微生物菌群、理化性质和挥发性风味物质。
1.3.3 测定方法
1.3.3.1 pH值测定
取每个阶段的香肠样品10 g加入90 mL蒸馏水中,13 500 r/min均质3 min,过滤后用pH计测定pH值。
1.3.3.2 色差值的测定
去除肠衣,香肠切成1 cm的薄片状,通过白板进行仪器校准,用色差仪对发酵香肠样品进行色度值分析,读取各样品的亮度值(L*)、红度值(a*)和黄度值(b*),并记录数据。
1.3.3.3 质构的测定
将发酵香肠置于操作台上,进行质构剖面分析(texture profile analysis, TPA),打开电源校正仪器后,设定测定参数为平底柱形探头36 R;测前速率5 mm/s,测试速率1.0 mm/s,测后速率5 mm/s,测试距离10 mm,两次下压间隔时间5 s。每组样品分别测定6次。
1.3.3.4 微生物指标的测定
在无菌操作台上,去掉肠衣,取10 g样品于90 mL 生理盐水中,摇瓶培养、梯度稀释后分别用YPD培养基、甘露醇氯化钠琼脂培养基、PCA培养基进行涂布,30 ℃培养48 h后分别记录酵母菌数、葡萄球菌数和总菌数。
1.3.3.5 脂肪氧化程度的测定[硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)法]
取5 g香肠样品剪碎后,加入25 mL质量分数为7.5%三氯乙酸(trichloroacetic acid,TCA)溶液,均质后静置30 min后进行抽滤,取5 mL混合液加入5 mL浓度为0.02 mol/L TBA溶液,沸水浴40 min后离心(6 000×g,15 min),取1 mL上清液加入1 mL氯仿,摇匀待分层后取上清液在532 nm处测定OD值[9]。TBA的计算如公式(1)所示:
TBA/(mg/100 g)=A532×7.8
(1)
式中:A532为532 nm处OD值。
1.3.3.6 蛋白质氧化测定
蛋白质浓度根据GB 5009.5—2016《食品中蛋白质的测定》测定。
羰基含量的测定:取6 g样品加入60 mL焦磷酸缓冲溶液并充分匀浆。分别取1 mL匀浆液置于2个离心管中,加入1 mL 20%(质量分数)的TCA后离心(10 000×g,15 min)。倒掉上清液后,一个离心管加入1 mL浓度为10 mmol/L的DNPH(溶解液为2 mol/L HCl)缓冲液,另一个离心管加入2 mol/L HCl作为空白对照,在黑暗的环境中孵育30 min,每3 min 漩涡振荡10 s。孵育完成后,在2个离心管中分别加入1 mL质量分数为20%的TCA溶液离心15 min。收集下层样品并加入3 mL浓度为10 mmol/L的HCl[溶解液为V(乙醇):V(乙酸乙酯)=1:1],离心(12 000×g,5 min)取沉淀,重复洗涤3次。加入2 mL 盐酸胍4 ℃过夜后,第2天离心(12 000×g,5 min)测OD370值。羰基含量的计算如公式(2)所示:
(2)
式中:A1为实验组样品的吸光度;A0为空白组的吸光度;ρ为蛋白质质量浓度,mg/mL。
1.3.3.7 挥发性风味物质测定
取0.5 g香肠样品于20 mL顶空瓶中,50 ℃孵育20 min后进样。气相-离子迁移谱条件:分析时间为26 min,色谱柱类型:FS-SE-54-CB-1 15 m,ID:0.53 mm,柱温40 ℃,载气为氮气(99.999%),IMS温度为45 ℃。自动顶空进样单元:进样体积500 μL,孵育时间20 min,孵育温度为50 ℃,进样针温度为85 ℃,孵化转速为500 r/min[9]。
1.3.3.8 发酵香肠感官评价分析
将发酵成熟的香肠清洗外部,放入蒸锅蒸20 min后切片装盘,邀请12位实验员对香肠进行感官指标评定。评定标准如表1所示。

表1 发酵香肠感官评定评分标准Table 1 Sensory scoring evaluation standard of fermented sausage
1.4 数据处理与分析
应用IBM SPSS Statistics 21进行显著性分析,P<0.05表示差异显著。每个样品重复测定3次,使用Excel统计数据,结果表示为平均值±标准偏差,应用Origin 2019b 32bit制图。
2 结果与分析
2.1 发酵香肠pH的变化
低pH有助于防止杂菌过度增殖导致产品腐败,有助于延长产品货架期[10-11]。如图1所示,在发酵第3天,3组发酵剂添加组香肠的pH值显著降低,空白组显著高于其他3组。可能由于菌株分解产生酸类物质,导致香肠内部pH迅速降低。发酵3 d以后,pH值上升,可能是由于菌种活跃度降低导致产酸速率变慢,同时蛋白物质分解产生碱性物质。在发酵第15天,添加混菌组的pH值为5.6,显著低于其他3组。
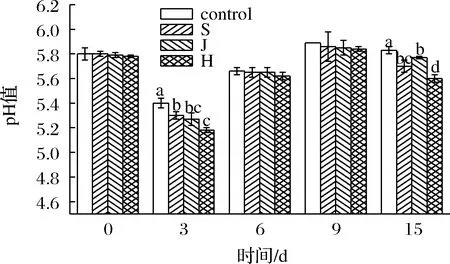
图1 不同发酵剂对发酵香肠pH值的影响Fig.1 Effects of different starters on the pH value of fermented sausage注:将同一发酵天数中不同处理组进行对比,字母如果不相同表示差异显著(P<0.05);control为空白对照组、S为葡萄球菌组、J为酵母菌组、H为混菌组(下同)。
2.2 发酵香肠色差值的变化
香肠外观颜色与接种的发酵剂密切相关[12]。香肠不同发酵时间的红度值(a*)、黄度值(b*)和亮度值(L*)如图2-a所示。结果表明,发酵过程中,4组香肠的红度值都呈现上升趋势,在发酵的第9天,混菌组的红度值最高,显著高于其他3组,在发酵最后一天红度值的排序为混菌组>单菌组>空白组。由图2-b可知,4个处理组香肠的黄度值都在发酵过程中均不同程度的下降,最后一天的数据表明,接种德巴汉逊氏酵母菌与混菌组的黄度值显著高于空白组,添加腐生葡萄球菌的黄度值与空白组无显著差异。由图2-c可知,发酵后期,混菌组的亮度值最高,单菌组的亮度值显著高于空白对照组。在所有接菌组中,添加混菌发酵剂比添加单菌发酵剂亮度更高,由此可知,添加微生物发酵剂能够改善香肠色泽,其中混合添加组的效果更佳。

a-红度值;b-黄度值;c-亮度值图2 不同发酵剂对发酵香肠色差值的影响Fig.2 Effects of different starters on the color of fermented sausage
2.3 发酵香肠质构的变化
质构对发酵香肠的品质具有重要影响。本实验使用质构仪对发酵香肠的硬度、黏聚性、弹性、咀嚼性进行测定。由表2可知,在发酵初期,4组发酵香肠的4个质构指标并没有显著差异。在发酵的第6天,4个处理组的硬度、咀嚼性均升高,这可能是因为随着发酵时间的延长引起发酵香肠水分散失,导致硬度增加。在发酵后期,混菌组与酵母菌组发酵香肠的硬度显著高于空白组,混菌组发酵香肠的咀嚼性显著高于其他3组。在发酵过程中,各组发酵香肠的弹性均有所下降,但在发酵后期,混菌组发酵香肠的弹性显著高于其他组。在发酵过程中,4个处理组发酵香肠的黏聚性并没有显著变化,各组之间差异不显著。以上结果表明,接种混菌发酵剂能够改善香肠的质构。

表2 不同发酵剂对发酵香肠质构的影响Table 2 Effect of different starters on texture of fermented sausage
2.4 发酵香肠微生物指标的变化
酵母菌是发酵肉制品中对风味影响最主要的菌种[13]。如图3所示,在发酵的15 d中,第0天,添加酵母菌组和混菌组的香肠中酵母菌菌数高于其他2组。发酵第3天,所有组酵母菌菌数均开始增加,表明人工添加发酵剂和自然发酵香肠中的酵母菌都开始生长。3 d以后所有组的酵母菌菌数都有不同程度的下降,其中空白组最为显著。可能因为发酵香肠失水导致香肠内部环境不适合酵母菌的生长。结果表明,在发酵第15天,混菌组发酵香肠的酵母菌菌数量显著高于其他组。

图3 不同发酵剂对发酵香肠酵母菌总数的影响Fig.3 Effects of different starters on the total amount of yeast of fermented sausage
葡萄球菌是发酵肉制品中常见的微生物,其对肉制品的发色有显著贡献[14]。如图4所示,在发酵初期,由于刚添加活化后的菌种,所以腐生葡萄球菌组和混菌组的香肠中葡萄球菌菌数最高。3 d后,未添加葡萄球菌的2组葡萄球菌菌数呈现先升高再降低的趋势,可能因为来源于香肠制作过程或者环境中的葡萄球菌开始生长,而其他添加葡萄菌组的数值下降可能是因为香肠环境内部已不适合菌株的生长。在发酵后期,混菌组的葡萄球菌菌数显著高于其他3组。

图4 不同发酵剂对发酵香肠葡萄菌总数的影响Fig.4 Effects of different starters on the total amount of Staphylococci in fermented sausage
发酵香肠中风味和滋味的产生和微生物群落有着密切联系[15]。检测发酵香肠中菌落总数的变化情况,有助于分析其在香肠中发挥的作用。如图5所示,发酵初期,添加菌种组的菌落总数高于空白组,3 d 后所有组均有所下降,在发酵后期,空白组的菌落总数显著高于其他3组,这表明人工接种的菌株在香肠发酵初期活性强,在后期可能有抑制杂菌生长的作用,在一定程度上可提高发酵香肠安全性。

图5 不同发酵剂对发酵香肠菌落总数的影响Fig.5 Effects of different starters on the total number of colonies in fermented sausage
2.5 发酵香肠脂肪氧化程度的变化
研究表明,适度的脂肪氧化能够促进发酵香肠的风味产生,但是过度氧化则会引起产品腐败变质,对人体健康产生危害。因此脂质氧化程度对于发酵肉制品的质量非常重要,是重要的检测指标之一。丙二醛是不饱和脂肪酸氧化分解的产物,表示其含量的TBARS值是评价肉制品脂肪氧化最常用的指标之一。
由图6可知,在0~6 d的发酵过程中,各个处理组发酵香肠的TBARS值均呈上升趋势,但是4个处理组间差异不显著。在发酵的第9天和第15天,3个添加组香肠的脂肪氧化程度显著低于空白组,而且葡萄球菌添加组和混菌添加组显著低于酵母添加组,这与WU等[16]的结果一致。以上结果表明,接种发酵菌株后能够产生抗氧化作用,提高发酵香肠产品的安全性。
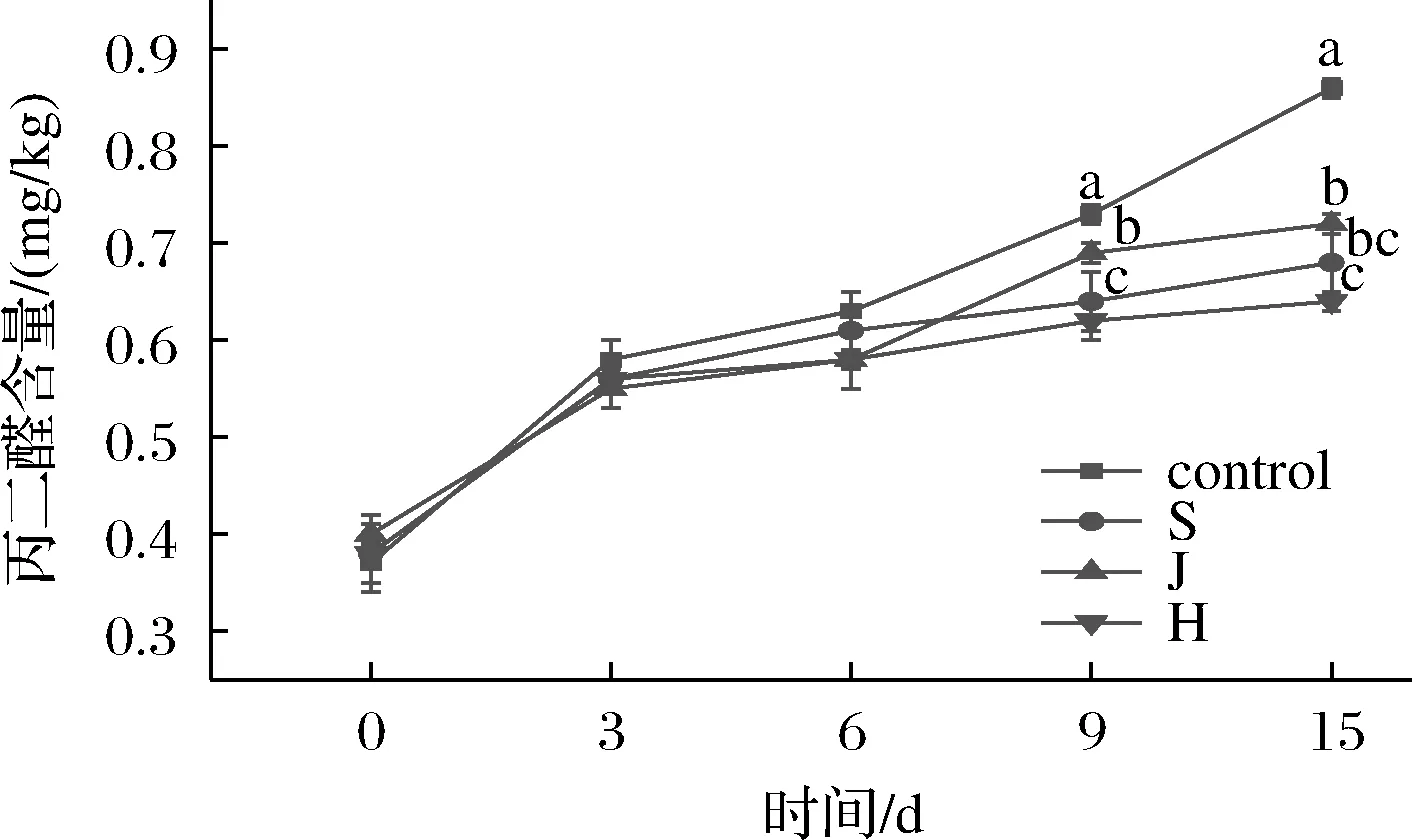
图6 不同发酵剂对发酵香肠的脂肪氧化程度的影响Fig.6 Effects of different starters on the degree of lipid oxidation in fermented sausage
2.6 发酵香肠蛋白质氧化程度的变化
羰基是蛋白质氧化程度的产物之一,是氧化应激的一种化学修饰,主要是由于氧自由基攻击氨基酸侧链产生的。研究表明,羰基含量越高,蛋白质氧化程度越高[17]。
如图7所示,在整个发酵期间,不同处理组的蛋白质氧化程度均呈上升趋势。在发酵的0~9 d,各处理组间无显著差异。在发酵的第15天,3个接菌组的蛋白质氧化程度显著低于空白组,说明接种发酵剂可以降低发酵香肠产品的蛋白氧化程度,这与MARTUSCELLI等[18]的实验结果一致。而且混菌组的蛋白质氧化程度显著低于单菌组。

图7 不同发酵剂对发酵香肠蛋白质氧化程度的影响Fig.7 Effects of different starters on the degree of protein oxidation in fermented sausage
2.7 发酵香肠风味物质的变化
发酵肉制品独特的风味是其广受消费者欢迎的原因之一,风味的形成主要与糖原、脂质及蛋白质的分解有关[19]。同时,风味的产生也与微生物的作用密不可分。如表3所示,在发酵香肠产品中共检测到醇类、酮类、醛类、酯类以及其他类物质36种。在发酵香肠产品中,本实验中只检测到一种烷烃类物质,为2-乙酰基噻唑,其具有烤板栗、烤肉以及坚果香,可作为香精原料[20-22]。发酵肉制品中通常会有醇类物质的产生,而醇类物质检测阈值较高,一般不认为是发酵肉制品的香气贡献者,但它是形成酯类物质的重要底物[23]。由表3可知,接菌组香肠的醇类物质含量显著高于空白组,而且混菌组的醇类物质含量显著高于单菌组,但是2个单菌组间没有显著差异。酮类化合物的产生途径主要是脂质氧化、微生物β-氧化反应和与甲基酮相关的反应。在本实验中,能够产生黄油香气的3-羟基-2-丁酮、产生荨麻和果香的2-庚酮、以及具有烧烤和甜味的2-戊酮均被检出。对于酮类物质,混菌组和腐生葡萄球菌组的峰强度显著高于其他2组。醛类化合物产生的途径是脂质氧化与细菌的氨基酸代谢[24-25]。醛类物质的含量与TBARS值直接相关,与风味可接受度呈负相关,过度氧化可导致以己醛为代表的醛类物质大量增加,会给肉制品带来腐臭的味道。在发酵结束后,空白组香肠的醛类物质含量显著高于其他3组,其中混菌组的醛类含量最低,表明混合添加发酵剂可在一定程度上抑制香肠的过度氧化。酯类被认为是发酵肉制品中果味和花香味的主要香气来源[26-27]。其中具有果香和焦糖风味的丁酸乙酯气味最强,其次是具有甜味的乙酸乙酯,两种物质均在发酵香肠中检测到,而且接菌组显著高于空白组,其中混菌组香肠的含量最高。对于酯类物质总量,4个处理组峰强度为混菌组>德巴汉逊氏酵母组>腐生葡萄球菌组>空白组。综上所述,添加微生物发酵剂能够使发酵香肠具有更好的风味,其中混菌添加组的效果更佳。
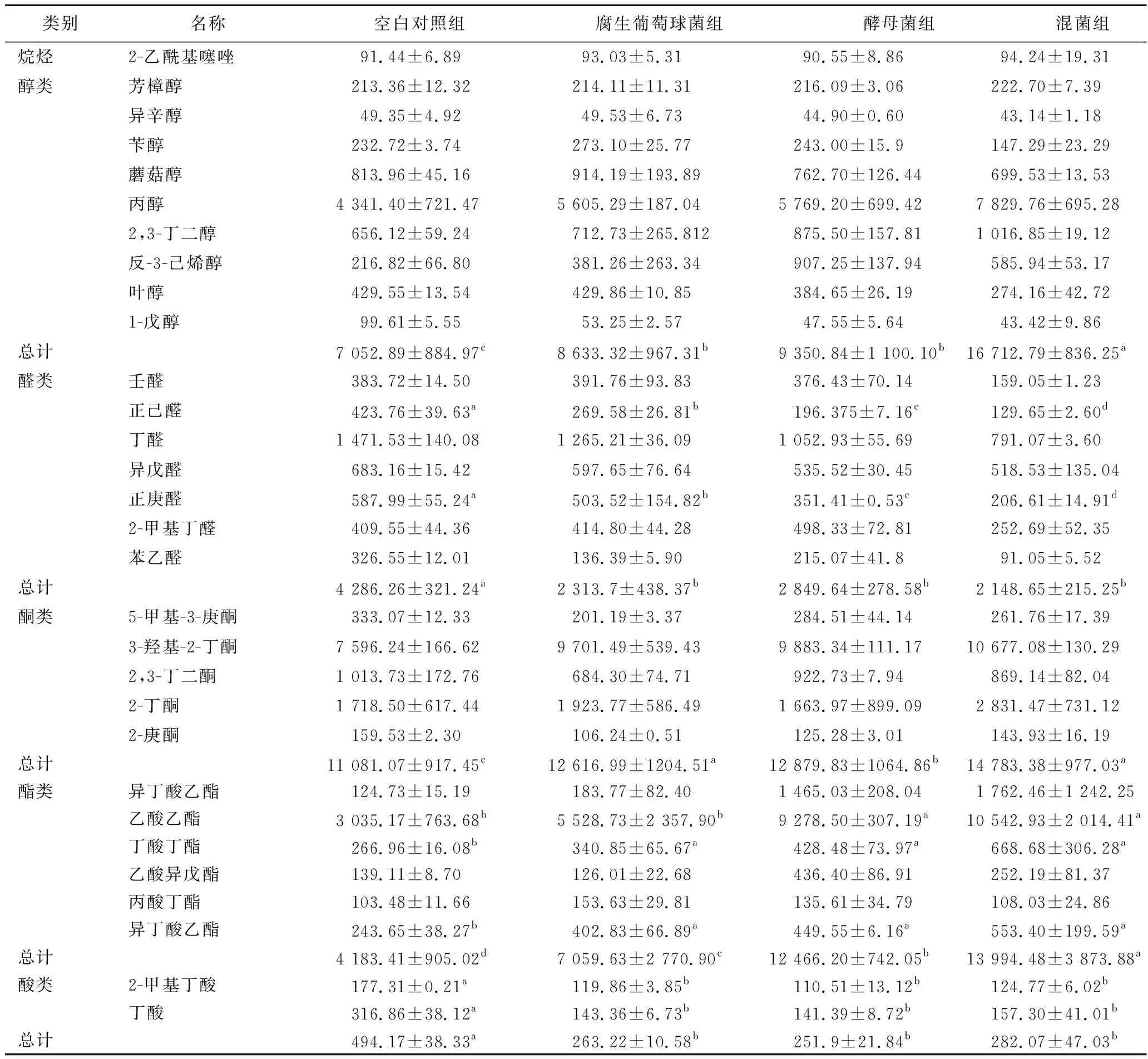
表3 发酵香肠第15天挥发性风味物质信号强度Table 3 Signal intensity of volatile compounds in fermented sausage on day 15
2.8 发酵香肠感官评价
感官评价是食品品质评价的关键指标之一。本实验分别从外观、风味、质地、滋味、整体接受性5个方面对不同组别的发酵香肠进行评价。结果如图8所示,接菌组的各项指标均比空白组好,其中混菌组的发色效果最好,颜色亮红,肉味纯正浓郁,弹性十足有嚼劲,滋味鲜美,受到品评员的好评。由此可知,接种微生物发酵剂能够从产品的外观、风味、质地、滋味等方面产生比空白组更好的效果,而且,接种混合微生物发酵剂优于单菌发酵剂。

图8 发酵香肠的感官评价Fig.8 Sensory evaluation of fermented sausage
3 结论
综上,本实验利用实验室从宣威火腿中筛选出具有优良发酵特性的德巴汉逊氏酵母与腐生葡萄球菌作为香肠的发酵剂,单一或混合接入发酵香肠后,通过对其理化指标、微生物指标、氧化程度等进行分析,得到以下结果,添加不同微生物发酵剂均可在不同程度上抑制发酵香肠的杂菌生长,促进发酵香肠发色,提高其弹性和咀嚼度,促进酯类等风味物质产生,提高消费者对产品的接受度,其中,混菌发酵组效果最佳。
