草莓液态与固态糖渍过程中的水分分布与迁移规律
2023-10-09王锐牛丽影胡丽丽李大婧张钟元聂梅梅肖亚冬刘春菊吴海虹肖丽霞
王锐,牛丽影,胡丽丽,李大婧,张钟元,聂梅梅,肖亚冬,刘春菊,吴海虹,肖丽霞
1(扬州大学 食品科学与工程学院,江苏 扬州,225000)2(江苏省农业科学院 农产品加工研究所,江苏 南京,210014)
草莓营养丰富,含水量高达90%,但其肉质细嫩且无果皮保护,在采摘后高度易腐[1]。将草莓部分脱水处理,制作成草莓干是一种延长保存期的良好方式。草莓干属于果脯蜜饯类食品,口感酸甜适宜且韧弹爽口,而广受消费者喜爱[2]。渗透脱水是草莓干制作的重要步骤,目前,果脯类食品糖渍有固态(solid osmotic dehydration,SSD)和液态(liquid osmotic dehydration,LOD)2种,其中SSD是指将果蔬等直接接触渗透剂(糖、盐等),外界无外源水的介入,而LOD是指将果蔬等浸入具有一定比例渗透剂的渗透溶液[3]。不同的渗糖方式对草莓内水分的影响不同,物料内水分的变化直接影响产品品质[4],目前研究多采用干燥曲线以及干燥数学模型来预测干燥过程果蔬中水分含量变化[5],但干燥曲线所描述的过程为草莓中整体水分含量的变化[6],无法反映水分分布的均匀性与不同结合状态水的变化规律[7];并且干燥动力学模型主要是对草莓干燥曲线的数学模拟,虽然也能为现实生产提供一定的指导,但面对实际生产中加工工艺等变化因素,其指导具有一定的局限性[4]。
低场-核磁共振(low-field nuclear magnetic resonance,LF-NMR)是一种“非破坏性”技术,可以实时监测样品在脱水的过程中水分状态的分布[8],其中氢质子核磁成像(magnetic resonance imaging,MRI)可以清晰地显示水分在样品内部的空间分布[9]。目前为了分析不同加工处理方式对果蔬物料干燥过程的影响,已经将LF-NMR技术运用其中,如王海鸥等[10]通过LF-NMR分析了护色剂、热烫和超声波-热烫3种不同护色预处理对牛蒡片真空冷冻干燥特性的影响,通过分析弛豫时间T2值,表示热烫和超声波-热烫会导致冻干牛蒡片中残留水分流动性增加;张鹏飞[11]采用LF-NMR对比分析弛豫时间T2值与对应峰面积A2值,发现超声渗透脱水与渗透脱水均可以改变桃片内部水分状态和分布,但超声渗透脱水可以加速渗透过程中水分迁移。另外,JIN等[12]表示干燥过程中食品内的水分分布是保持品质的关键因素,通过MRI计算西兰花内部的水分分布,对于找到能保留热敏性营养成分的加工条件是必不可少的。因此,为了更好地结合草莓干加工中渗糖与后续的热风干燥2个必不可少的过程,提升草莓干的品质,通过LF-NMR技术对草莓SSD和LOD过程中的水分进行对比监测,从水分的角度对不同的加工工艺进行区分、选择与优化是必要的。
草莓中的水分一般以结合水、不易流动水和自由水形式存在[13],姜佳惠[6]和程新峰[14]对草莓进行不同方式的预处理,表示不同的处理方法对物料的水分状态有不同的影响,进而影响着后续的加工过程。渗透脱水是一种部分脱水的浸渍过程,不同的渗透方式可能会对草莓内水分的形态带来不同的影响,同样,过程进行的程度会影响后续干燥的效果[15]。所以为了获得具有适宜水分含量以及良好口感的草莓干,本文以草莓为研究对象,采用LF-NMR横向弛豫时间(T2)的反演谱以及MRI,分析在不同渗透时间下,2种渗透方式的草莓内部水分状态,为渗透脱水时间的确定以及草莓干加工工艺的改进提供理论依据。
1 材料与方法
1.1 材料
草莓:速冻蒙特瑞草莓,购自云南曲靖县。
1.2 仪器与设备
MesoMR23-060H-1低场核磁共振分析仪,苏州纽迈分析仪器股份有限公司;DH6-9073B5-Ⅲ电热恒温鼓风干燥箱,上海新苗医疗机械制造有限公司。
1.3 实验方法
1.3.1 草莓的渗透处理
大小、形状、成熟度一致的冷冻草莓(每只草莓约5 g),解冻后分为2组,一组按照料液比1:4(g:mL)加入30%的蔗糖溶液做为液态浸渍,另一组按照草莓质量的30%添加蔗糖做为固态浸渍。2种浸渍方法均每8 h取样,共浸渍72 h。其中不同取样时间与不同渗透方式的草莓均用不同容器加工处理,达到浸渍时间时,将草莓取出,用蒸馏水冲洗表面,并使用吸水纸吸干表面水分,进行指标测定。
1.3.2 草莓含水率的测定
采用GB 5009.3—2016中直接干燥法,取一定质量的不同渗透时间的草莓样品,放置在105 ℃烘箱,干燥至恒重。记录干燥前、后样品的质量,进行含水率的计算。
1.3.3 核磁共振波谱的测定条件
参考LI等[16]方法,并稍作修改。将草莓脯放在60 mm核磁专用聚四氟乙烯管上,将其置于直径为60 mm、磁场强度0.5 T、磁场温度32 ℃、主频为21.0 MHz的磁场中心区域。在FID序列下确定中心频率以及寻找90°和180°脉冲宽度,收集Carr-Pur-cell-Meiboom-Gill序列(CPMG)弛豫信号。信号采集参数:90脉冲和180脉冲时间分别为24.48 μs和40.0 μs,2次扫描之间的重复采用等待时间Tw为4 000 ms,模拟增益RG1为20,数字增益DRG1为3,前置放大增益PRG为0,回波个数 NECH为15 000,累加次数Ns为16。使用Multi Exp Inv Analysis 软件,结合迭代重建技术(simultaneous iterative reconstruction technique,SIRT)对CPMG弛豫数据进行多指数拟合,迭代次数为100 000。通过拟合,得到弛豫时间、峰面积以及每个峰面积所对应的峰比例。对反演后的数据进行单位质量处理,作为分析样品各组分变化的依据。
1.3.4 氢质子密度成像的测定
参考GENG等[17]方法。利用成像软件获得磁共振图像。使用SE成像序列获得质子密度加权图像。使用以下扫描方案:Read size=256;Phase size=192,切片宽度=2.0 mm,层数=6,回波时间(echo time,TE)为20 ms,重复时间(time of repetition,TR)为500 ms。
1.4 数据处理,
采用Excel和Origin 2019软件对数据进行分析处理;采用SPSS 26软件进行分析,采用Duncan法进行显著性分析(设定P<0.05为显著差异)。
2 结果与分析
2.1 两种糖渍方式下草莓含水率的变化
如图1所示,2种渗透方式中草莓均随着糖渍时间的延长草莓含水率总体呈现下降趋势,但2种方式下脱水速率和相同渗透压时间下的含水率明显不同。LOD过程,草莓在渗透的前16 h 内含水率由91.83%迅速下降至82.47%,随后下降趋势明显减缓,在48~72 h含水率无显著变化(P<0.05),而在SSD过程中这种下降减缓发生在浸渍24 h(含水率为76.88%)之后,其中32 h就与72 h含水率无显著差异(P<0.05)。渗透72 h后,LOD草莓中含水率为79.90%,SSD草莓中含水率为74.56%。显然,草莓在渗透过程中具有一定的持水性,但是不同的渗透方式对草莓渗透过程中的持水性有着有不同的影响。
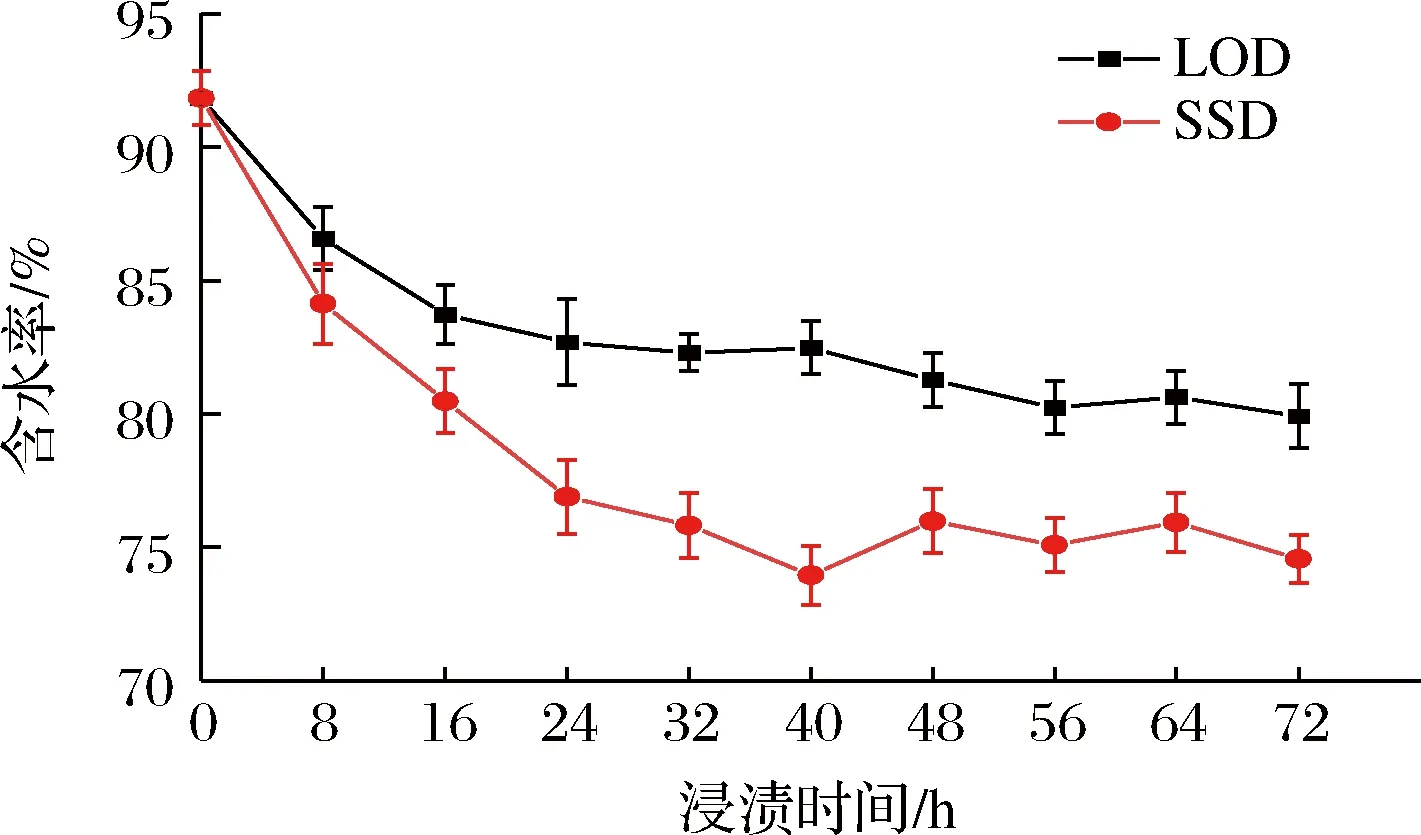
图1 两种渗透方式下草莓水分的变化Fig.1 Changes of moisture content in strawberry during LOD and SSD
2.2 草莓中不同状态水的含量变化
本实验采用LF-NMR对SSD和LOD过程中草莓的横向弛豫时间(T2)进行检测,在食品中,T2弛豫时间越短水分子自由度越低[8]。如图2所示,渗糖过程中的草莓均出现了3个峰,可将草莓的T2分为3个区域,表示草莓中有3种状态的水分存在,与陈新峰[14]的研究一致。其中T21、T22、T23数值大小表示水分的流动性强弱,所在区域所代表的水分别存在于细胞壁中、细胞质或细胞间隙中和液泡中,分别对应结合水、不易流动水和自由水,因此可用3个区域的峰面积(A21、A22、A23)表征不同形态水分的含量[6]。如表1所示,2种渗透方式未处理与渗透72 h后草莓的A21数值均无显著差异(P<0.05),表明渗透72 h内,2种渗透方式对草莓内的结合水分含量影响较小;随着渗糖时间的延长,草莓中A22、T22与T23均呈下降趋势,说明2种渗糖方式均能对不易流动水进行有效的脱除,同时增强了草莓对剩余不易流动水与自由水的结合效果;浸渍至72 h,相比0 h,固态渗糖中草莓T22、T23和A22的分别下降了74.00%、78.23%和69.00%,而在LOD中仅下降了33.78%、20.76%和39.57%,说明固态渗糖对于上述的脱除和结合效果均优于液态渗糖。

a-SSD;b-LOD图2 渗透过程中草莓横向弛豫时间T2反演谱Fig.2 Inversion spectrum of transverse relaxation time T2 of strawberry during osmotic dehydration
2种渗糖方式的A23值变化趋势不同。SSD中A23值在渗透过程中持续下降,在渗糖72 h时显著低于渗糖0 h(P<0.05),而在液态渗糖中上述下降不显著(P>0.05),综合SSD中A21值变化不显著而A22值持续下降的现象,推测固态渗糖对自由水分的脱除具有更好的效果。T21所在区域对应细胞壁中水,它们与果胶、纤维素等紧密结合[14],2种渗糖方式的T21值变化趋势表现出明显差别。据报道,凝胶的形成与加工过程中高甲酯化果胶和蔗糖的作用密切相关[18],在LOD中,LOD 72 h相比LOD 0 h,其T21值出现显著上升(P<0.05),猜测有两方面原因,一方面可能由于果胶与水形成较好交联需要有足够的蔗糖浓度支撑[21],实验中LOD渗透环境中水分占比较大,果胶与水的交联程度不够,另一方面蔗糖具有多羟基结构,亲水性较强[19],蔗糖与细胞壁上果胶对水形成了一定的竞争[20],使得细胞壁中水的流动性略有增强。而在SSD中,草莓的T21值逐渐下降,表明SSD产生了更适宜果胶凝胶形成的渗糖环境,在高溶质浓度低pH环境下细胞壁中果胶相互交联能对水分产生更大的束缚作用[21]。
2.3 核磁共振总峰积分面积与草莓含水率的相关性分析
如图3所示,采用线性方程拟合后,2种渗透方式下草莓的低场核磁共振峰积分面积总和的值与含水率的线性关系均显著(P<0.05),其中SSD过程下的线性方程为y=-4 689.75+79.64x(R2=0.964 2),LOD过程下的线性方程为y=-3 489.87+69.29x(R2=0.908 3)。以上结果表明,将T2反演图谱的积分总面积与线性方程进行结合后,可以采用LF-NMR对渗糖过程中草莓无损检测,得到低场核磁共振的总峰面积,从而间接推测出测定时刻草莓的含水率。这种间接测定水分的方式在烤羊肉过程[9]、干燥油脂丰富的核桃的过程[22]和干燥切片胡萝卜的过程[23]均有研究表明其具有一定的可行性,在本研究结果显示此方式也有无损监控草莓渗透过程含水率的潜力。并且结果显示此方法对SSD处理草莓中水分含量的预测结果要优于LOD。

a-SSD;b-LOD图3 不同渗透方式下草莓含水率与低场核磁共振总峰积分面积的相关性分析Fig.3 Correlation analysis between moisture content and total peak integral area of low field NMR of strawberries at different osmotic dehydration methods
2.4 糖渍过程中水分分布的核磁共振成像分析
图4为草莓渗透过程中的MRI成像图。核磁共振成像分析仪将磁共振信号强度转变成图像的形式,其中氢质子越活跃且密度越高,图像则更加明亮[24]。由渗透0 h草莓图像看出,冻融草莓内大部分区域明亮,但随着渗糖过程的进行,草莓形态明显变小,且明暗区域的分布情况也发生改变。SSD过程中草莓内部暗部区域逐渐增多,且边缘处亮度逐渐升高,在草莓四周形成了一条明亮的“水带”,说明其中水分存在明显的由内向外转移的过程[14]。而LOD中对草莓内部水分分布状态与SSD明显差异,区别主要体现在以下两个方面:a)草莓内部暗部区域未发生明显变化;b)草莓周边未形成明显“水带”。因此推测SSD和LOD过程草莓中的水分从内部向表皮的转移,是一个持续且需要时间积累的过程,但相比LOD,SSD草莓内部水分向草莓表皮的转移程度会更加“剧烈”,且会在草莓的表皮处“堆积”。

a-SSD;b-LOD图4 不同渗透方式处理过程中草莓的氢质子成像图Fig.4 Hydrogen proton images of strawberries treated with different infiltration methods
3 结论
研究结果表明,通过LF-NMR可以对渗透过程中草莓内部水分形态的变化规律进行较好的描述。SSD和LOD对草莓内的结合水峰面积(A21)影响较小,但均能对其中不易流动水(A22)进行有效的脱除;且根据弛豫时间T2值结果显示,2种渗透方式均使得草莓中不易流动水与自由水的流动性降低。另外,通过对比弛豫时间T2值与其对应的峰面积A2可知,SSD相比LOD对自由水有更好的脱除效果,同时使得草莓对结合水的结合能力增强,而LOD处理却使草莓中结合水的自由度升高,以上结果可能成为不同渗透方式制得的草莓干品质差异的重要原因。渗糖方式影响着草莓的氢质子密度图的亮度,SSD处理将草莓内部的水分向草莓外部转移,使草莓的氢质子密度图中央出现明显并且逐渐扩大暗部区域,而LOD的氢质子密度图没有出现这种现象。另外,SSD和LOD过程中草莓的含水率和核磁共振峰总积分面积均存在良好的线性关系,而其中LF-NMR更适合用于预测SSD过程中草莓样品中的水分含量。结果为以LF-NMR无损检测草莓水分含量与状态来判断渗糖进行程度,以及渗糖方式的选择与条件的优化提供理论支持。
